(以下内容仅供医学药学专业人士阅读参考,如您非前述专业人士,请离开本页。)
匹配调整间接比较(MAIC):比较卡马替尼与其他MET抑制剂在治疗MET外显子14跳跃突变的晚期非小细胞肺癌中的总生存和治疗相关不良事件[1]
Matching-Adjusted Indirect Comparison (MAIC) of overall survival (OS) and treatment related adverse events (TRAE) comparing Capmatinib (CAP) with other Mesenchymal-epithelial transition (MET) Inhibitors for treatment of advanced non-small cell lung cancer (aNSCLC) with MET Exon 14 skipping mutations.
Yi-Long Wu, et al.
2024 WCLC EP.12D.05
背景:MET抑制剂是METex14跳突的晚期非小细胞肺癌的首选治疗方案。截止本分析时(2023年8月),全球有4种MET抑制剂(卡马替尼 CAP、特泊替尼 TEP、赛沃替尼 SAV、谷美替尼 GLU)获批且发表了相应的注册临床研究数据。在缺乏头对头研究的情况下,通过对一线治疗的总生存(OS)和总人群治疗相关不良事件(TRAE)进行非锚定匹配调整间接比较(MAIC),以平衡不同临床研究患者基线的差异,从而评估卡马替尼与其他MET抑制剂的相对疗效和安全性。
方法:对卡马替尼GEOMETRY mono-1研究和GEOMETRY-C研究中患者的基线特征进行加权处理,以匹配对照药物的临床研究基线(SAV的II期研究:NCT02897479,GLU的GLORY研究,TEP的VISION研究),进行两两比较。Cox比例风险回归分析用于确定与OS显著相关的匹配变量。经匹配调整后,将加权的卡马替尼OS曲线与对照药的OS曲线进行比较,以估计初治患者的风险比(HR)。对于TRAE,调整总体人群和亚洲人群的基线特征,然后重新计算。
结果:卡马替尼一线治疗的OS在数值上优于SAV(HR 0.532,95% CI 0.265 - 1.068)、TEP(HR 0.870,95% CI 0.579 - 1.307)。由于GLU的一线OS尚不成熟,未进行比较。在总体人群中,卡马替尼的任意级别的TRAE发生率显著低于SAV和GLU(CAP vs SAV:-9.3%, vs GLU:-7.1%),数值上低于TEP(CAP vs TEP:-1.1%)。在亚洲人群中,与所有对照药物相比,卡马替尼的任意级别TRAE发生率最低(CAP vs SAV:-11.4%,vs GLU:-12.6%,vs TEP:-11.1%)。
结论:与所有对照MET抑制剂相比,卡马替尼在一线治疗中显示出OS的获益趋势,且无论在总体人群还是亚洲人群中TRAE的发生率均较低。
点评专家
哈尔滨医科大学附属肿瘤医院
中国医药教育协会肺部肿瘤专业委员会副主任委员
中国抗癌协会临床肿瘤学会小细胞肺癌专委会副主任委员
中国抗癌协会肿瘤支持治疗专业委员会常委
国家抗肿瘤药物临床应用监测专家委员会肺癌组专家成员
中国抗癌协会肿瘤微循环专业委员会常委
中国医疗保健国际交流促进会胸部肿瘤分会常委
中国临床肿瘤学会理事会理事
中国抗癌协会化疗专业委员会委员
黑龙江省抗癌协会肺癌专委会前主任委员
黑龙江省医学会肺癌专委会主任委员
黑龙江省医学会呼吸肿瘤联盟主席
中国肿瘤临床杂志编委
刚刚结束的2024年世界肺癌大会(WCLC),展示了一项不同MET抑制剂治疗METex14跳突NSCLC患者的研究,也为MET抑制剂之间缺乏直接的对照研究弥补了空缺。
METex14跳突是明确的致癌驱动变异,在NSCLC患者中的突变率约为1%~3%[2]。目前,全球已有5款针对METex14跳突NSCLC的MET抑制剂获批上市,分别是卡马替尼、特泊替尼、赛沃替尼、谷美替尼和伯瑞替尼。今年WCLC大会中 “卡马替尼与其他MET抑制剂治疗METex14跳突晚期NSCLC的OS和TRAE的匹配调整间接比较(MAIC)”研究,是在缺乏头对头研究的情况下,通过对一线治疗的总生存(OS)和总人群治疗相关不良事件(TRAE)进行非锚定匹配调整间接比较(MAIC),来评估卡马替尼与其他MET抑制剂的相对疗效和安全性。
研究采用匹配调整间接比较(MAIC)的方法来评估卡马替尼对比其他MET抑制剂的风险-获益特征。研究基于卡马替尼临床研究中患者水平的数据去调整并匹配与其他MET-TKI临床研究之间的基线特征差异,使卡马替尼调整后的样本人群与其他MET-TKI临床研究的基线可比。
在一线治疗中,卡马替尼对比赛沃替尼、特泊替尼均展现出数值更优的总生存期(OS),死亡风险分别降低约47%和13%,谷美替尼由于OS尚不成熟未做比较。这一结果,也充分证实了卡马替尼一线治疗相较于其他MET-TKIs有数值上的更长生存获益趋势,对比赛沃替尼降低死亡风险约67%,对比特泊替尼降低死亡风险约15%。
在安全性方面,无论在总体人群还是亚洲人群中,卡马替尼的治疗相关不良反应(TRAE)发生率均较低,尤其在亚洲患者中可将TRAE发生风险显著降低约10%。
与所有对照MET抑制剂相比,卡马替尼在一线治疗中显示出OS的获益趋势,且安全性也得到充分体现。
该研究是首个比较卡马替尼与其他MET-TKIs在METex14 NSCLC患者(包括全球和亚洲人群)中的疗效(OS)和安全性(TRAE)的研究。MAIC是在缺乏头对头研究的情况下受到广泛应用一种药品评价方法,通过调整不同研究入组患者基线特征的差异进行匹配,从而较为准确地进行两两对比,为临床实践和决策提供参考和指导。
在疗效方面,OS作为肿瘤临床研究的金标准,是衡量抗肿瘤药物疗效的最关键指标,不会受到不同评估标准的影响,具有重要的参考意义。此次MAIC在原先单臂注册临床研究的基础上,补充证明了卡马替尼一线治疗有明确的生存获益趋势。
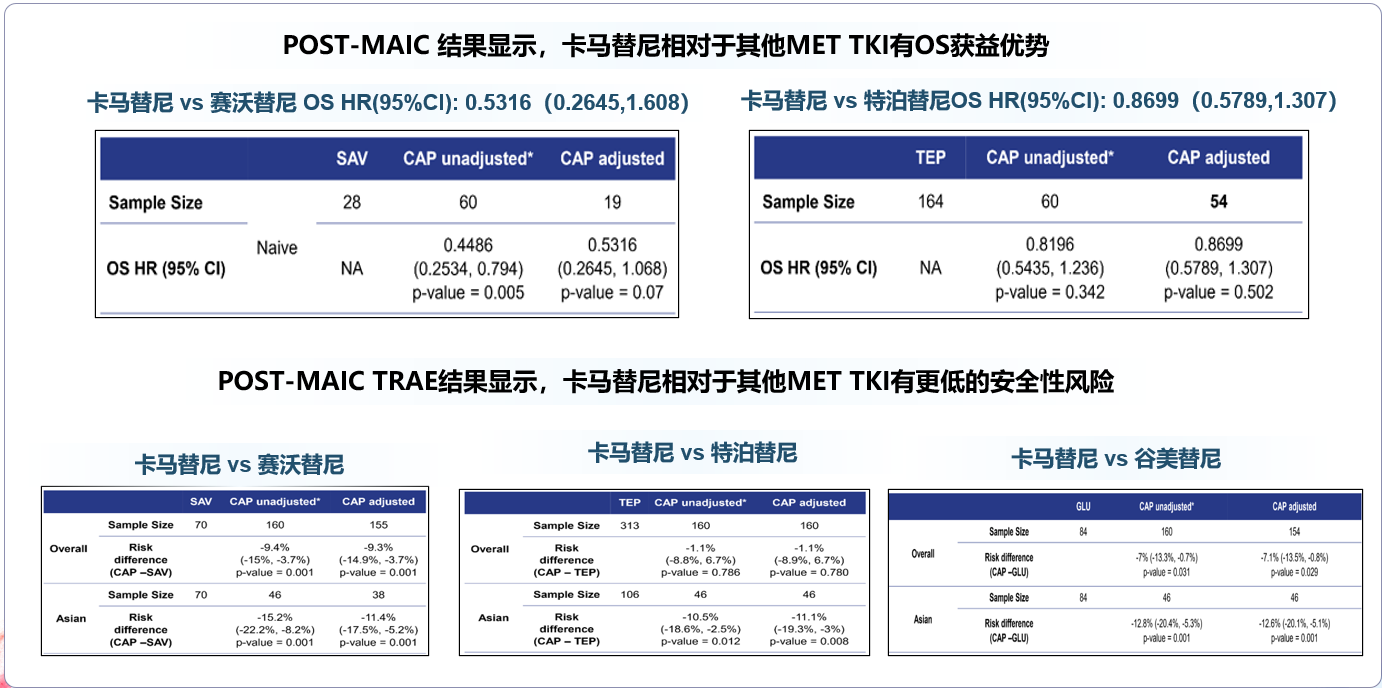
本研究也是首次将卡马替尼全球注册临床和中国注册临床研究的安全性数据进行汇总,与其他MET抑制剂进行比较。研究结果再一次证明了卡马替尼的疗效和安全性,尤其在亚洲患者中,显著地降低TRAE的发生风险约10%,让患者可以更加安全的用药,减少药物带来的不良反应,提高患者的生活质量。
虽然由于样本量小和MAIC方法学的局限性,残差偏倚仍然存在,希望今后有更大样本量或头对头比较的研究进一步来验证,但本次的MAIC比较,也为临床的治疗选择,提供了有利的证据。
一项单中心真实世界经验:达拉非尼联合曲美替尼在BRAF V600突变非小细胞肺癌中的应用[3]
Dabrafenib-trametinib in BRAF V600-mutated non-small-cell lung cancer: a single center real world experience
Andrea Sbrana, et al. (通讯作者:Andrea Sbrana)
FUTURE ONCOLOGY
IF = 3.0
目的:本研究回顾性地评估了2017年至2022年在单一中心接受治疗的BRAF突变非小细胞肺癌(NSCLC)患者中达拉非尼/曲美替尼联合疗法的效果。
患者:研究分析了42名患者(27名接受一线治疗,15名接受二线/后续治疗)的反应和安全性数据。
结果:客观缓解率为73.8%,接受一线或二线治疗的患者之间没有差异。接受一线联合疗法的患者中观察到的中位无进展生存期(PFS)长于二线/后续治疗患者(分别为19.9个月[95% CI:19.7-20] vs 13.1个月[95% CI:8.6-17.6]; p = 0.012),且具有统计学意义。一线联合治疗患者的中位总生存期(OS)为29.9个月(95% CI: 14.1-45.7),后续治疗线患者的中位OS为22.4个月(95% CI: 14.6-30.2)。联合疗法耐受性良好。
结论:本研究证实了达拉非尼/曲美替尼联合疗法在BRAF V600突变NSCLC中的疗效。
点评专家
天津医科大学肿瘤医院 肺部肿瘤内科副主任
美国Moffitt Cancer Center访问学者
天津医科大学肿瘤医院新世纪人才
美国癌症研究学会(AACR)会员
中国临床肿瘤学会(CSCO)会员
中国抗癌协会(CACA)会员
天津市抗癌协会肺癌专业委员会委员
擅长肺癌、胸腺瘤等胸部肿瘤以及恶性胸腹水的化疗及分子靶向治疗。
非小细胞肺癌(NSCLC)约占肺癌的85%,在NSCLC中,BRAF 基因突变率为1.5%-3.5%;BRAF V600约占所有BRAF突变的50%,其中最常见类型为V600突变[4-5]。BRAF突变患者整体预后较差。BRAF突变在V600密码子附近的激活环(A环)或464-469残基处的磷酸结合环(P环)最为常见。虽然BRAF突变属于少见突变,但是中国肺癌患者基数大, BRAF突变患者的数量并不少。
达拉非尼联合曲美替尼治疗BRAF V600突变阳性的NSCLC患者的全球和中国注册临床研究均验证了非常显著的疗效和安全性结果。全国注册研究BRF113928 [6]研究结果显示,一线接受达拉非尼联合曲美替尼治疗ORR达到64%,中位DOR达到15.2个月,中位PFS达到14.6个月,中位OS达到24.6个月,同时该研究中的安全性数据也体现出双靶治疗对于患者的良好的耐受性,研究结果中也并未发现非预期的不良反应。2022年世界肺癌大会 (WCLC) [7]首次公布了Dab+Tram治疗BRAF V600E突变中国NSCLC患者的数据。这也是首个前瞻性中国BRAF突变NSCLC临床研究,该研究填补了亚洲人群的空白。疗效数据显示:不论独立评审委员会(IRC)评估,还是研究者评估的ORR均为75%,优于全球注册研究的ORR结果。双靶全线治疗在中国人群中均取得了更好的疗效。本研究展示了更优于注册研究的缓解和生存疗效,在接受联合治疗作为一线治疗的患者与接受二线或后续治疗的患者之间,未观察到反应差异:疾病控制率 均大于 90%,ORR一线组和二线或后续组分别为 73.3% 和 74.1%,说明双靶治疗对于该靶点患者的病灶缓解深度上的疗效很客观。在缓解深度不错的前提下去细化观察一线组和二线或后线组人群的生存数据,我们看到该研究中一线治疗患者的 PFS 更长,为 19.9 个月(95% CI:19.7-20),而后续治疗组观察到的 PFS 为 13.1 个月(95% CI:8.6-17.6),且具有统计学意义的差异 (p = 0.012);一线患者和二线及进一步治疗患者的 OS 差异分别为 29.9 个月 (95% CI: 14.1-45.7) 和 22.4 个月 (95% CI: 14.6-30)。从全程管理角度考虑,双靶治疗放在前线可以将生存获益最大化。
在安全性方面,注册研究中显示中国人群与全球人群安全性一致,未观察到新的安全性风险。本真实世界临床实践中同样未发现新的安全性信号发生,只有两名患者需要减少剂量,两人都是由于发热,经过处理得到很好的控制。且本研究中的患者中位年龄为 71 岁,较注册研究中更趋向于老龄化,且还包括大约 80% 的 IV 期病例,依然显示了优异的安全性数据。
在BRAF V600突变NSCLC患者中,小分子靶向药展现出了良好的治疗前景。在2022年3月,达拉非尼联合曲美替尼方案获国家药品监督管理局(NMPA)批准用于治疗BRAF V600突变阳性转移性NSCLC,是中国首个且唯一获批针对BRAF V600突变阳性转移性NSCLC的治疗药物 。国内外指南目前对BRAF V600突变NSCLC的治疗均推荐首选靶向治疗,2024年V6版NCCN指南[8]中推荐达拉非尼联合曲美替尼或康奈非尼联合比美替尼,BRAF抑制剂单药治疗仅在特殊情况下作为治疗推荐。2024年CSCO指南[9]中,晚期BRAF V600突变NSCLC患者的一线首选方案是达拉非尼联合曲美替尼,且是唯一治疗推荐。关于BRAF V600突变NSCLC术后辅助治疗、双靶耐药机制、全程管理和其他联合方案及AE的控制策略等方面的问题,值得更进一步探索。
达拉非尼联合曲美替尼辅助治疗III期黑色素瘤的最终结果[10]
Final Results for Adjuvant Dabrafenib plus Trametinib in Stage III Melanoma. .
Georgina V. Long(通讯作者:Georgina V. Long)
The New England journal of medicine
IF = 158.5
背景:这项试验的5年结果显示,与安慰剂比较,达拉非尼联合曲美替尼辅助治疗在BRAF V600突变的III期黑色素瘤患者中带来了更长的无复发生存和无远处转移生存。仍需要更长期的数据,包括有关总生存的数据。
方法:研究随机分配了870名切除的BRAF V600突变III期黑色素瘤患者,接受12个月的达拉非尼(每天两次,每次150毫克)联合曲美替尼(每天一次,每次2毫克)治疗,或者接受两种匹配的安慰剂。在这里,我们报告这项试验的最终结果,包括总体生存、黑色素瘤特异性生存、无复发生存和无远处转移生存的结果。
结果:达拉非尼联合曲美替尼的中位随访时间为8.33年,安慰剂为6.87年。Kaplan-Meier估计总生存率显示达拉非尼联合曲美替尼优于安慰剂,尽管获益并不显著(死亡风险比,0.80;95%置信区间[CI],0.62至1.01;按分层对数秩检验P=0.06)。在几个预先设定的亚组中观察到一致的生存获益,包括792名BRAF V600E突变的黑色素瘤患者(死亡风险比,0.75;95% CI,0.58至0.96)。达拉非尼联合曲美替尼组的无复发生存率优于安慰剂组(复发或死亡的风险比,0.52;95% CI,0.43至0.63),无远处转移生存率也优于安慰剂组(远处转移或死亡的风险比,0.56;95% CI,0.44至0.71)。未报告新的安全信号,这一发现与以前的试验报告一致。
结论:在近10年的随访后,在切除的III期黑色素瘤患者中,达拉非尼联合曲美替尼辅助治疗的无复发生存率和无远处转移生存率均优于安慰剂。总生存率分析显示,联合治疗组的死亡风险比安慰剂组低20%,但获益并不显著。在BRAF V600E突变的黑色素瘤患者中,结果表明联合治疗组的死亡风险降低了25%。
线粒体在BRAF突变型肿瘤中的作用及靶向治疗的潜力[11]
Role of mitochondria and potential of mitochondria-targeted therapy in BRAF mutant cancer: A review.
Yanyan Gao, et al.(通讯作者:Yanyan Gao)
Critical Reviews in Oncology / Hematology
IF =6.2
经典的丝裂原活化蛋白激酶(MAPK)信号传导途径,Ras/Raf/MEK(丝裂原活化蛋白激酶/ERK激酶)/ERK蛋白激酶级联,是调节细胞生长、分化和增殖的保守级联反应。2002年在几种人类肿瘤中发现了BRAF的癌症激活突变,从而确立了BRAF在癌症中的重要性。目前,BRAF被认为是影响癌症表型的驱动突变,使其成为癌症治疗的重要靶点。选择性BRAF抑制剂在涉及转移性黑色素瘤患者的临床试验中显示出前景。然而,对BRAF抑制剂治疗的耐药机制导致了短暂的治疗反应。因此,有必要进一步深入研究,以探索对抗BRAF抑制剂有效性的耐药机制。代谢重编程在BRAF突变癌症中扮演着新兴角色。线粒体代谢及其密切相关的由线粒体介导的信号通路已成为治疗BRAF突变癌症的潜在新靶点。本文综述了BRAF突变在癌症中的作用、BRAF抑制剂的临床病理学相关性以及BRAF突变癌症中线粒体代谢、线粒体动力学和线粒体介导的死亡的最新进展。这篇综述将为未来的癌症研究提供信息,并为BRAF突变癌症的新型治疗组合奠定基础。
揭示HGF/c-Met信号在非小细胞肺癌肿瘤微环境中的作用[12]
Unveiling the Role of HGF/c-Met Signaling in Non-Small Cell Lung Cancer Tumor Microenvironment.
Shuxi Yao, et al.(通讯作者:Shu Xia)
International journal of molecular sciences
IF = 5.6
非小细胞肺癌(NSCLC)的特征是几种分子突变,这些突变导致了癌症的发展和进展。这些突变包括表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)、人表皮生长因子受体2(HER2)和间充质-上皮转化因子(c-MET)。其中,肝细胞生长因子(HGF)/c-MET信号通路在NSCLC中起着至关重要的作用。尽管如此,HGF/c-MET信号轴在重塑肿瘤微环境(TME)中的参与仍然相对未被探索。本综述探讨了HGF/c-MET信号通路在正常和癌细胞中的生物学功能,汇总了其在NSCLC肿瘤微环境中的多方面作用,包括肿瘤细胞增殖、迁移和侵袭、血管生成和免疫逃逸。此外,我们总结了MET靶向治疗在NSCLC中的当前进展和临床应用,并对MET靶向治疗NSCLC的研究方向进行了展望,如新型MET抑制剂的开发和联合免疫疗法的潜力。
[1] Wu Yilong et al.Matching-Adjusted Indirect Comparison (MAIC) of overall survival (OS) and treatment related adverse events (TRAE) comparing Capmatinib (CAP) with other Mesenchymal-epithelial transition (MET) Inhibitors for treatment of advanced non-small cell lung cancer (aNSCLC) with MET Exon 14 skipping mutations.2024 WCLC EP.12D.05
[2]Liu SY, Gou LY, LiAN, et al.The unique characteristics of MET exon 14 mutation in Chinese patients with NSCLC.J Thorac Oncol 2016;11:1503–10.
[3] Sbrana A, et al. Dabrafenib-trametinib in BRAF V600-mutated non-small-cell lung cancer: a single center real world experience. Future Oncol. 2024;20(24):1745-1751.
[4] Villaruz, L.C., et al. Clinicopathologic features and outcomes of patients with lung adenocarcinomas harboring BRAF mutations in the Lung Cancer Mutation Consortium. Cancer, 2015. 121(3): p. 448-56.
[5] issot, C., et al. Clinical characteristics and outcome of patients with lung cancer harboring BRAF mutations. Lung Cancer, 2016. 91: p. 23-8.
[6] Planchard, D., et al., Dabrafenib plus trametinib in patients with previously untreated BRAF(V600E)-mutant metastatic non-small-cell lung cancer: an open-label, phase 2 trial. Lancet Oncol, 2017. 18(10): p. 1307-1316.
[7] Fan Yun, et al . Safety and Efficacy of Dabrafenib Plus Trametinib in Chinese Patients With BRAF V600E- Mutation Positive Metastatic NSCLC.2022 WCLC . EP08.02-052.
[8] 2024年第6版《NCCN肿瘤临床实践指南:非小细胞肺癌》
[9] 中国临床肿瘤学会.非小细胞肺癌诊疗指南2024版.
[10] Long GV, et al. Final Results for Adjuvant Dabrafenib plus Trametinib in Stage III Melanoma. N Engl J Med. 2024 Jun 19.
[11] Gao Y,et al. Role of mitochondria and potential of mitochondria-targeted therapy in BRAF mutant cancer: A review. Crit Rev Oncol Hematol. 2024 Nov;203:104484.
[12] Yao S, et al. Unveiling the Role of HGF/c-Met Signaling in Non-Small Cell Lung Cancer Tumor Microenvironment. Int J Mol Sci. 2024 Aug 22;25(16):9101.
审批码TAB0033055-76942,有效期为2024-10-25至2025-10-24,资料过期,视同作废
排版编辑:YX











 苏公网安备32059002004080号
苏公网安备32059002004080号


