近年来,年轻乳腺癌患者发病率不断呈现上升趋势,该群体的复发和转移风险高,整体预后差。特别是携带BRCA1/2基因突变的患者,其复发风险及对侧乳腺癌发病率显著增高,并常伴有明显的家族遗传性。
随着精准医学的不断发展,乳腺癌患者的治疗也更加趋向个体化,精准化。其中BRCA1/2基因检测在精准医疗时代具有极为重要的临床意义,特别是在肿瘤的风险评估及个体化治疗中。
中山大学孙逸仙纪念医院刘强教授牵头的YBCC专家组也深入探讨了BRCA1/2基因检测的适应症,旨在为这部分患者提供个性化的治疗策略,包括确定是否需要进行对侧乳腺切除等手术方案,并改进术后监测与辅助化疗计划。本期特邀刘强教授针对BRCA基因的介绍、BRCA1/2 基因检测的临床意义、适用人群以及具体检测流程进行深入探讨,以飨读者。
鉴往知来:BRCA 基因的奥秘
乳腺癌易感基因(BRCA)是重要的抑癌基因,通过修复双链DNA断裂参与同源重组修复(HRR)途径,从而防止细胞过度增殖并维持基因组稳定性。BRCA1和BRCA2是与乳腺癌相关的最重要且研究最广泛的易感基因,分别于 1990年与1994年被鉴定出来。其中,BRCA1位于人类染色体17q21上,含有23个外显子, 编码由1863个氨基酸残基构成的蛋白质;而BRCA2位于人类染色体13q12上,含有27个外显子,编码由3418个氨基酸残基构成的蛋白质。BRCA1/2编码的蛋白作用于多种细胞生命活动过程,包括DNA损伤修复、基因转录调控和细胞周期调节等[1]。
BRCA1/2基因突变会导致同源重组缺陷,使得基因组不稳定性显著增加,与包括乳腺癌、卵巢癌、前列腺癌、胰腺癌等多种肿瘤的发生发展密切相关。根据突变类型,BRCA突变包括单核苷酸变异(SNV)、小片段插入/缺失(InDel)、拷贝数变异(CNV)和大片段重排(LGR)等,同时其内含子发生的变异也可能影响蛋白质功能。此外,BRCA突变分散遍布于2个基因序列的全长,很难找到固定的突变热点,即使存在突变热点,在不同地域及不同种族之间差异也很大。根据突变来源,BRCA基因突变分为胚系突变(gBRCAmut)和体细胞突变(sBRCAmut)。gBRCAmut是指来源于精子或卵母细胞的生殖细胞突变,导致机体所有细胞都带有突变,可以遗传给后代,胚系检测一般使用血液、唾液、口腔拭子等样本,目前以血液(白细胞)样本为主;sBRCAmut是指发生于肿瘤细胞中的BRCA基因突变,为非遗传性突变。在乳腺癌中以gBRCA突变为主,占所有BRCA突变的70%以上[2]。
立足当下
BRCA1/2 基因检测的重要临床意义
遗传咨询与风险评估
全球范围内,大约5%~10%的乳腺癌患者、10%~15%的卵巢癌患者、4%~7%的胰腺癌患者、6%的转移性前列腺癌患者携带gBRCA1/2突变的人群[3]。另有研究显示,对于携带BRCA1和BRCA2突变的人群,其80岁前罹患乳腺癌的终生累积风险分别高达72%和69%[4]。因此,了解BRCA1/2基因状态,有助于进行相关的遗传风险管理,包括采取预防性手术、制定定期筛查方案、对家属遗传风险进行评估等。
判断疾病风险与预后
研究表明,与非突变患者相比,携带BRCA突变的乳腺癌其肿瘤组织病理分级更高、中枢神经系统转移更多[5]。此外,多项研究均显示携带BRCA1/2基因突变的乳腺癌有预后更差的趋势。一项纳入60项研究共105 220例乳腺癌患者的Meta分析显示,BRCA1基因突变患者OS和乳腺癌特异性生存期(BCSS)短于未突变者(OS:HR=1.30,95%CI: 1.11~1.52, P=0.001; BCSS: HR=1.45, 95%CI: 1.01~2.07, P=0.045),BRCA2突变患者BCSS短于未突变者(HR=1.29, 95%CI: 1.03~1.62,P=0.03)[6]。
指导手术决策
保乳手术是大多数早期乳腺癌患者的首选方式,但对于携带gBRCAm的患者,是否应选择更为激进的单侧或双侧乳房切除术一直存在争议。一项关于保乳术后同侧新发肿瘤风险的Meta分析[7]表明,gBRCAm携带者的新发肿瘤风险较非携带者显著升高。然而,保乳手术与乳房切除术的OS或远处复发率并无显著差异。
NCCN指南[8]建议,对于年轻(≤35岁)或绝经前的gBRCAm早期乳腺癌患者,应在与医生充分讨论后考虑额外的风险降低策略,同时考虑对侧乳腺癌的风险以及原发肿瘤复发的风险。ASCO指南[9]也指出,对于gBRCAm患者,在权衡对侧乳腺癌风险、肿瘤复发率以及患者能否进行长期影像学监测(如乳腺X线或磁共振成像)的前提下,可以考虑保乳治疗策略。中国年轻乳腺癌(YBCC)专家组[10]则对此进行了投票,投票结果显示,无论对于有乳腺癌或卵巢癌家族史的年轻乳腺癌患者,还是患有三阴性乳腺癌的年轻患者,均有超过半数专家(分别为53%和52%)不推荐其等待BRCA1/2基因检测结果再决定手术方式。对于术前已知携带BRCA1/2基因胚系致病突变的年轻乳腺癌患者,如果具备保乳条件,72%的专家认为需与患者充分沟通患侧复发和对侧新发乳腺癌的风险,并充分考虑患者年龄、家族史及个人意愿等条件后再决定是否保乳。
指导用药
(1)BRCA1/2基因突变与铂类化疗:铂类化疗药物通过引起 DNA 损伤破坏基因组稳定性,引起细胞死亡,被广泛应用于临床一线治疗各种肿瘤。晚期或复发、转移性三阴性乳腺癌患者若携带BRCA1/2基因突变,对铂类化疗有着更高的客观缓解率,TNT III 期研究[11]结果表明,在gBRCAm TNBC患者亚组中,与多西他赛相比,卡铂显著提高了ORR (68.0% vs. 33.3%; P =0.03)和PFS(6.8 个月s vs. 4.4 个月)。NCCN指南推荐对于携带gBRCA1/2突变的复发性/IV期TNBC患者,将铂类药物(顺铂和卡铂)列为首选治疗方案。
(2)BRCA1/2基因突变与 PARP抑制剂的合成致死效应:PARP是一种修复DNA单链损伤至关重要的酶,当PARP抑制剂选择性抑制 PARP介导的DNA单链损伤修复途径时,未修复的 DNA 单链损伤经过复制后将转化为 DNA 双链断裂。正常细胞可通过同源重组修复 DNA 双链断裂,然而在BRCA1/2基因突变的肿瘤细胞中,因为同源重组修复功能的缺陷,DNA 双链断裂得不到修复,DNA 损伤不断积累,最终导致细胞死亡,即合成致死效应。
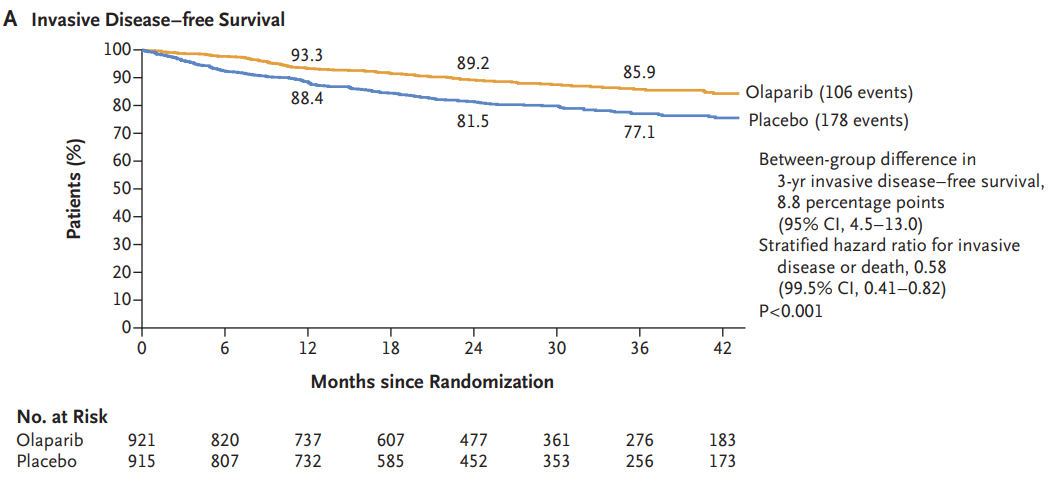
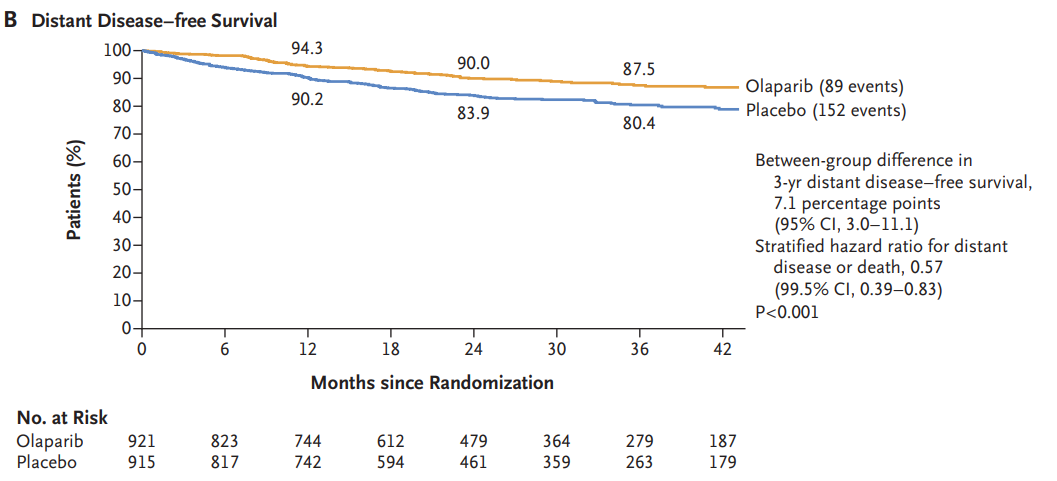
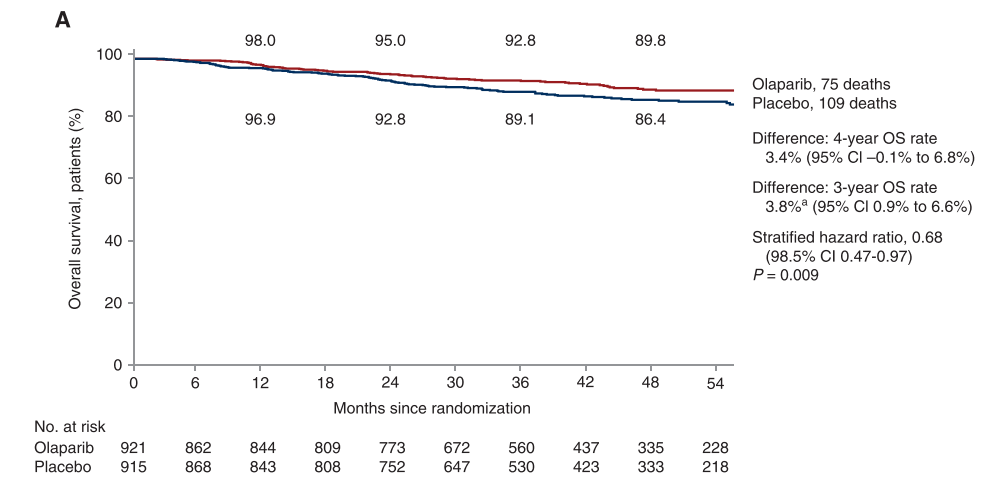
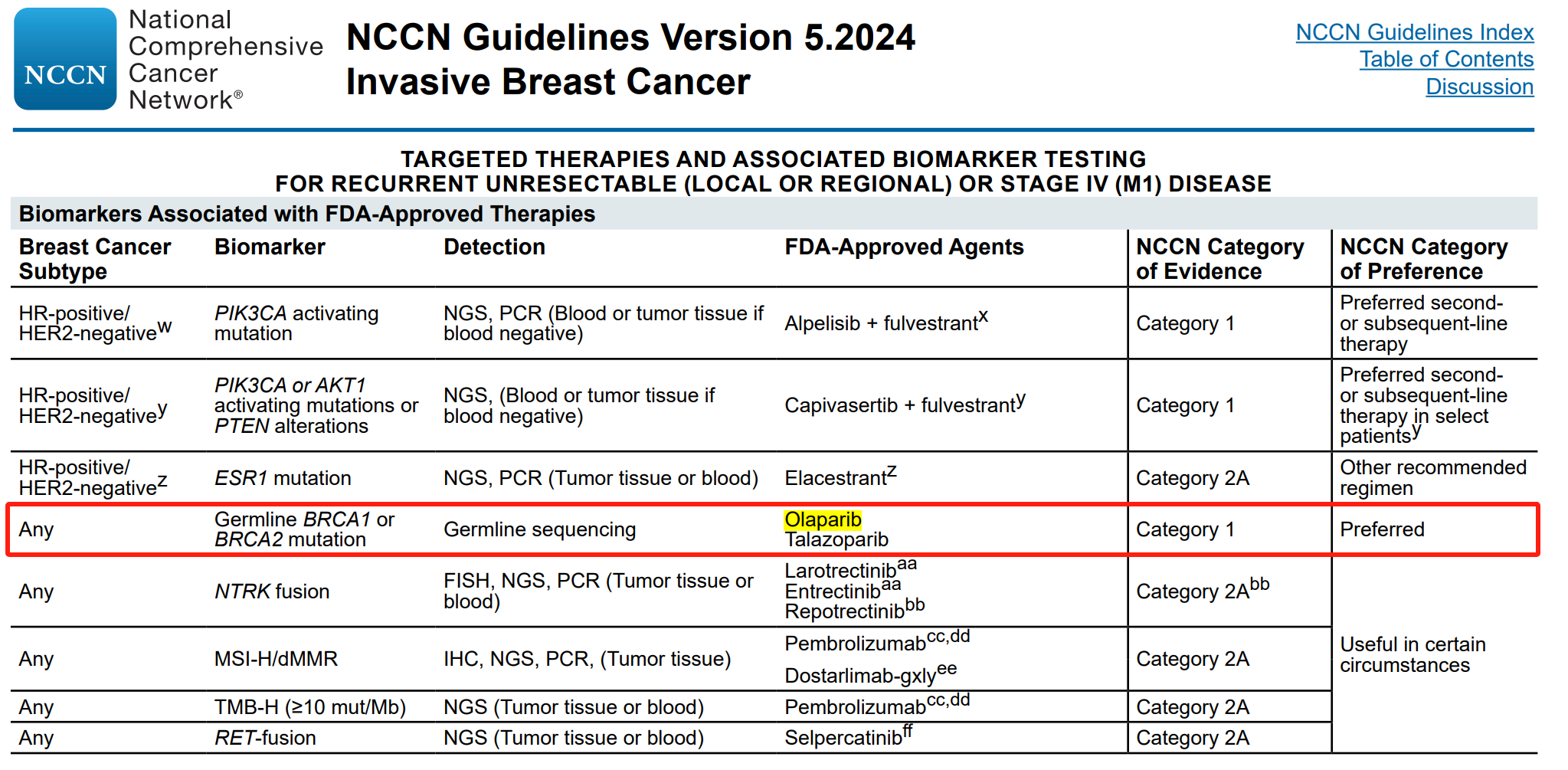
在早期阶段,OlympiA研究[12]评估了在携带gBRCA1/2突变的高危HER2阴性乳腺癌患者中,化疗后奥拉帕利与安慰剂1年治疗的疗效。结果显示,奥拉帕利组和安慰剂组的3年iDFS率分别为85.9% vs 77.1%,降低疾病复发、新发肿瘤或死亡的风险42%(HR=0.58,P<0.0001);两组3年DDFS分别为87.5% vs 80.4%,降低远处疾病复发或死亡风险43%(HR=0.57,P < 0.01)。中位随访 3.5 年,两组4年OS率分别为89.8% vs 86.4%(HR=0.68;P=0.01),降低了32%的死亡风险[13]。基于此,NCCN指南建议,对于携带gBRCA 1/2突变的HER2阴性乳腺癌患者,可考虑加用1年奥拉帕利辅助治疗。

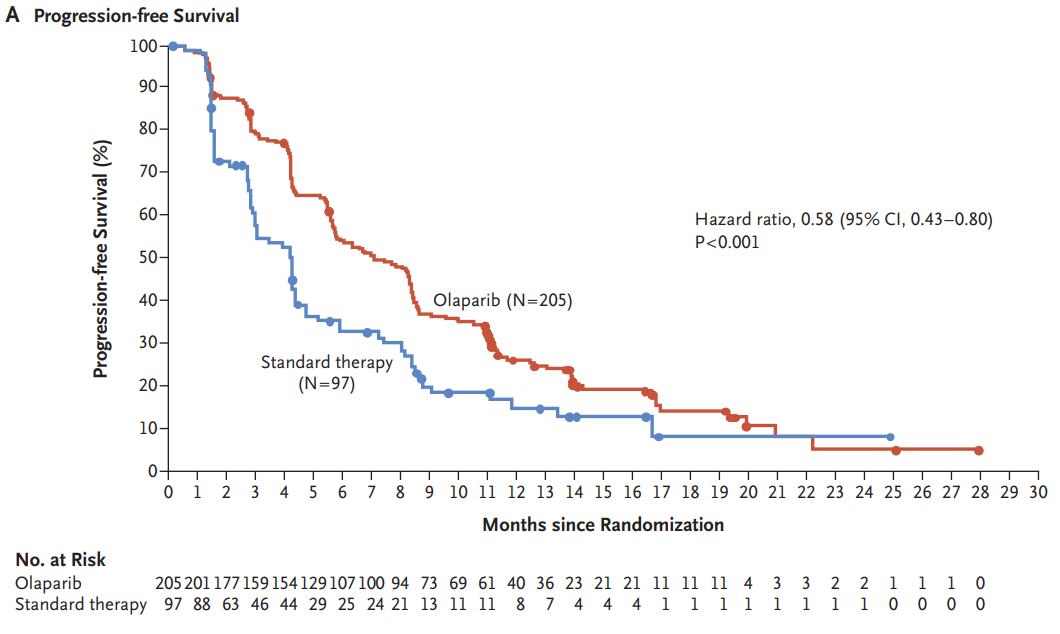
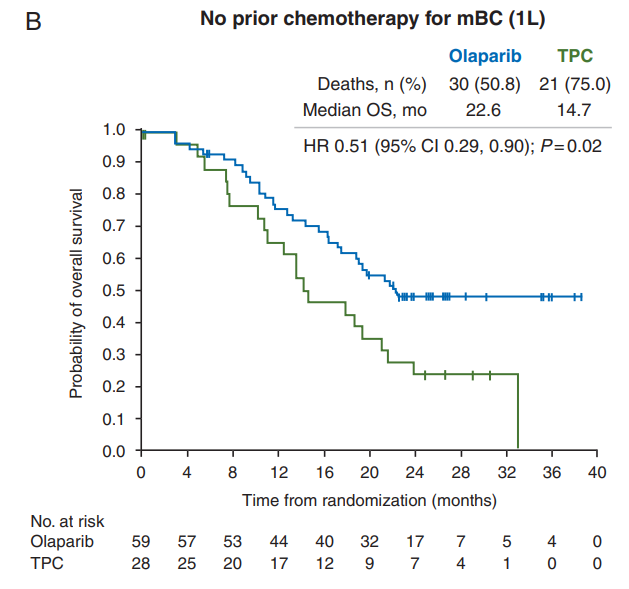
在晚期阶段,OlympiAD Ⅲ期临床试验[14]共纳入302例BRCA1/2突变且HER2阴性转移性乳腺癌患者,按照2∶1的比例随机分配至奥拉帕利组或医师选择的标准化疗方案组。奥拉帕利组ORR较标准化疗方案组提高,分别为59.9%(95%CI:52.0%~67.4%)和28.8%(95%CI:18.3%~41.3%)。PFS分别为7.0个月和4.2个月,疾病进展或死亡风险降低42%(HR=0.58,95%CI:0.43~0.80,P < 0.01)。延长随访发现,奥拉帕利一线治疗的中位OS较标准化疗方案组延长(22.6个月vs 14.7个月,HR=0.51,95%CI:0.29~0.90,P=0.02)。此外,在III期EMBRACA试验[15]中,他拉唑帕利改善了gBRCA1/2突变患者的PFS和ORR(PFS:8.6个月vs 5.6个月,ORR:62.6%vs27.2%),但未改善总生存期。基于上述 III 期试验的结果,NCCN指南推荐奥拉帕利和他拉唑帕利作为gBRCA1/2突变晚期乳腺癌患者的首选。
见微知 “著”
BRCA 基因检测的指南推荐人群及检测流程
NCCN 指南建议对具有以下特征的乳腺癌患者进行BRCA检测:
诊断年龄≤50岁
符合以下治疗指征
1) 在转移性乳腺癌的系统治疗决策中使用 PARP 抑制剂
2) 在高风险、HER2阴性乳腺癌的辅助治疗决策中使用奥拉帕利
符合以下病理/组织学特征
1) 三阴性乳腺癌
2) 多发性乳腺癌
3) 伴有弥漫性胃癌个人或家族史的浸润性小叶癌
男性乳腺癌患者
具有阿什肯纳兹犹太血统的乳腺癌患者
具有肿瘤家族史的患者
1) ≥1 直系亲属有≤50岁发病的乳腺癌史
2) ≥1 直系亲属确诊男性乳腺癌/卵巢癌/胰腺癌/转移性、高危或极高危前列腺癌
3) ≥3旁系亲属确诊乳腺癌和/或前列腺癌(包括患者本人)

ESMO 2023 年指南[16]建议,符合国家胚系检测标准以及适合奥拉帕利治疗的早期乳腺癌患者、所有新诊断的HER2 阴性转移性乳腺癌以及CDK4/6治疗失败后的HR+、HER2阴性转移性乳腺癌的患者进行 gBRCA 检测[17]。
此外,YBCC专家组针对乳腺癌患者推荐行BRCA1/2基因胚系突变检测的指征也进行了投票。对于有乳腺癌或卵巢癌等相关家族史、三阴性乳腺癌和40岁以下的年轻乳腺癌患者,由于其BRCA1/2基因胚系突变频率较高,分别有97%、91%和63%的YBCC专家推荐其行BRCA1/2基因胚系突变检测,而35%的专家推荐将BRCA1/2基因胚系检测的年龄延后至<45岁,另有29%的专家推荐NCCN指南的BRCA1/2基因胚系检测指征:需要化疗的HER2阴性乳腺癌患者。
BRCA 基因突变检测通常基于下一代测序 (NGS) 技术,这项技术通过靶向测序分析特定的基因,具有较低的成本、高精度和良好的解释性。BRACAnalysis CDx 是目前唯一被 FDA 批准的伴随 gBRCAm 诊断测试,用于评估奥拉帕利在乳腺癌患者中的适用性。基于NGS技术的BRCA1/2基因检测流程可以概括为以下 6个环节,即样本获取及处理、核酸抽提、文库构建、上机测序、下机数据分析以及变异解读,每个环节都应包括相应的质控步骤。
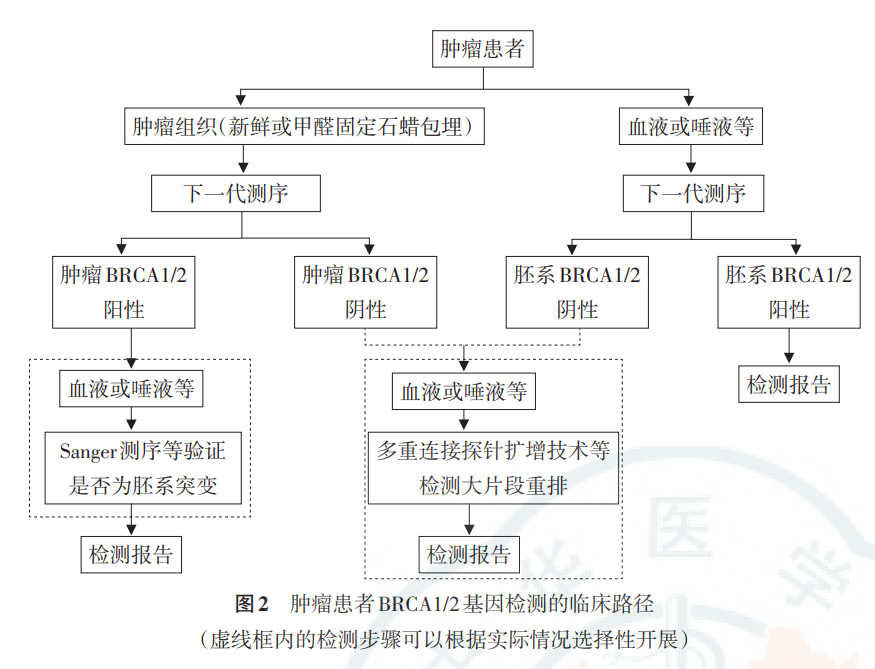
图9:肿瘤患者 BRCA1/2基因检测的临床路径(虚线框内的检测步骤可以根据实际情况选择性开展)[18]
专家介绍
中山大学孙逸仙纪念医院外科主任
逸仙乳腺肿瘤医院执行副院长、乳腺肿瘤中心主任、乳腺外科主任
ESO-ESMO年轻乳腺癌国际共识专家组成员
中国临床肿瘤学会乳腺癌专业委员会常务委员兼副秘书长
中国抗癌协会乳腺癌专业委员会常务委员
中国抗癌协会肿瘤分子医学专业委员会常务委员
广东省医学会乳腺病分会主任委员
广东省抗癌协会乳腺癌专业委员会候任主任委员
中国普通外科杂志副主编和中华内分泌外科杂志副总编辑
新加坡国立大学外科博士,回国前任哈佛大学 Dana Farber癌症中心讲师
特别提醒:第二届YBCC大会即将于2024年12月27日—28日在广州召开,大会将聚焦年轻乳腺癌临床热点和争议问题。本次大会也将推出中国首个可供患者查询包含BRCA1/2基因等突变基因在内的致病率信息数据库,以便更好地帮助医生进行医疗决策,敬请期待。

[1]Wan A, et al. Biochim Biophys Acta Rev Cancer. 2023 Jul;1878(4):188907.
[2]Winter C, et al. Ann Oncol. 2016;27(8):1532-1538. doi:10.1093/annonc/mdw209
[3]Szentmartoni G, et al. Biomedicines. 2024 Mar 6; 12(3): 593.
[4]Dubsky P, et al. NPJ Breast Cancer. 2024 Sep 5;10(1):77.
[5]Aleskandarany M, Cet al. Breast Cancer Res Treat. 2015; 150(1): 81-90.
[6]ZHONG Q, et al. Clin Cancer Res, 2015, 21(1):211-220.
[7]Valachis A, et al. Breast Cancer Res Treat. 2014;144:443–55.
[8]NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic V.5.2024.
[9]Tung NM, et al. J Clin Oncol. 2020;38:2080–106.
[10]中国临床肿瘤学会乳腺癌专家委员会,等. 中华医学杂志,2023,103(6):387-403.
[11]Tutt A, et al. Nat Med. 2018;24:628–37.
[12]Tutt ANJ, et al. N Engl J Med. 2021 Jun 24; 384(25): 2394-2405.
[13]Geyer CE Jr, et al. Ann Oncol 2022;33:1250–1268.
[14]Robson ME, et al. Ann Oncol, 2019, 30(4): 558-566.
[15]TuttA. Et al. Ann Oncol,2018,29(1):18-21.
[16]Loibl S, et al. Ann Oncol. 2024; 35: 159–82.
[17]ESMO. Breast cancer pocket guideline 2023 https://data.esmo.org/guidelines/pdf/ESMO_2023_BreastCancer.html. 2024.
[18]《基于下一代测序技术的BRCA1/2基因检测指南(2019版)》编写组. 中华病理学杂志,2019,48(9):670-677.
排版编辑:肿瘤资讯-yu











 苏公网安备32059002004080号
苏公网安备32059002004080号


