
神经营养酪氨酸受体激酶(NTRK)基因融合已被证实为多种儿童和成人实体瘤的致癌驱动基因之一[1],其在儿童高级别胶质瘤(HGG)和低级别胶质瘤(LGG)中的发生率分别高达6.2%和1.6%[2]。拉罗替尼(Larotrectinib)是一种高选择性、对CNS肿瘤具有高度活性的TRK抑制剂,已获批用于治疗携带NTRK融合基因的成人和儿童实体瘤患者[3-4]。临床研究及实践中,拉罗替尼持续显示出良好的疗效与安全性,且在儿童患者中似乎显示出较成人更好的疗效应答[5]。在2024年的第21届国际儿科神经肿瘤学研讨会(2024 ISPNO)上,拉罗替尼治疗儿童TRK融合原发性CNS肿瘤患者的长期随访研究数据进行了更新[6]。本期,我们特邀我们特邀首都医科大学附属北京儿童医院何乐健康和首都医科大学附属北京同仁医院张伟令教授,为我们解读该研究,为临床诊疗指引方向。
特邀专家
国家儿童医学中心、首都医科大学附属北京儿童医院
国家卫生健康委儿童血液病、恶性肿瘤专家委员会 副主任委员
国家卫生健康委儿童血液病、恶性肿瘤专家委员会 病理专业委员会 主任委员
中华医学会病理学分会儿科学组组长
中国抗癌协会小儿肿瘤专业委员会 病理学组 组长
中国抗癌协会肿瘤病理专业委员会 儿童肿瘤病理学组 组长
福棠儿童医学发展研究中心 病理专业委员会 主任委员
中国研究型医院学会超微及分子病理专业委员会妇儿学组副组长
中国研究型医院学会超微及分子病理专业委员会常委
中华医学会北京分会病理专业委员会委员
北京医师协会 临床病理专科医师分会理事
北京肿瘤学会病理专业委员会常委
中华病理学杂志 编委
诊断病理学杂志 常委
擅长儿童病理尤其是儿童肿瘤病理的诊断。在国内外杂志上发表论文100余篇,获各级科学奖三项,主编【临床病理诊断与鉴别诊断-儿童疾病】,第五版WHO 【Pediatric tumors】编委。
首都医科大学附属北京同仁医院儿科
中国抗癌协会小儿血液肿瘤分会委员
北京抗癌协会小儿血液肿瘤分会委员
中国研究型医院学会儿科肿瘤专业委员会常务委员
中国抗癌协会儿童肿瘤整合康复专业委员会常务委员
中华医学会儿科学分会精准医学委员会委员
北京医学会儿科分会委员
中国优生科学协会罕见病及精准医学组委员
北京医学会罕见病分会委员
中国生物医学工程学会靶向治疗技术分会儿童肿瘤精准治疗专委会常委
世界华人医师儿科协会血液与肿瘤专家委员会委员
中国女医师协会儿科学分会委员
国际儿科杂志编委
中国医学前沿杂志编委
研究速递
研究名称:
拉罗替尼在儿童NTRK基因融合原发性CNS肿瘤患者中的长期疗效和安全性:一项更新分析。
研究概述:
本研究纳入两项临床试验(NAVIGATE研究和 SCOUT研究)中,年龄<18岁的儿童NTRK基因融合CNS肿瘤患者(n=38例),主要研究终点为经过独立审查委员会(IRC)根据神经肿瘤疗效评估标准(RANO)评估的客观缓解率(ORR)。在事后分析中,允许没有疾病进展(PD)的儿童患者停止拉罗替尼治疗并继续处于随访观察状态,停止治疗的儿童患者的疾病进展和治疗应答由研究者根据RANO或RECIST v1.1标准进行评估,研究设计如图1所示。

图1 研究设计
研究结果:
· 基线数据
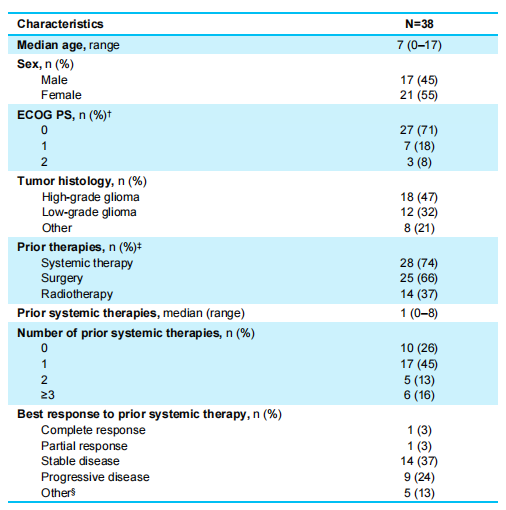
截至2023年7月20日,共有38例儿童患者被纳入分析,基线数据如表1所示。所有儿童患者的中位年龄为7岁(范围0~17岁),HGG和LGG儿童患者分别有18例(47%)、12例 (32%);既往曾接受过系统治疗、手术和放疗的儿童患者比例分别为74%、66%、37%。既往治疗中最佳反应为完全缓解(CR)、部分缓解(PR)和稳定状态(SD)的儿童患者分别有1例(3%)、1例(3%)和14例(37%),有5例儿童患者(13%)既往治疗无法进行疗效评价。
表1 儿童患者基线特征数据
· NTRK融合状态
通过 Sanger测序和NGS检测手段,分别在1例(3%)和37例(97%)患者中识别出NTRK基因融合,相比于NTRK1(6例,16%)和NTRK3基因融合(4例,11%),NTRK2基因融合为最常见的类型(28例,74%)。此外,一共检测出29种融合伴侣,其中AGAP1::NTRK2(8%)、GKAP1::NTRK2(8%)和NACC2::NTRK2(8%)是最常见的融合,如图2所示。
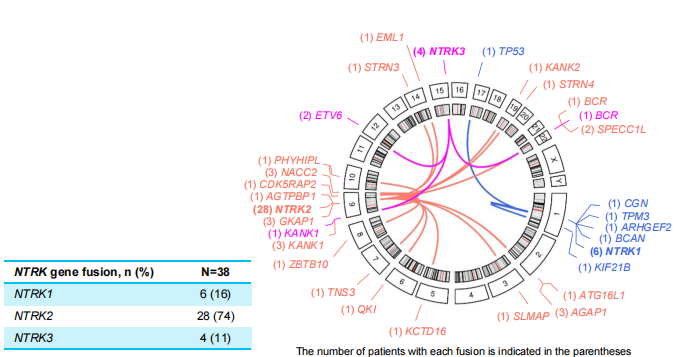
图2 NTRK基因融合检测
· 治疗应答
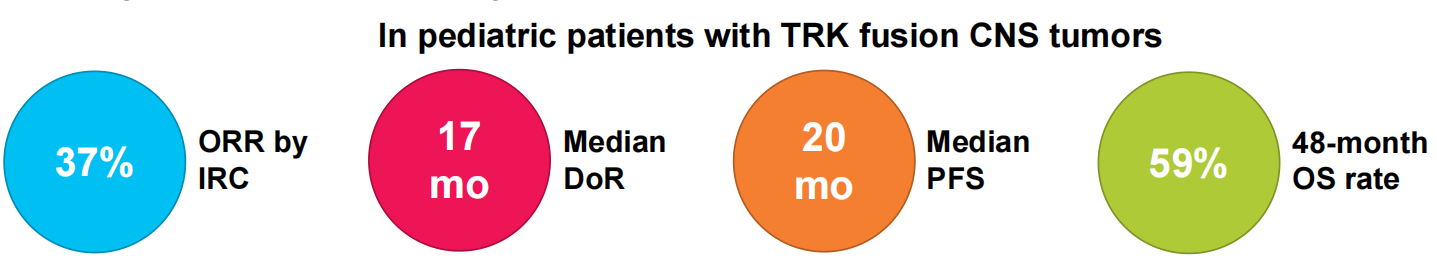
研究结果提示,所有儿童患者的ORR为37%(95%CI:22~54),其中3例(8%)为CR,11例(29%)为PR;HGG和LGG组的ORR分别为33%(95% CI:13~59)和42%(95%CI:15~72)。所有病灶可测量儿童患者(27例)的ORR为52%(95%CI:32–71)。
所有儿童患者的24周疾病控制率(DCR)为74%(95%CI:57~87),HGG和LGG组的DCR分别为72%(95%CI:47~90)和92%(95%CI:62~100),治疗应答数据如表2所示,儿童患者肿瘤退缩情况和治疗周期如图3所示。
表2 儿童患者治疗应答数据
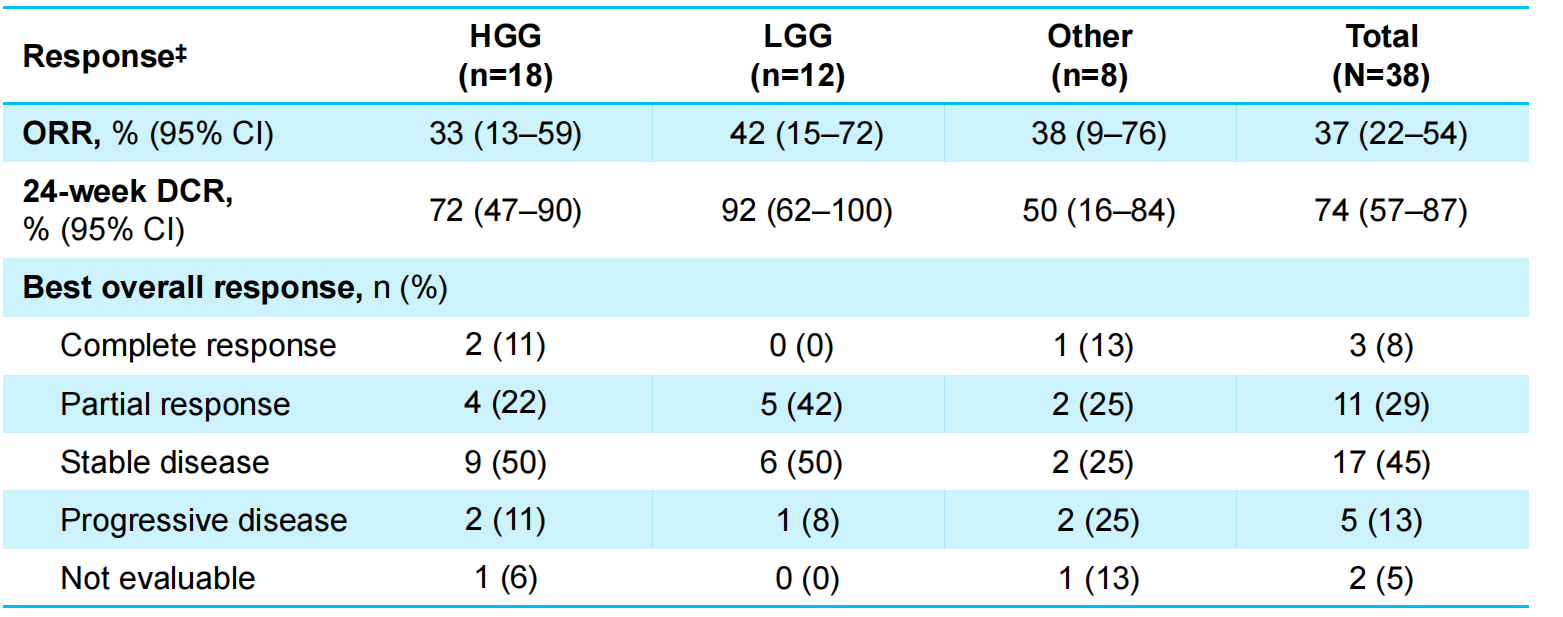
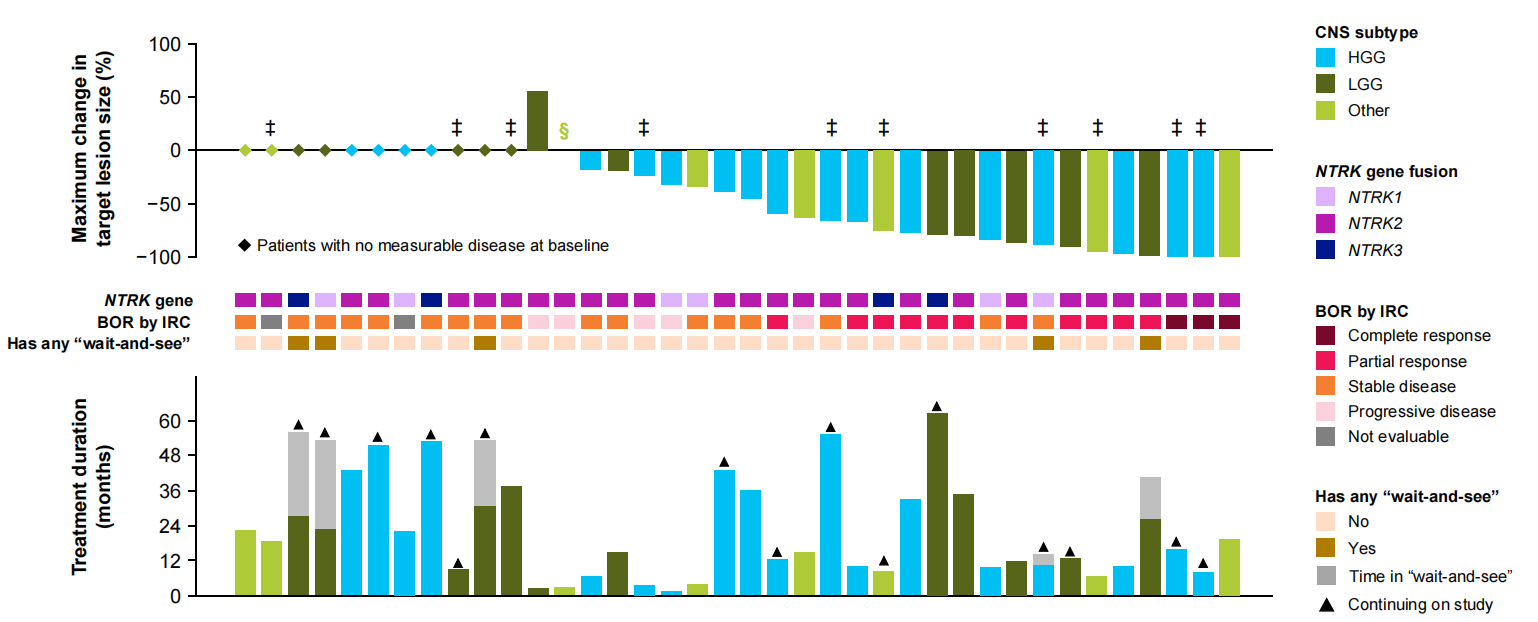
图3 儿童患者肿瘤退缩情况和治疗周期
· “等待观察”状态儿童患者
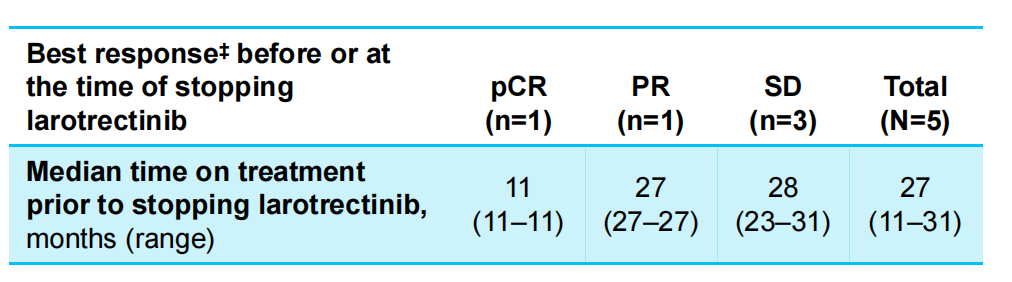
4例LGG儿童患者与1例HGG儿童患者进入到了“等待观察”状态,中位“等待观察”时间为20个月(范围4~29个月),5例儿童患者在数据截止时仍存活,15例儿童患者在停止拉罗替尼治疗时的状态分别为病理学完全缓解(pCR,1例)、PR(1例)、SD(3例),儿童患者在停止拉罗替尼治疗时的治疗时间数据如表3所示。
表3 等待观察”状态儿童患者数据
· 儿童患者生存数据
在中位随访时间分别为9、40和46个月时,缓解持续时间(DoR)、无进展生存期(PFS)和总生存期(OS)分别为17个月[95%CI:6~不可估计(NE)]、20个月(95%CI:11~51)和未达到;48个月PFS率和48个月OS率分别为33%(95%CI:14~51)和59%(95%CI:41~78;图4)。
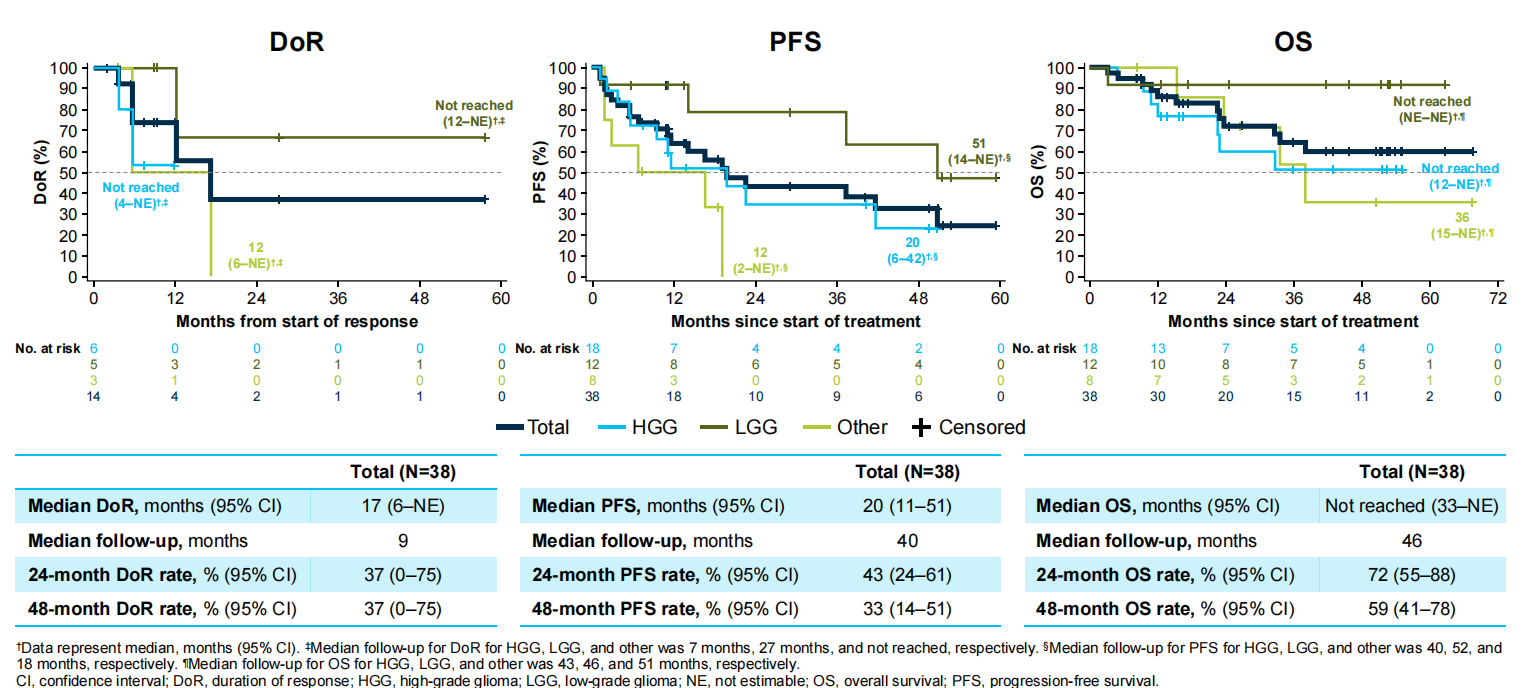
图4 儿童患者DoR、PFS和OS数据
· 安全性数据
23例(60.5%)的儿童患者发生治疗相关不良事件(TRAE),主要为1~2级(图5)。4例(10.5%)的儿童患者报告了3~4级TRAE;4例(10.5%)的患者经历了神经系统TRAE,均为1~2级;没有儿童患者因TRAE而停止治疗。
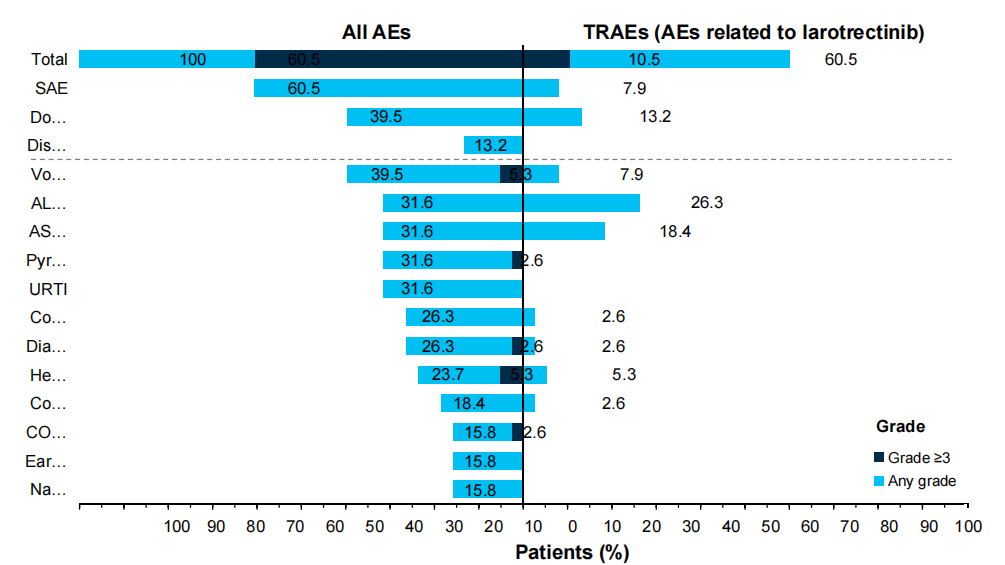
图5 儿童患者不良事件发生情况
研究结论:
拉罗替尼在NTRK基因融合原发性CNS肿瘤的儿童患者中表现出快速且持久的缓解、高DCR和良好的安全性,这一疗效反应在HGG、LGG和其他较少见的原发性CNS肿瘤种均可见。5例进入“等待观察”状态的儿童患者未观察到疾病进展,未来仍需更长时间的随访来确定哪些患者可以在中途停止治疗。此外,该研究结果也支持在CNS肿瘤儿童患者中更广泛地采用NGS检测来确定NTRK基因融合状态。
专家解读
张伟令:长期随访数据彰显长效获益,拉罗替尼有望造福NTRK基因融合CNS肿瘤儿童患者
原发性中枢神经系统(CNS)肿瘤是儿童癌症的第二大病因,约占所有儿童癌症诊断的四分之一[7-9],目前,手术仍是首选治疗方法,但对于部分恶性程度较高的肿瘤(如HGG),可能会由于患病部位特殊而无法手术,或因无法切除干净而导致肿瘤复发。虽然放化疗也是CNS肿瘤的主要治疗手段之一,但化疗的毒副作用和放疗对神经系统功能的影响,也会给CNS肿瘤儿童患者带来极大的治疗痛苦,甚至影响儿童患者的远期健康,这导致放疗和化疗的临床应用受限[10-11]。因此,临床迫切需要能够穿透血脑屏障且有效安全的治疗方案。
NTRK基因融合的发现以及TRK抑制剂的问世,给原发性CNS肿瘤儿童患者带来了新的治疗希望。拉罗替尼是一种TRK抑制剂,现已在我国获批治疗NTRK基因融合阳性的局部晚期或转移性实体瘤的成人和儿童患者,开启了肿瘤精准诊疗新时代。基于既往和现有的临床数据,《NCCN儿童中枢神经系统肿瘤指南(2023年v1版)》推荐拉罗替尼作为NTRK基因融合阳性的复发或进展性CNS儿童肿瘤患者的优选治疗方案,2021年发布的《加拿大儿童患者TRK融合肿瘤的生物标志物检测和治疗共识》中也建议不可手术或存在远处转移的NTRK基因融合阳性的高级别神经胶质瘤儿童患者考虑使用拉罗替尼一线治疗[12-13]。
本研究的结果进一步证实了拉罗替尼在穿透血脑屏障方面的能力,以及长期治疗中能够发挥持久的抗肿瘤作用,研究中的48个月PFS率和48个月OS率分别高达33%和59%,证实了拉罗替尼在原发性CNS肿瘤儿童患者长期治疗中的临床价值,为此类患者带来长期生存希望。此外,本研究有74%的儿童患者疾病控制至少持续了24周,HGG儿童患者的24周DCR为72%,而LGG儿童患者中,这一数据高达92%。更加值得一提的是,本研究入组的患者仅10例(26%)在应用拉罗替尼时是一线治疗,既往曾接受≥二线治疗的患者比例达29%,这意味着本研究入组的大部分儿童患者有前线治疗历史,可能意味着肿瘤较难控制,也可能意味着儿童患者一般状态较差,更易出现治疗不良事件。结合入组儿童患者基线状态角度分析,拉罗替尼的疗效反应更加值得肯定。而从安全性角度,本研究入组的儿童患者仅4例(10.5%)儿童患者报告了3~4级TRAE,没有儿童患者因TRAE导致治疗中断,意味着拉罗替尼的安全性良好,大部分儿童患者可耐受长期治疗。
期待未来有更多的长期随访数据、更大样本量的临床观察分析进一步夯实拉罗替尼在原发性CNS肿瘤儿童患者治疗中的疗效和安全性,期待随着未来越来越多的研究开展,拉罗替尼将造福更多NTRK融合肿儿童患者。
何乐健教授:原发性CNS肿瘤常见NTRK2基因融合,NTRK精准检测将为患者带来更多获益
TRK抑制剂现已成为NTRK基因融合实体瘤患者的重要治疗手段,使得NTRK融合基因检测被推荐用于晚期成人和儿童实体瘤患者;对于发生率高的局部晚期肿瘤患者,在新辅助治疗前,也应进行NTRK融合基因检测[14]。但在临床实践中,接受NTRK检测的患者仍相对较少,我国接受检测的儿童患者甚至不足2%。鉴于上述研究中,NTRK基因融合原发性CNS肿瘤儿童患者,经TRK抑制剂拉罗替尼治疗后,长期存活;以及既往NTRK基因融合实体瘤的疗效,应推荐相关儿童肿瘤患者进行规范化的NTRK融合基因检测。
在大多数实体瘤中,NTRK基因融合中以NTRK1和NTRK3基因融合病例更为常见,而NTRK2基因融合相对少见[16-19];在中枢神经系统肿瘤中,NTRK2基因融合则更为常见。此外,越来越多的NTRK融合伴侣被发现,但是目前尚不清楚特定的融合伴侣是否会影响肿瘤的进展以及拉罗替尼的疗效,未来需要开展相关研究来进一步证实。
准确检测出NTRK基因融合至关重要。如今,有多种NTRK的基因融合检测方法,包括FISH、IHC、RT-PCR、基于DNA或RNA的NGS等,这些方法各有优势和局限性,如FISH、IHC、RT-PCR的检测周期相抵较短,IHC和RT-PCR的价格相对较低,但IHC无法鉴别融合类型和伴侣基因,FISH对操作/判读技术要求较高,RT-PCR对样本质量要求较高等,相比较而言,NGS检测虽然检测周期较长、价格较昂贵,但具有高度的敏感性,可检测出未知融合基因[5]。因此,条件允许时,NTRK基因检测的首选方法是基于DNA/RNA的NGS。若NGS不可及,可以使用RT-PCR或FISH方法检测,由于IHC敏感性低,常作为初诊筛查时使用。本研究中有37例儿童患者通过NGS检测证实了存在NTRK融合,再次显示这一检测方法在NTRK融合基因检测中的应用价值。
未来,期待NTRK融合基因检测能够得到关注,也期待能有更多的循证医学证据让我们更加深入的了解NTRK基因融合类型和融合伴侣对肿瘤发生、发展乃至治疗中的应用价值,让病理诊断能够在精准治疗中发挥更大价值。
1. Amatu A, et al. Ann Oncol. 2019;30:viii5–viii15.
2. Forsythe A, et al. Ther Adv Med Oncol. 2020;12:1758835920975613.
3. Bayer. VITRAKVI US PI. 2021.
4. Bayer. VITRAKVI SmPC. 2021.
5. 中国抗癌协会小儿肿瘤专业委员会, 等. 中国肿瘤临床, 2023, 50(17): 865-872.
6. Sebastien Perreault, et al. ISPNO 2024, (HGG-02).
7. Siegel RL, et al. Cancer statistics, 2020. CA Cancer J Clin 2020 Jan;70(1):7-30.
8. Ramadeep SA, et al. Neuro Oncol. 2009 Aug;11(4):403-13.
9. Lacour B, et al.Eur J Cancer Prev. 2010 May;19(3):173-81.
10. Lafay-Cousin L, et al. Oncologist. 2009;14(4):433–444.
11. El-Ayadi M, et al. Oncotarget. 2017;8(38):64564–64578.
12. Gajjar A, et al.J Natl Compr Canc Netw, 2022, 20(12):1339-1362.
13. Perreault S, et al. Curr oncol, 2021, 28(1):346-366.
14. Xu C, et al. Thorac Cancer. 2022 Nov;13(21):3084-3097.
15. Kriti Jindal , et al. 2021 ESMO. abstract 102P.
16. Vaishnavi A, et al. Cancer Discov. 2015;5(1):25–34.
17. Drilon A, et al. N Engl J Med. 2018;378(8):731–739.
18. Kummar S, Lassen UN. Target Oncol. 2018;13(5):545–556.
19. Stransky N, et al. Nat Commun. 2014;5:4846.
20. Solomon JP, et al. Mod Pathol. 2020;33(1):38-46.
审核号:MA-LAR-CN-0250-1
排版编辑:肿瘤资讯-ZY











 苏公网安备32059002004080号
苏公网安备32059002004080号


