本期精选6篇在2024年7月份发表的结直肠癌领域文献,部分研究邀请到山东第一医科大学附属肿瘤医院李明焕教授进行深入解读。
专家介绍
肿瘤学博士,主任医师、硕士研究生导师
齐鲁卫生与健康领军人才
中国抗癌协会放射肿瘤学青年委员
山东省抗癌协会放射肿瘤分会常委
山东省医学会泌尿男生殖系肿瘤MDT组副主委
山东省临床肿瘤学会前列腺癌专委会副主委
山东省免疫学会微生态免疫专委会副主委
山东省医师协会放疗专业委员
在FOLFOX联合帕尼单抗诱导后,接受氟尿嘧啶/亚叶酸联合或不联合帕尼单抗维持治疗的RAS野生型转移性结直肠癌患者,皮肤病学相关的生活质量结局:II期PanaMa(AIO KRK 0212)研究预设的二次分析1
评价转移性结直肠癌(mCRC)维持治疗效果的关键终点包括生存和生活质量结果。该研究的目的是在亚叶酸、氟尿嘧啶和奥沙利铂联合帕尼单抗诱导治疗后,比较分别接受氟尿嘧啶和亚叶酸(FU/FA)+帕尼单抗(Pmab)或单独FU/FA作为维持治疗的两组RAS野生型(wt) mCRC患者的皮肤病学相关生活质量(DRQOL)。
II期随机PanaMa (AIO KRK 0212;NCT01991873)试验纳入了来自德国70个组织机构/学术中心的387例患者。对于DRQOL结果的评估是该研究预先设定的二次分析内容,并通过癌症治疗功能评估-表皮生长因子受体抑制剂(FACT-EGFRI)、皮肤病学生活质量指数(DLQI)和皮肤指数-16(Skindex-16)三种问卷完成,DRQOL评估每两个治疗周期进行一次,直到疾病进展/死亡。
接受诱导治疗的310/377例患者(82%)和随机分组接受维持治疗的216/248例患者(87%)至少完成了1份DRQOL问卷。根据美国国家癌症研究所(NCI)-不良事件通用术语标准(CTCAE)的规范,在诱导治疗期间经历皮肤毒性的患者与未经历皮肤毒性的患者相比三种评价方法得到的DRQOL结果均显著更差(即在第2周期Skindex-16结果的平均差为-12.87;95%置信区间(CI)为-20.01~-5.73;P<0.001)(表1)。在维持治疗期间,接受单独FU/FA治疗的患者比接受FU/FA+Pmab治疗的患者通过三种评价方法得到的DRQOL结果均显著改善(即在第6周期Skindex-16结果的平均差为-16.53;95% CI为-22.68~-10.38;P<0.001)(表2)。
表1:诱导治疗期间的DRQOL评分
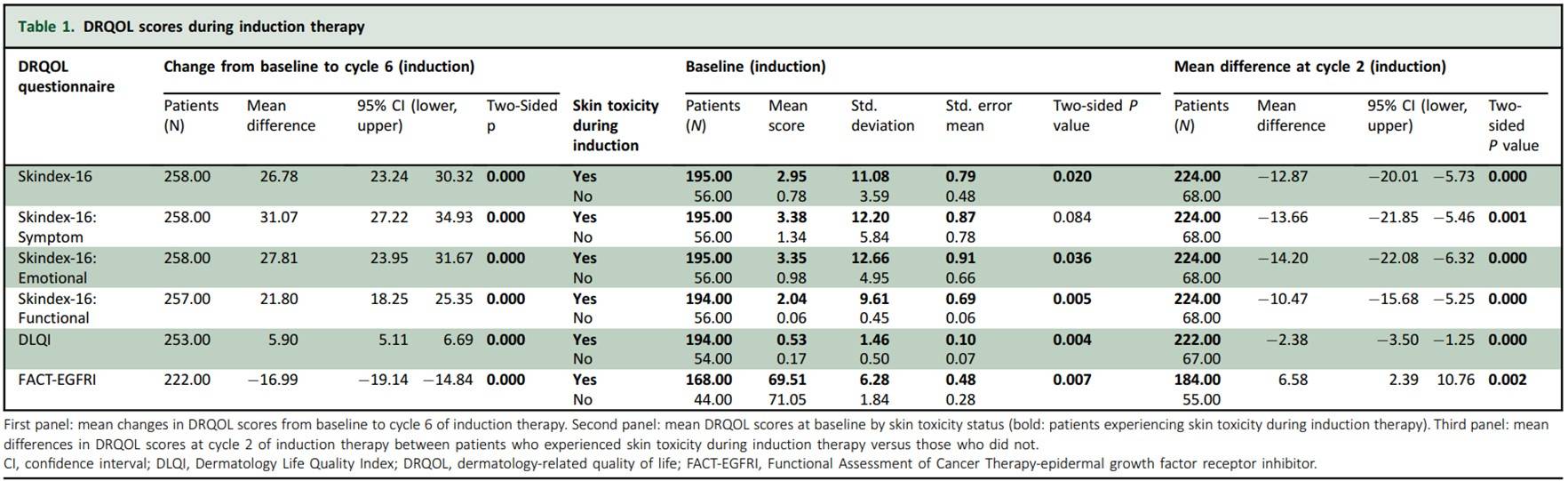
表2:维持治疗期间的DRQOL评分
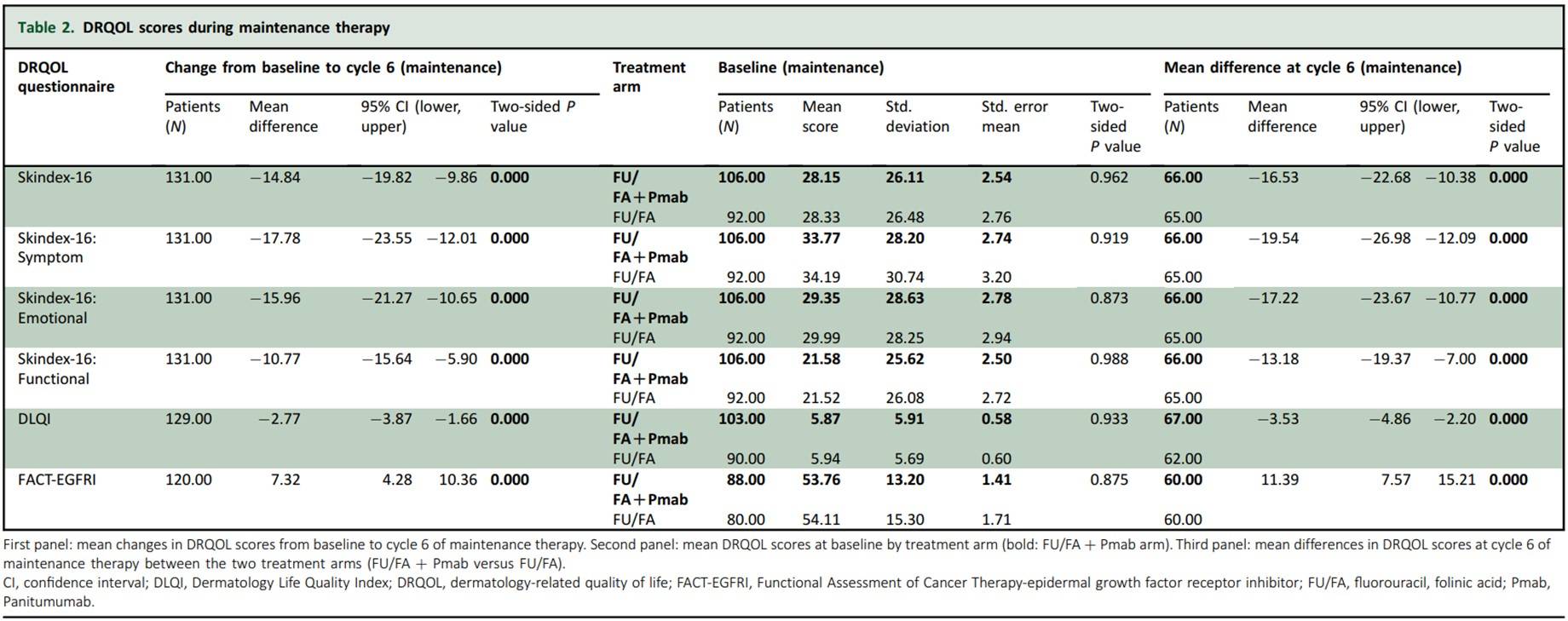
该项II期随机临床试验的二次分析发现,诱导治疗期间患者报告的DRQOL结果与皮肤毒性(根据NCI-CTCAE规范)相关。在RAS wt mCRC患者中,与接受单独FU/FA维持治疗相比,接受FU/FA+Pmab维持治疗与不佳的DRQOL相关。
与NeoRAS野生型转移性结直肠癌相关的临床特征:SCRUM-Japan GOZILA子研究2
“NeoRAS WT”是指在转移性结直肠癌(mCRC)的一线治疗后RAS突变(MTs)的消失。该研究通过对血浆循环肿瘤DNA的二代测序来评估NeoRAS WT mCRC的发病率和临床病理特征。符合条件的患者为初始通过组织学诊断为RAS MT mCRC随后接受了系统性治疗的入组GOZILA研究的mCRC患者。NeoRAS WT的定义为血浆中没有可检测到的RAS MT。在所有符合条件的患者(A组)和至少在血浆中检测到一种体细胞改变的亚组(B组)中对NeoRAS WT进行评估。
总计分析了478例患者。A组NeoRAS WT的发生率为19.0%(91/478),B组为9.8%(42/429)。“无肝脏或淋巴结转移”、“组织学检测的除KRAS外显子2突变之外的其他RAS突变” 这两个因素与NeoRAS WT的发生显著相关。总体来看,接受了抗EGFR单克隆抗体(mAbs)治疗的NeoRAS WT患者中有1/6达到部分缓解,有2/6达到≥6个月的疾病稳定(图1)。此外该研究还观察到有意义的NeoRAS WT mCRC患病率,并且基于抗EGFR单克隆抗体治疗NeoRAS WT mCRC可能是有效的。
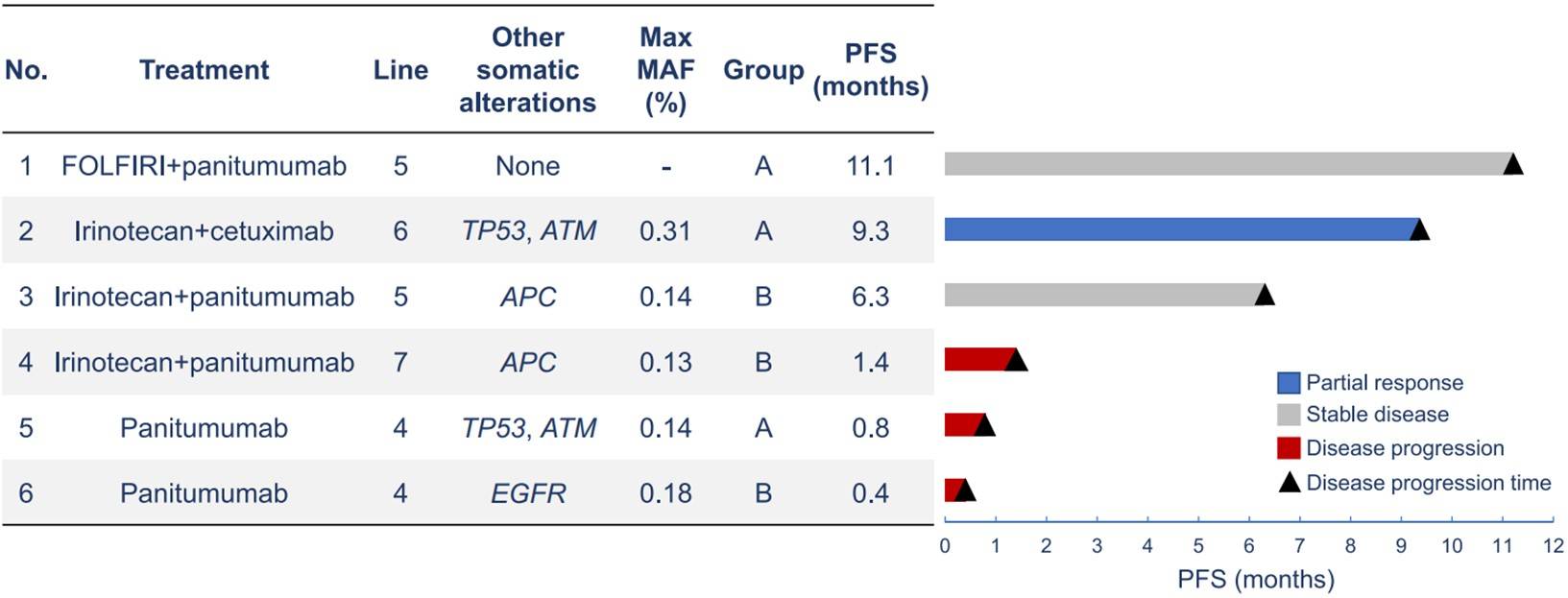
图1:NeoRAS WT mCRC患者抗EGFR治疗的临床结果(N=6)
李明焕教授:肿瘤细胞在治疗压力下不断地演进、转化。以前大家关注结直肠癌RAS WT患者经抗EGFR抗体治疗后发生耐药的不同机制。但是17%的实体瘤涉及KRAS MTs,而且约50% mCRC患者有RAS MTs。该研究显示,RAS 突变的结直肠癌患者, 在一线治疗后也有可能突变消失即NeoRAS WT,这些患者后线应用抗EGFR单克隆抗体的治疗可能有效。 而且该研究还分析出了与产生NeoRAS WT相关的一些临床病理特征:如产生NeoRAS WT mCRC患者通常无肝脏和淋巴结转移,多发生在非KRAS exon 2 MTs以外的RAS MTs人群。
转化为NeoRAS WT mCRC的机制尚不清楚,目前有几种思考:其一为瘤内异质性,具有低突变等位基因频率(MAF) RAS MT的mCRC可能代表肿瘤内RAS MT和WT 克隆混合存在的证据,并且治疗后由于RAS MT克隆的减少而转化为RAS WT。 另一种可能的解释为转移病灶的异质性,例如本研究显示肝转移和淋巴结转移的患者发生NeoRAS WT 的概率低。还有一种解释就是治疗压力引起的克隆选择,NeoRAS WT现象主要发生在贝伐珠单抗治疗的患者中,证实了以前的报道,即贝伐珠单抗是一线治疗是ctDNA RAS突变清除的独立预测因子。
确实,后线的精准治疗需要结合临床特征和精准检测来指导。但目前缺乏对NeoRAS WT mCRC人群的共识定义。特别在当仅测量RAS MT时,不能确定RAS MT是否消失或是否无法检测到ctDNA,即检测的敏感性、特异性等问题需要进一步探索。例如该研究中当检测极限 (即最小可检测MAF) 定义为0.34%和1%时,B组NeoRAS WT发生率分别为2.5%和1.5%。
总之,肿瘤在不断进化,精准检测指导精准治疗,不断带来新的希望,值得探索。
COLUMBIA-1: durvalumab + oleclumab 联合化疗和贝伐珠单抗治疗微卫星稳定型转移性结直肠癌的随机研究3
COLUMBIA-1 研究(NCT04068610)是一项在微卫星稳定型的mCRC初治患者中开展的Ib期(可行性验证部分;第1部分)/ II期(随机试验部分;第2部分)试验。第2部分的患者被随机分配接受标准治疗(对照组)或标准治疗加durvalumab和oleclumab(试验组)。该研究的目的是验证在标准治疗方案(FOLFOX+贝伐珠单抗)中加入durvalumab(抗PD-L1)和oleclumab(抗CD73),是否能增强mCRC患者的抗肿瘤疗效。主要终点包括安全性和有效性。
该研究的第1部分入组了7例患者,第2部分入组了52例患者(其中每组26例)。在第2部分的对照组和试验组中分别有80.8%和65.4%的患者发生了≥3级治疗期间出现的不良事件(TEAE),发生严重TEAE的比例分别对应为26.9%和46.3%。试验组相比对照组的客观缓解率(ORR)在数值上更高(61.5% [95%置信区间(CI),40.6-79.8] vs 46.2% [95% CI, 26.6-66.6]),但尚未达到统计学的显著性差异阈值(表3)。
表3:ITT人群的疾病缓解和生存数据
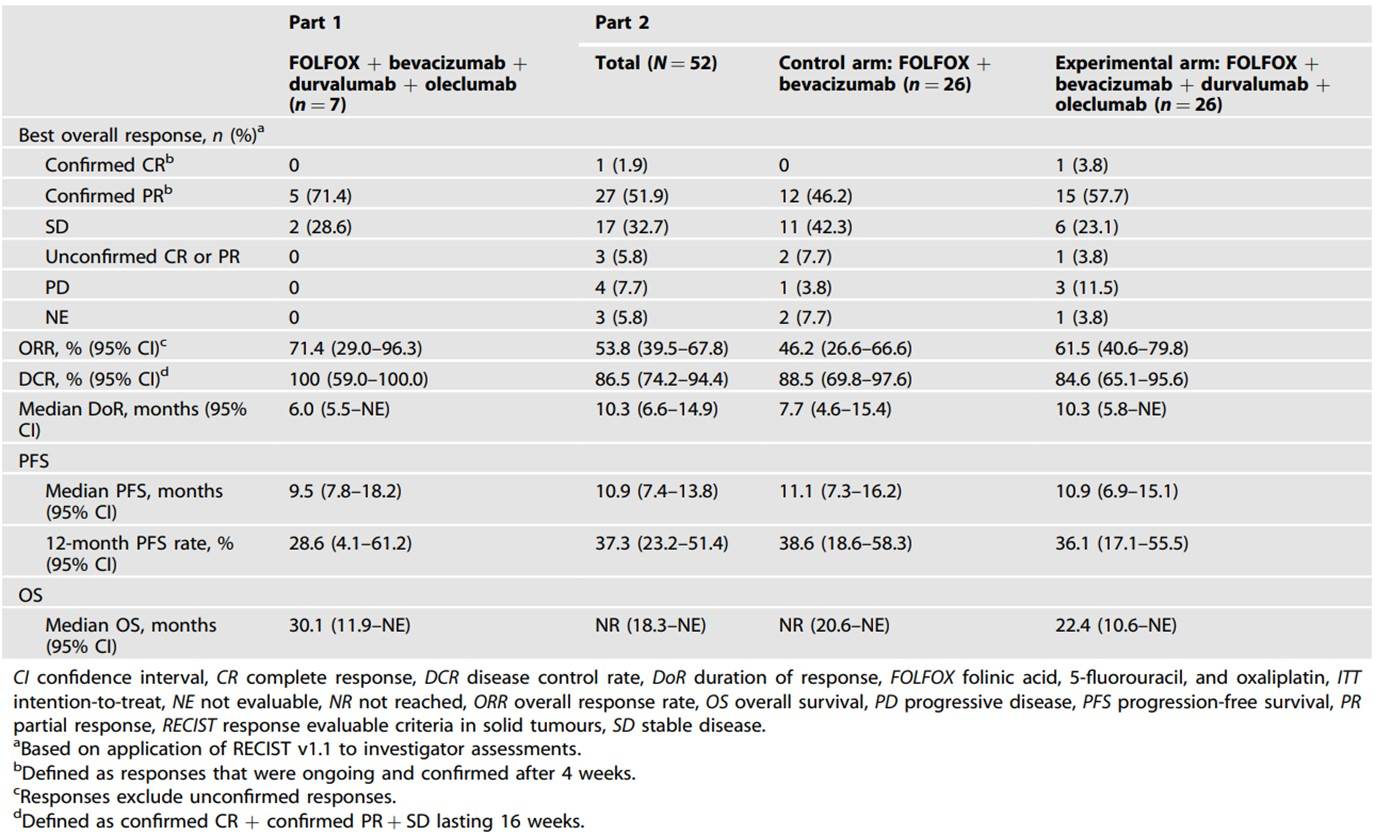
FOLFOX和贝伐珠单抗联合durvalumab和oleclumab的安全性是可控的。然而,该联合疗法呈现出的疗效结果还无法确保其在微卫星稳定型mCRC患者中进一步开发。
局部晚期直肠癌患者含mFOLFIRINOX的
全程新辅助治疗vs术前放化疗:UNICANCER-PRODIGE 23试验的
长期结果4
当前局部晚期直肠癌的标准治疗已达到了出色的局部疾病控制,但转移率仍然很高。PRODIGE 23研究展示了全程新辅助治疗相比标准治疗对该类患者的无疾病和无转移生存期的改善。该文进一步报告了PRODIGE 23研究中总生存的长期结果。该研究中接受新辅助化疗mFOLFIRINOX(6个周期)序贯放化疗、手术和辅助化疗(6个周期)的患者所在组为新辅助化疗组;接受放化疗、手术和辅助化疗(12个周期)的患者所在组为标准治疗组。该研究探索了经腹膜MRI确认的cT3/T4分期的局部晚期直肠腺癌患者分别接受两种治疗策略的结果。既往已报道了该项多中心、随机、开放标签、3期试验的研究设计、参与者和主要终点无病生存期 (DFS)等。关键的次要终点还包括总生存期(OS)、无转移生存期 (MFS)以及局部和转移性复发率。
该研究的中位随访时间为82.2个月,新辅助化疗组和标准治疗组的7年DFS率分别为67.6% (95% CI 60.7% ~ 73.9%)和62.5% (95% CI 55.6% ~ 68.6%) (受限平均生存时间[RMST]相差5.73个月;95% CI 0.05-11.41;P=0.048)。新辅助化疗组的7年MFS率为79.2% (95% CI 73.0%-84.4%),标准治疗组的7年MFS率为72.3% (95% CI 65.8%-77.8%) (RMST相差6.1个月;95% CI 0.93-11.37;P=0.021)。新辅助化疗组的7年OS率为81.9% (95% CI 75.8%-86.6%),标准治疗组为76.1% (95% CI 69.7-81.2) (RMST相差4.37个月;95% CI 0.35-8.38;P=0.033)(图2)。相比于既往的分析报告,安全性概况保持稳定。
mFOLFIRINOX新辅助化疗后序贯放化疗改善了局部晚期直肠癌患者的OS、远期DFS和MFS的获益,这一策略应被视为该类患者最佳的治疗选择之一。
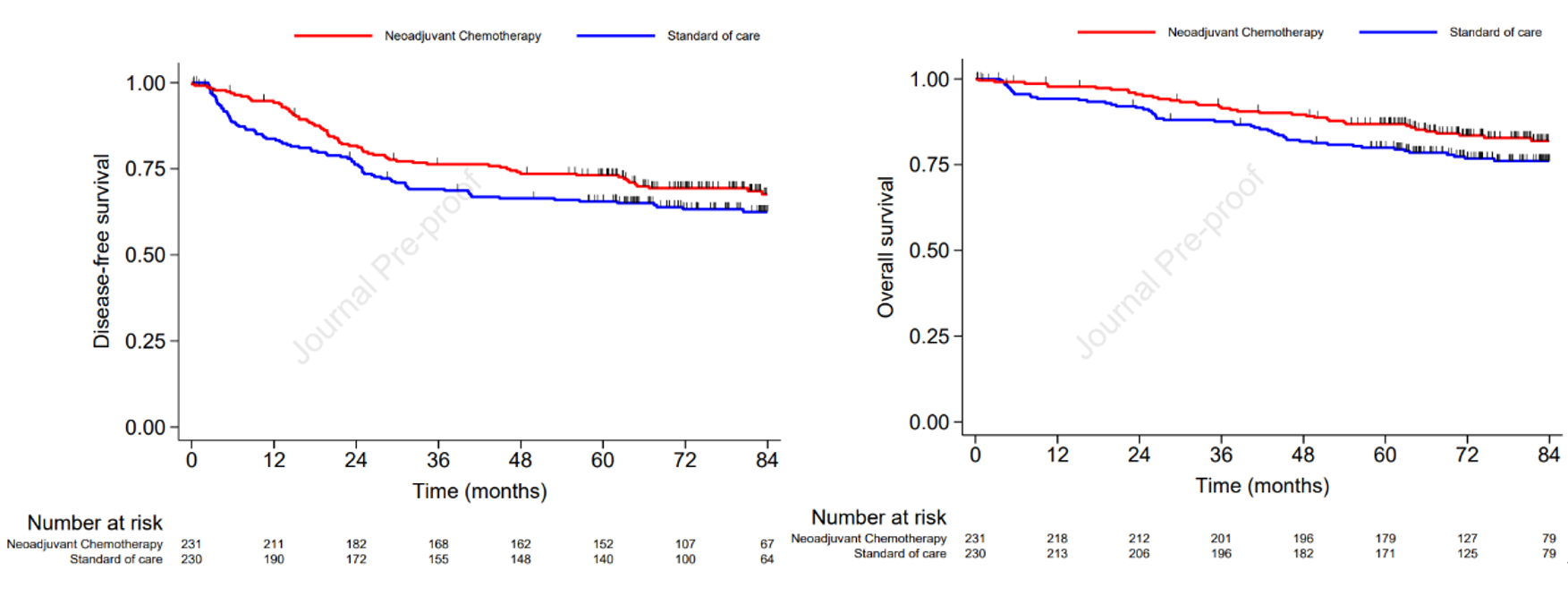
图2: 新辅助化疗组和标准治疗组的DFS和OS
李明焕教授: 局部晚期的直肠癌既有局部复发风险又有远处转移的风险。远转风险来自远处微小转移病灶,而且这些亚临床转移灶有可能在肿瘤发生发展的早期已经存在。 相较于单纯手术,理论上通过围手术期的系统治疗能够在一定程度上消灭微转移,从而改善MFS,进而转化为OS获益。
对于局部晚期中低位直肠癌,术前同步放化疗基础上如何进一步优化围手术期治疗,不断创新的TNT模式正在确立新的标准。 RAPIDO、STELLAR和PRODIGE 23研究都证实了术前化疗联合术前放疗相较于标准的同步放疗能够改善DFS或MFS, 而且STELLAR和PRODIGE 23研究证实TNT模式改善了OS。虽然入组人群、研究终点,随访时间等有不同,越来越多的研究提示,足够强度和疗程的TNT模式,不但能提高pCR而且能改善OS。 术前治疗的依从性和完成率较好,通过探索和优化放疗模式、化疗强度和化疗周期等,将为减少盆腔复发、保肛、改善生存提供最佳策略。
新辅助免疫治疗用于错配修复完整或微卫星稳定型局部晚期直肠癌的随机II期试验(TORCH)5
研究人员开展了一项前瞻性、多中心、随机、开放标签的II期试验并采用了优效性设计。该研究的目的是评估将PD-1抑制剂加入全程新辅助治疗(iTNT)中,是否能提高错配修复完整或微卫星稳定型(pMMR/MSS)局部晚期直肠癌(LARC)患者的完全缓解 (CRs),并是否有助于后续的“观察-等待(WW)”策略。临床分期T3-4和/或N+的直肠腺癌患者符合入组条件,他们被随机分配到A组或B组。A组患者接受短程放疗(SCRT),随后接受卡培他滨联合奥沙利铂和特瑞普利单抗的6周期巩固免疫化疗;B组患者先接受2个周期的诱导免疫化疗,随后接受SCRT及剩余的4周期免疫化疗。此后根据肿瘤缓解情况选择全肠系膜切除术或WW。主要终点为CR(包括术后病理CR [pCR]和采取WW策略期间的临床CR[cCR])。相比于历史数据显示的传统全程新辅助治疗(TNT)后25%的CR率提升,该研究预先设定的统计假设是iTNT后CR率可提升40%。
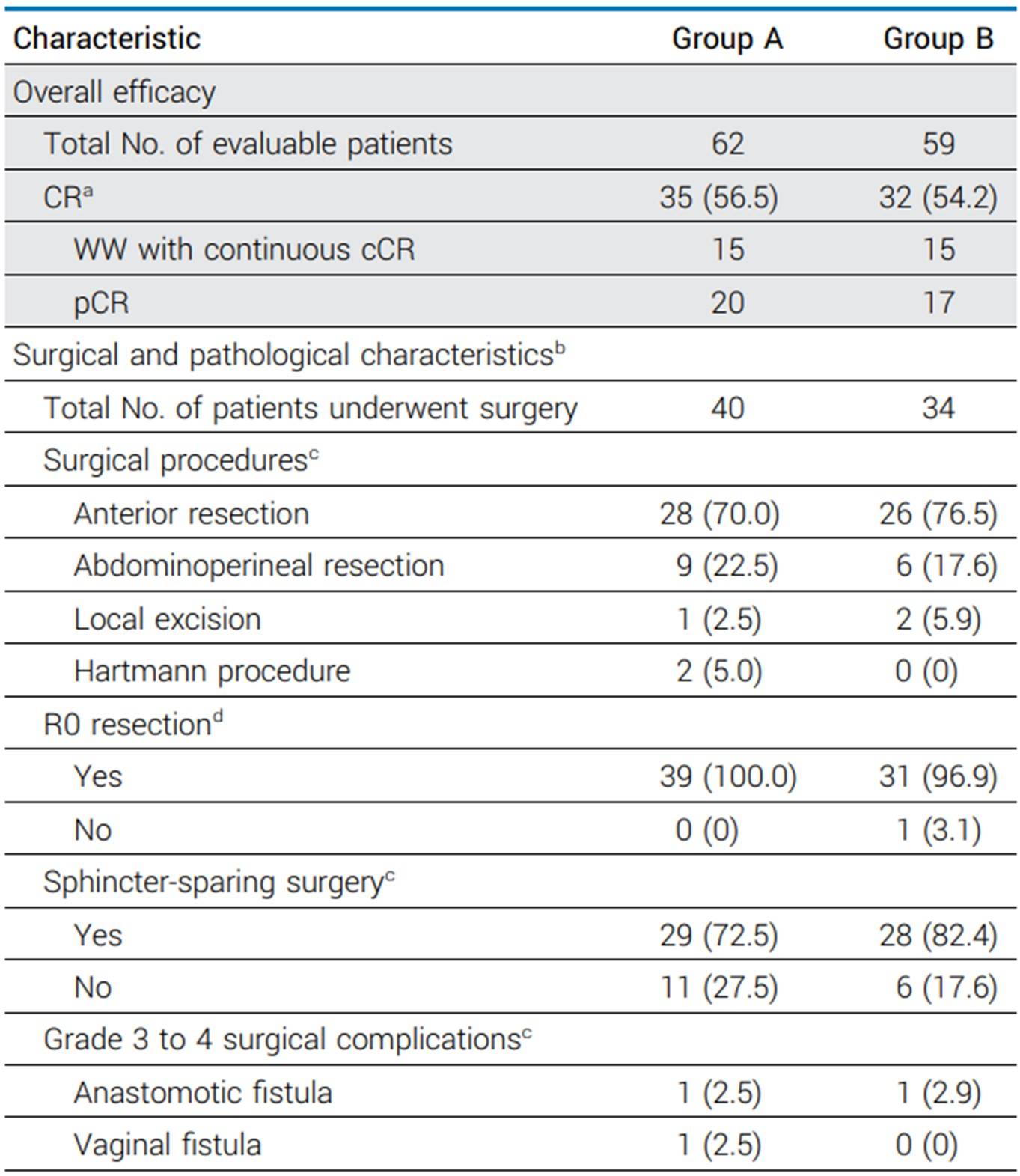
在纳入的130例患者中,121例pMMR/MSS患者可评估(A组62例,B组59例)。在中位随访19个月时,A组的CR率为56.5%,B组为54.2%(表4)。两组均满足预先设定的统计学假设(P<0.001)。两组报告的pCR率均为50%。每组各有15例患者后续接受了WW并保持了无病状态。最常见的3-4级毒性是血小板减少症和中性粒细胞减少症。与B组患者相比,A组患者在新辅助治疗期间的cCR率较高(43.5% vs 35.6%), 同时3-4级血小板减少症的发生率较低(24.2% vs 33.9%)。
表4:手术患者接受iTNT的总体疗效、手术情况和病理情况(关键数据节选)
与历史基准数据相比,iTNT方案显著提高了pMMR/MSS型LARC患者的CR率,且毒性可耐受。在未来的验证性研究中可选择先期SCRT序贯免疫化疗的方案。(注册编码:ClinicalTrials.gov NCT04518280)
李明焕教授:研究者一直在探索免疫治疗如何使pMMR/MSS型结直肠癌患者获益。本研究提示对于LARC, 短程放疗联合免疫化疗可以提高pCR。近期多项短程放疗联合免疫的术前治疗研究(如UNION、AVERECTAL等)一致显示出短程放疗联合免疫治疗较标准同步放化疗能够进一步提高pCR, 但是似乎长程放化疗联合同步免疫治疗并不能进一步改善pCR。 这可能与放化疗、特别是放疗对免疫治疗疗效的影响有关。确实,研究提示放射治疗靶区范围、剂量分割模式,时机等都会影响免疫治疗的疗效。短程放疗较少的引起机体淋巴细胞减少,而且早期加入可能对增强抗原释放、调节肿瘤免疫微环都起积极作用,从而与免疫治疗协同增效。免疫治疗的到来,改变着治疗格局,给其他治疗模式带来挑战和机遇,最佳的联合模式需要不断探索优化。
局部晚期直肠癌的新辅助短程放疗后进行卡瑞利珠单抗联合化疗(UNION):一项多中心随机III期试验的早期结果6
既往的一项II期试验展示了新辅助短程放疗(SCRT)后使用CAPOX和卡瑞利珠单抗(PD-1单抗)治疗局部晚期直肠癌(LARC)的潜在临床活性。本文报道的III期研究旨在进一步证实“SCRT后序贯CAPOX和卡瑞利珠单抗”与“长疗程放化疗(LCRT)后序贯单独的CAPOX”,作为LARC新辅助治疗的有效性和安全性。在该项随机III期试验中,T3-4/N+直肠腺癌患者被随机分配(1:1)接受SCRT或LCRT,随后分别接受2个周期的卡瑞利珠单抗联合CAPOX治疗或单独CAPOX治疗。手术后每组患者均接受6个周期的卡瑞利珠单抗联合CAPOX治疗,随后各组再对应接受最多17个周期的卡瑞利珠单抗治疗或6个周期的CAPOX治疗。主要终点是由盲法独立审查委员会评估的病理完全缓解(pCR)率(ypT0N0)。关键的次要终点包括3年无事件生存率(EFS)和总生存率(OS)。
2021年7月至2023年3月,入组的意向治疗人群包括113例试验组患者和118例对照组患者,两组患者的手术完成率分别为92%和83.9%。截至数据截止日期(2023年7月11日),试验组的pCR率为39.8%[95%置信区间(CI) 30.7%-49.5%],而对照组为15.3% (95% CI 9.3%-23.0%)(差值为24.6%;比值比为3.7;95% CI 2.0-6.9;P<0.001)(图3)。两组的手术并发症发生率分别为40.0%和40.8%,≥3级治疗相关不良事件发生率分别为29.2%和27.2%。3年EFS率和OS尚未成熟。
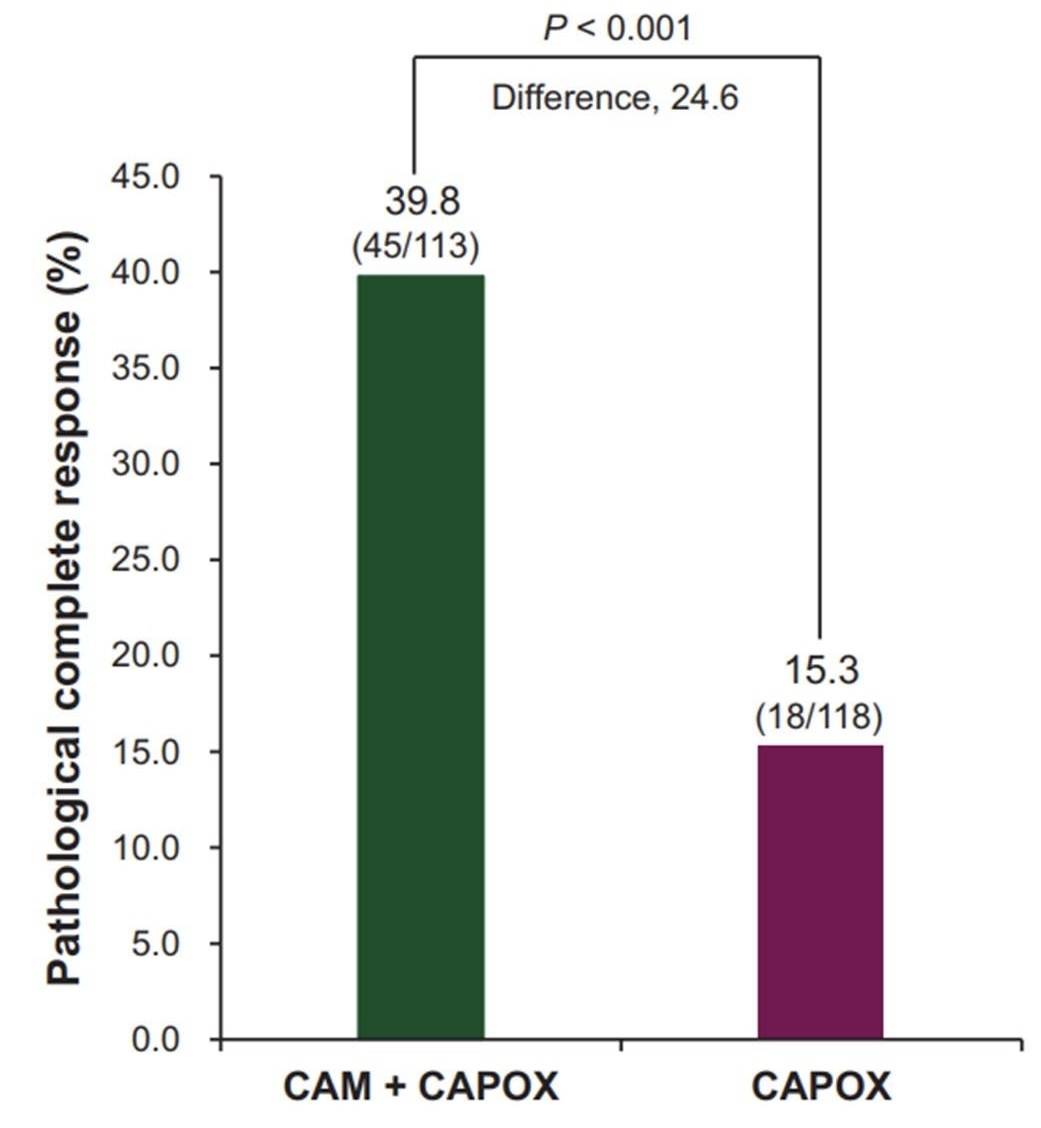
图3:治疗意向人群的病理完全缓解率
在LARC患者中,新辅助SCRT后序贯卡瑞利珠单抗联合CAPOX治疗的pCR率显著高于LCRT后序贯单独CAPOX治疗的pCR率,并且具有可耐受的安全性。SCRT后序贯卡瑞利珠单抗联合化疗的方案可被推荐作为这类患者的新辅助治疗模式之一。
本期看点:
1、一项随机II期研究(PanaMa)的二次分析,评估了FOLFOX联合帕尼单抗诱导治疗期间与单独FU/FA或FU/FA+帕尼单抗维持治疗期间RAS野生型mCRC患者的皮肤病相关生活质量。
2、一项NeoRAS主题研究(SCRUM-Japan GOZILA)的子研究,通过对血浆循环肿瘤DNA的二代测序评估了NeoRAS WT mCRC的发病率和临床病理特征,并指出基于抗EGFR单克隆抗体治疗NeoRAS WT mCRC可能是有效的。
3、一项1b/Ⅱ期研究(COLUMBIA-1),验证了在标准治疗方案中加入durvalumab(抗PD-L1)和oleclumab(抗CD73),是否能增加初治的微卫星稳定型mCRC患者的抗肿瘤疗效。结果显示尽管安全性是可控的,但该联合疗法呈现出的疗效还无法确保其在该类患者中进一步开发。
4、一项随机III期研究(UNICANCER-PRODIGE 23)的长期生存数据分析,结果显示术前使用mFOLFIRINOX后序贯放化疗作为全程新辅助治疗,相比于标准术前放化疗,可以显著改善局部晚期直肠癌患者的OS、远期DFS和MFS的获益,且安全性与既往的报告相比保持稳定。
5、一项随机II期研究(TORCH),结果表明将PD-1抑制剂加入到全程新辅助治疗中可显著提高pMMR/MSS型局部晚期直肠癌患者的CR率,对于保留器官具有极大的潜力。
6、一项随机研究(UNION),是首项评估SCRT、免疫治疗联合化疗用于LARC新辅助治疗的III期研究,达到pCR主要终点。结果显示,在LARC患者中新辅助SCRT后序贯卡瑞利珠单抗联合CAPOX治疗的pCR率显著高于LCRT后序贯单独CAPOX治疗的pCR率,并且具有可耐受的安全性。
1、Ballhausen A, Karthaus M, Fruehauf S, et al. Dermatology-related quality-of-life outcomes in patients with RAS wild-type metastatic colorectal cancer treated with fluorouracil and folinic acid with or without panitumumab (Pmab) maintenance after FOLFOX + Pmab induction: a prespecified secondary analysis of the phase II randomized PanaMa (AIO KRK 0212) trial. ESMO Open. 2024;9(7):103628.
2、Osumi H, Shinozaki E, Nakamura Y, et al. Clinical features associated with NeoRAS wild-type metastatic colorectal cancer A SCRUM-Japan GOZILA substudy. Nat Commun. 2024;15(1):5885.
3、Segal NH, Tie J, Kopetz S, et al. COLUMBIA-1: a randomised study of durvalumab plus oleclumab in combination with chemotherapy and bevacizumab in metastatic microsatellite-stable colorectal cancer. Br J Cancer. Published online July 25, 2024.
4、Conroy T, Castan F, Etienne PL, et al. Total neoadjuvant therapy with mFOLFIRINOX versus preoperative chemoradiotherapy in patients with locally advanced rectal cancer: long-term results of the UNICANCER-PRODIGE 23 trial. Ann Oncol. Published online July 8, 2024.
5、Xia F, Wang Y, Wang H, et al. Randomized Phase II Trial of Immunotherapy-Based Total Neoadjuvant Therapy for Proficient Mismatch Repair or Microsatellite Stable Locally Advanced Rectal Cancer (TORCH). J Clin Oncol. Published online July 1, 2024.
6、Lin ZY, Zhang P, Chi P, et al. Neoadjuvant short-course radiotherapy followed by camrelizumab and chemotherapy in locally advanced rectal cancer (UNION): early outcomes of a multicenter randomized phase III trial. Ann Oncol. Published online July 2, 2024.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


