白血病是一组起源于造血干细胞的恶性肿瘤。近年来,越来越多的基因突变被发现与白血病的发生发展密切相关。DNA甲基化是表观遗传学修饰的重要方式,而DNMT3A作为重要的DNA甲基转移酶,参与调控造血干细胞的自我更新与分化。研究发现,DNMT3A突变常为单等位基因突变,双等位突变仅占3%左右,后者提示预后更差。Frontiers in Oncology就报道了一例携带四个跨染色体等位DNMT3A基因突变的急性髓系白血病(AML)病例。我们一起来寻根溯源。

病例介绍:不简单的简单病例——四个DNMT3A突变的秘密
患者,男,56岁,因体检发现血常规异常收住院。既往体健,无特殊病史。查体:贫血貌,全身浅表淋巴结未触及肿大,胸骨无压痛,心肺腹查体未见明显异常,脾脏肋缘下未触及,双下肢无水肿。
血常规:WBC 12.6×109/L,HGB 75g/L,PLT 36×109/L。骨髓象:增生明显活跃,粒系占0.745,原始粒细胞占0.410,形态异常。红系占0.075,巨核细胞少见。骨髓活检:骨髓增生明显活跃,粒系增生明显活跃,原始细胞比例明显增高,红系缩小,巨核细胞数量减少。染色体核型分析:46,XY[20]。流式细胞术免疫分型:异常细胞群占有核细胞的36.2%,表达CD34、CD117、CD33、CD13、CD11b、CD38、HLA-DR、CD123、CD71、CD58、cMPO、cCD79a。诊断为AML-M4型。
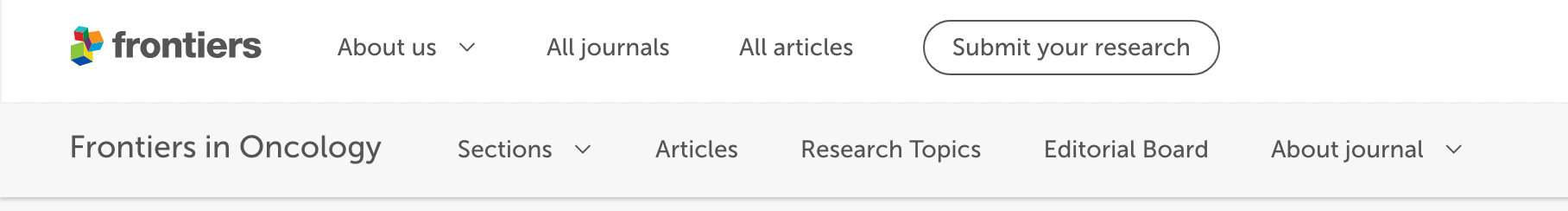
基因检测发现FLT3-ITD突变阳性。另外,二代测序还发现4个DNMT3A基因体细胞突变:
c.1592_1593insG, p.D531Gfs*15 (variant allele frequency (VAF): 15.13%);
c.1608C>G, p.Y536* (VAF: 47.87%);
c.2119G>T, p.G707C (VAF: 9.04%);
c.2695C>T, p.R899C (VAF: 7.65%)。
G707C和R899C是两个已知的致病性错义突变,而D531Gfs*15和Y536*是两个此前未报道的移码突变。有趣的是,长读长测序技术进一步证实,这4个突变位于不同的等位基因上(in trans)。也就是说,患者携带有双等位DNMT3A基因突变。基于4个突变的VAF,治疗组推测在诊断时Y536*突变(VAF~50%)位于所有白血病细胞的一个DNMT3A等位基因上,而其他3个较低VAF的突变则位于另一等位基因的3个亚克隆中。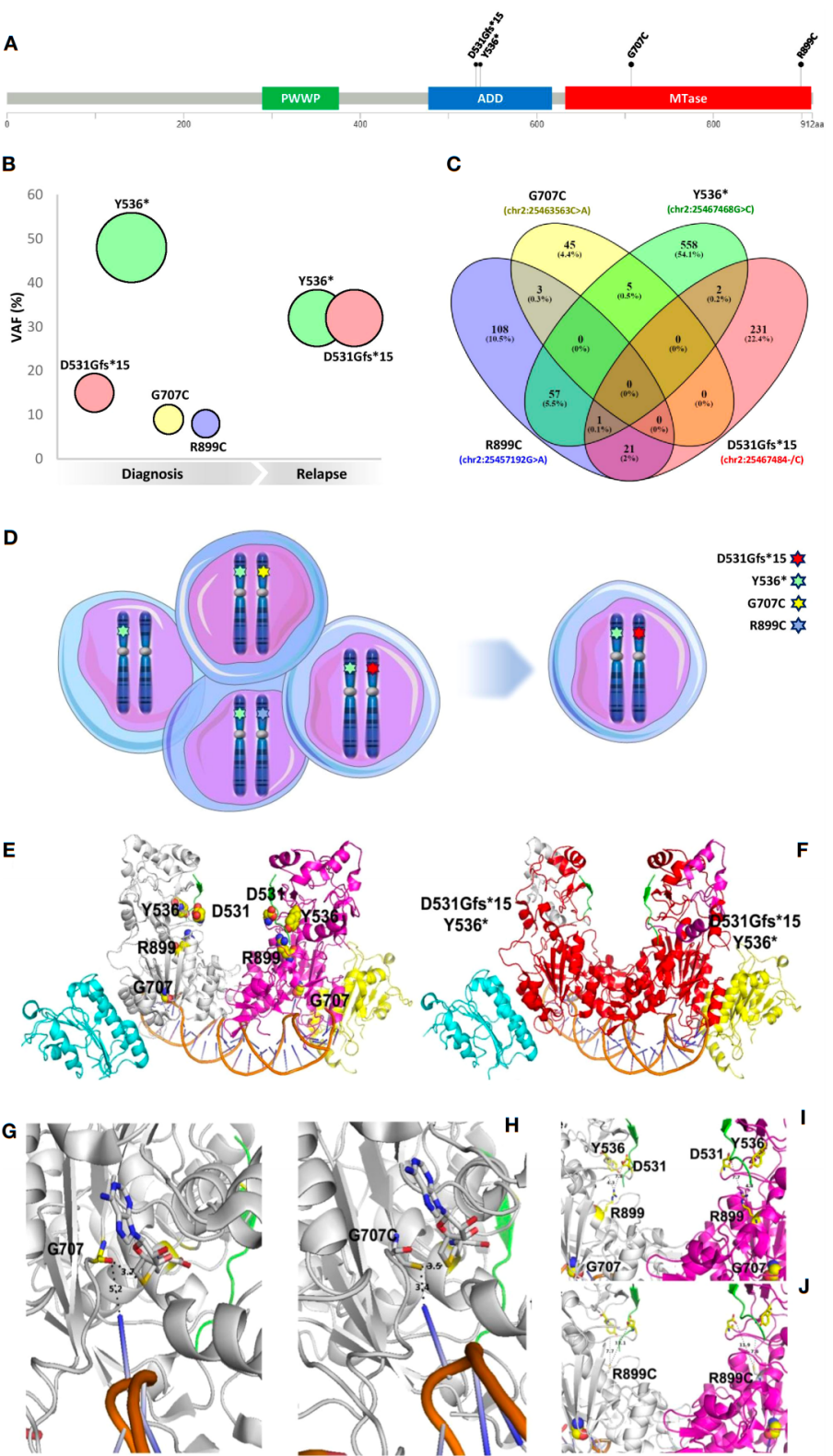
图1:基因突变的分子表型和三维模型
为了研究这些突变对DNMT3A蛋白功能及基因组甲基化修饰的影响,治疗组进行了一系列分子生物学研究。首先,利用直接测序技术在mRNA水平验证了这些突变的存在,排除了无义介导的mRNA降解。随后,利用三维结构模拟预测发现,所有突变均可导致DNMT3A活性降低或丧失。结合Alu重复序列检测全基因组甲基化水平发现,在携带双突变的复发亚克隆中,DNMT3A功能几乎完全丧失,但基因组甲基化水平反而出现全面升高,尤其在与造血分化相关基因的启动子区域高甲基化最为明显。
诊疗经过:多维度解析DNMT3A突变的动态演变与临床影响
根据上述检查结果,患者最终诊断为伴FLT3-ITD突变及DNMT3A双等位基因突变的急性髓系白血病(AML-NOS)。遂给予IA“3+7”方案诱导化疗。诱导后复查骨髓提示完全缓解,基因检测未发现DNMT3A突变。之后予以3个疗程大剂量阿糖胞苷巩固化疗。期间病情稳定,复查骨髓持续完全缓解。因其有同胞全相合供者,遂行异基因造血干细胞移植。移植后100天,骨髓提示完全供者嵌合。
然而移植后10个月,患者出现盗汗、乏力,查血常规示WBC 15.6×109/L,HGB 82g/L,PLT 28×109/L。骨髓象示原始粒细胞占0.410,流式免疫分型示异常细胞群占0.480,提示白血病复发。骨髓短串联重复序列(STR)分析提示混合嵌合,分子学检测发现FLT3-ITD突变阳性,DNMT3A突变中仅p.D531Gfs*15(VAF 32.75%)和p.Y536*(VAF 32.12%)阳性。
因此,在复发时仅有一个双突变亚克隆得以扩增。遂给予沙利度胺治疗,但疗效欠佳,2个月后患者因感染、出血而死亡。
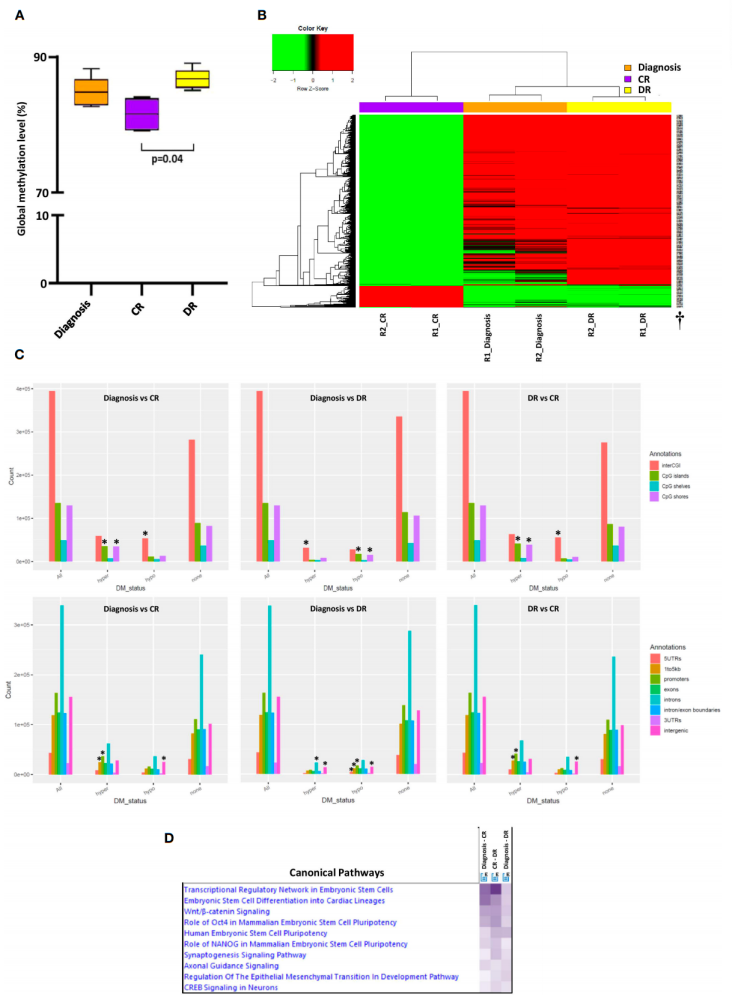
图2:DNA甲基化分析和功能分析
全基因组甲基化芯片分析显示,诊断与复发时的甲基化谱系高度相似,与缓解时相比均出现全基因组高甲基化,尤其在CpG岛及其邻近区域、基因启动子区和转录起始位点上游1-5kb区域高甲基化最为显著。进一步通路分析提示,这些高甲基化的差异甲基化区域富集有胚胎发育和细胞分化相关基因。
寻根溯源:DNMT3A双突变导致基因组高甲基化之谜
本例报道的携带DNMT3A双等位基因突变的AML病例,凸显了DNMT3A异常在AML发病机制中的独特作用。尽管DNMT3A突变在AML中较为常见,但多为单等位突变。患者携带的4个DNMT3A突变均位于不同等位基因上,且均为功能缺失性突变,导致DNMT3A活性几乎完全丧失。
有趣的是,尽管DNMT3A是重要的DNA甲基化转移酶,但在本例中其功能缺失却引起基因组水平的高甲基化,这看似有悖于DNMT3A的生理作用。事实上,在T细胞白血病中也曾观察到类似的现象,提示DNMT3A的去甲基化功能在淋系和髓系肿瘤中可能存在不同。一种可能的解释是,DNMT3A的缺失可能通过上调其同源基因DNMT3B的活性,从而导致整体甲基化水平的升高。另一种可能是,DNMT3A的缺失改变了DNA甲基化和组蛋白修饰之间的动态平衡,导致抑制性组蛋白标志物如H3K9me3、H3K27me3富集于特定区域,引起局部高甲基化。当然,这些假说还需要进一步的实验证据支持。
此外,本例还展现了DNMT3A突变在AML克隆演变中的作用。携带双重截短突变的亚克隆在化疗后得以存活并扩增,最终导致白血病复发,提示DNMT3A突变与耐药和复发密切相关。近期一项研究发现,携带两个DNMT3A突变的AML患者生存期更短,预后更差。因此,监测DNMT3A突变的克隆动态变化,可能有助于评估疾病进展风险,指导临床干预。
总之,DNMT3A突变虽在AML中较为常见,但其发病机制仍不完全清楚。本病例凸显了DNMT3A双等位突变在白血病发生发展中的特殊作用,为深入理解其致病机理提供了新的视角。未来还需更多的研究来阐明DNMT3A突变与其他遗传学事件之间的相互作用,为携带DNMT3A突变的AML患者量身定制个体化治疗方案。
小结:AML诊疗新视角:DNMT3A突变的启示与思考
这位56岁男性AML患者,经二代测序发现其携带罕见的DNMT3A双等位基因突变,包括2个新发现的截短突变和2个已知致病性错义突变,共同导致DNMT3A功能几乎完全丧失。尽管如此,与缓解时相比,患者诊断和复发时的基因组甲基化水平反而出现整体升高,提示DNMT3A突变导致的表观遗传异常在AML发病中可能扮演关键角色。此外,携带双重截短突变的亚克隆在化疗后存活并扩增,最终导致白血病复发,凸显了DNMT3A突变与耐药、预后不良的密切关联。
本例为我们深入理解DNMT3A突变在AML发病机制中的独特作用提供了新的视角,但同时也提出了一些值得思考的问题:
1) DNMT3A缺失为何反而导致基因组高甲基化?是否存在尚未发现的补偿性甲基化机制?
2) DNMT3A双突变克隆如何在化疗压力下存活并扩增?是否对现有治疗方案耐受?
3) 针对DNMT3A突变的个体化治疗策略有哪些?如何有效清除残留的突变亚克隆?
一名52岁男性患者因反复发热、乏力2天就诊,腹部超声示脾脏增大,局灶性病变大小约15cm,PET-CT示脾脏肿块FDG代谢增高,周围淋巴结代谢增高。超声引导下脾脏病变穿刺活检病理示异常B淋巴细胞弥漫性增生,免疫组化示B细胞标志物CD20、CD79b、PAX5阳性,Ki-67增殖指数60%。诊断该患者为原发性脾弥漫大B细胞淋巴瘤,Lugano分期IIS期。该患者首选的治疗方案应为:
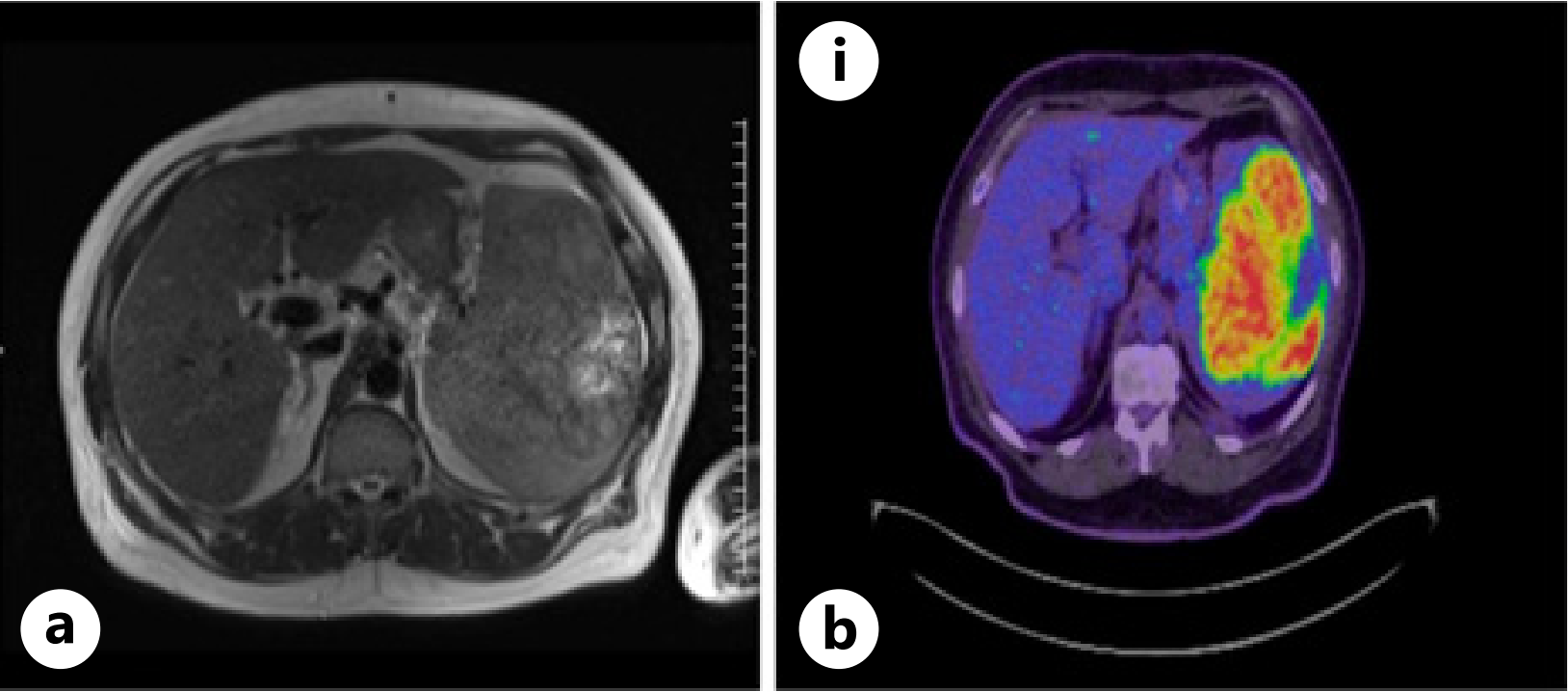
图:腹部MRI和全身18F-FDG PET-CT结果
该患者首选的治疗方案应为:
A. 脾切除术联合CHOP(环磷酰胺、阿霉素、长春新碱、泼尼松)方案化疗4个周期
B. R-CHOP(利妥昔单抗、环磷酰胺、阿霉素、长春新碱、泼尼松)方案化疗6个周期
C. 利妥昔单抗单药治疗,每3周1次,共8次
D. 脾区放射治疗,总剂量30Gy/15次
上一期《寻根溯源丨弥漫大B细胞淋巴瘤发生在股骨远端,你见过吗?》 的答案为D
Cumbo C, Orsini P, Anelli L, et al. Case report: biallelic DNMT3A mutations in acute myeloid leukemia. Front Oncol. 2023;13:1205220. Published 2023 Jun 28. doi:10.3389/fonc.2023.1205220
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


