本期精选5篇在2024年6月份发表的结直肠癌领域文献,邀请到浙江大学医学院附属第一医院方维佳教授对研究进行深入解读。
专家介绍
国家卫健委能力建设及继教肿瘤专委会 委员
中国临床肿瘤学会 理事
中国临床肿瘤学会胆道肿瘤专委会 常委
中国临床肿瘤学会放射介入专委会 常委
中国医师协会肿瘤医师分会 委员
中国医师协会多学科综合治疗专委会 委员
中国转化/精准医学学会细胞治疗分会 委员
浙江省可持续发展研究会医疗专委会 委员
浙江省抗癌协会整合肿瘤专委会 副主委
香港大学 访问学者
美国印第安纳大学 访问学者
结直肠癌同时性转移患者原发灶的前期切除与不切除:荷兰和丹麦结直肠癌学组进行的随机Ⅲ期CAIRO4研究1
PI: Miriam Koopman 荷兰;发表于Annals of Oncology
有关不可切除的同时性转移结直肠癌(mCRC)患者的回顾性研究表明,前期原发肿瘤切除(PTR)与更长的总生存期(OS)相关。CAIRO4研究的目的是明确在系统治疗的基础上增加前期PTR,是否会为无严重的原发肿瘤症状的同时性mCRC患者带来生存获益。
该项随机Ⅲ期研究在荷兰和丹麦的45家医院开展。纳入标准包括既往未经治疗的mCRC,不可切除的转移灶及无严重的原发肿瘤症状。患者被随机(1:1)分配到两组,一组患者接受前期PTR后进行系统治疗,另一组患者仅接受系统治疗。两组患者接受的系统治疗为一线氟尿嘧啶为基础的化疗联合贝伐珠单抗。主要终点是意向治疗人群的OS。该研究已在ClinicalTrials.gov注册,编码为NCT01606098。
2012年8月至2021年2月期间共206例患者被随机分入两组。204例患者被纳入意向治疗分析集中 (无前期PTR的患者人数=103例,接受前期PTR的患者人数=101例),其中116例患者为男性(57%),他们的中位年龄为65岁(IQR 59-71)。中位随访时间为69.4个月。无前期PTR组患者的中位OS为18.3个月(95% CI 16.0-22.2),而前期PTR组患者的中位OS为20.1个月(95% CI 17.0-25.1) (p = 0.32)(图1)。无前期PTR组的3-4级不良事件发生数量为71例(72%),前期PTR组则为61例(65%)(p=0.33)。无前期PTR组报告了3例(3%)可能与治疗相关的死亡,而前期PTR组则报告了4例(4%)。
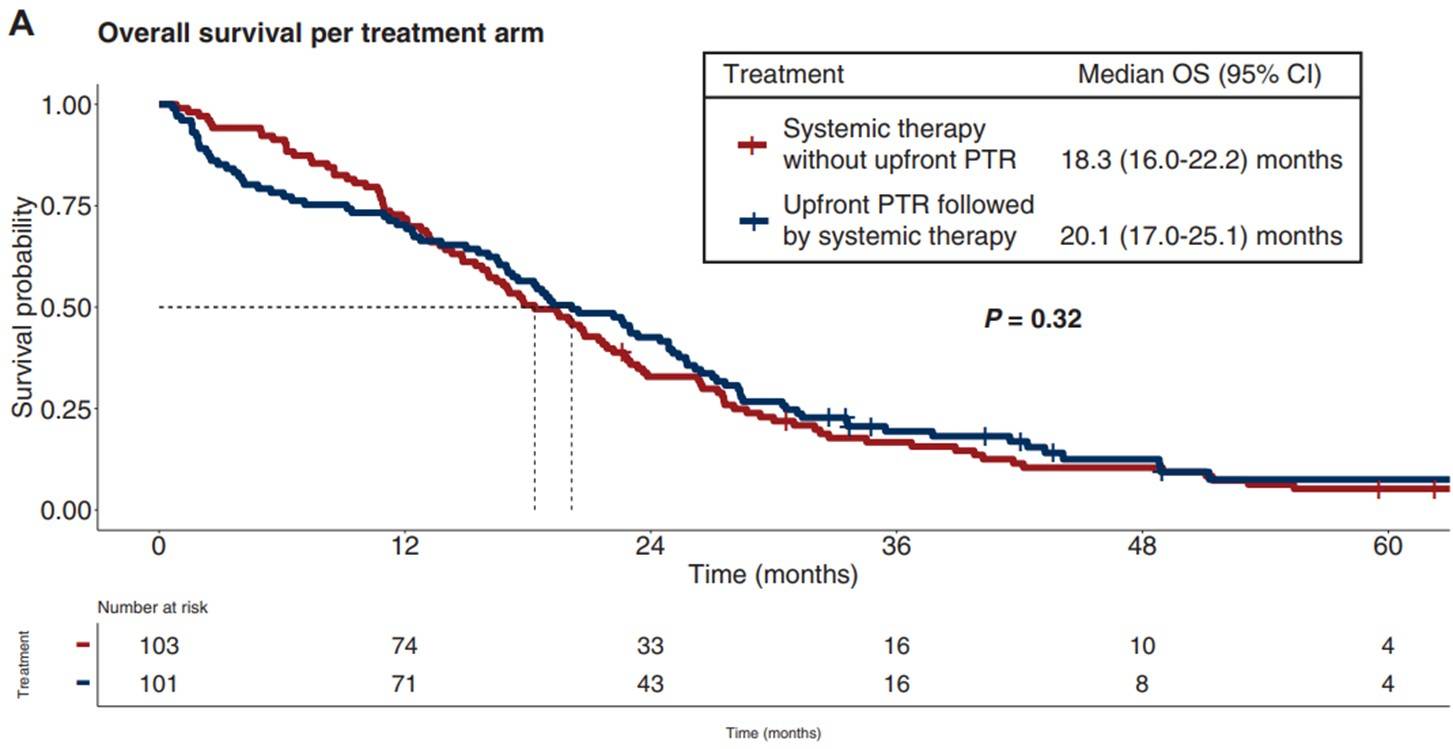
图1:意向治疗人群各治疗组的总生存期(主要终点)
对无严重原发肿瘤症状的同时性mCRC患者而言,在姑息性系统治疗的基础上增加前期PTR并不能带来额外的生存获益。这种方式不应再被视为治疗标准。
方维佳教授:对于初诊时肠道原发肿瘤不伴有明显症状的患者,该类患者是否应该切除原发灶再进行化疗,在临床上尤其在结直肠外科医生中间,存在较大实际决策的差异,主要集中在以下两点:第一,原发肿瘤的存在是否会增加后续治疗中出现肠道相关并发症的风险?第二,原发肿瘤的切除能否带来额外的生存获益?CAIRO4随机对照研究的结果回答了以上问题,并且和既往多项研究一致,即针对原发灶无严重症状且存在同时性不可切除转移病灶的mCRC,先行切除原发灶是不予推荐的。
题外话:两组生存曲线显示,初期手术组和非手术组有交叉,有变得更差的趋势,而在12个月左右之后,转而显示相比于非手术组,有一定的生存获益,除了先行切除原发灶会导致针对转移灶启动系统治疗时间的推迟从而影响生存数据之外,探索分析更多影响因素,可能有助于提高真正有指征先行切除原发灶患者的围手术期管理,进而改善生存。
Botensilimab联合Balstiliumab治疗复发/难治性微卫星稳定转移性结直肠癌:Ⅰ期临床研究2
PI: Justin Stebbing & Anthony B. El-Khoueiry 美国;发表于Nature Medicine
既往研究显示微卫星稳定的转移性结直肠癌(MSS mCRC;错配修复正常)对免疫检查点抑制剂的反应不佳。Botensilimab (BOT)是一种Fc段增强的多功能抗细胞毒性T淋巴细胞相关蛋白4 (CTLA-4)抗体,该研究设计旨在观察BOT应用于MSS mCRC这样的“冷”肿瘤/免疫治疗反应差的实体肿瘤时的情况。
一项正在进行的Ⅰ期研究对BOT联合或不联合balstiliumab(BAL;抗PD-1抗体)的治疗方案进行了评估,主要终点是安全性和耐受性。在研究的剂量递增阶段以及在MSS mCRC患者中(使用联合剂量递增/剂量扩展数据)分别对主要终点进行了分析。次要终点包括研究者根据RECIST 1.1版确认的客观缓解率(ORR)、疾病控制率(DCR)、缓解持续时间(DOR)和无进展生存期(PFS)。
该研究展示了148例接受BOT和BAL治疗的重度预治疗的MSS mCRC患者的临床结局(6例来自剂量递增队列;142例来自剂量扩展队列),其中101例患者被认为是疗效可分析的,随访时间至少为6个月。89%的MSS mCRC患者(131/148)发生了治疗相关不良事件(TRAEs),最常见的是乏力(35%,52/148),腹泻(32%,47/148)和发热(24%,36/148),没有报告5级TRAEs。12%的患者因TRAE (18/148;数据完全成熟)终止治疗。疗效可分析人群(n = 101)的ORR为17% (17/101;95%置信区间(CI),10-26%),DCR为61% (62/101;95% CI, 51-71%),中位DOR未达到(NR;95% CI, 5.7个月-NR),中位PFS为3.5个月(95% CI, 2.7-4.1个月),中位随访时间为10.3个月(范围0.5-42.6个月;有待于数据进一步成熟)(图2)。
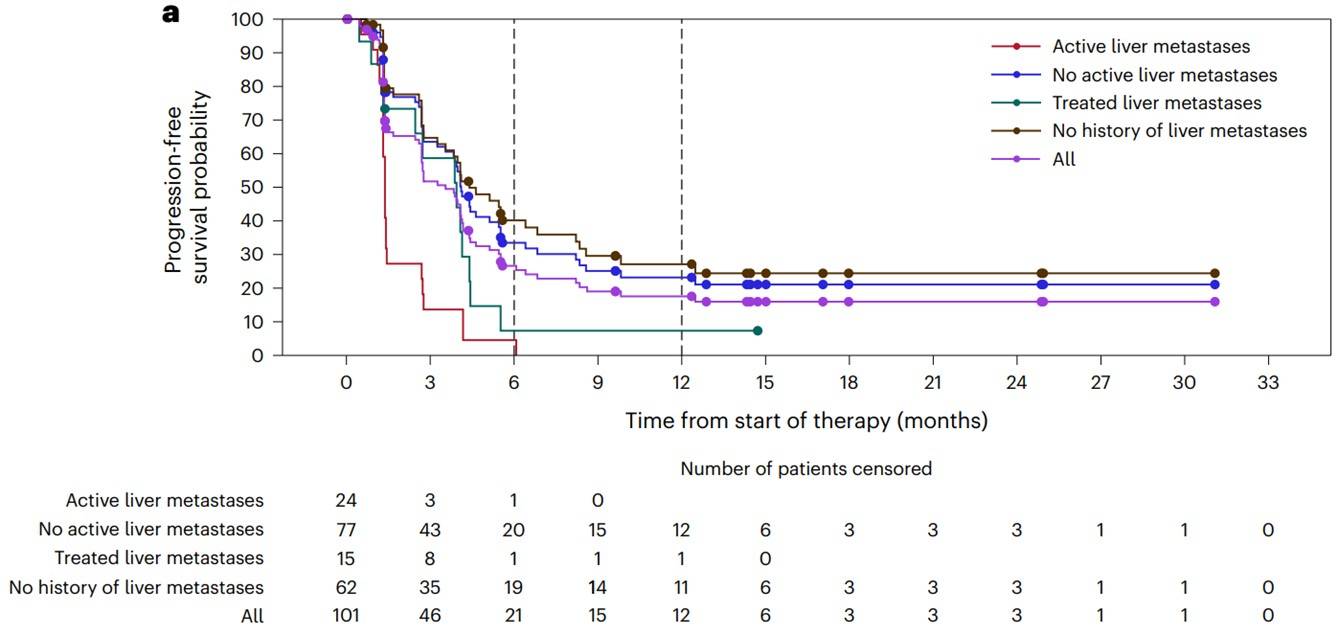
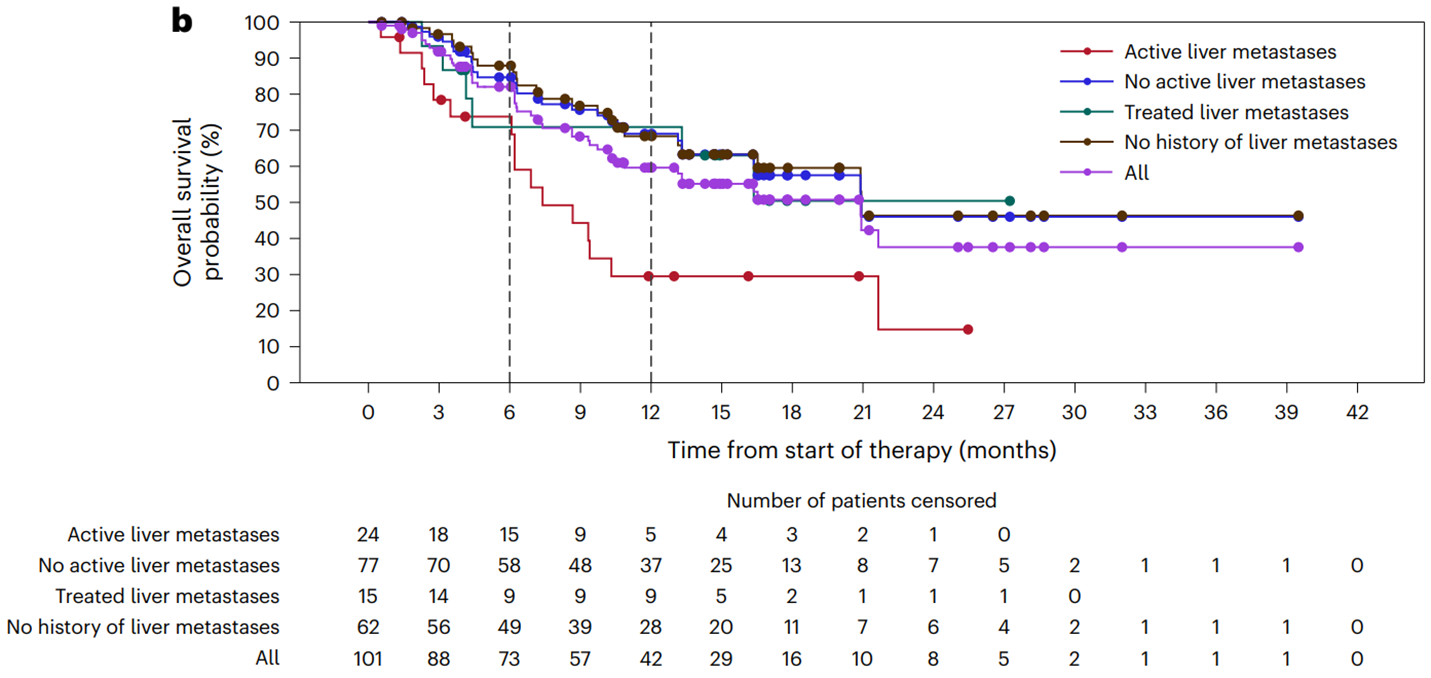
图2:根据肝脏转移灶的受累情况分析疗效可评估患者的临床结局:(a)PFS;(b)OS
BOT联合BAL的组合显示出可管理的安全性特征,没有出现新的免疫介导的安全信号。同时,该药物组合带来的持久缓解也展示出令人鼓舞的临床活性。(ClinicalTrials.gov注册编码:NCT03860272)
方维佳教授:抗CTLA-4抗体的加入,可通过强化与抗原呈递细胞的结合来提高T细胞致敏和活化,以及增加NK细胞的结合使得更多的Treg细胞被清除。本研究与既往多个MSS晚期肠癌免疫治疗研究相比,有效率得到了令人惊喜的提高,研究对比了有肝转移和无肝转移患者ORR的差别,前者为0%,后者达到了22%;值得注意的是,治疗相关副反应中有32%的患者(148位患者中)出现腹泻,并被推荐早期使用英夫利西单抗治疗。此外,还有分别多达69%、75%和86%的病人均未或分别没有接受过瑞戈非尼和曲氟尿苷/替匹嘧啶的治疗。此项研究结果表明,肠癌MSS患者的免疫治疗仍然任重道远,需要更多细致设计和针对免疫微环境或特定转移特征患者的深入研究。
帕博利珠单抗联合比美替尼和贝伐珠单抗治疗难治性微卫星稳定型结直肠癌的Ⅱ期研究3
PI: Robert W. Lentz 美国;发表于Clinical Cancer Research
在该项由研究者发起的单中心Ⅱ期研究中,研究人员评估了在微卫星稳定的转移性结直肠癌(MSS mCRC)中阻断MAPK和VEGF通路对克服免疫治疗耐药的作用。
二线及以上治疗进展后的MSS、BRAF野生型mCRC患者,接受帕博利珠单抗、比美替尼和贝伐珠单抗治疗,直到疾病进展或不可耐受的毒性。在经历安全性导入期后,入组患者被随机分配到比美替尼7天导入治疗组或同步开始所有研究药物治疗组,以探索MEK抑制是否可能增加肿瘤的免疫原性。主要终点是所有患者的客观缓解率(ORR,根据RECIST v1.1评价)。
共计50例患者接受了研究治疗,其中54%为男性,所有患者的中位年龄为55岁(31-79岁)。主要终点ORR为12.0%(95% 置信区间[CI] 4.5-24.3%),与历史对照数据相比统计学差异不到5%(p=0.038,高于预先设定的阈值0.025)。疾病控制率为70.0% (95% CI 55.4-82.1%),中位无进展生存期为5.9个月(95% CI 4.2-8.7个月),中位总生存期为9.3个月(95% CI 6.7-12.2个月)(图3)。在随机队列之间没有观察到疗效差异。3级和4级不良事件的发生率分别为56%和8%,其中最常见的是皮疹(12%)和天冬氨酸转氨酶升高(12%)。
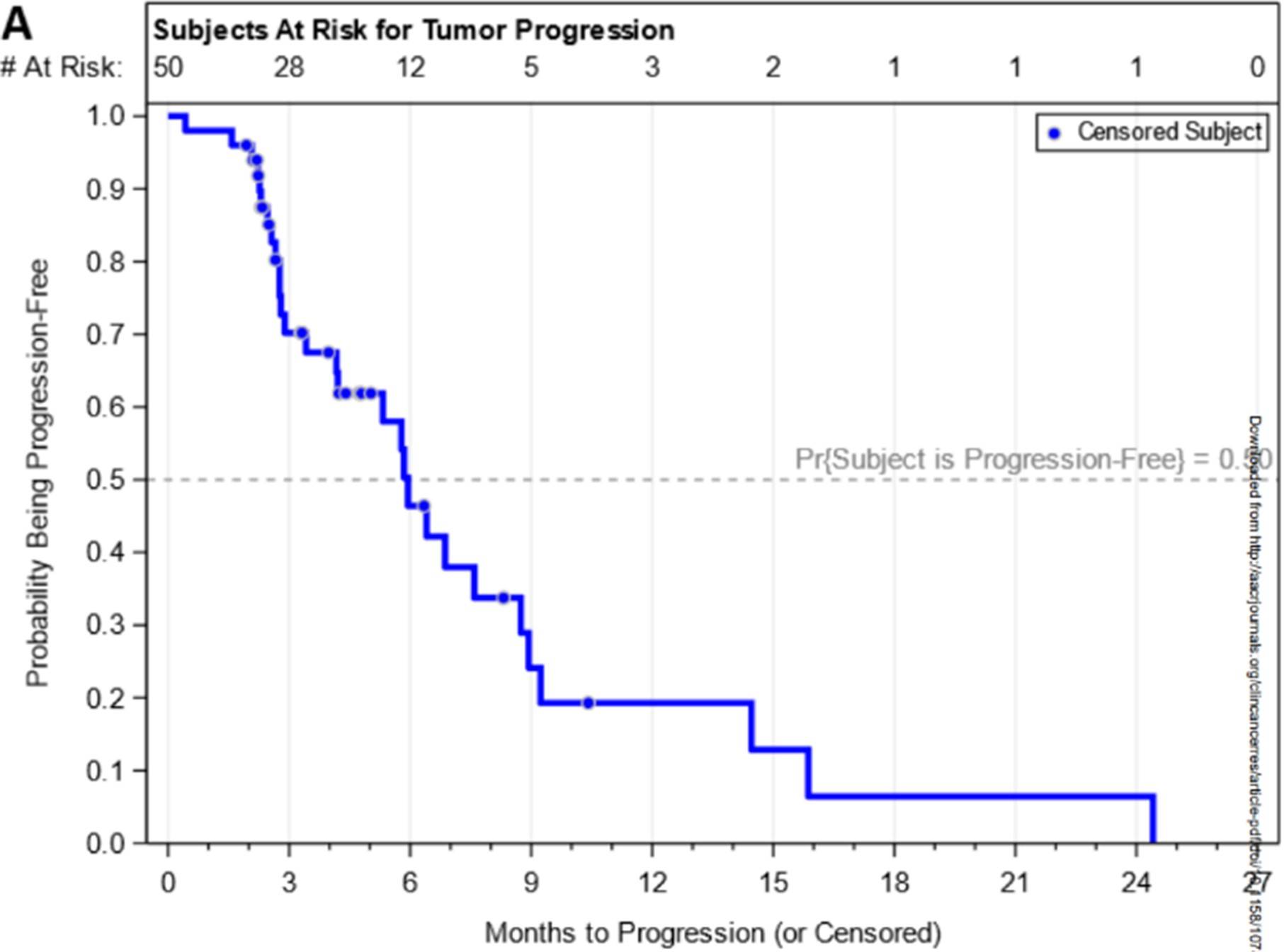
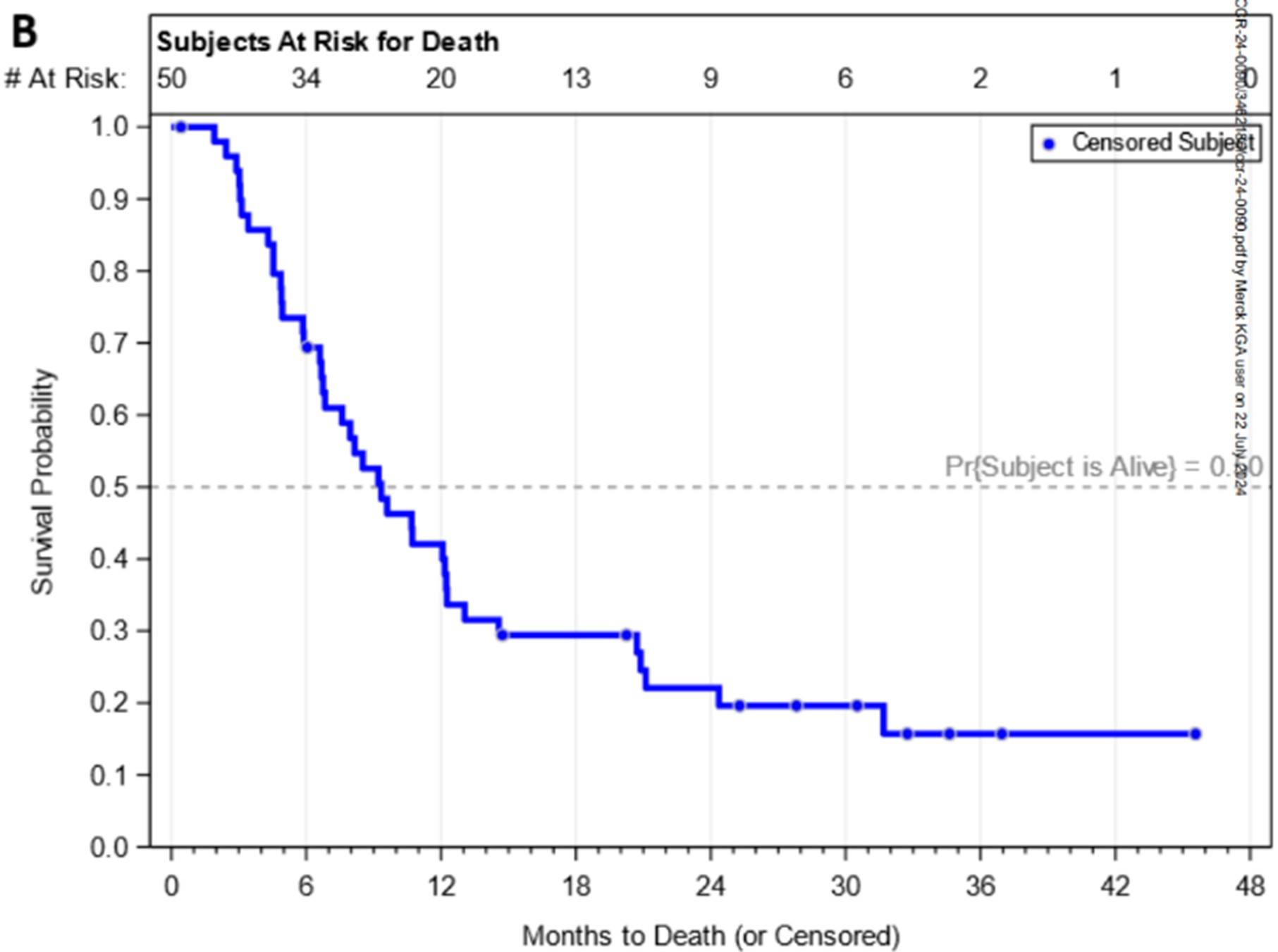
图3:试验的生存结果。(A)无进展生存期和(B)总生存期的Kaplan-Meier曲线
本研究未达到主要终点,帕博利珠单抗、比美替尼和贝伐珠单抗联合治疗与历史对照数据相比没有得到更高的ORR,但显示出较高的疾病控制率,并且在难治性MSS mCRC中展现出可接受的安全性。
方维佳教授: 从Ⅰ期的REGONIVO 研究的36% ORR到REGOMUNE的0%,从Ⅱ期的LEAP-005的22% ORR到CAMILLA的28%,从随机Ⅲ期的IMblaze370的2%~3% ORR到LEAP-017并未显著改善生存的报告,多年来多种组合多项研究都希望为MSS型肠癌病人找到免疫治疗的获益人群。本研究也是一样,可惜无论是七天的比美替尼run in还是全部药物启用,都无法证明显著优于历史对照数据,故该领域研究还是任重道远。文中提出,非肝转移晚期肠癌是今后研究的方向,不过我认为毕竟肝转移是肠癌转移的更常见部位,“明知山有虎,偏向虎山行“,这个方向理应是广大临床及转化研究专家攻坚克难的主战场。
局部晚期错配修复缺陷结肠癌的新辅助免疫治疗4
PI: Myriam Chalabi 荷兰;发表于The New England Journal of Medicine
非转移性结肠癌患者中有10%至15%的肿瘤为错配修复缺陷(dMMR)。在这些患者中,化疗的效果有限。新辅助免疫治疗的应用已显示出良好的效果,但相关的研究数据仍然不足。
在一项Ⅱ期研究中,非转移性、局部晚期、先前未经治疗的dMMR结肠癌患者接受新辅助纳武利尤单抗联合伊匹木单抗治疗。两个主要终点分别是安全性和3年无病生存率,其中安全性是通过手术的准时性(即由于治疗相关毒性事件而导致的手术计划推迟≤2周)来定义的。次要终点包括病理缓解和基因组学分析结果。
在115例入组患者中,113例患者(98%;97.5%置信区间[CI],93-100)按期手术,2例患者手术延迟达2周以上。5例患者(4%)发生了3级或4级免疫相关不良事件,没有患者因不良事件而停止治疗。在纳入疗效分析的111例患者中,109例患者(98%;95% CI, 94-100)被观察到病理缓解,105例患者(95%)达到主要病理缓解(定义为残余存活肿瘤细胞≤10%),75例患者(68%)达到病理完全缓解 (残余存活肿瘤0%)(表1)。中位随访26个月(范围:9-65个月)无患者出现疾病复发。
表1: 纳入疗效分析的患者的病理缓解情况

在局部晚期dMMR结肠癌患者中,新辅助纳武利尤单抗联合伊匹木单抗治疗具有可接受的安全性,并且可使高比例的患者产生病理缓解。(Bristol Myers Squibb资助;NICHE-2 ClinicalTrials.gov注册编码:NCT03026140)
方维佳教授:免疫治疗的出现为dMMR/MSI-H结直肠癌患者的治疗提供了新的选择,领域内同时关注三个问题:第一,双免还是单免治疗?虽然该联合疗法在多种癌症的治疗中显示出优于单一药物的疗效,但不可否认双药治疗可能会带来更多、更严重的免疫相关不良反应;第二,治疗持续时间及疗效评估如何?在NICHE-2研究中,手术前仅接受两剂纳武利尤单抗(3mg/kg)和一剂伊匹木单抗(1mg/kg),98%的患者及时接受了手术,提示双免治疗是安全的;第三,新辅助免疫治疗后是否还需要辅助治疗?目前没有NICHE-2患者出现疾病复发的报道,尚有待于该研究的双终点之一的三年DFS数据的报告。从我个人角度,结合CHECKMATE142等结果的报告,在无免疫治疗禁忌的dMMR患者中,无论是局晚还是初始不可切除,都值得用双免组合去为患者争取更优的生存获益。
新辅助卡瑞利珠单抗联合阿帕替尼治疗局部晚期高度微卫星不稳定性或错配修复缺陷型结直肠癌(NEOCAP):一项单臂、开放标签、Ⅱ期研究5
PI: 丁培荣 中国;发表于Lancet Oncol
对于错配修复缺陷的结直肠癌,在晚期治疗和新辅助治疗中应用PD-1抑制剂都是非常有效的。该研究旨在探讨PD-1抑制剂联合血管生成抑制剂新辅助治疗的疗效和安全性,以及局部晚期错配修复缺陷的结直肠癌患者器官保全的可行性。
位于中国广州的中山大学肿瘤防治中心和省中医院联合启动了一项单臂、开放标签、Ⅱ期试验(NEOCAP)。纳入的患者包括年龄在18-75岁,未经治疗,错配修复缺陷或高度微卫星不稳定或POLE/POLD1突变,局部晚期结直肠癌(直肠癌为cT3或N+,结肠癌为浸润深度≥5mm的T3或T4伴或不伴N+),ECOG评分为0-1。治疗方案为第1天静脉注射200 mg卡瑞利珠单抗,第1-14天口服250 mg阿帕替尼,每3周为一个周期。用药持续3个月后进行手术,如果患者未进行手术则用药持续6个月。出现临床完全缓解的患者继续观察,不进行手术。研究的主要终点是病理或临床完全缓解的患者比例。接受至少一个周期新辅助治疗并在基线评估后至少有一次肿瘤评估的入组患者被纳入疗效分析,接受至少一次药物剂量的患者被纳入安全性分析。该研究已在ClinicalTrials.gov上注册(NCT04715633)并正在进行中。
在2020年9月29日至2022年12月15日期间共入组了53名患者,1名患者因被发现是错配修复正常和微卫星稳定而被排除在疗效分析之外。纳入分析的患者中女性为23例(44%),男性为29例(56%)。中位随访时间为16.4个月(IQR 10.5-23.5个月)。临床完全缓解的患者为28例 (54%;95% CI 35-68),其中24例患者进入临床观察(包括20例结肠癌和多发性原发性结直肠癌患者)。52例患者中有23例(44%)接受了原发肿瘤手术,14例(61%;95% CI 39-80)出现病理完全缓解(图4)。52例患者中合计共38例 (73%;95% CI 59-84)为完全缓解。53例患者中有20例(38%)发生3-5级不良事件,其中最常见的是转氨酶升高(6例[11%])、肠梗阻(4例[8%])和高血压(4例[8%])。53例患者中有6例(11%)发生与药物相关的严重不良事件。1例患者死于治疗导致的免疫相关性肝炎。
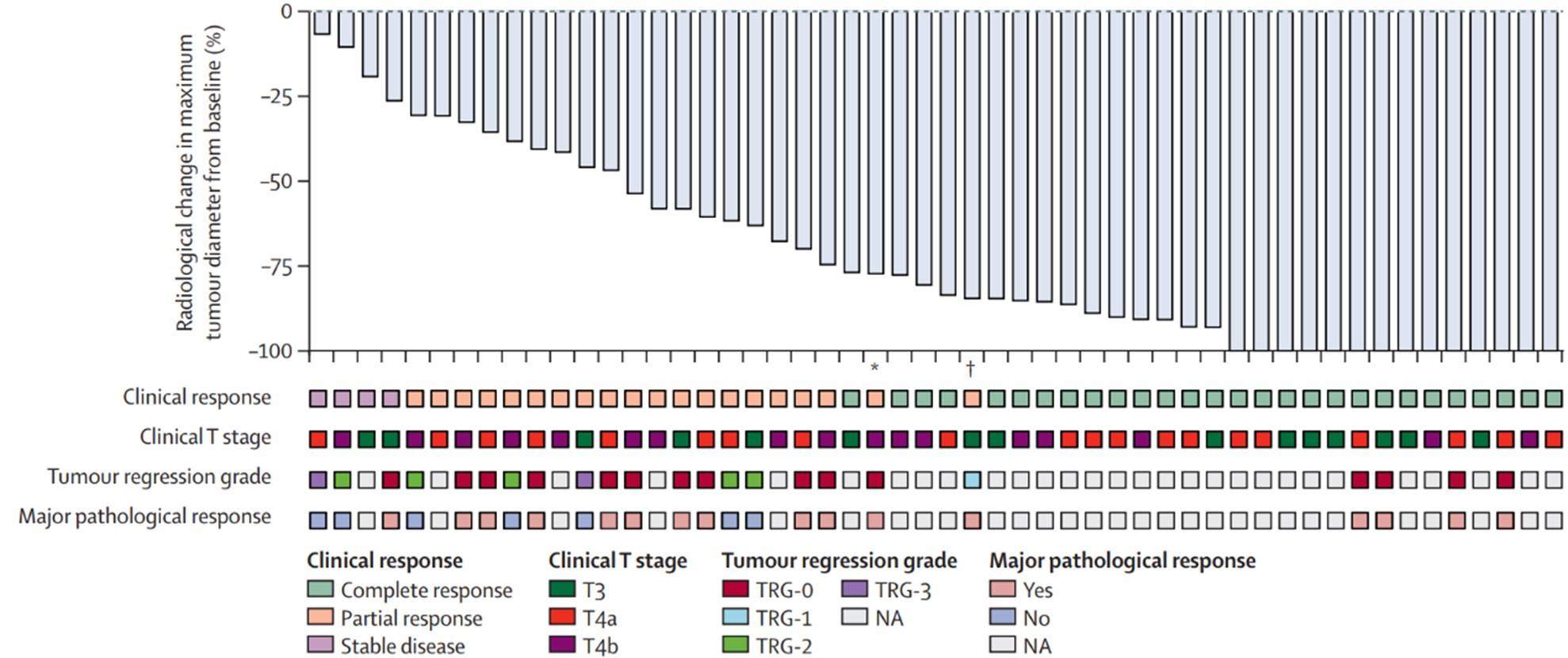
图4:肿瘤直径自基线起的最大影像学改变瀑布图
新辅助卡瑞利珠单抗联合阿帕替尼在局部晚期错配修复缺陷或高度微卫星不稳定的结直肠癌患者中显示出有前景的抗肿瘤活性。应高度警惕并监测免疫相关不良事件。器官保全的实现似乎不仅对直肠癌患者有希望,而且对那些临床完全缓解的结肠癌患者也有希望。还需要更长时间的随访来评估采取临床观察方案的肿瘤学结局。(资助项目:国家自然科学基金、广东省基础与应用基础研究基金、中山大学肿瘤防治中心癌症创新研究项目)
方维佳教授:新辅助免疫治疗正成为dMMR/MSI-H结直肠癌新辅助治疗的优选方案,以下两类患者人群可能为新辅助免疫治疗的巨大获益人群:首先,对于具有高危复发或转移风险的患者,尤其是T4b或肿瘤负荷较大者,新辅助免疫治疗可能降低其复发风险;其次,有重要器官功能保留需求的患者,比如肛门保留。这一变化反映了对dMMR/MSI-H结直肠癌生物学特性的更深入理解以及治疗策略的不断优化。NEOCAP研究作为首次对局晚期结直肠癌使用免疫治疗后“观察与等待”策略可行性的前瞻性探索,为局部晚期MSI-H/dMMR结肠癌患者新辅助治疗获得cCR后实现器官功能保留带来了重要的循证医学证据。此外,该研究也在前期各项新辅助免疫治疗的数据中,证实了更长时间的药物暴露可为患者带来更高比例的获益,同时,免疫检查点抑制剂和VEGFR抑制剂的首次组合,也是本研究的亮点之一。
本期关键信息总结:
1. 一项随机Ⅲ期研究(CAIRO4),探索了前期原发肿瘤切除是否会为无严重原发肿瘤症状的同时性mCRC患者带来生存获益。结果表明,对无严重原发肿瘤症状的同时性mCRC患者而言,在姑息性系统治疗的基础上增加前期PTR并不能带来额外的生存获益。
2. 一项Ⅰ期研究,对Botensilimab联合balstiliumab治疗复发/难治性微卫星稳定转移性结直肠癌的疗效和安全性进行了初步验证,结果展示出这种新型联合疗法在安全性、耐受性以及抗肿瘤活性方面的前景,尤其是在无肝转移的患者中,可能为这类“冷”肿瘤患者提供新的治疗希望。
3. 一项Ⅱ期研究,在MSS mCRC的患者中探索了帕博利珠单抗、比美替尼和贝伐珠单抗联合治疗的疗效、安全性和耐药性特征,尽管未达到比历史对照数据更高的ORR,但在基线无肝转移患者中观察到改善疗效的信号,并识别了可能预测疗效的生物标志物以及治疗期间可能的耐药机制。
4. 一项Ⅱ期研究(NICHE-2),探索了纳武利尤单抗联合伊匹木单抗用于局部晚期非转移性dMMR结肠癌患者新辅助治疗的疗效。结果显示出可接受的安全性且MPR率达95%,pCR率达68%。
5. 一项Ⅱ期单臂研究(NEOCAP),探索了卡瑞利珠单抗联合阿帕替尼用于局部晚期MSI-H/dMMR结直肠癌患者新辅助治疗的有效性、安全性和器官保全的可行性。这是第一项研究PD-1抑制剂联合VEGFR抑制剂在该人群中疗效的试验,也是首次探讨了免疫治疗后临床完全缓解结肠癌患者使用观察等待疗法策略的可行性。结果显示出有前景的抗肿瘤活性和器官保全的希望。
1. Van der Kruijssen DEW, Elias SG, van de Ven PM, et al. Upfront resection versus no resection of the primary tumor in patients with synchronous metastatic colorectal cancer: the randomized phase 3 CAIRO4 study conducted by the Dutch Colorectal Cancer Group and the Danish Colorectal Cancer Group. Ann Oncol. Published online June 7, 2024.
2. Bullock AJ, Schlechter BL, Fakih MG, et al. Botensilimab plus balstilimab in relapsed/refractory microsatellite stable metastatic colorectal cancer: a phase 1 trial. Nat Med. Published online June 13, 2024.
3. Lentz RW, Friedrich TJ, Blatchford PJ, et al. A phase II study of potentiation of pembrolizumab with binimetinib and bevacizumab in refractory microsatellite stable colorectal cancer. Clin Cancer Res. Published online June 13, 2024.
4. P Chalabi M, Verschoor YL, Tan PB, et al. Neoadjuvant Immunotherapy in Locally Advanced Mismatch Repair-Deficient Colon Cancer. N Engl J Med. 2024;390(21):1949-1958.
5. Yu JH, Xiao BY, Li DD, et al. Neoadjuvant camrelizumab plus apatinib for locally advanced microsatellite instability-high or mismatch repair-deficient colorectal cancer (NEOCAP): a single-arm, open-label, phase 2 study. Lancet Oncol. 2024;25(7):843-852.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


