2024年5月31日-6月4日,2024年美国临床肿瘤学会(ASCO)年会于美国芝加哥正式召开,本次大会报道了多项高度微卫星不稳定/错配修复缺陷(MSI-H/dMMR)型结直肠癌和实体瘤的最新前沿进展。
其中有中山大学肿瘤防治中心徐瑞华教授牵头开展的“IBI310(抗CTLA-4抗体)+信迪利单抗(抗PD-1抗体)新辅助治疗MSI-H/dMMR型结直肠癌患者:一项随机、开放标签、Ib期研究结果”;还有浙江大学附属第二医院丁克峰教授等研究人员开展的“替雷利珠单抗新辅助治疗局部晚期MSI-H/dMMR型结直肠癌的单臂多中心研究”;以及免疫治疗在MSI-H/dMMR型实体瘤的探索研究“Iparomlimab(QL1604)在无法切除MSI-H/dMMR型实体瘤患者中的疗效研究”。
专家介绍
中山大学附属第一医院胃肠三科科主任、胃肠中心副主任
中华医学会外科分会手术学组委员
中华医学会外科分会青委会委员
中国医师协会微无创分会胃肠外科专委会副主委
中国研究型医院协会结直肠肛门外科分会副主委
广东省医疗行业管理协会胃肠消化外科分会主委
广东省医学会减重代谢学组副主委
广东省抗癌协会腹腔热灌注副主委
广东省医院协会减重代谢分会副主委
广东省医学会外科分会胃肠学组组长
中国抗癌协会胃癌专业委员会委员
中国抗癌协会胃癌专业委员会腹腔镜学组委员
中国医师协会外科医师分会微创外科委员会委员
中国医师协会外科医师分会肿瘤外科分会委员
中国医师协会外科医师分会专业信息传播和教育工作委员会委员
中国医师协会内镜医师分会腹腔镜外科专委会委员
中国研究型医院协会结直肠专委会副主委
中国研究型医院协会肿瘤委员会委员
中国老年保健医学研究会胃肠外科分会常委
中华外科青研社胃肠学组成员
中华消化外科菁英会胃肠学组成员

精准治疗,检测先行
MSI是指DNA复制过程中由于插入或缺失突变而导致的MS序列长度或碱基组成的变化,这种改变通常由dMMR引起1。肿瘤的MSI状态可分为稳定(MSS)、低不稳定性(MSI-L)或高不稳定性(MSI-H)1。MSI-H在实体瘤(如子宫内膜癌、结直肠癌和胃癌)中的发生率很高2。dMMR可能是由于MMR基因的种系突变(Lynch综合征),在这种情况下,恶性肿瘤存在遗传模式3。然而,dMMR更常见于MMR基因的散发突变,这种情况通常伴有CpG岛甲基化表型(CIMP)。值得注意的是,50%的散发病例还表现出BRAF激活突变(V600E)。因此,在CIMP和这种BRAF突变患者中,通常可以排除Lynch综合征4,5。大多数临床研究表明,MSI-H/dMMR实体瘤患者从免疫检查点抑制剂(ICI)中获得显著获益6-8。此外,决定ICI治疗获益的关键因素是患者的MSI状态,而不是特定类型的癌症9。
MSI和MMR在结直肠癌中的检测具有重要的临床指导意义。MSI和MMR的检测不仅可以帮助预测患者的预后,还可以指导个体化治疗方案的制定,尤其是在局部进展期结直肠癌及其他肿瘤免疫治疗方面。检测指导精准诊疗,通过检测MSI-H和dMMR,可以更精准地为患者提供治疗方案,提升治疗效果和生存率。

2024 ASCO中国之声:新辅助免疫治疗局部进展期MSI-H/dMMR结直肠癌
局部进展期结直肠癌(LACRC)术后局部复发和远处转移的风险很高。传统的手术切除模式不能满足所有这些患者的需求,尽管新辅助治疗有时可以提供额外的疗效。新辅助化疗(nCT)对LACRC MSI-H/dMMR患者的疗效如何?
2024年ASCO大会上,中山大学肿瘤防治中心徐瑞华教授受邀就“IBI310(抗CTLA-4抗体)+信迪利单抗(抗PD-1抗体)新辅助治疗MSI-H/dMMR型结直肠癌患者:一项随机、开放标签、Ib期研究结果”进行了精彩报告10。这是一项随机、开放标签的Ib期研究,评估了IBI310联合信迪利单抗用于高度微卫星不稳定(MSI-H)/错配修复缺陷(dMMR)结直肠癌患者新辅助治疗的临床疗效。
研究共纳入了局部晚期(IIB-III期)、可切除的MSI-H/dMMR CRC患者。患者随机分为两组:A组接受1个周期的IBI310(1mg/kg)联合2个周期的信迪利单抗(200mg,每三周一次),B组仅接受2个周期的信迪利单抗(200mg,每三周一次)作为新辅助治疗;主要终点为病理完全缓解率(pCR),次要终点包括R0切除率和安全性10。
截至2024年2月4日,共纳入101名患者。两组患者的基线特征如下表所示10:
患者基线特征
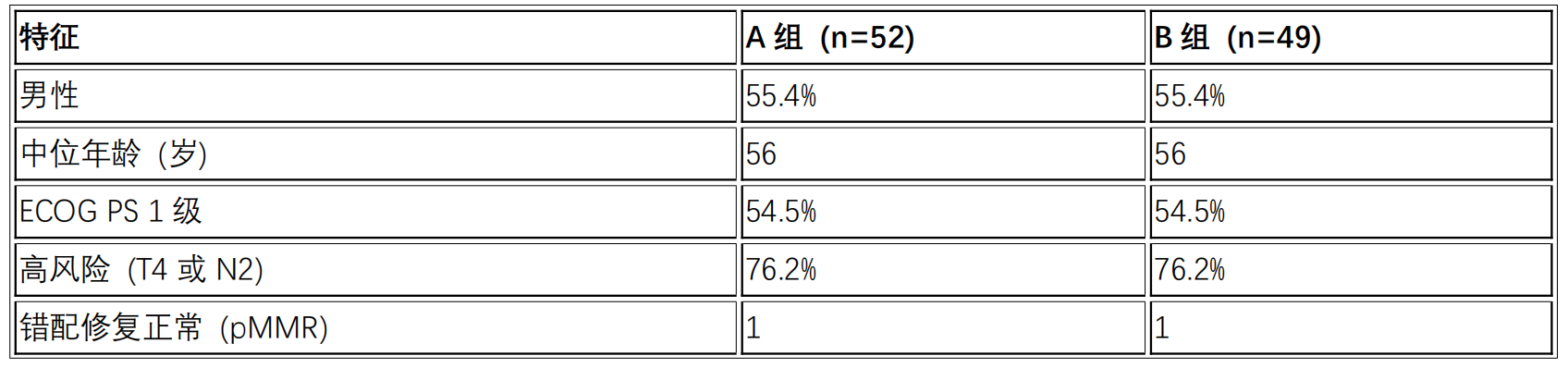
研究结果显示10,在两组中各有1例患者术后病理提示错配修复正常(pMMR)。在pCR率方面,A组为80.0%(40/50,5%CI:66.3-90.0),B组为47.7%(21/44,95%CI:32.5-63.3,p= 0.0007)。所有接受手术的患者均达到R0切除。第一次给药到手术的中位时间为47天(范围:35-82天)。发生手术延迟3例,其中A组2例因2级甲状腺功能减退(延迟2天),1例则因1级甲状腺功能亢进(延迟13天);B组中,因其他原因延迟的患者1例(延迟26天)。
A组和B组患者的不良事件(TEAEs)发生情况如下表所示:
不良事件(TEAEs)
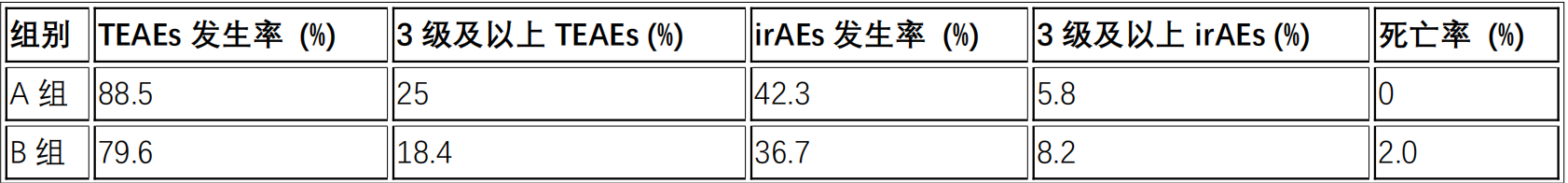
该研究结果可知,与单药应用信迪利单抗相比,IBI310联合信迪利单抗新辅助治疗用于MSI-H/dMMR结直肠癌患者可显著改善pCR率;两个治疗组的安全性相当并可控10。
大会的另一项研究,也说明了MSI和MMR检测的重要意义和指导作用,那便是浙江大学附属第二医院丁克峰教授领衔的“替雷利珠单抗新辅助治疗局部晚期MSI-H/dMMR型结直肠癌的单臂多中心研究”11。
该研究是一项多中心的II期开放标签研究(NCT05116085),纳入年龄≥18岁、临床分期为II/III期的MSI-H/dMMR CRC患者,ECOG体能状态(PS)为0-1,且符合R0(完全)切除标准的患者11。患者每三周接受一次替雷利珠单抗 200mg静脉注射,共3个周期,随后在首次替雷利珠单抗给药后的10周内进行手术切除11。主要终点是主要病理反应(MPR)率(指手术切除的原发肿瘤中残留的活跃肿瘤细胞≤10%的患者比例)11。次要终点包括病理完全缓解(pCR)率(指手术切除标本中无残留肿瘤的患者比例)和安全性。R0切除率为探索性终点。
总体共纳入33名患者,分布于中国的8个研究中心。患者基线特征如下11:
患者基线特征

研究结果显示,在接受手术的29名患者中,主要病理反应(MPR)率为89.7%,病理完全缓解(pCR)率为62.1%11。
疗效评估
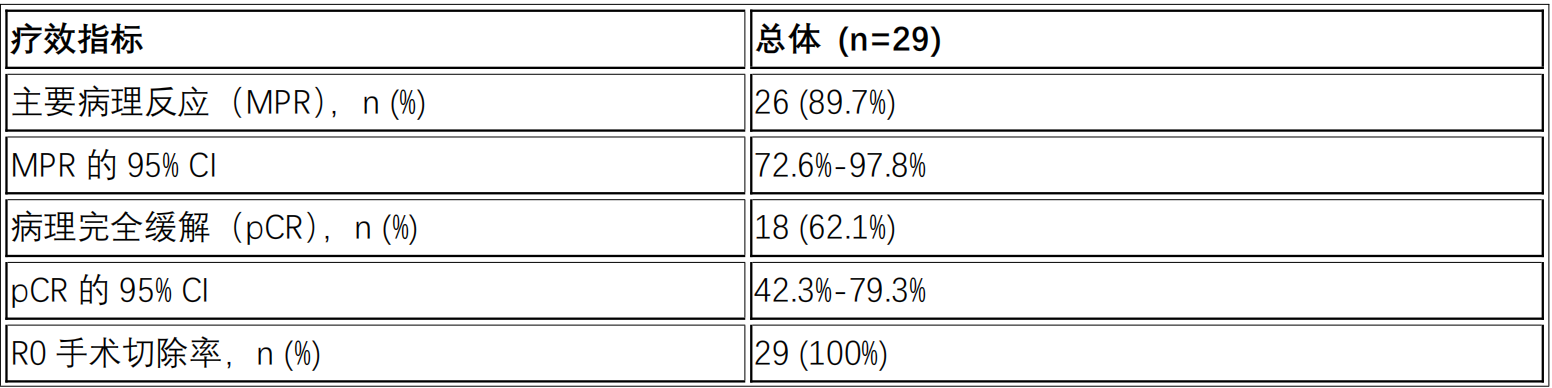
常见的不良事件包括甲状腺功能减退(所有为1-2级),未见3级及以上或严重的手术相关不良事件11。
不良事件(TRAEs)

该研究结果再次印证了MSI和MMR检测对局部进展期结直肠癌诊疗的指导作用以及对免疫治疗疗效的预测,结果表明,替雷利珠单抗新辅助治疗在局部晚期MSI-H/dMMR型CRC患者中表现出高的MPR和pCR率,显示出显著的抗肿瘤活性和良好的手术切除效果。

2024 ASCO中国之声:MSI/MMR检测已进入实体瘤时代
2024年ASCO大会,MSI-H/dMMR型局部进展期结直肠癌免疫治疗大放异彩,取得了令人瞩目的疗效获益。免疫治疗在MSI-H/dMMR型实体瘤中的应用也在积极展开,未来MSI/MMR检测将应用于更广泛的癌种中,推动免疫治疗与精准医疗的发展。
另一项发表于本次大会的中国研究很好地展现了MSI/MMR检测在实体瘤中的应用价值——“Iparomlimab(QL1604)在无法切除MSI-H/dMMR型实体瘤患者中的疗效研究”12。 Iparomlimab是一种新型的抗PD-1抗体,已在无法切除/转移性MSI-H/dMMR型实体瘤患者中展示了良好的抗肿瘤活性和耐受性。该研究旨在评估Iparomlimab在这类患者中的疗效和安全性。
这是一项单臂、多中心II期临床试验,纳入了病理诊断为MSI-H/dMMR无法切除/转移性实体瘤的患者。患者接受Iparomlimab治疗(200mg,静脉注射,每三周一次;体重<40kg的患者剂量为3mg/kg)。主要终点为根据RECIST 1.1标准由独立影像学评审委员会(IRRC)评估的确认客观缓解率(ORR)。入组并接受至少一个周期治疗的患者被纳入意向治疗(ITT)集。复发/难治性患者被纳入全面分析集(FAS),作为主要疗效分析人群12。
截至2023年1月12日,共纳入120名患者,ITT集中有60名患者纳入FAS。117名患者(97.5%)为IV期疾病。中位既往治疗线数为2。具体基线特征如下表所示12:
患者基线特征

研究结果显示12,Iparomlimab在ITT和FAS集中均显示出较高的客观缓解率(ORR)和疾病控制率(DCR),其中完全缓解率(CR)和部分缓解率(PR)也达到较高水平。中位缓解持续时间(DoR)、中位无进展生存期(PFS)和中位总生存期(OS)均未达到(NE),但24个月的DoR和PFS率显示出持久的疗效。Iparomlimab在治疗过程中显示出良好的耐受性。虽然TRAEs发生率较高,但大多数为轻至中度。免疫相关不良事件(irAEs)发生率适中,最常见的irAEs为甲状腺功能减退。治疗相关严重不良事件(TRSAEs)发生率较低,未出现治疗相关死亡案例。
由此可见,无论是在局部进展期结直肠癌还是其他实体瘤领域,MSI/MMR状态在预测肿瘤免疫治疗应答方面发挥着极其重要的角色,因此,在给予免疫治疗之前确定晚期实体瘤患者的MSI状态非常重要,MSI状态已成为临床肿瘤学的重要考虑因素。
多项研究展示了免疫治疗和联合治疗在MSI-H/dMMR型结直肠癌中的显著疗效和安全性。通过检测微卫星不稳定性高(MSI-H)和错配修复缺陷(dMMR),能够有效指导局部进展期结直肠癌及实体瘤免疫治疗,显著提升患者的治疗效果和生存率。随着检测技术和治疗方案的不断进步,dMMR/MSI-H型实体瘤的治疗前景将更加广阔,有望为更多患者带来临床获益。未来的研究和临床试验将继续探索和优化这些治疗方法,为提高患者的总体生存率和生活质量提供坚实的科学依据。
1. Cohen R, et al. JAMA Oncol (2019) 5(4):551–5.
2. Hause RJ, et al. Nat Med (2016) 22(11):1342–50.
3. Aaltonen LA, Set al. N Engl J Med (1998) 338(21):1481–7.
4. Herman JG, et al. Proc Natl Acad Sci USA (1998) 95(12):6870–5.
5. Domingo E, et al. J Med Genet (2004) 41(9):664–8.
6. Overman MJ, et al. Lancet Oncol (2017) 18(9):1182–91.
7. Le DT, et al. N Engl J Med (2015) 372(26):2509–20.
8. Marabelle A, et al. J Clin Oncol (2020) 38(1):1–10.
9. Le DT, et al. Science (2017) 357(6349):409–13.
10. Rui-Hua Xu et al. ASCO 2024. Abs.3505.
11. Ke-Feng Ding, et al. ASCO 2024. Abs.3599.
12. Weijian Guo et al. ASCO 2024. Abs.3578.
排版编辑:栗子











 苏公网安备32059002004080号
苏公网安备32059002004080号


