外科手术是可切除非小细胞肺癌(NSCLC)患者的最重要手段之一。相关数据显示,经病理分期I期、II期和IIIA/B期NSCLC患者的术后5年总生存率分别为73%~90%、56%~65%和24%~41%%[1]。为进一步改善患者预后,全球专家学者致力于探索如何预防疾病复发、控制远处转移。随着对NSCLC预后因素的深入认识及研究数据的不断积累和成熟,ctDNA检测在预测和监控早期NSCLC患者术后疾病复发等方面显现出重要的临床价值[2]。然而,ctDNA的检测易受肿瘤临床特征和生物学特征的影响。既往研究显示,ctDNA水平与肿瘤负荷显著相关,还与肿瘤的基因突变特征存在一定的相关性[3]。近期,发表于《Annals of Oncology》杂志(IF:50.5)的一篇文献,探索了ctDNA在早期NSCLC患者的复发预测价值,并结合影像学肿瘤体积进一步评估该人群的预后[4]。【肿瘤资讯】现邀哈尔滨医学大学附属第二医院王秋实教授特此点评,探讨ctDNA动态检测和影像学肿瘤体积在早期可切除NSCLC患者中的预测价值。
研究介绍
本研究是一项回顾性研究。研究人群为2016年4月至2018年8月期间接受标准治疗(手术±新辅助/辅助治疗)的早期NSCLC患者。分别在术前(基线)和术后4周、7个月、10个月和13个月采集患者的血液样本。共2个队列,其中队列1(N=85)旨在评估ctDNA与早期复发的相关性,以及结合影像学的肿瘤体积进行复发风险分析;队列2(N=32)为独立队列,用于验证队列1的结果。采用术前最接近手术时间(中位时间:59天,范围3~183天)的CT和PET影像学检查结果评估患者的肿瘤体积。对于部分实性肿瘤,通过CT肺窗划分肿瘤的磨玻璃成分和实性成分。总肿瘤体积为磨玻璃结节和实性结节体积的总和。
研究结果
患者基线特征
患者具体基线特征见表1。在队列1(N=85)中,68%为腺癌,I期患者占比48%,28%的患者接受了新辅助治疗,27%的患者接受了辅助治疗。
表1 基线特征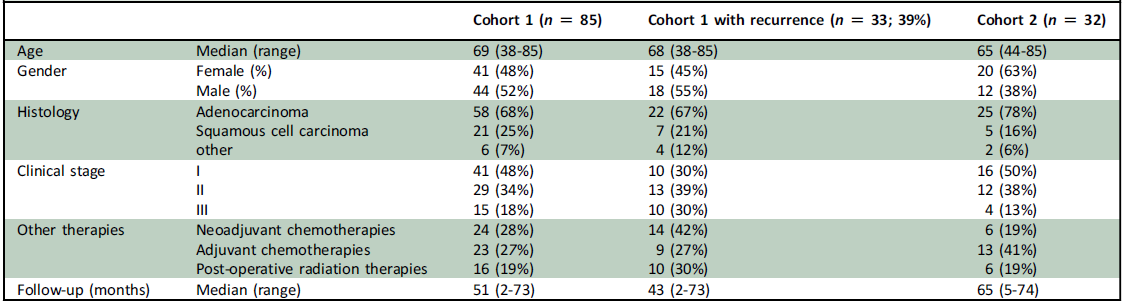
术前ctDNA检测
在队列1中,共80例患者进行了ctDNA分析,其中有48例(60%)患者检测到ctDNA。在接受新辅助治疗的患者中(N=24),有18例(75%)在术前检测到了ctDNA;在未接受新辅助治疗的患者中(N=56),术前检测到ctDNA的患者有30例(54%)。此外,组织学分级越高(G1:38%;G2:52%;G3+:85%),检测到ctDNA的比例越高。肺腺癌患者中腺泡状亚型和非腺泡状亚型检测到ctDNA的比例相同(均为44%)。
截止数据分析,中位随访时间为4.3个月,其中39%的患者出现了疾病复发。与术前未检测到ctDNA的患者相比,术前检测到ctDNA患者的无复发生存期(RFS)(HR=2.14;P=0.06)和总生存期(OS)(HR=3.29;P=0.047)更差(图1),表明术前ctDNA可能具有预后价值。
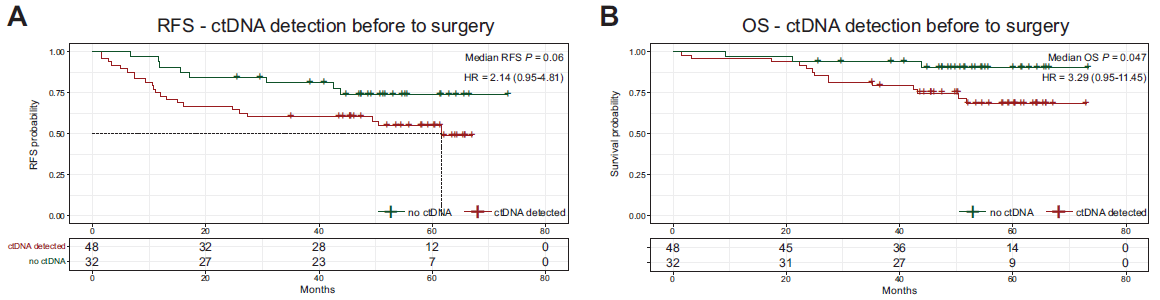 图1 术前检测到ctDNA与较差的临床预后有关
图1 术前检测到ctDNA与较差的临床预后有关
标准治疗后检测到ctDNA与较差预后有关
在标准治疗后,与未检测到ctDNA的患者相比,检测到ctDNA患者的RFS(HR=2.80;P=0.01)和OS(HR=3.99;P=0.0053)显著缩短(图2)。
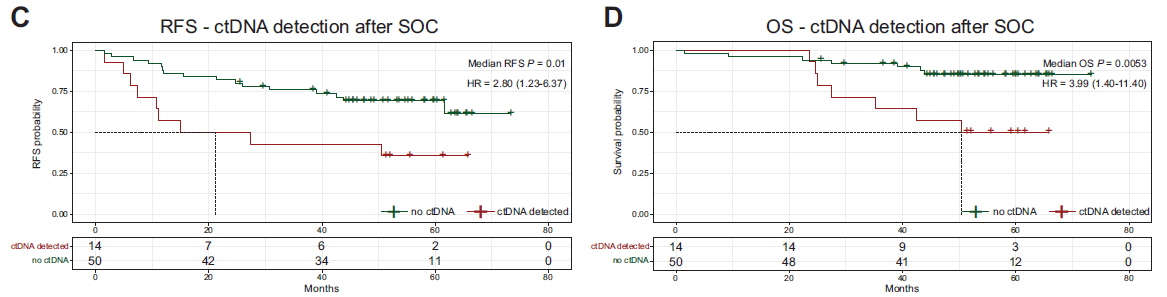 图2 标准治疗结束后检测到ctDNA与较差的临床预后有关
图2 标准治疗结束后检测到ctDNA与较差的临床预后有关
ctDNA 清除界定低风险或低复发患者
治疗前检测到ctDNA且在标准治疗后ctDNA清除的患者,其RFS和OS与整个研究期间检测不到ctDNA患者的RFS(HR=1.5; P=0.478)和OS(HR=4.6;P=0.186)无显著差异。然而,可持续检测到ctDNA患者的RFS和OS相较整个研究期间检测不到ctDNA患者的RFS和OS更短(图3)。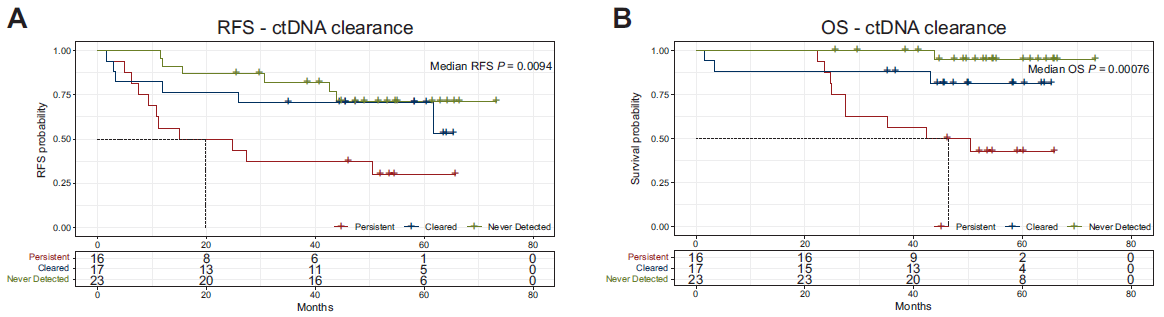 图3 完成标准治疗后ctDNA未清除与疾病复发风险增加和总生存期缩短有关
图3 完成标准治疗后ctDNA未清除与疾病复发风险增加和总生存期缩短有关
ctDNA检测联合影像学肿瘤体积可预测临床预后
基线检测到ctDNA患者的影像学肿瘤体积更大(P<0.009),且影像学肿瘤体积与ctDNA有关。计算可检测到ctDNA的最佳肿瘤体积cutoff值,并将患者分为小肿瘤体积组和大肿瘤体积组,进而建立3个风险组:低风险(小肿瘤体积,且基线未检测到ctDNA)、中风险(大肿瘤体积或基线检测到ctDNA)和高风险(大肿瘤体积,且基线检测到ctDNA)。
在队列1中,与低风险组(N=19)相比,高风险组患者(N=32)的复发风险更高(HR=3.0;P=0.049),但高风险组和中风险组(N=20)的RFS相当(HR=1.5;P=0.518)。队列2的分析结果与队列1一致。此外,在队列1和队列2中,不同风险组的OS具有显著差异(图4)。
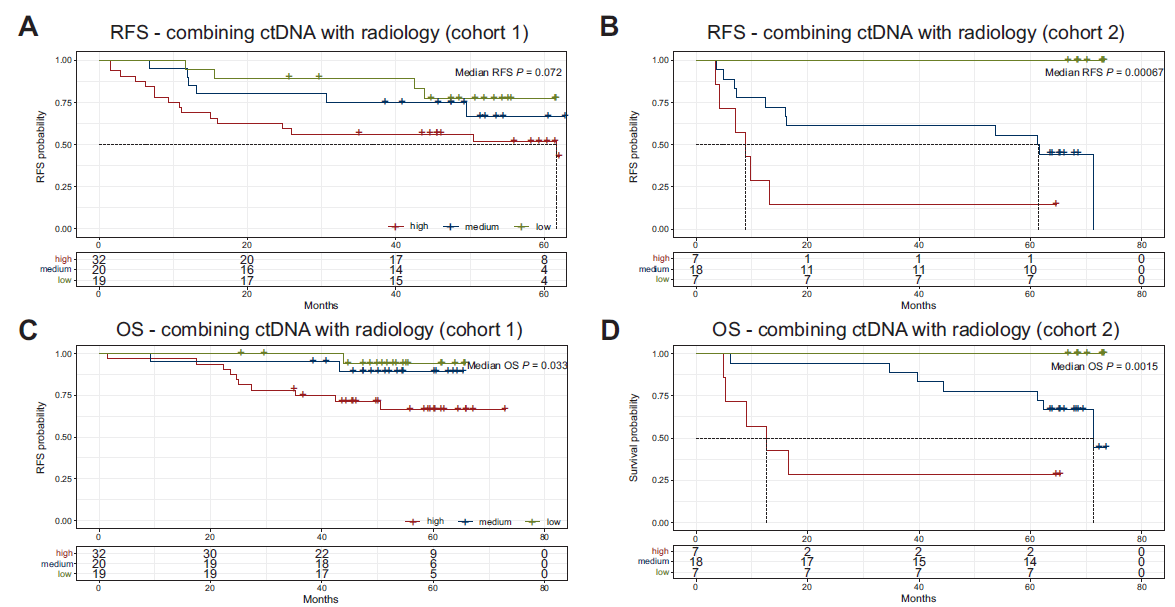 图4 基于ctDNA和影像学肿瘤体积的风险预测模型
图4 基于ctDNA和影像学肿瘤体积的风险预测模型
小结
这项研究表明,持续存在的ctDNA对患者的临床预后具有高度预测作用,且结合影像学肿瘤体积可进一步提高预测效果。ctDNA和影像学监测是指导早期NSCLC患者后续随访和制定治疗决策的重要工具。
医学博士,硕士研究生导师
哈尔滨医科大学附属第二医院胸外科副主任
黑龙江省抗癌协会肺癌专业委员会委员
黑龙江省抗癌协会食管癌专业委员会青年委员会委员
黑龙江省康复医学会胸外科康复专业委员会委员
哈尔滨市医学会医疗事故专业技术鉴定专家库成员
中国肺癌防治联盟黑龙江省分联盟委员
黑龙江省医师协会加速康复外科委员会委员
对于早期NSCLC患者,术后转移和复发被认为是影响长期生存和预后的关键因素。然而,目前基于影像学的诊断存在较大滞后,不利于早期预测。近年来,诸多研究表明ctDNA在NSCLC的早期诊断、用药指导、疗效评估、预后判定、早期复发监测、分子异质性评估、肿瘤动力学监测以及遗传因素识别等方面具有重要的指导意义。越来越多的研究表明,在早期可切除的NSCLC患者中, ctDNA与肿瘤的转移和复发密切相关。一项评估围手术期ctDNA与术后疾病复发相关性的前瞻性研究显示,在330例I-III期NSCLC患者中,相较术前ctDNA阴性患者,术前ctDNA阳性患者的RFS更短(HR=4.2;P<0.001);且术后1个月ctDNA阳性患者相较ctDNA阴性患者的复发风险更高(HR=14.3;P<0.001)。此外,对于术后ctDNA阳性人群,相较未接受辅助治疗的患者,接受辅助治疗患者的RFS更优(HR=0.3;P=0.008)[5]。
这项研究同样提示,ctDNA可预测早期可切除NSCLC患者的疾病复发。对于术前ctDNA阳性的I-III期NSCLC患者,其复发风险显著高于ctDNA阴性患者;且术后4周ctDNA阳性人群较ctDNA阴性人群也具有更高的疾病复发风险。此外,对于术前ctDNA阳性患者,术后ctDNA阴性患者较术后ctDNA持续阳性患者的RFS观察到有缩短的趋势(HR=2.50;P=0.075),但与术前和术后ctDNA均阴性患者的RFS相当(HR=1.5;P=0.478),提示ctDNA或可作为指导术后辅助治疗的标志物。目前术后ctDNA辅助治疗的相关临床研究正在开展中(NCT04585477、NCT04611776、NCT05457049)。
此外,该研究进一步评估了肿瘤体积与ctDNA在早期NSCLC患者中的相关性。既往研究提示,高肿瘤负荷与ctDNA阳性相关[3]。在此次报道的研究中,与ctDNA阴性患者相比,ctDNA阳性患者的总肿瘤体积更大(P=0.009)。值得关注的是,该研究整合了ctDNA状态与影像学肿瘤体积,建立了复发风险预测模型(低风险、中风险和高风险),并在队列2中进一步验证了此模型的可行性,这对于临床实践中术后患者的随访监测和及早干预提供了更为精准的参考依据。
目前已经有越来越多的研究数据支持ctDNA动态监测在预测早期NSCLC患者术后疾病复发方面的价值。但NSCLC往往具有高度异质性,既往研究提示肿瘤分化程度、组织学类型、胸膜浸润等是早期NSCLC患者的独立预后因素[6]。未来仍有待更多前瞻性临床研究的探索,以进一步评估基于分子标志物和临床病理高危因素在可切除NSCLC患者疾病复发领域的价值和临床意义。
[1] Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2016;11(1):39-51. doi: 10.1016/j.jtho.2015.09.009. PMID: 26762738.
[2] Morgensztern D. The expanding role of circulating tumor DNA in resectable non-small cell lung cancer. Cancer. Published online February 29, 2024. doi: 10.1002/cncr.35268. Epub ahead of print. PMID: 38421941.
[3] Lam VK, Zhang J, Wu CC, et al. Genotype-Specific Differences in Circulating Tumor DNA Levels in Advanced NSCLC. J Thorac Oncol. 2021;16(4):601-609. doi: 10.1016/j.jtho.2020.12.011. Epub 2020 Dec 31. PMID: 33388476.
[4] Tran HT, Heeke S, Sujit S, et al. Circulating tumor DNA and radiological tumor volume identify patients at risk for relapse with resected, early-stage non-small-cell lung cancer. Ann Oncol. 2024;35(2):183-189. doi: 10.1016/j.annonc.2023.11.008. Epub 2023 Nov 21. PMID: 37992871.
[5] Xia L, Mei J, Kang R, et al. Perioperative ctDNA-Based Molecular Residual Disease Detection for Non-Small Cell Lung Cancer: A Prospective Multicenter Cohort Study (LUNGCA-1). Clin Cancer Res. 2022;28(15):3308-3317. doi: 10.1158/1078-0432.CCR-21-3044. PMID: 34844976.
[6] Moreira AL, Ocampo PSS, Xia Y, et al. A Grading System for Invasive Pulmonary Adenocarcinoma: A Proposal From the International Association for the Study of Lung Cancer Pathology Committee. J Thorac Oncol. 2020;15(10):1599-1610. doi: 10.1016/j.jtho.2020.06.001. Epub 2020 Jun 17. PMID: 32562873.
本材料由阿斯利康提供,仅供医疗卫生专业人士参考,不可用于推广目的。
审批编号:CN134921
过期日期:2024-8-6
排版编辑:肿瘤资讯-张钰晴











 苏公网安备32059002004080号
苏公网安备32059002004080号


