肺癌是我国发病率和死亡率最高的肿瘤[1]。非小细胞肺癌(NSCLC)是肺癌的主要病理类型,约占所有肺癌患者的80%~85%[2],其中约30%的NSCLC患者初诊时可进行手术切除[3]。术后辅助化疗的探索为IB-III期NSCLC患者带来了一定的生存获益,但仍有超过一半的患者在5年内出现疾病复发,II期和III期NSCLC患者的5年OS率约为53%~60%和26%~36%[4],有待进一步改善远期预后。据相关数据显示,EGFR突变发生率在可切除NSCLC患者和晚期NSCLC患者中相似[5]。EGFR-TKIs在EGFR突变NSCLC辅助治疗进行了诸多探索。基于此,JAMA oncology杂志(IF: 28.4)发表了一篇报道,针对经手术切除后的EGFR突变NSCLC的辅助治疗进行了阐述[7]。【肿瘤资讯】现邀山东省立医院彭忠民教授特此点评,结合临床实践及最新研究数据进展,对EGFR-TKIs在EGFR突变NSCLC辅助治疗的现状及未来趋势进行了深度探讨。
EGFR-TKIs在EGFR突变NSCLC辅助治疗中的地位已然明晰
早期针对EGFR-TKI辅助治疗NSCLC的III期临床研究并未根据EGFR突变状态进行人群筛选,RADIANT研究是其中之一。该研究评估了厄洛替尼和安慰剂2年辅助治疗在IB-IIIA期(第6版TNM分期)NSCLC中的有效性和安全性,主要研究终点为DFS。中位随访47个月时,厄洛替尼和安慰剂的DFS未观察到显著差异(HR=0.90,P=0.32),OS也无显著差异(HR=1.13,P=0.34)。在该研究纳入EGFR突变患者(16.5%)中,厄洛替尼2年辅助治疗相较安慰剂有DFS(HR=0.61)和OS(HR=1.09)获益趋势(表1)。
EVIDENCE研究纳入322例经手术切除的II-IIIA期EGFR突变NSCLC患者,随机接受埃克替尼或含铂化疗,主要终点为DFS。结果显示,与化疗相比,埃克替尼显著改善DFS(HR=0.36,P<0.001),然而OS数据尚未成熟。
ADAURA研究是全球首个证实辅助靶向治疗能为IB-IIIA期(AJCC第7版TNM分期)EGFR突变(19del/21L858R)NSCLC患者带来DFS和OS获益的III期注册临床研究。该研究共纳入682例经手术完全切除的IB-IIIA期EGFR突变(19del/21L858R)NSCLC患者,按1:1比例随机接受奥希替尼或安慰剂3年辅助治疗(选择性辅助化疗后),主要研究终点为研究者评估的II-IIIA期患者的DFS,次要研究终点包括IB-IIIA期患者(整体人群)的DFS、OS和安全性。奥希替尼组和安慰剂组的中位随访时间分别为22.1个月和14.9个月,与安慰剂相比,奥希替尼明显改善IB-IIIA期(HR=0.20, 95%CI:0.14- 0.30; p<0.001)和II-IIIA期(HR=0.17,95%CI:0.11-0.26; P<0.001)患者的中位DFS。增加2年随访时间的更新数据显示,无论在IB-IIIA期(HR=0.27 , 95%CI:0.21-0.34)还是II-IIIA期(HR=0.23, 95%CI: 0.18-0.30)人群中,奥希替尼相较安慰剂仍保持明显的DFS获益。此外,亚组分析显示,在IB人群中,与安慰剂相比,奥希替尼辅助治疗同样观察到DFS获益趋势(HR=0.41, 95%CI:0.23-0.69),研究结果进一步支持奥希替尼在此类患者中的应用。
表1 EGFR-TKIs辅助治疗EGFR突变NSCLC的III期临床研究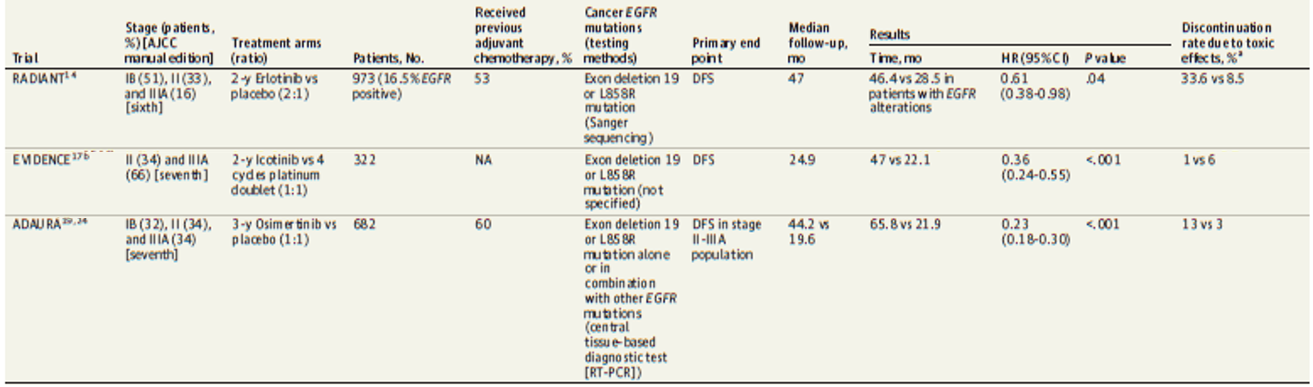
EGFR-TKI辅助治疗精准之路任重道远
疾病复发模式
一项回顾性分析经手术切除IB-IIIA期NSCLC患者的辅助治疗模式和临床预后的研究显示,最常见的转移部位为脑(41%)、肺(33%)、骨(24%)和肝脏(13%)。与EGFR野生型患者相比,EGFR突变患者疾病复发风险更高(97% vs 68%,P=0.007),但远处转移率无显著差异。另一项评估5780例IA-III期肺癌患者中EGFR的临床特征和预后价值的回顾性研究显示, EGFR突变患者脑转移发生率更高(所有分期:15.9% vs 12.2%,P<0.01)。
在ADAURA研究中,与安慰剂组相比,奥希替尼组CNS复发率明显降低(1% vs 10%,HR=0.18; 95%CI 0.10-0.33)。更新数据显示,奥希替尼组和安慰剂组36个月CNS复发率分别2%和13%。此外,研究发现奥希替尼的局部复发率和远处转移率在数值上均低于安慰剂。奥希替尼组和安慰剂组最常见的首个复发部位为肺(12% vs 26%)、淋巴结(6% vs 17%)、CNS(6% vs 11%)和骨(4% vs 9%)。然而,在EVIDENCE研究中,埃克替尼组和化疗组的最常见复发部位不同;埃克替尼组中脑转移最为常见(7%),而化疗组中以局部复发最为常见(14%)。
复发后疾病管理
在EGFR-TKI辅助治疗期间或完成后,患者不可避免地会出现疾病复发。目前这部分人群的临床研究数据较少。在一项厄洛替尼辅助治疗IA-IIIA期NSCLC的单臂、II期SELECT研究中(N=100),40例患者出现疾病复发,其中仅4例发生在辅助治疗期间(1例出现T790M突变),至疾病复发的中位时间为完成辅助治疗后25个月。复发患者接受厄洛替尼一线治疗具有可观的疗效(中位治疗持续时间为13.1个月)。目前数据显示,EGFR-TKI辅助治疗的耐药机制因复发时间而异,缺乏前瞻性临床研究数据,未来值得进一步探索。
共突变和肿瘤微环境
合并致癌基因突变是EGFR突变NSCLC患者的重要预后因素。在晚期EGFR突变NSCLC患者中,合并TP53突变患者接受EGFR-TKI的PFS和OS更短。此外,合并TP53/RB1突变会增加基因组的不稳定性,可能增加SCLC转化发生风险。早期NSCLC存在高度肿瘤内异质性,这可能与EGFR-TKI辅助治疗期间或之后的治疗失败相关。
深入了解肿瘤微环境有助于辅助治疗选择。细胞因子、生长因子、免疫细胞浸润、T细胞受体谱系和代谢表型可能是克隆进化的潜在决定因素,并影响辅助治疗的结果。
微小残留病灶和循环肿瘤DNA的作用
循环肿瘤DNA(ctDNA)用于动态监测疾病反应是晚期NSCLC的热点研究领域。在脱落肿瘤中,相较组织活检,ctDNA更有可能捕捉肿瘤的异质性,并可作为肿瘤进展的早期预测指标。通过ctDNA检测微小残留病灶(MRD)以预测可切除NSCLC患者复发的可能性正在如火如荼的研究中。
在晚期EGFR突变NSCLC患者中,ctDNA可作为疗效的预测工具,并可监测肿瘤耐药和复发,以便及早更换治疗方案。一项韩国研究对278例切除IA-IIIA期EGFR突变NSCLC患者进行了回顾性MRD纵向监测,旨在评估ctDNA清除率与临床预后的相关性。相较基线ctDNA阳性但术后4周MRD阴性和基线ctDNA阴性患者,基线ctDNA阳性且术后4周MRD阳性患者的DFS更差,3年DFS率分别为50%,78%和83.3%(P=0.02)。
血浆ctDNA分析可有效检测NSCLC术后MRD,并有助于制定个体化辅助治疗策略。然而,MRD尚未证实具有预测价值,因此不宜用于制定治疗决策。此外,基于MRD状态的升阶梯和降阶梯治疗需要大型随机临床研究进行评估。
辅助治疗时长
在SELECT和RADIANT两项研究(2年厄洛替尼治疗)中,EGFR-TKI 治疗中止后,DFS生存曲线开始收敛,因此延长辅助治疗时长可能是改善生存的关键。ADAURA研究采用了奥希替尼辅助治疗3年的时间。在更长的随访时间和奥希替尼暴露时间后,未发现新的安全性信号。考虑到3年辅助治疗后仍可能疾病复发,目前正计划开展一项II期研究,以评估5年辅助治疗的有效性和安全性。
山东省立医院胸外科主任
山东大学教授(二级)博士生导师
中国抗癌协会肺癌专业委员会委员
山东省医学会胸外科分会候任主任委员
山东省医学会肺结节多学科联合委员会主任委员
《中国肺癌杂志》编委
EGFR是NSCLC最常见的驱动突变基因。鉴于EGFR-TKIs在晚期NSCLC治疗领域取得的成功,国内外专家学者逐渐将关注点聚焦于可切除NSCLC人群。既往第一/二代EGFR-TKIs在可切除EGFR突变NSCLC患者中进行了多项临床研究探索。RADIANT研究结果显示,厄洛替尼辅助治疗IB-IIIA期(第6版TNM分期)与安慰剂的DFS无统计学差异(50.5个月 vs 48.2个月; HR=0.90, 95%CI 0.74-1.10, P=0.324),但在研究EGFR突变亚组分析观察到DFS获益趋势(46.4个月 vs 28.5个月; HR=0.61, 95%CI 0.38-0.98, P=0.039),提示EGFR突变NSCLC患者是EGFR-TKI辅助治疗的优势人群。随后的EVIDENCE研究专门针对EGFR突变II-IIIA期NSCLC患者,评估了埃克替尼对比单纯化疗的有效性。结果显示,该研究达到了主要终点DFS(47.0个月 vs 22.1个月; HR=0.36, 95%CI 0.24-0.55, P<0.0001),然而初步的OS数据未观察到获益趋势(HR=0.91, 95%CI 0.42-1.94)。
基于这么多年在EGFRm NSCLC辅助靶向治疗中的探索,EGFR-TKI奠定了其在可切除EGFR突变NSCLC患者辅助靶向治疗的标准地位。自2020年以来,ADAURA研究不断刷新和填补数据空白,为临床实践中患者管理提供了高级别循证医学证据支持。然而,如何践行以患者为中心,使EGFR突变NSCLC患者实现获益最大化成为了国内外临床专家的热衷研究领域。从近年来的研究趋势来看,主要为两个方向——“深度”和“广度”。“深度”即结合多维度biomarker探索优势人群。在晚期EGFR突变NSCLC患者中,合并TP53突变患者可能与EGFR-TKIs耐药相关[8]。在早期EGFR突变NSCLC患者中,有27%~48%的患者合并TP53突变,而合并TP53突变早期EGFR突变NSCLC患者的RFS更差(HR=2.50,P=0.009)[9,10],提示这部分人群更适用于升阶梯治疗。此外,基于ctDNA的MRD检测已成为肺癌术后较可靠的生物标志物,目前根据MRD状态指导术后辅助治疗的临床研究正在进行中[11]。与此同时,对于可切除IB-IIIA期EGFR突变NSCLC患者,如何进一步拓展获益人群以及优化诊疗模式——“广度”的探索,目前也有多项临床研究进行中。此外,结合临床实践,EGFR-TKI的治疗时长以及复发后的患者管理也有待未来更多前瞻性研究的探索。
积跬步以至千里。早期NSCLC精准治疗之路是必然趋势,未来基于多维度biomarker的深入探索以及诊疗模式的优化将有助于可切除EGFR突变NSCLC患者实现获益最大化。
[1] Han BF, Zheng RS, Zeng HM, et al. Cancer incidence and mortality in China, 2022. Journal of the National Cancer Center. 2024;4(1):47-53. doi: 10.1016/j.jncc.2024.01.006.
[2] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015. CA Cancer J Clin. 2016;66(2):115-132. doi: 10.3322/caac.21338. Epub 2016 Jan 25. PMID: 26808342.
[3] Le Chevalier T. Adjuvant chemotherapy for resectable non-small-cell lung cancer: where is it going?. Ann Oncol. 2010;21 Suppl 7:vii196-vii198. doi: 10.1093/annonc/mdq376. PMID: 20943614.
[4] Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer. J Thorac Oncol. 2016;11(1):39-51. doi: 10.1016/j.jtho.2015.09.009. PMID: 26762738.
[5] Pi C, Xu CR, Zhang MF, et al. EGFR mutations in early-stage and advanced-stage lung adenocarcinoma: Analysis based on large-scale data from China. Thorac Cancer. 2018;9(7):814-819. doi: 10.1111/1759-7714.12651. Epub 2018 May 2. PMID: 29722148.
[6] Passaro A, Mok TSK, Attili I, et al. Adjuvant Treatments for Surgically Resected Non-Small Cell Lung Cancer Harboring EGFR Mutations: A Review. JAMA Oncol. 2023;9(8):1124-1131. doi: 10.1001/jamaoncol.2023.0459. PMID: 37166792.
[7] Ferrara MG, Belluomini L, Smimmo A, et al. Meta-analysis of the prognostic impact of TP53 co-mutations in EGFR-mutant advanced non-small-cell lung cancer treated with tyrosine kinase inhibitors. Crit Rev Oncol Hematol. 2023;184:103929. doi: 10.1016/j.critrevonc.2023.103929. Epub 2023 Feb 10. PMID: 36773668.
[8] Jung HA, Lim J, Choi YL, et al. Clinical, Pathologic, and Molecular Prognostic Factors in Patients with Early-Stage EGFR-Mutant NSCLC. Clin Cancer Res. 2022;28(19):4312-4321. doi: 10.1158/1078-0432.CCR-22-0879. PMID: 35838647.
[9] Hondelink LM, Ernst SM, Atmodimedjo P, et al. Prevalence, clinical and molecular characteristics of early stage EGFR-mutated lung cancer in a real-life West-European cohort: Implications for adjuvant therapy. Eur J Cancer. 2023;181:53-61. doi: 10.1016/j.ejca.2022.12.010. Epub 2022 Dec 19. PMID: 36638752.
[10] Desai A, Vázquez TA, Arce KM, et al. ctDNA for the Evaluation and Management of EGFR-Mutant Non-Small Cell Lung Cancer. Cancers (Basel). 2024;16(5):940. Published 2024 Feb 26. doi: 10.3390/cancers16050940. PMID: 38473302.
本材料由阿斯利康提供,仅供医疗卫生专业人士参考,不可用于推广目的。
审批编号:CN-133846
过期日期:2024-07-22
排版编辑:肿瘤资讯-邓文普











 苏公网安备32059002004080号
苏公网安备32059002004080号


