在初诊非小细胞肺癌(NSCLC)患者中,约有10%的患者伴脑转移[1]。根据美国国家综合癌症网络(NCCN)指南的诊疗建议,对于脑转移病灶数量和体积有限的患者,应接受立体定向放射外科(SRS)或手术切除(若有症状)后行SRS/全脑放疗(WBRT),之后行针对胸部病灶的根治性治疗(手术±全身治疗)[2]。然而,对于全身与局部模式治疗寡转移病灶的联合方式和时机,目前尚无共识。近期The Journal of thoracic and cardiovascular surgery杂志(IF: 6)发表了一篇基于美国国家癌症数据库(NCDB)的临床研究,进一步揭示多模式治疗在NSCLC伴局限性脑转移人群的重要价值[3]。【肿瘤资讯】现邀浙江省肿瘤医院曾剑教授特此点评,从外科角度分析初诊临床T1-3, N0-1期NSCLC伴局限性脑转移人群包含手术切除在内的多模式诊疗的有效性。
研究介绍
本研究旨在评估对于NSCLC伴脑转移患者,采用包括胸部手术切除的多模式治疗对比全身治疗±放疗的总生存期(OS)。研究人群包括2010年至2017年期间诊断为临床T1-3, N0-1, M1b-c(第8版TNM分期),且初诊时伴同时性脑转移的NSCLC患者;完成脑部SRS或外科手术切除后接受肺部原发病灶根治性治疗的患者;排除接受外科手术或脑部SRS后进行WBRT的患者,因WBRT通常用于脑转移病灶负荷较重的患者。基于患者胸部治疗的模式进行分组,“胸外科手术”队列为接受解剖性肺切除人群±全身治疗/放疗,“非胸外科手术”队列为接受全身治疗±放疗人群(图1);前者仅纳入外科手术切除或脑部SRS后4个月内进行胸部手术的患者,其中胸部手术仅限于解剖性肺切除,包括肺段切除术、肺叶切除术、扩大肺叶切除术或双肺叶切除术以及全肺切除术。OS定义为从诊断时间开始至死亡或末次随访时间。通过Kaplan–Meier方法和多变量调整的COX比例风险回归模型对比“胸外科手术”队列和“非胸外科手术”队列的OS;此外,采用倾向性评分匹配(PSM)方法对“胸外科手术”队列和“非胸外科手术”队列进行匹配,并比较两个队列的OS。
图1 研究设计

研究结果
共1240例患者符合入组标准,其中“胸外科手术”队列共270例(21.8%),“非胸外科手术”队列共970例(78.2%)。患者基线特征见表1。在“胸外科手术”队列,患者更年轻、白种人更多,且收入更高;此外,该队列中肺腺癌组织学类型比例更高、T和N分期更低,接受脑部外科手术切除比例更高。
表1 患者基线特征
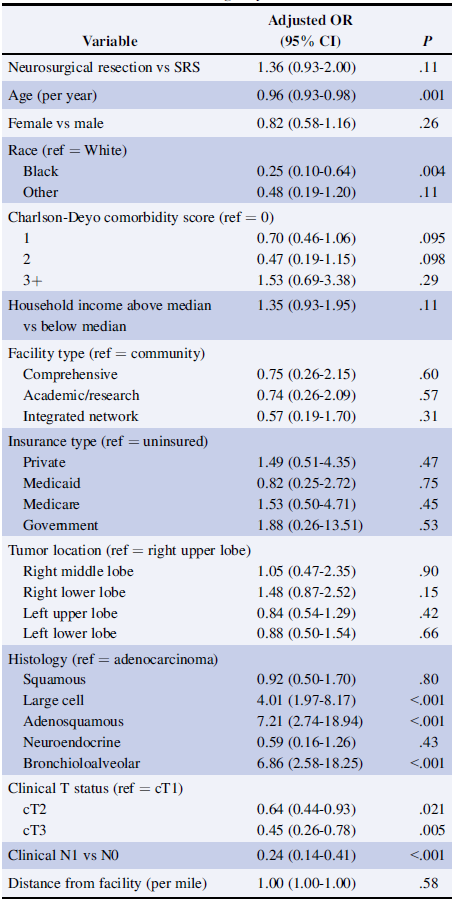
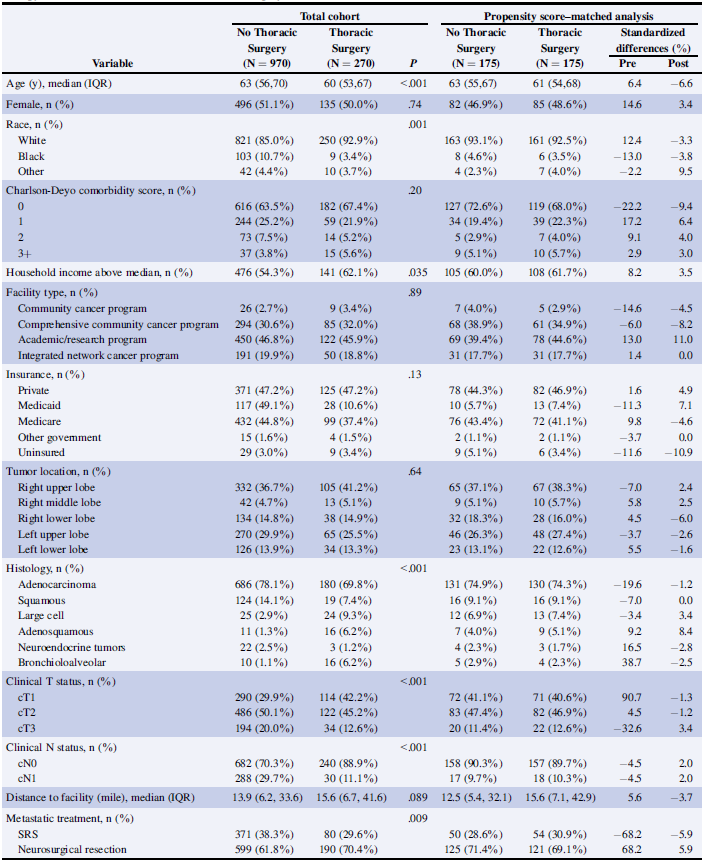 多变量调整的logistic回归显示,年龄较小、白种人、大细胞/腺鳞癌/支气管肺泡癌组织学类型和较低的临床T和N人群,都与使用胸部手术作为原发病灶的多模式治疗相关(表2)。
多变量调整的logistic回归显示,年龄较小、白种人、大细胞/腺鳞癌/支气管肺泡癌组织学类型和较低的临床T和N人群,都与使用胸部手术作为原发病灶的多模式治疗相关(表2)。
表2 “胸外科手术”和“非胸外科手术”的多变量调整的logistic回归
 整个研究的中位随访时间为20.9个月(IQR, 9.7-36.7)。结果显示,与“非胸外科手术”队列相比,“胸外科手术”队列的2年OS率更高(P<0.001)(图2)。
整个研究的中位随访时间为20.9个月(IQR, 9.7-36.7)。结果显示,与“非胸外科手术”队列相比,“胸外科手术”队列的2年OS率更高(P<0.001)(图2)。
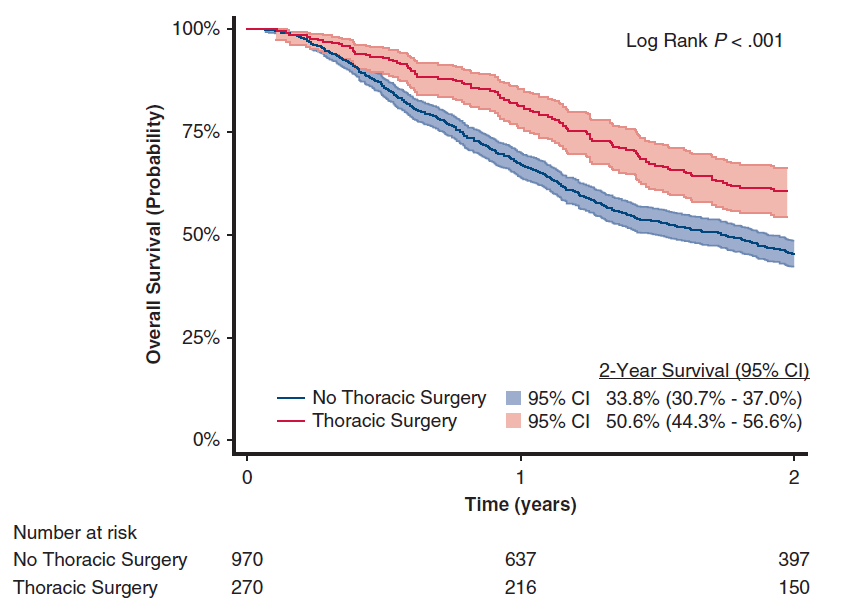
图2 整体人群中,“胸外科手术”队列和“非胸外科手术”队列的OS
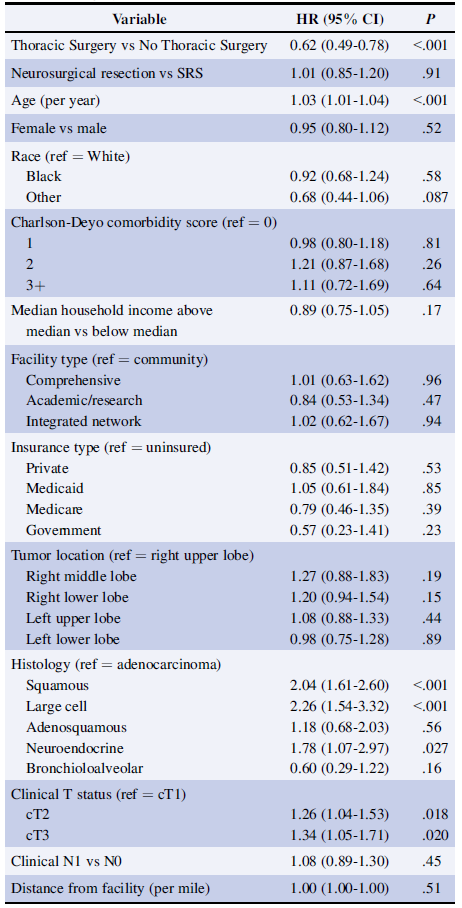
经多变量调整的COX比例风险回归模型分析,与接受全身治疗的患者相比,接受胸部原发病灶切除患者的OS更优(HR=0.62, 95%CI 0.49-0.78, P<0.001)(表3)。
表3 多变量调整的COX比例风险回归模型分析与OS相关的独立因素
对两个队列进行1:1倾向性评分匹配后,共评估了350例患者,两个队列的基线特征均衡。结果分析显示,接受胸部手术切除原发病灶可显著延长患者OS(图3)。
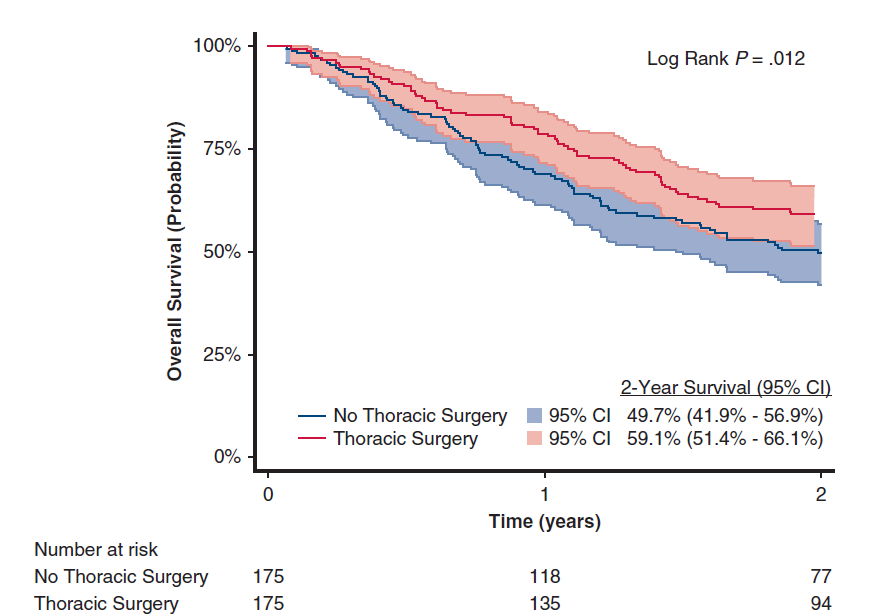
图3 倾向性评分匹配后,“胸外科手术”和“非胸外科手术”的OS
此外,在脑转移病灶接受外科手术切除患者中,经1:1 PSM后,与接受全身治疗相比,胸部原发病灶接受手术切除患者的2年OS率更高(图4)。其中,接受胸部手术联合全身治疗患者较胸部放疗联合全身治疗患者的2年OS率有显著提升(图5)。
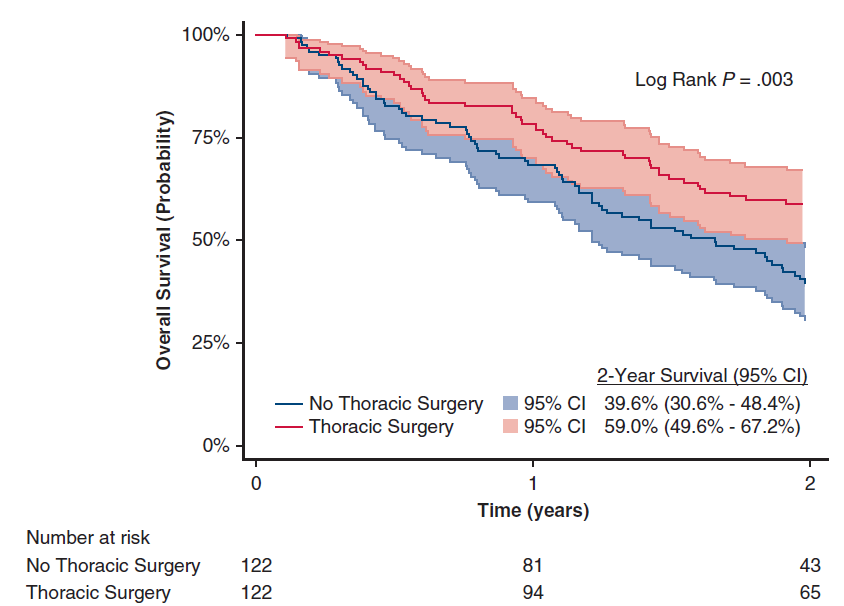
图4 在脑转移病灶接受外科手术切除患者中,经1:1 PSM后,“胸外科手术”和“非胸外科手术”的OS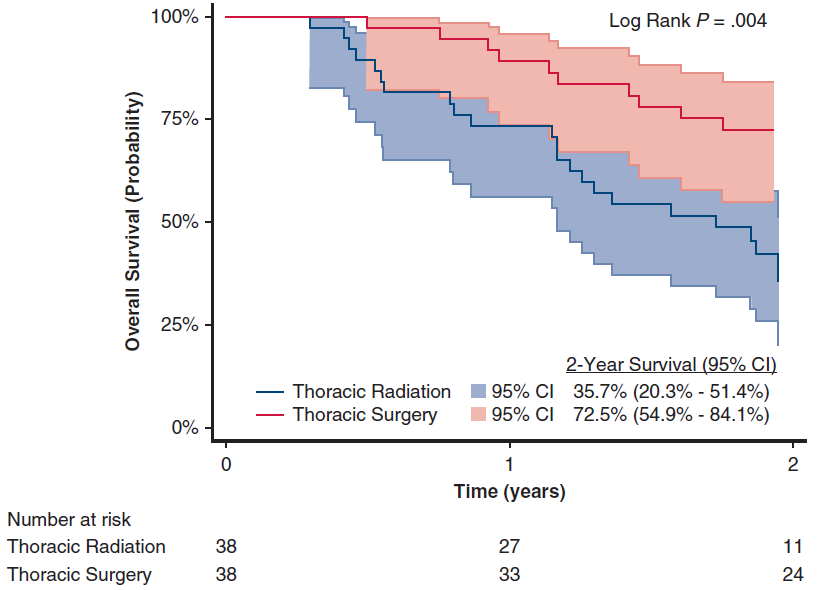
图5 在脑转移病灶接受外科手术切除患者中,经1:1 PSM后,胸部手术+全身治疗和胸部放疗+全身治疗患者的OS
在298例临床淋巴结阴性亚组中,经PSM分析后,与接受全身治疗±放疗的患者相比,接受包含手术切除的多模式治疗患者的2年OS率更高(P=0.001)(图6)。
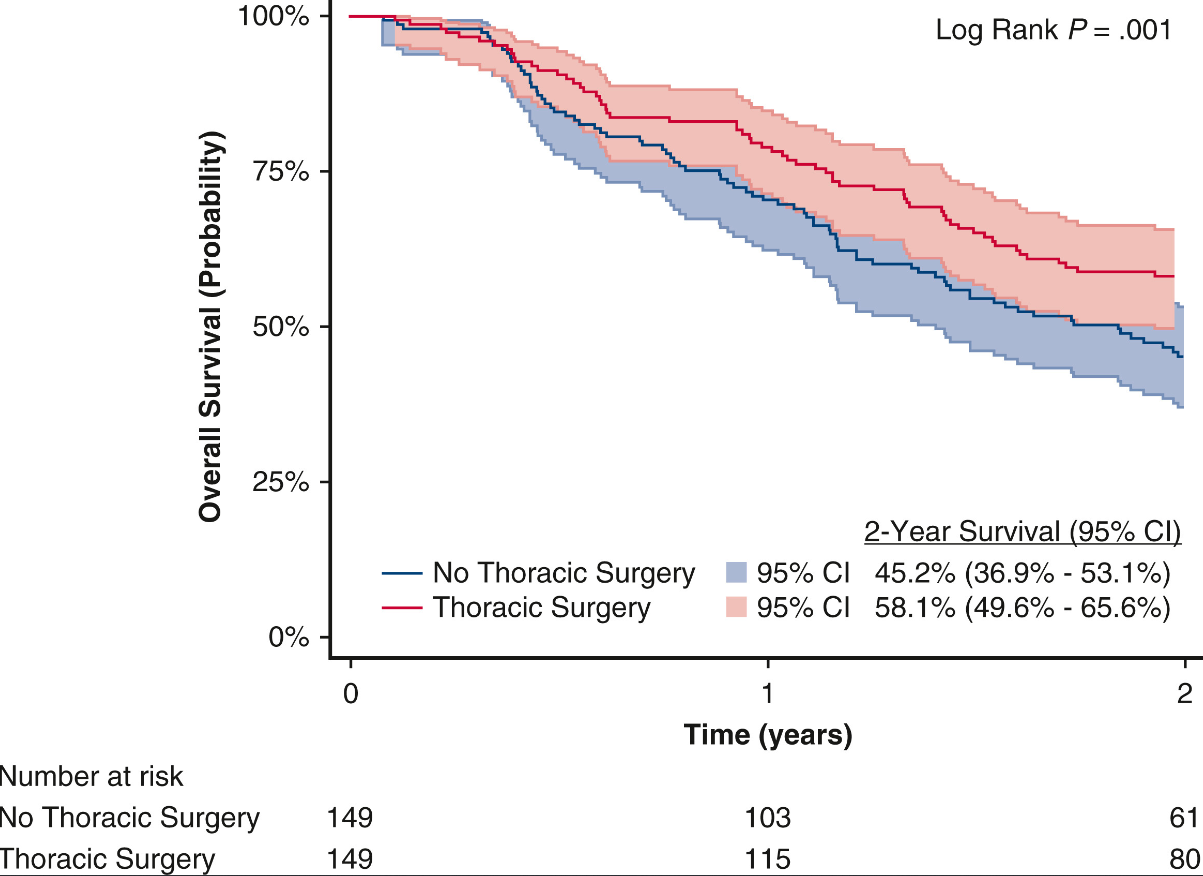
图6 “胸外科手术”和“非胸外科手术”队列中临床N0亚组的OS
小结
在这项全国性分析中,对于初诊NSCLC(cT1-3、N0-1)仅伴同时性局限性脑转移患者,在进行脑部SRS或外科手术切除后,接受胸部病灶手术切除的多模式治疗相较全身治疗±放疗可显著改善总生存期。在经过多变量调整的COX比例风险回归模型和倾向性评分匹配后,肺部原发病灶切除与OS改善相关;且在淋巴结阴性和脑转移病灶接受手术切除亚组中,该多模式治疗仍展现出OS获益趋势。该研究结果进一步支持NCCN指南将胸外科手术作为部分cM1b-且仅伴同时性脑转移NSCLC患者的治疗选择。
浙江省肿瘤医院肺外科副主任
中国医药教育协会胸外科专委会委员
中国转化医学联盟胸部肿瘤外科专委会委员
浙江省医师协会胸外科医师分会副会长
浙江省医师协会肿瘤MDT专委会青委副主委
浙江省医学会胸外科学分会青委副主委
浙江省抗癌协会肺癌专委会青委副主委
浙江省医学会肿瘤外科学分会委员
浙江省预防医学会第一届肺癌预防与控制专委会委员
脑部是肺癌最常见的远处转移部位之一,肺癌脑转移患者的预后差,自然平均生存时间仅为1~2个月[4]。根据SEER数据库的一项长期随访结果显示,在非转移性NSCLC患者中,肺腺癌、鳞癌和大细胞癌发生脑转移的风险分别为11%、6%和12%[5]。近年来,外科手术、放射治疗技术和内科治疗的迅速发展,为NSCLC脑转移患者提供了越来越多的治疗选择,但对于初诊时仅伴局限性脑转移的NSCLC患者,尚未明确胸部原发病灶的最优治疗模式。既往一项随机II期研究显示,对于局限性转移的NSCLC患者(≤5个病灶),随机接受SABR联合化疗或单纯化疗,主要研究终点为PFS;结果显示SABR联合化疗相较单纯化疗可显著延长患者的PFS(9.7个月 vs 3.5个月, P=0.01)[6]。另一项随机II期研究探索了原发病灶局部治疗(手术或放疗)对比观察在寡转移NSCLC(≤3个转移病灶)中的有效性,主要研究终点为PFS;中位随访38.8个月时,接受局部治疗患者的PFS较单纯观察患者的PFS更长(14.2个月 vs 4.4个月,P=0.022),且总生存期也有获益趋势(37.6个月 vs 9.4个月,P=0.034)[7]。以上均提示,对于局限性转移NSCLC患者,肺部原发病灶接受根治性治疗的生存更优。
在此项研究中,研究者聚焦于IV期(cM1b-c)NSCLC伴同时性局限脑转移患者,探索了以胸部病灶根治性手术为基础的多模式在cT1-3, N0-1, M1b-c患者中的疗效。结果显示,对于这部分人群,对肺部原发病灶进行根治性切除相较单纯全身治疗可取得更优的长期生存。考虑到偏倚,该研究还采用了多变量调整的COX比例风险回归模型和倾向性评分匹配方法进行分析,结果与整体人群一致。整体研究结果为包含手术切除的多模式在该特殊人群的应用提供了观察性研究数据支持。
考虑到此项研究为一项回顾性研究,尽管统计方法采用了多变量调整的COX比例风险回归模型和倾向性评分匹配,以及敏感性分析以提高研究数据的可靠性,但仍存在混杂因素偏倚。更为值得注意的是,该研究并未记录脑转移病灶的数目;既往研究显示,对于单转移病灶或较少脑转移病灶患者,更倾向于接受外科手术切除[8];而在此项研究中,脑转移病灶接受外科手术切除亚组中,胸部原发病灶进行手术切除相比单纯全身治疗取得了20%的2年OS率提升,提示该亚组人群或许能从此多模式诊疗中获益最佳。另外,此项研究纳入的是2010年至2017年期间人群;近年来,转移性NSCLC的全身治疗飞速发展,未来有待进一步探索新治疗模式在该人群的有效性。随着基因检测的普及,如果驱动基因突变阳性,推荐外科手术后辅以精准靶向治疗。最后,研究目前的中位随访时间较短,未来有待更长时间随访,以观察长期获益情况;未来也有待前瞻性临床研究进行验证。
[1] Waqar SN, Samson PP, Robinson CG, et al. Non-small-cell Lung Cancer With Brain Metastasis at Presentation. Clin Lung Cancer. 2018 Jul;19(4):e373-e379. doi: 10.1016/j.cllc.2018.01.007. Epub 2018 Mar 9. PMID: 29526531.
[2] National Comprehensive Cancer Network. The NCCN clinical practice guidlines in oncology for non-small cell lung cancer (version 3. 2024). https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf
[3] Kumar A, Kumar S, Potter AL, et al. Surgical management of non-small cell lung cancer with limited metastatic disease involving only the brain. J Thorac Cardiovasc Surg. 2024 Feb;167(2):466-477.e2. doi: 10.1016/j.jtcvs.2023.04.034. Epub 2023 Apr 29. PMID: 37121537.
[4] 中国医师协会肿瘤医师分会,中国医疗保健国际交流促进会肿瘤内科分会.肺癌脑转移中国治疗指南(2021年版)[J].中华肿瘤杂志 2021年43卷3期, 269-281页, MEDLINE ISTIC PKU CSCD CA BP, 2021.DOI:10.3760/cma.j.cn112152-20210104-00009.
[5] Goncalves PH, Peterson SL, Vigneau FD, et al. Risk of brain metastases in patients with nonmetastatic lung cancer: Analysis of the Metropolitan Detroit Surveillance, Epidemiology, and End Results (SEER) data. Cancer. 2016 Jun 15;122(12):1921-7. doi: 10.1002/cncr.30000. Epub 2016 Apr 8. PMID: 27062154.
[6] Iyengar P, Wardak Z, Gerber DE, et al. Consolidative Radiotherapy for Limited Metastatic Non-Small-Cell Lung Cancer: A Phase 2 Randomized Clinical Trial. JAMA Oncol. 2018 Jan 11;4(1):e173501. doi: 10.1001/jamaoncol.2017.3501. Epub 2018 Jan 11. PMID: 28973074.
[7] Gomez DR, Tang C, Zhang J, et al. Local Consolidative Therapy Vs. Maintenance Therapy or Observation for Patients With Oligometastatic Non-Small-Cell Lung Cancer: Long-Term Results of a Multi-Institutional, Phase II, Randomized Study. J Clin Oncol. 2019 Jun 20;37(18):1558-1565. doi: 10.1200/JCO.19.00201. Epub 2019 May 8. PMID: 31067138.
[8] Kalkanis SN, Kondziolka D, Gaspar LE, et al. The role of surgical resection in the management of newly diagnosed brain metastases: a systematic review and evidence-based clinical practice guideline. J Neurooncol. 2010 Jan;96(1):33-43. doi: 10.1007/s11060-009-0061-8. Epub 2009 Dec 4. PMID: 19960230.
本材料由阿斯利康提供,仅供医疗卫生专业人士参考,不可用于推广目的。
审批编号:CN133706
过期日期:2024-7-14
排版编辑:肿瘤资讯-张钰晴











 苏公网安备32059002004080号
苏公网安备32059002004080号


