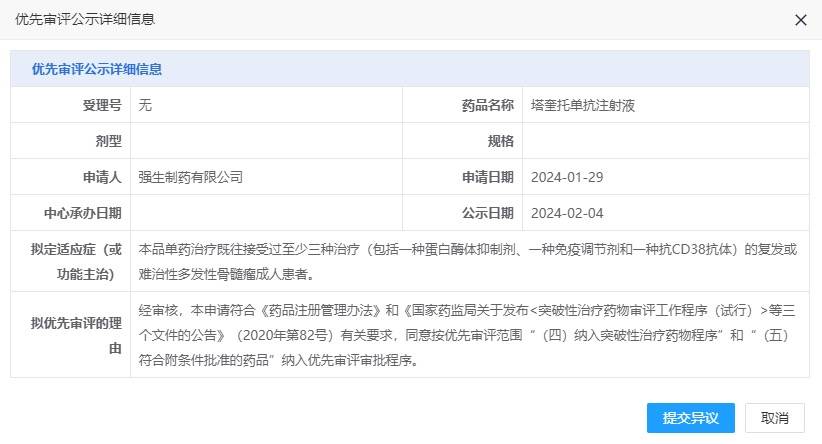
2023年2月4日,中国药品审评中心(CDE)网站显示,Talquetamab拟纳入优先审评,适应症为单药治疗既往接受过至少三种治疗(包括一种蛋白酶体抑制剂、一种免疫调节剂和一种抗CD38抗体)的复发和难治性多发性骨髓瘤(R/R MM)成人患者。Talquetamab是一款first-in-class现货型双特异性T细胞结合抗体,能同时靶向MM细胞上的GPRC5D和T细胞上的CD3。GPRC5D(G蛋白偶联受体C5家族亚型D)在多发性骨髓瘤上高度表达,CD3参与激活T细胞[1]。临床前研究结果已证实,Talquetamab通过招募和激活CD3阳性T细胞,诱导T细胞介导的GPRC5D阳性多发性骨髓瘤细胞的杀伤,并抑制肿瘤的形成和生长。
破局困境,GPRC5D是R/R MM治疗最有潜力的新型靶点
MM是一种遗传复杂性和异质性的恶性肿瘤,其发病率和死亡率均较高[2],占所有血液系统恶性肿瘤的15%~20%,5年生存率为60%[3]。MM可影响多个器官系统,导致疲劳、疼痛、呼吸困难和活动能力问题等。尽管治疗(包括靶向B细胞成熟抗原[BCMA]的抗体-药物偶联物、双特异性抗体[BsAb]和嵌合抗原受体T细胞[CAR-T]疗法)取得了进展,但患者仍会经历缓解和复发周期。随着每一种新线治疗(LOT)的实施,由于疗效不佳、毒性累积和合并症的日益普遍,停药风险增加[4]。LOT需要针对新靶点的不同作用机制的新疗法,以改善患者结局。
GPRC5D是治疗多发性骨髓瘤的新靶点。GPRC5D位于人类染色体12p13上,是一种孤儿G蛋白偶联受体,其配体未知,由于缺乏体内模型,其在正常组织和MM中的信号机制和功能尚未确定[5, 6]。
研究显示,GPRC5D蛋白在免疫细胞和皮肤、舌的上皮结构中均有表达。在免疫细胞区室中,GPRC5D蛋白主要表达于浆细胞表型的细胞,在正常B细胞、T细胞、自然杀伤细胞、单核细胞、粒细胞和骨髓祖细胞中几乎无表达。从表达谱上看,相较于CD38和BCMA这两个MM靶点,靶向GPRC5D特异性高于CD38和与BCMA(图1)[7]。另外,由于胞外结构域短,使用T细胞重定向剂靶向的GPRC5D表位可能更靠近质膜,可促进T细胞和靶细胞之间更紧密的免疫突触,从而可能驱动更大的细胞毒性,这一发现也驱动了科学家开发可同时靶向T细胞、靶细胞的新型免疫疗法[8]。
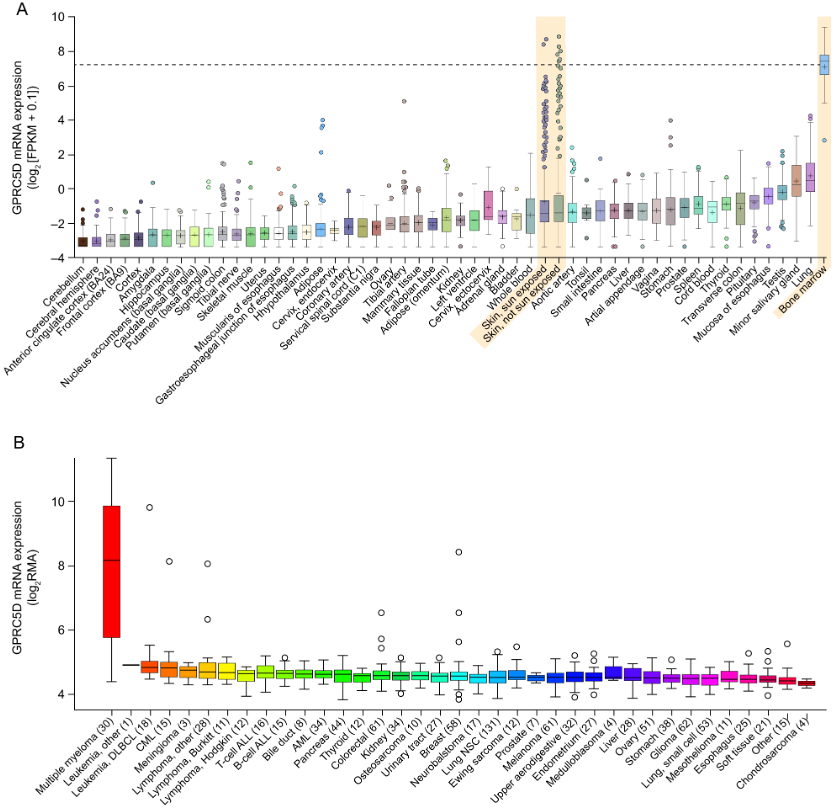
图1 GPRC5D在正常组织与肿瘤组织中的表达谱[7]
Talquetamab是与GPRC5D和CD3结合的免疫球蛋白(Ig)G4型的BsAb,目的是招募和激活T细胞靶向骨髓瘤细胞。靶向GPRC5D的初始CAR-T在对BCMA CAR-T耐药的MM中显示出临床活性[9]。在临床前研究中,Talquetamab在MM骨髓样本中显示出高细胞毒性[10]。这些研究结果提示,Talquetamab是未来多线耐药的MM临床研究的理想候选疗法。
多线治疗耐药后,靶向GPRC5D/CD3 Talquetamab治疗仍能显示出临床活性
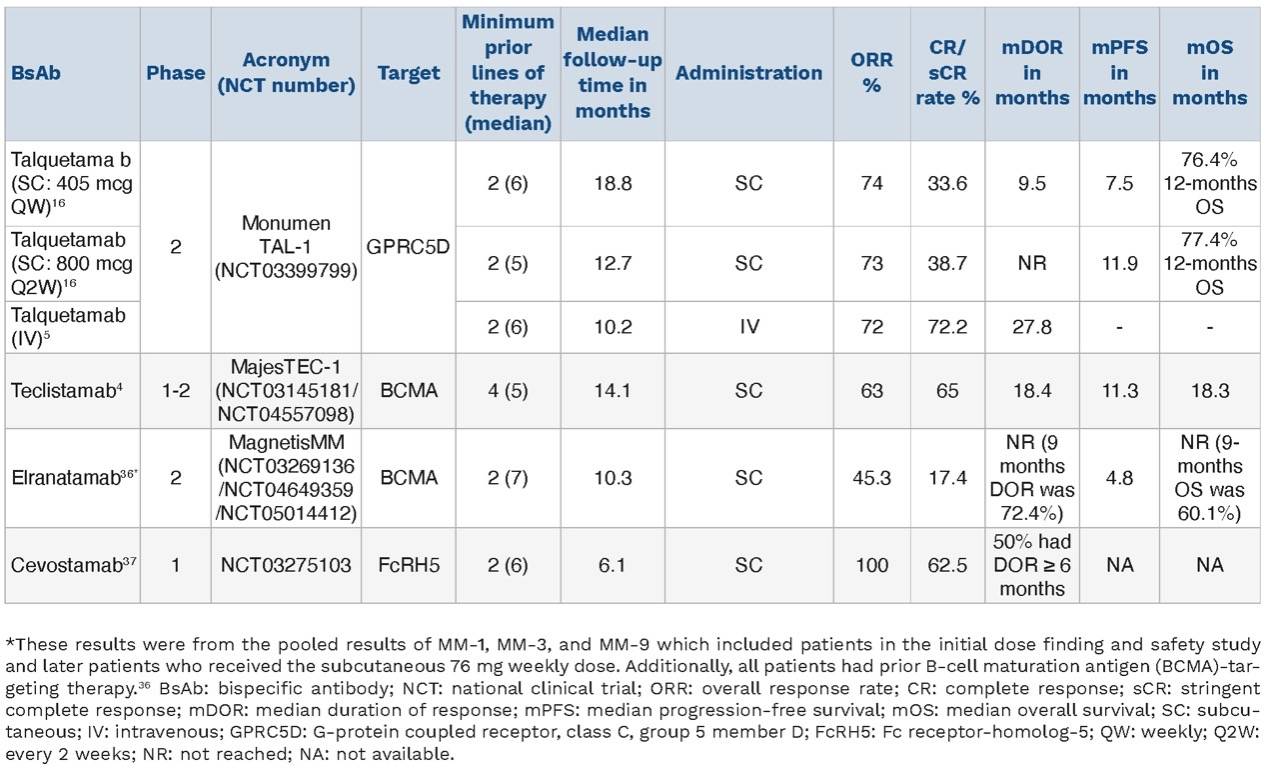
在1期开放标签MonumenTAL-1试验中,Talquetamab展示出前所未有的治疗潜力,在既往接受过大量治疗(中位线数为6)的人群中,Talquetamab仍具有高疗效[11]。在该试验中,Talquetamab以每2周0.8 mg/kg(Q2W)或每周0.4 mg/kg(QW)皮下给药,并以递增剂量给药在两个水平均显示出相似的疗效。在中位12.7个月随访时,0.8 mg/kg剂量水平的ORR为71.7%,非常好的部分缓解(VGPR)或更好的缓解率为60.7%:完全缓解(CR)为9%,严格意义的完全缓解(sCR)为29.7%,中位缓解持续时间为7.8个月。中位随访18.8个月时,0.4 mg/kg剂量水平达到了74.1%的ORR和59.4%的VGPR或更好的ORR:CR为9.8%,sCR为23.8%,中位缓解持续时间为10.2个月[11]。
基于以上结果,美国食品药品监督管理局于2022年6月29日授予Talquetamab突破性疗法认定(Breakthrough Therapy identification)。
特别值得关注的是,对于既往接受过靶向T细胞疗法的患者,如CAR-T细胞疗法或其他BsAb疗法,Talquetamab治疗能否展示其临床活性?
2023年ASCO大会上更新了MonumenTAL-1 II期结果,结果表明在既往接受过BsAb或CAR-T治疗的患者中,中位随访11.8个月时,ORR为63%,53%达到VGPR或以上。在这一队列中,71%的患者既往接受过CAR-T治疗,35%既往接受过BsAb治疗,6%同时接受过这两种治疗。该队列的mPFS为5.1个月。结果表明,即使在既往接受过T细胞重定向治疗的人群中,Talquetamab仍保持疗效[12](表1)。
表1 靶向GPRC5D/CD3的双特异性抗体研究进展[13]
聚焦免疫联合治疗,挽救MM患者T细胞凋亡/耗竭状态
达雷妥尤单抗是目前认为可促进效应T细胞的扩增和耗竭调节性T细胞的CD38单抗,那么达雷妥尤单抗与Talquetamab联合治疗能否进一步改善疗效?
在TRIMM-2试验中,Talquetamab与达雷妥尤单抗联合用于既往接受过三线或更多线治疗的患者,包括蛋白酶体抑制剂(PI)和免疫调节药物(IMiD)。II期试验最近在ASCO2023上报告了结果,该人群的中位既往接受过五线治疗,18%为高危细胞遗传学,25%为髓外疾病,58%为三级难治性(77%为抗CD38治疗难治性)。中位随访时间为11.5个月,整个队列的ORR为78%(既往未接受过抗CD38治疗的患者为100%),CR/sCR为45%,VGPR为66%或更高。mPFS为19.4个月,12个月总生存期(OS)为93%。即使在抗CD38、抗BCMA和BsAb治疗难治的患者中,ORR也分别为76%、64%和75%[14]。
简而言之,Talquetamab代表了R/R MM患者的另一种T细胞重定向治疗方案。2023年2月4日,中国药品审评中心(CDE)网站显示,Talquetamab拟纳入优先审评,适应症为单药治疗既往接受过至少三种治疗(包括一种蛋白酶体抑制剂、一种免疫调节剂和一种抗CD38抗体)的R/R MM成人患者。在未来,我们期待更多以GPRC5D为靶点的药物临床试验传来好消息,给R/R MM患者带来治疗曙光。
[1] AGENCY. E M. TALVEY Summary of Product Characteristics. [J]. August 2023.
[2] COWAN A J, ALLEN C, BARAC A, et al. Global Burden of Multiple Myeloma: A Systematic Analysis for the Global Burden of Disease Study 2016 [J]. JAMA Oncol, 2018, 4(9): 1221-7.
[3] HE J, SCHMEROLD L, VAN RAMPELBERGH R, et al. Treatment Pattern and Outcomes in Newly Diagnosed Multiple Myeloma Patients Who Did Not Receive Autologous Stem Cell Transplantation: A Real-World Observational Study : Treatment pattern and outcomes in patients with multiple myeloma [J]. Adv Ther, 2021, 38(1): 640-59.
[4] FONSECA R, USMANI S Z, MEHRA M, et al. Frontline treatment patterns and attrition rates by subsequent lines of therapy in patients with newly diagnosed multiple myeloma [J]. BMC Cancer, 2020, 20(1): 1087.
[5] BRÄUNER-OSBORNE H, JENSEN A A, SHEPPARD P O, et al. Cloning and characterization of a human orphan family C G-protein coupled receptor GPRC5D [J]. Biochim Biophys Acta, 2001, 1518(3): 237-48.
[6] VERKLEIJ C P M, BROEKMANS M E C, VAN DUIN M, et al. Preclinical activity and determinants of response of the GPRC5DxCD3 bispecific antibody talquetamab in multiple myeloma [J]. Blood Adv, 2021, 5(8): 2196-215.
[7] RODRIGUEZ-OTERO P, VAN DE DONK N, PILLARISETTI K, et al. GPRC5D as a novel target for the treatment of multiple myeloma: a narrative review [J]. Blood Cancer J, 2024, 14(1): 24.
[8] LI J, STAGG N J, JOHNSTON J, et al. Membrane-Proximal Epitope Facilitates Efficient T Cell Synapse Formation by Anti-FcRH5/CD3 and Is a Requirement for Myeloma Cell Killing [J]. Cancer Cell, 2017, 31(3): 383-95.
[9] SMITH E L, HARRINGTON K, STAEHR M, et al. GPRC5D is a target for the immunotherapy of multiple myeloma with rationally designed CAR T cells [J]. Science Translational Medicine, 2019, 11(485): eaau7746.
[10] VERKLEIJ C P M, BROEKMANS M E C, VAN DUIN M, et al. Preclinical activity and determinants of response of the GPRC5DxCD3 bispecific antibody talquetamab in multiple myeloma [J]. Blood Advances, 2021, 5(8): 2196-215.
[11] CHARI A, MINNEMA M C, BERDEJA J G, et al. Talquetamab, a T-Cell–Redirecting GPRC5D Bispecific Antibody for Multiple Myeloma [J]. New England Journal of Medicine, 2022, 387(24): 2232-44.
[12] SCHINKE C D, TOUZEAU C, MINNEMA M C, et al. Pivotal phase 2 MonumenTAL-1 results of talquetamab(tal), a GPRC5DxCD3 bispecific antibody(BsAb), for relapsed/refractory multiple myeloma(RRMM) [J]. Journal of Clinical Oncology, 2023, 41(16_suppl): 8036-.
[13] LIU L, KRISHNAN A. Talquetamab in multiple myeloma [J]. Haematologica, 2024, 109(3): 718-24.
[14] DHOLARIA B R, WEISEL K, MATEOS M-V, et al. Talquetamab(tal) + daratumumab(dara) in patients(pts) with relapsed/refractory multiple myeloma(RRMM): Updated TRIMM-2 results [J]. Journal of Clinical Oncology, 2023, 41(16_suppl): 8003-.
排版编辑:Amiee











 苏公网安备32059002004080号
苏公网安备32059002004080号


