2024年02月19日Nature Communications在线刊登了短程化疗联合信迪利单抗一线治疗肺鳞癌的单臂Ⅱ期试验结果。该研究是由王慧娟教授团队发起并牵头,联合河南省内5家分中心:新乡市中心医院张桂芳教授团队、新乡医科大学第一附属医院姬颖华教授团队、平顶山市第一人民医院井小会团队、安阳市肿瘤医院王俊生团队和南阳市第二人民医院王启船教授团队共同完成的研究者发起的临床研究。
专家简介
河南省肿瘤医院 呼吸内科二病区主任
中国临床肿瘤学会(CSCO)免疫治疗专家委员会常委
中国临床肿瘤学会(CSCO)患者教育专家委员会常委
中国抗癌协会肿瘤整体评估专业委员会常委
中国抗癌协会肺癌专委会委员
中国初级卫生保健基金会胸部肿瘤精准治疗专业委员会副主委
国家临床医学研究中心中国呼吸肿瘤协作组青年委员会副主委
中国医药教育协会疑难肿瘤专业委员会常委
河南省抗癌协会青年理事会常务理事
河南省抗癌协会肺癌专业委员会青年委员会主任委员
中国抗癌协会肿瘤药物临床研究专业委员会委员
中国抗癌协会肿瘤支持治疗专业委员会委员
中国抗癌协会国际医学交流专业委员会委员
肿瘤学硕士、主治医师
河南省肿瘤医院呼吸内二病区
河南抗癌协会化疗专业委员会青年委员
河南抗癌协会呼吸与重症专业委员会委员
河南抗癌协会靶向治疗专业委员会委员
河南抗癌协会神经内分泌肿瘤专业委员会委员
IASLC会员
研究概况
研究的主要终点是中位无进展生存期(PFS),中位随访24.2个月时,65.9%(29/44)的可评估患者达到了疾病进展。中位PFS为11.4个月(95% CI:6.7-18.1月)。
该研究表明,短程化疗联合信迪利单抗一线治疗晚期肺鳞状细胞癌,有着完全不劣于标准化疗联合免疫治疗的抗肿瘤活性,毒副作用更低,有望成为晚期肺鳞癌的治疗新模式;但未来仍需开展随机对照的III期临床研究来进一步验证。

4-6个周期化疗联合免疫治疗是晚期鳞状非小细胞肺癌的一线标准治疗方案,这种联合治疗模式为患者带来生存获益的同时,不良反应也不容小觑;既往研究显示,化疗与免疫治疗有着协同增效的作用,但过量的化疗会杀伤免疫细胞,影响机体免疫功能。因此免疫联合化疗的最佳治疗模式仍亟待进一步探索;缩短化疗疗程能否在不影响疗效的同时减轻不良反应?信迪利单抗作为一种PD-1抑制剂,目前已获批用于晚期肺鳞癌的一线治疗。
这项Ⅱ期的临床研究旨在评估短疗程(2周期)化疗联合信迪利单抗的疗效和安全性。
研究方法
这是一项单臂的Ⅱ期临床试验(ChiCTR1900021726) ,入组时间为2020年5月至2022年6月。纳入的为经组织学证实的局部晚期或晚期鳞状非小细胞肺癌,年龄在18-75岁。
入组标准:既往未接受过用于晚期或转移性疾病的全身治疗,既往新辅助治疗或具有治愈性目的的化放疗应当在证实疾病复发之前至少6个月已结束;按照RECIST1.1标准至少存在一个可测量病灶、ECOG评分0-1、预期寿命≥12周、器官功能良好。
排除标准:有症状性脑转移或无症状脑转移未经治疗;严重间质性肺疾病或免疫相关性疾病。
给药方案
白蛋白紫杉醇260mg/m2 D1+卡铂(AUC=5)D1+信迪利单抗200mg ivgtt D1,Q3W,完成2个周期后,信迪利单抗单药维持治疗,直至疾病进展或出现不可耐受的毒性,最多完成2年的治疗。
主要研究终点为中位PFS,次要研究终点包括:客观缓解率(ORR),缓解持续时间(DOR),疾病控制率(DCR),总生存期(OS)和安全性。探索性目的包括:PD-L1表达与疗效和生存的关系,ctDNA清除与疗效的关系等。
研究结果
共48例患者签署知情同意,1例在方案修订前签署,1例违反入排标准,最终有46例患者纳入安全性分析,疗效可评估人群有44例。
疗效分析
截止到2023.08.31,中位随访时间为24.2个月,有42例停止了治疗,其中29例因疾病出现进展,中位PFS为11.4个月(95% CI:6.7-18.1月),达到了主要研究终点。客观缓解率为70.5%(31/44),疾病控制率达到93.2%。中位持续缓解时间(DOR)为13.6个月 [95% CI: 7.0–not evaluable (NE)],中位OS 27.2个月(95% CI: 20.2–NE) (图2a-2d).
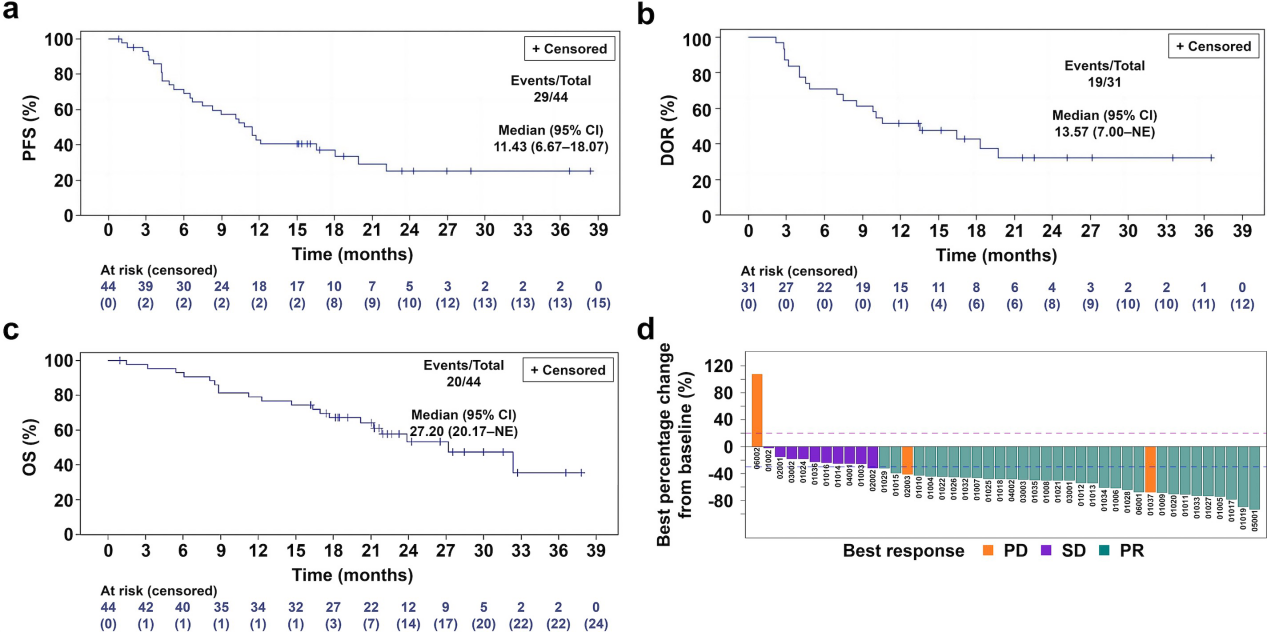
图2a 中位无进展生存期(PFS),2b 中位持续缓解时间(DOR),2c中位总生存期(OS),2d肿瘤缓解瀑布图
安全性分析
46例患者纳入安全性分析集,其中42例患者完成了至少2个周期的治疗;中位治疗周期数为11(范围-1-35个周期),中位治疗持续时间为7.8个月(范围:0.7-25.5个月)。91.3%(42/46)的患者出现了治疗相关的不良反应,其中≥3级不良反应的发生率为10.9%(表3);免疫相关不良反应(irAE)的发生率为30.4%,最常见的免疫相关不良反应为谷丙转氨酶升高,甲状腺功能减退,甲亢和皮疹(表4),无治疗相关死亡事件发生。
 表3,治疗相关不良反应(TRAE)
表3,治疗相关不良反应(TRAE)
 表4,免疫治疗相关不良反应(irRE)
表4,免疫治疗相关不良反应(irRE)
探索性分析
进一步的生物探索性分析发现PD-L1的表达[TPS<1%, n=19,TPS=1–49%, n=11, TPS≥50%, n=3, not detectable (ND), n=11]与中位PFS、ORR及OS无明显相关性,但DOR上表现出一定的差异((PD-L1低表达患者的DOR时间最长,p < 0.001),考虑与整体病例数较少及组间差异较大有关(补充图2a-2d)。
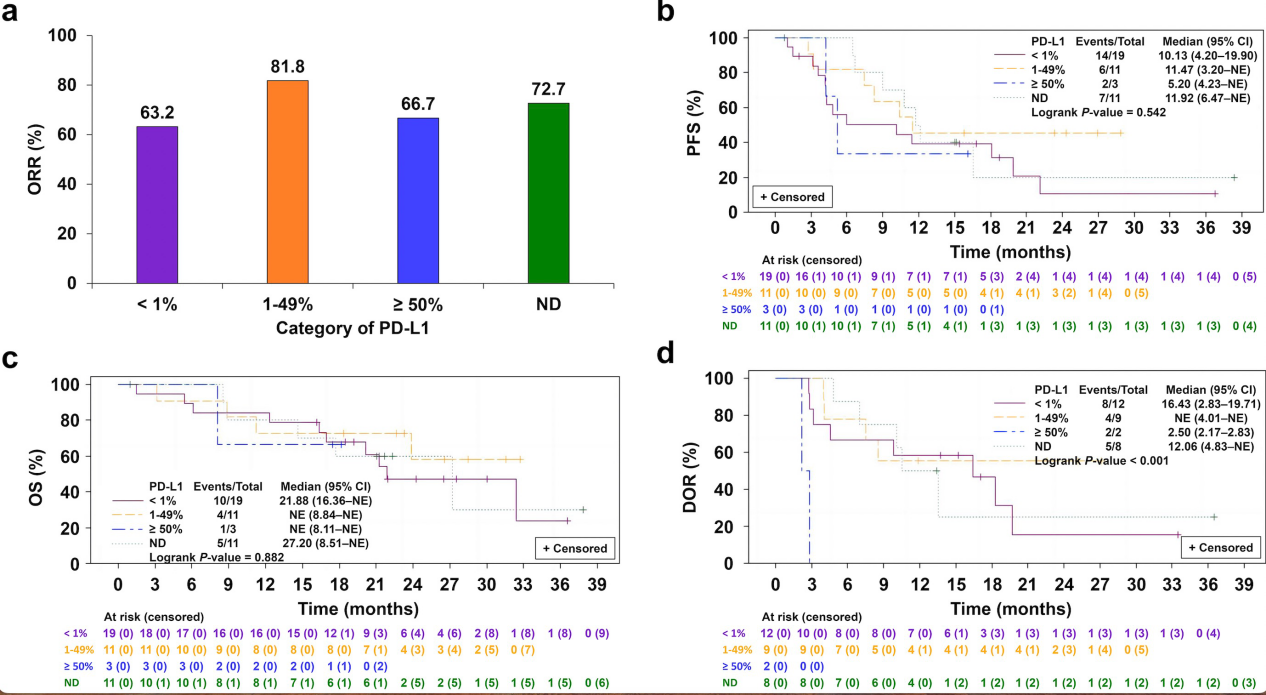 补充图2a,不同PD-L1表达状态的客观缓解率,2b,2c PD-L1表达状态与PFS及OS的关系,2d PD-L1表达状态与DOR的关系
补充图2a,不同PD-L1表达状态的客观缓解率,2b,2c PD-L1表达状态与PFS及OS的关系,2d PD-L1表达状态与DOR的关系
搜集了26例患者的血液标本进行检测发现,基线存在BRCA2, BRINP3, FBXW7, KIT 或 RB1 突变的患者,PFS更短(图3b);
同时对26例患者的血浆ctDNA与临床疗效的关系进一步分析发现,基线ctDNA阴性或在C2(第2治疗周期)ctDNA达到清除的患者有着较好的疗效和PFS,当剔除基线ctDNA阴性的患者,仍然发现C2达到清除的患者,有着更好的疗效和PFS( 图3c,d和图3 e,f)。
对23例同时拥有C1和C2时间点ctDNA 清除数据的患者,进行疗效分析显示,22例获得了PR,其中有19例患者至少在C1或C2时间点存在一次ctDNA清除(图 3g)。
 图3a 血液基因检测突变谱(按突变频率排列),3b 携带任意5个突变基因的PFS与野生型患者的PFS,3c 23例患者(C1或C2有ctDNA清除状态的患者,包括基线ctDNA阴性的患者)的客观缓解率,3d与3c相比,去除基线ctDNA为阴性的患者的客观缓解率,3g 23例患者血液ctDNA动态变化与肿瘤缓解的关系
图3a 血液基因检测突变谱(按突变频率排列),3b 携带任意5个突变基因的PFS与野生型患者的PFS,3c 23例患者(C1或C2有ctDNA清除状态的患者,包括基线ctDNA阴性的患者)的客观缓解率,3d与3c相比,去除基线ctDNA为阴性的患者的客观缓解率,3g 23例患者血液ctDNA动态变化与肿瘤缓解的关系
这些探索性分析提示ctDNA的早期动态变化和清除可能可以用来预测和指导患者个体化的治疗。
小 结
短程化疗联合信迪利单抗一线治疗晚期肺鳞癌,有着令人鼓舞的疗效和生存数据,且患者耐受更佳,有望成为晚期肺鳞癌治疗的新模式;值得进一步的扩大临床研究进行验证;探索性分析发现借助ctDNA早期清除情况,可为患者个体化的适应性治疗提供重要依据和支持。
排版编辑:肿瘤资讯-刘恩茂
Zhang M, Zhang G, Niu Y, Zhang G, et al. Sintilimab with two cycles of chemotherapy for the treatment of advanced squamous non-small cell lung cancer: a phase 2 clinical trial. Nat Commun. 2024 Feb 19;15(1):1512. doi:10.1038/s41467-024-45769-z.











 苏公网安备32059002004080号
苏公网安备32059002004080号


