关注专题,查看全系列精要解读
据2023年2月由国家癌症中心发布的的“2022年中国恶性肿瘤疾病负担情况”,宫颈癌是我国女性第五大高发肿瘤,发病率为21/10万人,为女性第六大致死瘤种。对于有远处转移的宫颈癌,其生存率显著更低。展望国家健康战略,未来继续落实健康中国行动和肿瘤防治行动实施方案具体要求,在危险因素综合防控、肿瘤筛查、早诊早治、规范化诊疗等重点领域稳步推进,力争在2030年初步遏制肿瘤负担上升势头。
在精准医学时代,免疫治疗成为突破口,生物标志物和新药的涌现为临床获益提供了机会。伴随着涌现的新研究成果,宫颈癌的免疫治疗在无进展生存期(PFS)和总生存期(OS)取得提升,2023年成为宫颈癌免疫治疗研究的鼓舞人心之年的同时,为患者带来更多希望。
2024年1月6日,由【肿瘤资讯】打造的重磅栏目之“妇科肿瘤年终盘点”顺利召开,会议期间重庆大学附属肿瘤医院的周琦教授带我们回顾了宫颈癌治疗领域的重要进展,【肿瘤资讯】特对主要内容进行整理,以飨读者。
国际妇癌联盟(IGCS)教育委员会委员
全国首席科学传播专家
中国抗癌协会肿瘤内分泌专委会主任委员
中国抗癌协会妇科肿瘤专委会(CGCS)前任主任委员
中国临床肿瘤学会妇科肿瘤专家委员会副主任委员
全国宫颈癌防治协作组副组长
中国优生优育协会CSCCP副主任委员
重庆市医师协会肿瘤医师分会会长
重庆市医学(妇科学)首席专家
局部晚期宫颈癌(LACC)
宫颈癌主要以HPV感染为主,与PD-L1阳性表达密切相关。研究表明,局部晚期宫颈癌中PD-L1的阳性表达率较高,在HPV感染相关性宫颈癌中CPS>1时,可达80%以上。在中国上市的PD-1抑制剂和双抗在宫颈癌中的适应症相对有限。除了卡度尼利单抗获批于含铂化疗失败后的复发转移性宫颈癌外,主要针对微卫星高度不稳定(MSI-H)/错配修复缺陷(dMMR)实体瘤,以及部分PD-L1阳性表达的宫颈癌。
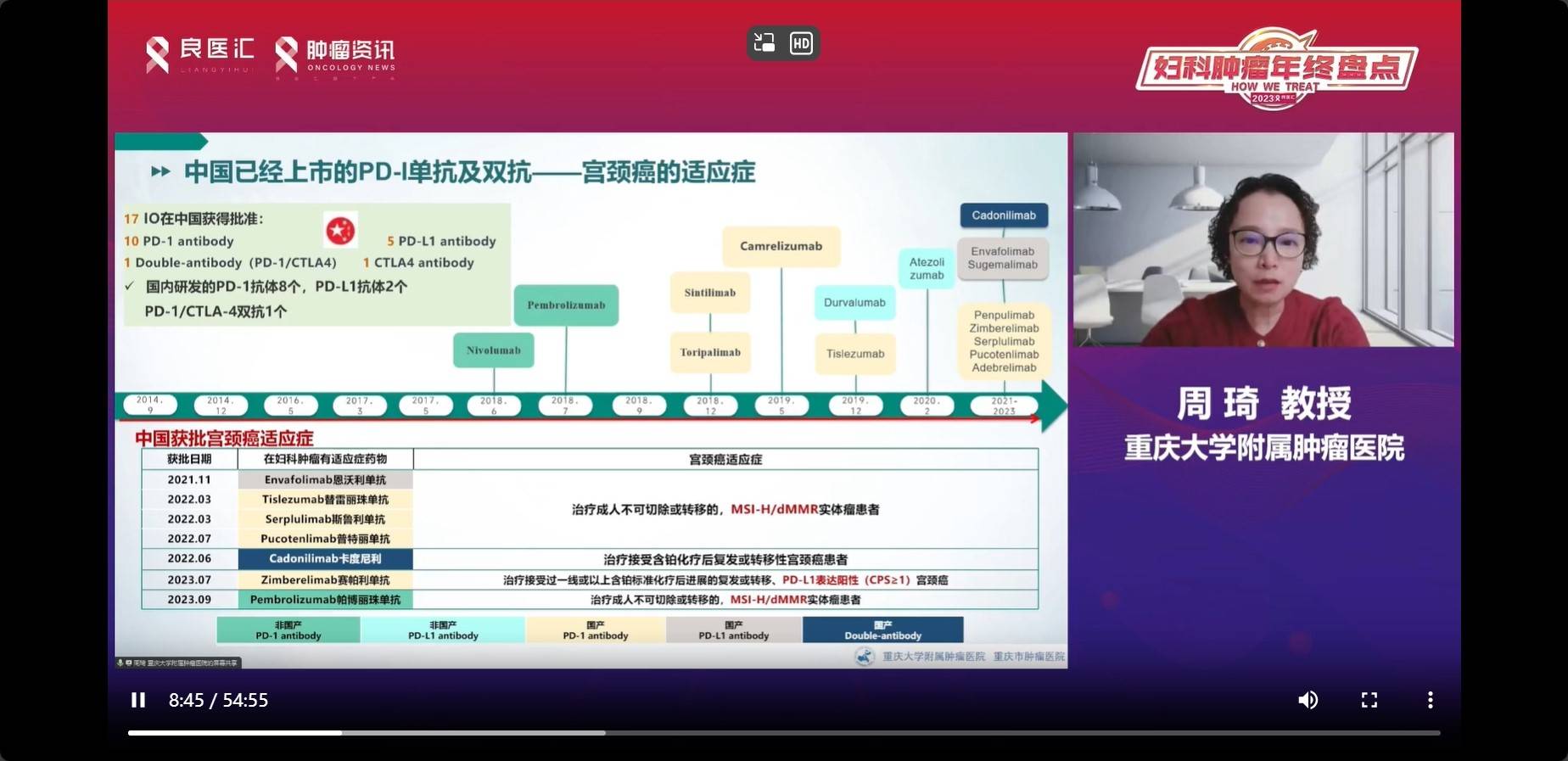
根据国际妇产科联合会(FIGO)的分期标准,局部晚期宫颈癌通常包括IB3期-IVA期。过去20多年,放化疗一直是标准治疗方法。然而,即使接受了这一标准治疗,约30%的患者仍会经历复发或转移。关于局部晚期宫颈癌治疗中同步放化疗与免疫治疗的连用策略备受关注。理论上,同步放化疗后DNA损伤可增强免疫性,放疗也可激活局部肿瘤T细胞浸润,介导适应性免疫。这一策略在其他实体瘤研究中有较多探索,宫颈癌作为同类肿瘤也不例外。
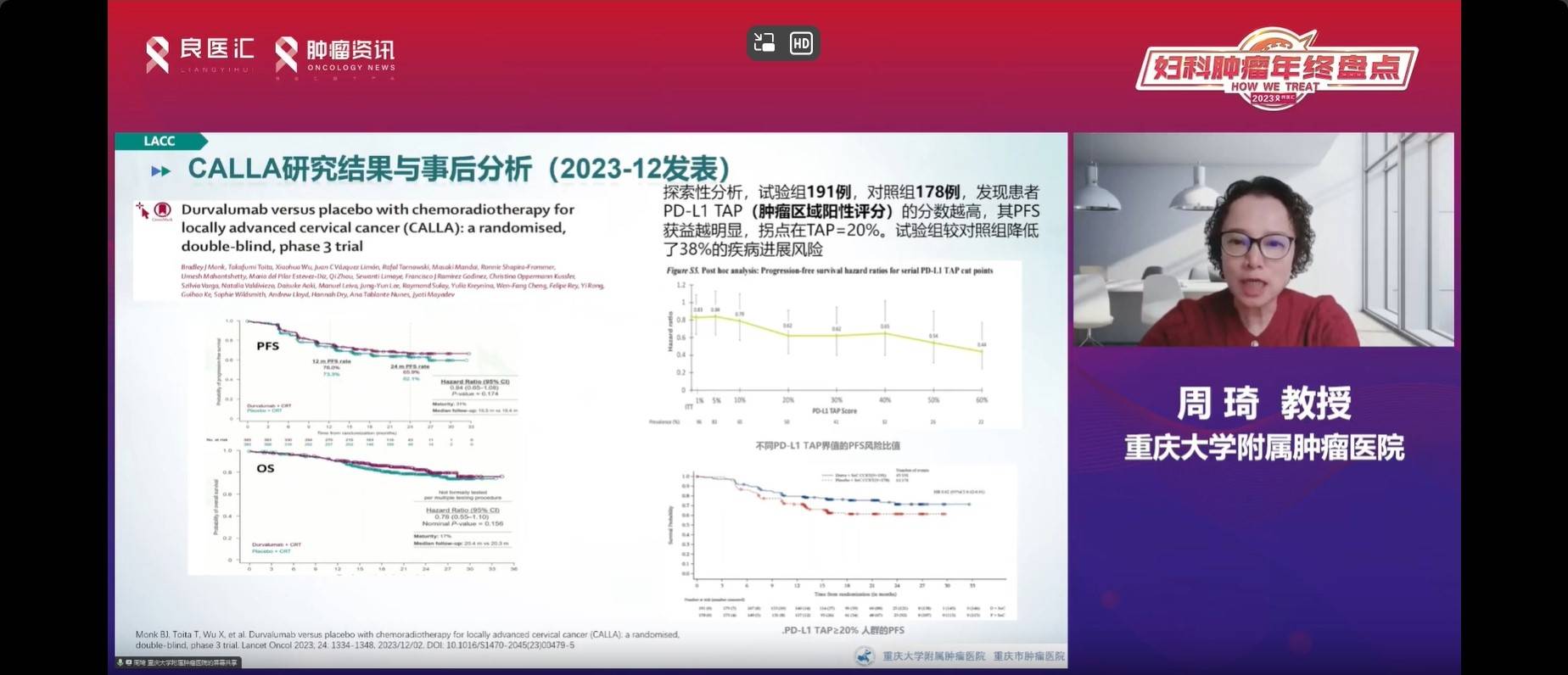
其中,CALLA研究作为III期研究,采用度伐利尤单抗联合同步放化疗及免疫维持方案,于2023年12月正式发布。然而,该研究未能展现出积极结果,患者PFS无改善。但研究事后分析发现,试验组中PD-L1阳性患者,尤其是肿瘤区域阳性评分(TAP)值较高的患者,表现出更好的PFS。该分析将TAP值的拐点或临界值定为20%,在这个阈值下,疾病复发的风险降低到了38%。
CALLA研究的反思引发了关于免疫与同步放化疗在宫颈癌治疗中的作用的疑虑。然而,事实并非如此。宫颈癌在同步放化疗后仍存在约30%的五年内复发风险。OUTBACK研究在同步放化疗后加入了四个疗程的TC(紫杉醇联合卡铂)化疗,但其结果也呈现阴性。同期,其他探索同步放化疗后加化疗策略的研究,包括口服氟尿嘧啶类药物治疗,也在去年的ESMO公布,但同样未取得积极效果。
这些结果引发如下思考和进一步探究:
- 不同免疫抑制剂是否会带来不同的疗效;
- 免疫治疗介入的最佳时间;
- 每种肿瘤,尤其是宫颈癌不同的病理类型、分期和免疫微环境可能影响免疫治疗效果。
在这些方面的深入研究将有助于我们更好地理解免疫治疗在局部晚期宫颈癌中的应用和优化。
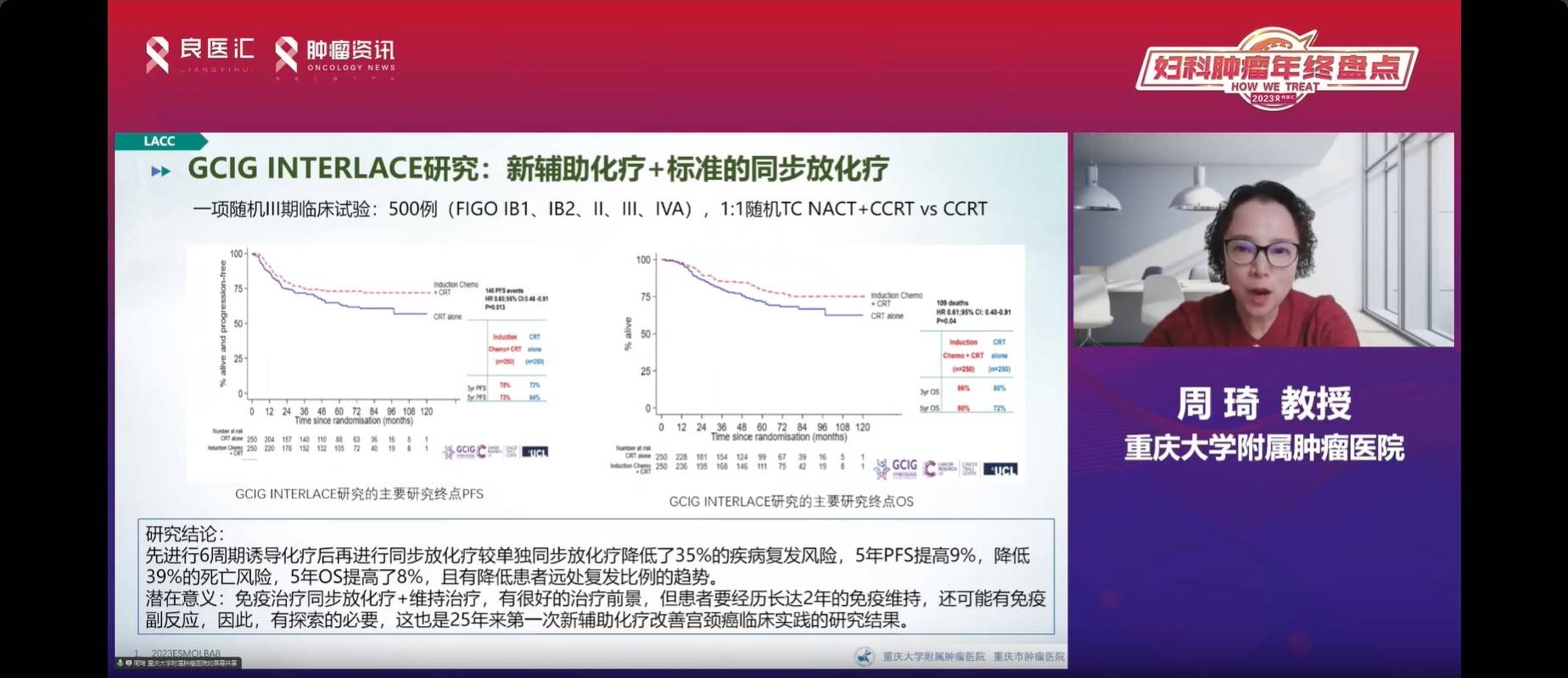
接下来是2023年ESMO公布的GCIG INTERLACE研究,该研究提出了对局部晚期宫颈癌治疗时间较长的同步放化疗加免疫的新辅助化疗策略。这项研究采用了III期的随机对照研究设计,纳入了500例宫颈癌患者,涵盖了1B1到IVA期。患者被随机分为两组,一组接受6个疗程的诱导化疗,然后进行同步放化疗;另一组仅接受同步放化疗。该研究获得了积极的结果,显示接受新辅助化疗的患者的五年PFS提高了9%,死亡风险降低了39%,五年OS也提高了8%,且远程复发转移的趋势降低。
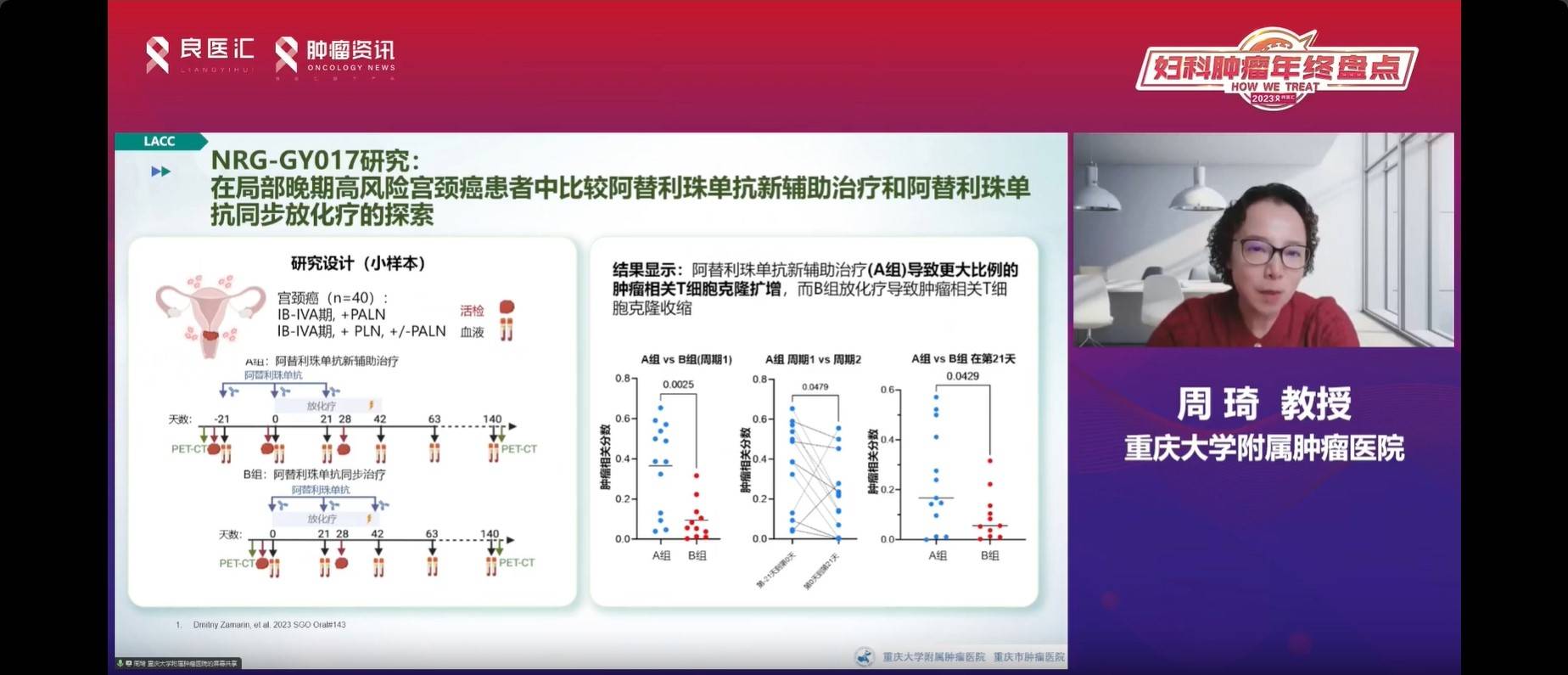
NRG-GY017研究探索了局部晚期宫颈癌中利用阿替利珠单抗进行新辅助治疗和同步放化疗的策略。尽管这是一项小样本研究,仅包含40例患者,但观察到A组患者相关T淋巴细胞克隆扩增的结果。其结果表明,新辅助免疫治疗对放化疗释放的T细胞具有不同的影响。而B组患者相关T细胞克隆减少。这可能是影响疗效的重要因素。初步结论表明,不同时期加入的免疫治疗可能导致不同的临床结局。在新辅助免疫治疗方面,总体而言,中位随访25.8个月的PFS显示了优势。其完全缓解率(CR)也表现良好,为45%,相比之下,B组为27%。PFS为82%,而B组为36%。因此,这项小样本研究初步显示了新辅助免疫治疗取得了积极的结果。
NICOL研究探索了在局部晚期宫颈癌患者中纳武利尤单抗联合同期放化疗并由纳武利尤单抗维持至半年的安全性和初步疗效。经中位随访23.8个月后,观察到16名患者的客观缓解率(ORR)为93.8%,24月PFS率为75%,其ORR大于CALLA研究的数据。提示免疫与同步放化疗的联合,特别是使用不同的PD-(L)1抑制剂,具有不同的疗效。这一研究结果于2023年6月正式发表于Nature Communications。

另外,2023年ASCO大会上发布了由马丁院士牵头的NACI研究,旨在评估卡瑞利珠单抗联合新辅助化疗治疗局晚期宫颈癌的疗效与安全性。从初步结果来看,ORR较高,达到97.6%,其中CR为18.8%,PR为78.8%。手术切除率达到了98.8%,32%的患者达到了病理完全缓解(pCR),27%的患者满足了术后辅助治疗的条件。新辅助化疗期间安全性良好,主要毒性为白细胞和淋巴细胞减少。此外,研究团队进行了生物标志物分析,发现在新辅助化疗和新辅助免疫治疗后,局部CD4淋巴细胞和CD8 T淋巴细胞显著增加,表明这对后续治疗产生积极效果。研究结果为局部晚期宫颈癌手术前的新辅助化疗提供了新的策略。

帕博利珠单抗联合同步放化疗在局部晚期宫颈癌治疗中呈现出潜在的治疗优势,一项于2020年发表于Cancer的II期研究(NCT 02635360)结果显示帕博利珠单抗序贯放化疗或联合同步放化疗的安全性和可行性,为相应III期研究提供了基础。KEYNOTE-A18是一项随机双盲III期研究,共纳入1060例FIGO 2014 IB2-IIB期(淋巴结阳性)或III-IVA期宫颈癌患者,其中亚洲人群占比近30%,中国患者149例,CPS≥1者超过90%。2023年ESMO中期数据分析显示,所有患者两年PFS提高了10.5%,疾病进展和死亡的风险降低了30%,预设的亚组分析获益基本一致,均支持帕博利珠单抗组更优。在III-IVA期患者中,两组中位PFS均未达到,疾病进展或死亡风险降低41% (HR=0.59 [95% CI, 0.43-0.82])。尽管OS数据尚不成熟,但两年的OS率有所提高,OS有获益的趋势。安全性可控,免疫介导相关的≥3级的不良事件发生率小于5%。在患者报告结局(PRO)中,EORTC QLQ-C30整体健康状态/生活质量评分变化显示帕博利珠单抗组未明显降低患者的生存质量。虽然最终OS结果仍需等待,但这一治疗策略有望成为局部晚期宫颈癌患者的重要选择。2024.1.12 FDA基于KEYNOTE A18研究结果批准帕博利珠单抗联合同步放化疗治疗FIGO 2014 III-IVA期宫颈癌患者。

复发/转移性宫颈癌(R/M CC)
KEYNOTE-158 II期研究首次证实了帕博利珠单抗单药在宫颈癌治疗中的有效性,尤其在CPS大于1的患者中。FDA于2018年6月根据该研究结果批准其在CPS大于1的患者中用于复发转移宫颈癌的治疗。在2024年NCCN指南中,将帕博利珠单抗列为PD-L1阳性或MSI-H的宫颈癌二线以上治疗的首选。在2023年9月,中国也批准了MSI-H/dMMR的帕博利珠单抗宫颈癌适应症。免疫联合治疗进入2.0时代,关注点集中在生物标志物筛选、克服耐药以及减少毒性。KEYNOTE-826的研究成果则将帕博利珠单抗、化疗与贝伐珠单抗联合治疗首次推至CPS大于1的一线治疗,显示该方案能够显著降低复发风险和死亡率,为复发性宫颈癌的一线治疗提供了潜在的新适应症。
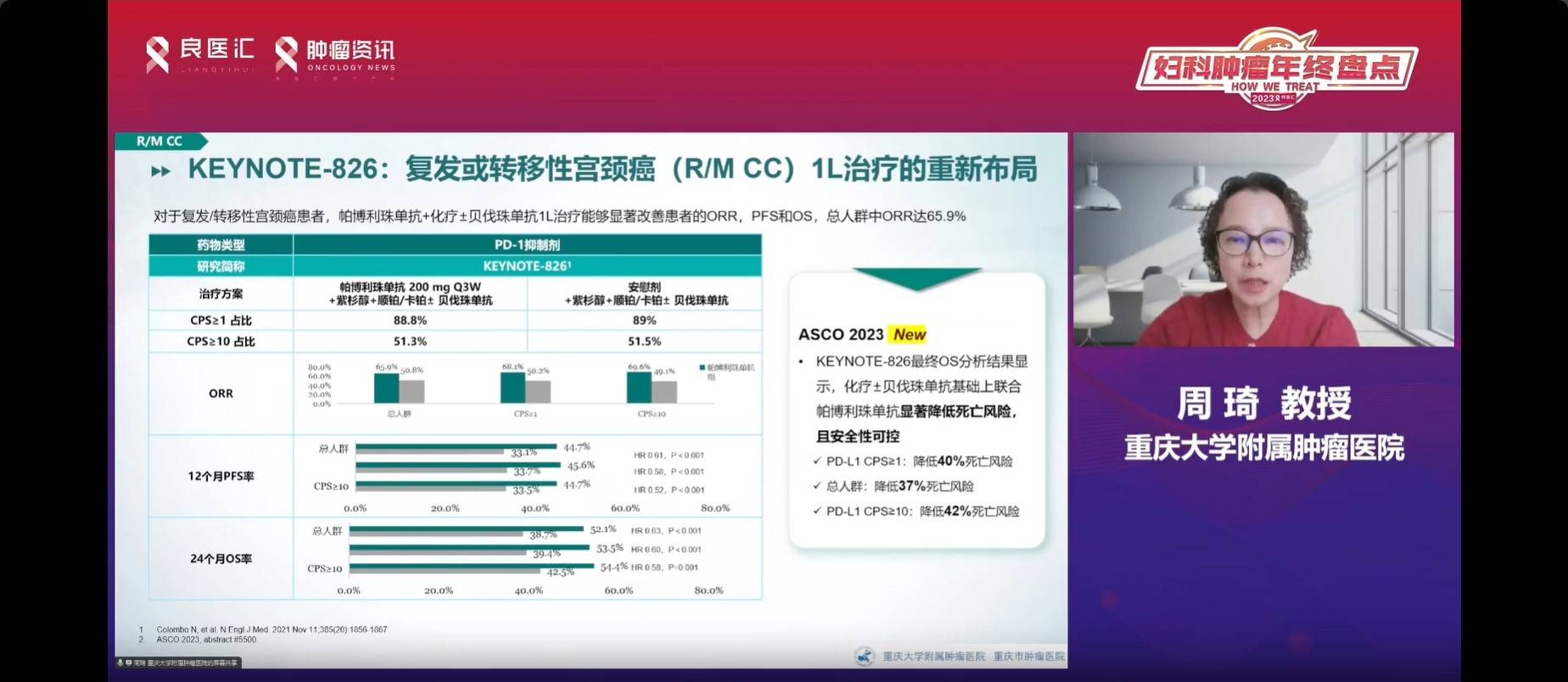
QL1604研究探讨了PD-1单抗与紫杉醇加顺铂或卡铂一线治疗复发转移宫颈癌的疗效。研究表明,该治疗方案的ORR达到了58.7%,中位持续缓解时间(DOR)为9.6个月,中位PFS为8.1个月。

2023年ESMO年会报告了艾帕洛利托沃瑞利单抗(QL1706)联合化疗±贝伐珠单抗一线治疗复发转移性宫颈癌的多中心单臂Ⅱ期临床试验。共纳入了60例未接受过全身治疗的转移性复发性宫颈癌。患者接受QL1706加紫杉醇和顺铂/卡铂(队列1)或再联合贝伐珠单抗(15 mg/kg,D1/D2)(队列2)治疗,共6个周期。中位随访时间为14.0个月。对全部58例患者进行疗效评估,ORR达到81%,其中8例患者达到完全缓解,39例部分缓解。疾病控制率达98.3%。中位PFS为14.3个月。OS在随访中,尚未达到。由目前的研究数据可以看出,艾帕洛利托沃瑞利单抗作为我国自主创新的双特异性抗体有望成为复发转移性宫颈癌治疗新的药物选择,期待未来能提供更为详尽的疗效结果。
由中山大学肿瘤防治中心、重庆附属肿瘤医院和辽宁省肿瘤医院共同牵头的III期随机双盲研究结果也将于2025年公布。

替雷利珠单抗联合根治性同步放化疗对复发转移宫颈癌的中期结果显示,截至2022年12月,该疗法安全性良好,其中35例患者的中位PFS为6.5个月,中位OS为9.9个月,CR/PR为14%,ORR为40%。

另一项开放标签的II期研究探讨了替雷利珠单抗联合或不联合欧司珀利单抗治疗复发转移宫颈癌的效果。虽然PD-L1阳性患者显示稍高的ORR,但由于样本量较小,其结论尚需谨慎。

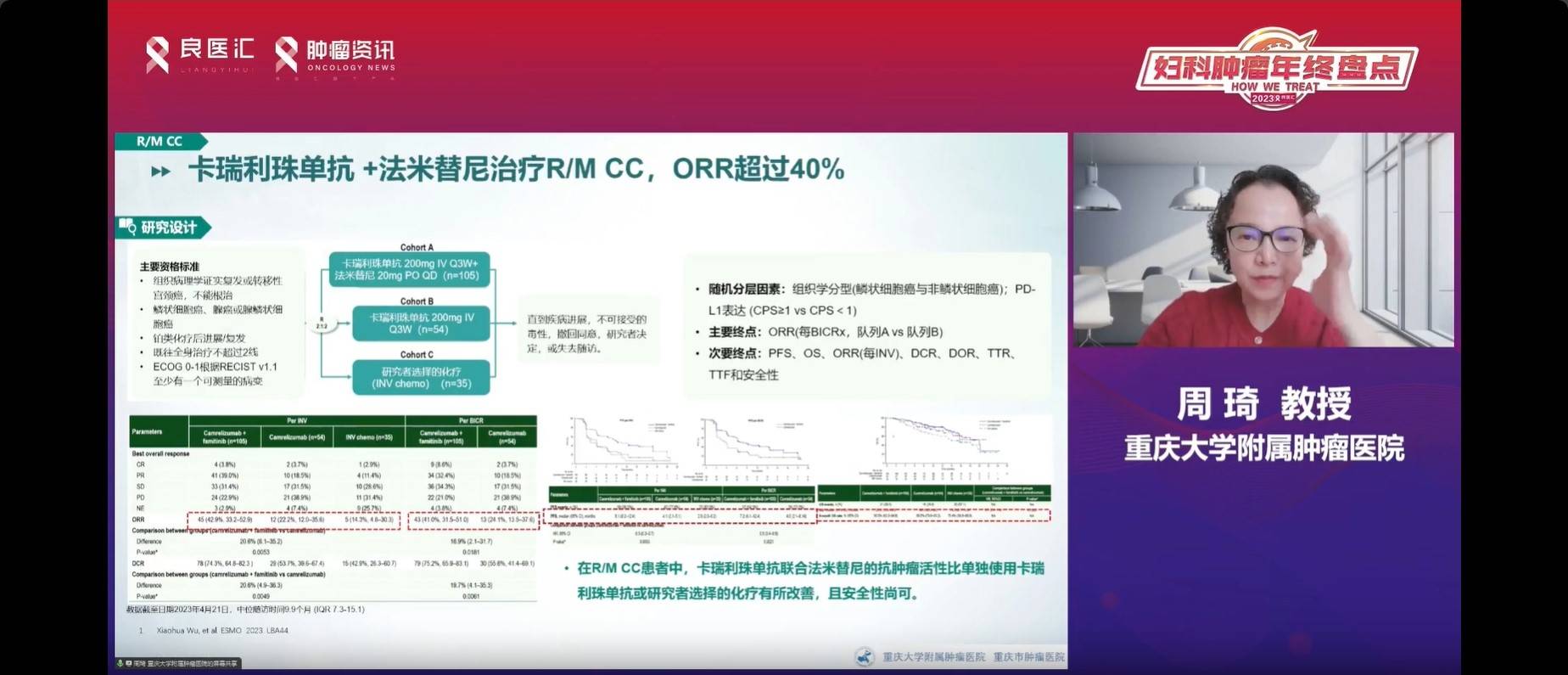
卡瑞利珠单抗与法米替尼联合治疗复发转移宫颈癌的研究包含了三个队列,尽管其中一个队列由于疗效不佳而停止,但其他两个队列表现出较好的ORR,显示了联合治疗的优势。
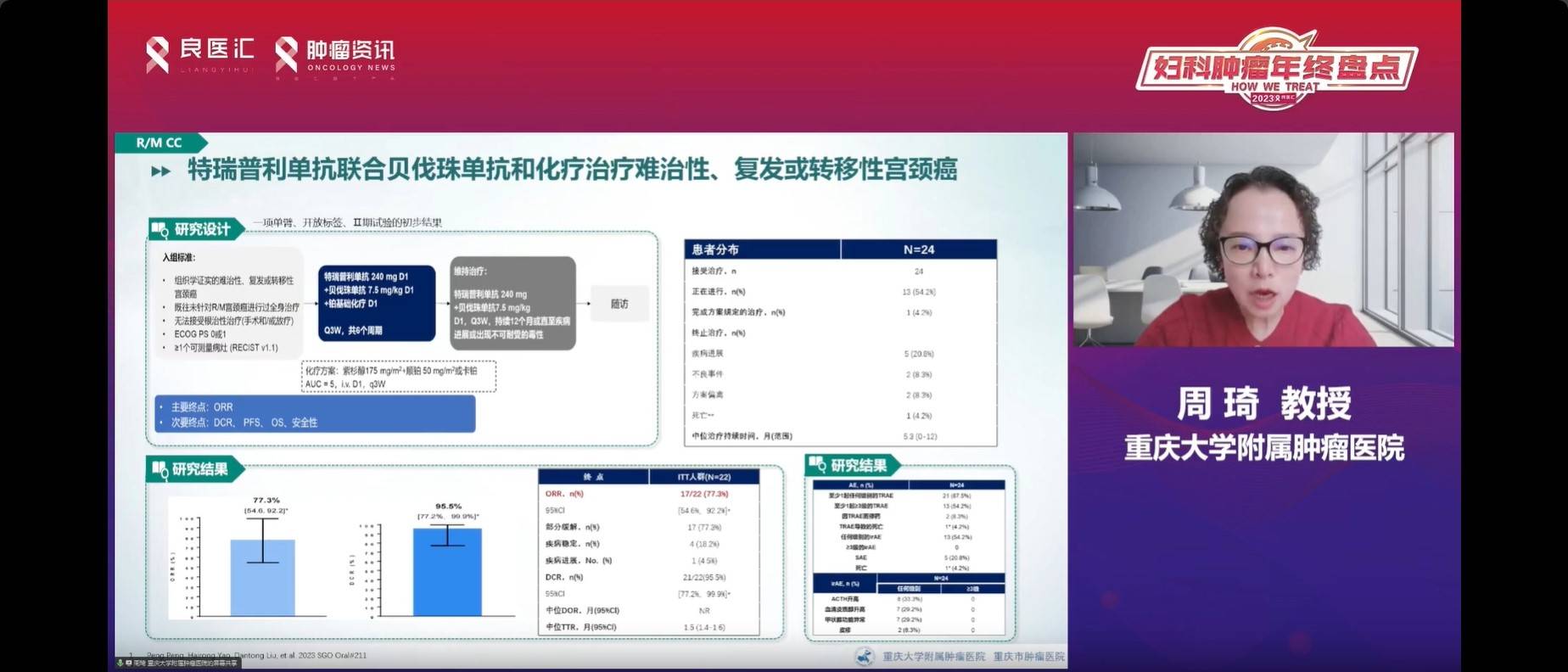
特瑞普利单抗联合贝伐珠单抗治疗难治性复发性宫颈癌的II期研究显示,其ORR达到了70.3%,展现了一种可行的治疗趋势。
另一项探索性研究考察了化疗联合派安普利单抗和安罗替尼的一线治疗,显示了较高的ORR为85.7%,且安全性可控。

复旦大学附属肿瘤医院牵头的SHR-1210-Ⅱ-217研究为卡瑞利珠单抗联合法米替尼治疗复发转移宫颈癌的II期研究。入组194例患者,中位随访时间9.9个月,结果显示,相比单用卡瑞利珠单抗,联合治疗提高了22%的ORR。无论是中央评估还是研究者评估,联合治疗组的DCR均达到74.3%。因此,卡瑞利珠单抗联合法米替尼被认为是更优越的治疗选择,该研究创新性地“去化疗”,其结果进一步肯定了“去化疗”在复发转移性宫颈癌中的可行性。

SHR-1701联合铂类化疗和BP102(贝伐珠单抗生物类似物)治疗复发转移性宫颈癌的1B/III期研究旨在评估该方案的疗效。治疗方案采用SHR-1701(30mg/kg)+紫杉醇(175mg/m2)+顺铂(50mg/m2)/卡铂(AUC 5)+BP102(15mg/kg)。共纳入了31名患者,中位随访时间为7.2个月。30名患者(96.8%)观察到靶病灶缩小。ORR为77.4%,其中包括4例CR,20例PR。所有24名所有治疗应答的患者,仍然持续应答。疾病控制率(DCR)为93.5%。6个月的无进展生存(PFS)率达到93.5%。这表明SHR-1701,这个由我国自主研发并具有知识产权的抗PD-L1/TGF-βRII双功能融合蛋白,可能为复发或转移性宫颈癌患者提供另一种治疗选择。随后开展的随机、双盲、安慰剂对照的III期研究也正在进行中,未来可能还会继续寻找合适的人群、标志物等。

替雷利珠单抗与欧司珀利单抗联合治疗(AdvanTIG-202研究)[1] 公布的结果符合业内预期,即在经治复发/转移性宫颈癌患者具有ORR获益,但其样本量较小。 
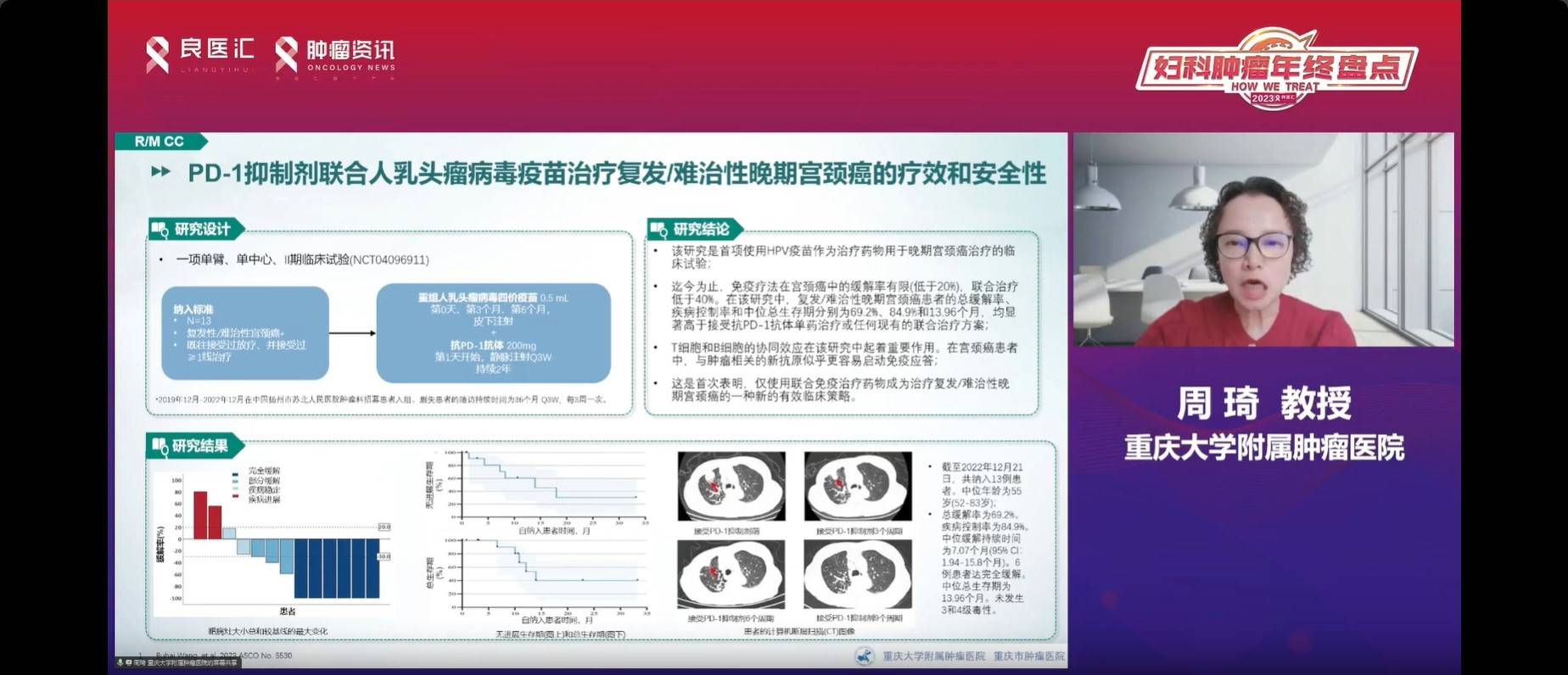
此外,关于PD-1抑制剂联合人乳头瘤病毒疫苗(HPV)治疗复发转移难治性宫颈癌的研究已在2023年ASCO上公布。尽管近年来治疗性疫苗在宫颈癌方面没有突破性进展,但该研究采用PD-1抑制剂与HPV疫苗联合治疗复发难治性宫颈癌,初步结果显示ORR接近70%,中位缓解时间约为7个月,6例患者完全缓解,中位OS达到13.96个月,且无三/四级毒性。期待未来进行更大规模的III期随机多中心研究,以确立治疗性疫苗联合PD-1抗体的更安全效果。
抗体药物偶联物(ADC)随着一线免疫治疗耐药带来的挑战在宫颈癌的治疗前景备受关注,尤其是Trastuzumab Vedotin(TV)和MIRV(以叶酸受体-α[FRα]为靶点的ADC)。TV是宫颈癌领域第一个FDA获批上市的ADC;2022年,MIRV获FDA加速批准用于宫颈癌和铂耐药卵巢癌的治疗。Innova TV301是一项III期开放标签、多中心研究,在2023年ESMO年会主席研讨会(Presidential Symposium)公布。研究显示,在一线治疗期间或治疗后疾病发生进展的复发性或转移性宫颈癌患者中,与单独化疗相比,接受TV治疗提高了复发难治宫颈癌的OS(11.5个月vs 9.5个月)和PFS(4.2个月vs 2.9个月),患者死亡风险降低了30%,表现出显著的统计学意义和临床意义。此外,德曲妥珠单抗(T-DXd,DS-8201)的临床研究在子宫颈癌、子宫内膜癌和卵巢癌中显示出良好的疗效。总体而言,ADC药物在妇科恶性肿瘤治疗中展现出令人鼓舞的前景,为提高患者生存率和降低死亡风险提供了新的选择。
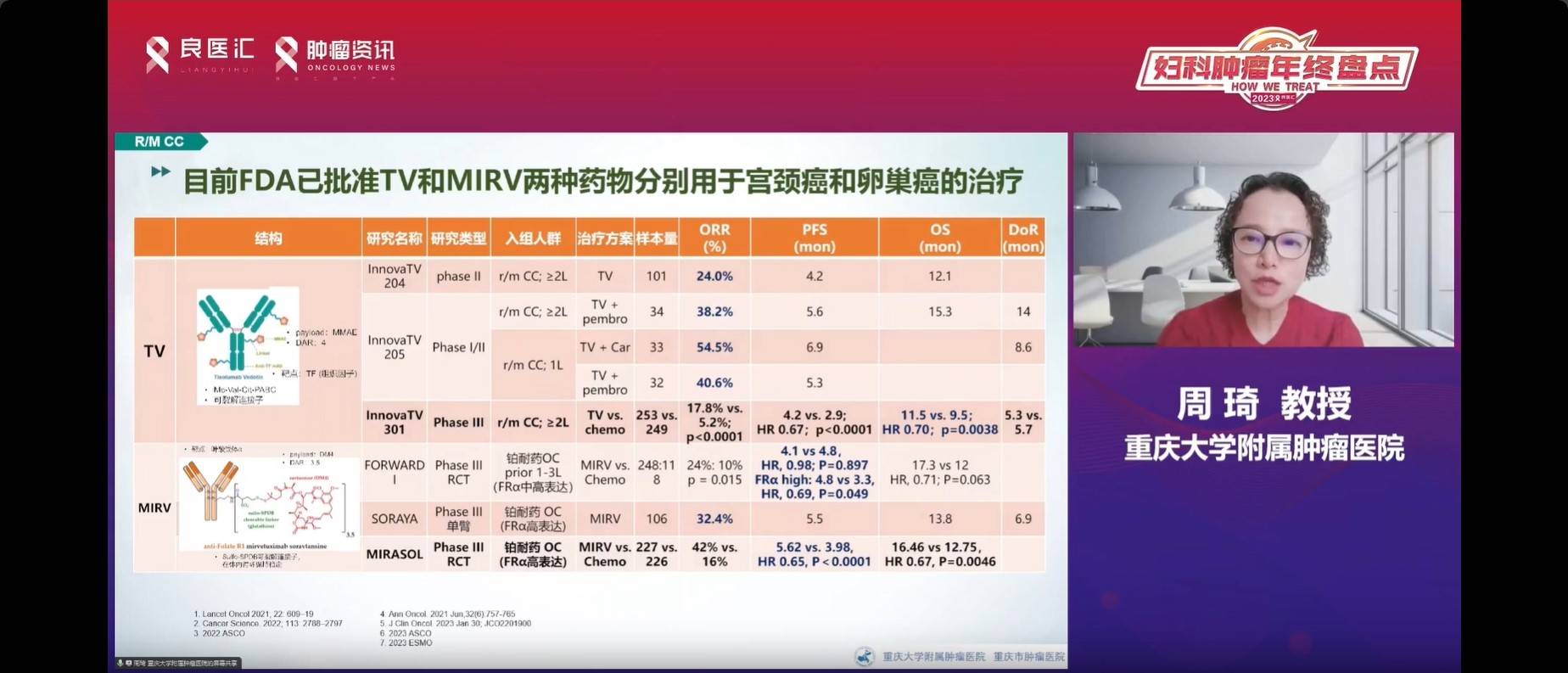
C018研究,针对RC48-ADC类药物,采用开放II期多队列篮子试验。计划入组120例患者,每个队列30例。截至2023年4月30日,宫颈癌队列入组17例,其中16例可评价。cORR达43.8%,DCR为87.5%,中位PFS为4.7个月。数据尚未发表,但表明其在宫颈癌治疗中具有一定疗效。

PRaG 3.0是RC48-ADC结合放疗、GM-CSF和IL-2联合PD-1抑制剂治疗HER2表达的晚期实体瘤患者的II期试验。在晚期实体瘤患者中表现良好,妇科恶性肿瘤中ORR为66.7%。在HER2 IHC(免疫组化)+ 的患者中,缓解率与IHC 2+-3+患者相似,是一个值得关注的研究。

HER2在妇科肿瘤的表达与其他肿瘤不同,福建省肿瘤医院的一项研究显示,宫颈癌HER2阳性表达率为50%,腺癌更高。对于HER2阳性患者,抗HER2的ADC药物可能带来更好的疗效。然而,未来的研究需关注HER2低表达或超低表达患者的疗效。宫颈癌中HER2阳性表达可能是不良预后的指标。早期检测HER2表达并采用高强度治疗,甚至联合抗HER2的ADC药物,可能提高患者的疗效。

新版NCCN指南要求在宫颈癌和子宫内膜癌中进行HER2免疫组化检测,可采用免疫组化、NGS等方式。然而,妇科恶性肿瘤面临的问题是缺乏针对性的HER2免疫组化判定标准,目前主要参照乳腺癌标准。
此外,还需关注HER2检测的时间和空间异质性,建议对多个部位进行检测,以获取更准确的结果。空间异质性问题也需注意,对于超低表达HER2的认定,期望未来病理科有更精确的检测方法。

小结
回顾2023,免疫治疗在宫颈癌领域正在不断研究和探索。在局部晚期宫颈癌,包括GCIG INTERLACE试验和Keynote-A18试验在内的数据强调了诱导化疗和免疫治疗的协同作用;对于复发转移性宫颈癌,需要考虑多药联合治疗在疗效上的提升,同时确保安全性,以达到1+1大于2的效果。在精准医学时代,精确治疗靶点、提高疗效、减低毒性、持续有效成为不断追求的目标。此外,新一代的ADC,如针对微管和组织因子的ADC药物,将有望为妇科恶性肿瘤带来新的治疗格局。我们的探索没有止境,今天的盘点也同时是未来的新起点。
排版编辑:樊雅琦











 苏公网安备32059002004080号
苏公网安备32059002004080号


