宫颈癌是影响全球女性健康的第四大恶性肿瘤,也是我国第二大女性恶性肿瘤。90%以上宫颈癌由人乳头瘤病毒(HPV)感染引起。虽然接种HPV疫苗可使青春期接种者的宫颈癌发病率降低90%,但要等到目前在青春期接种疫苗的人群步入中老年后,疫苗接种收益才能完全显现。因此,筛查仍然是宫颈癌预防的重要组成部分。目前,约有一半的宫颈癌发生在筛查不足的人群中。我们综合NEJM、JAMA等近期发表的文章,综述宫颈癌筛查的进展。
HPV感染与致癌
生殖器HPV感染是最常见的性传播感染之一。感染发生于上皮组织,传播途径一般是性接触。大多数HPV感染未被察觉,超过90%的新发感染会在1~2年内清除或不可检出。一些HPV类型持续感染可在数年内进展成宫颈癌及其他肛门生殖器癌症(包括阴道癌、外阴癌、阴茎癌和肛门癌),以及进展成口咽癌。宫颈HPV感染的自然史已经明确(图1)。首次HPV感染通常发生于开始有性接触的年龄,之后(具体取决于患者接受宫颈癌筛查的年龄)可检出宫颈癌前病变。宫颈癌通常是在感染发生数十年后被诊断出。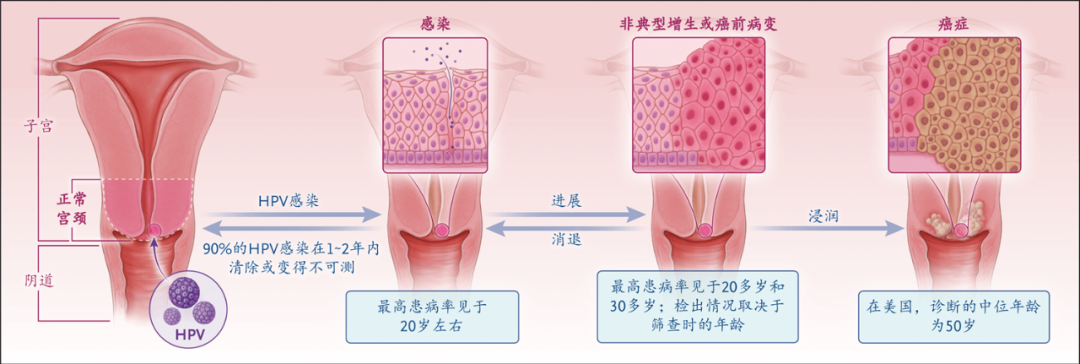
图1. HPV感染和进展成宫颈癌的自然
史图中显示了宫颈,以及宫颈从感染到癌前病变,再到癌症的组织学变化。HPV感染的最常见途径是性接触,最高患病率见于初次发生性接触的年龄。HPV感染基底上皮细胞,最常发生于宫颈内膜-宫颈阴道部交界处,此处的上皮细胞破裂使HPV有机会进入。大多数HPV感染会在1~2年内清除或变得不可测,但有一少部分持续存在并在数月至数年内进展成癌前病变。大多数癌前病变会消退,但有一少部分持续性病变会进展成浸润性癌,这一过程大多耗时10年以上。癌前病变和癌症的这一间隔时间使我们有机会通过筛查来有效检出早期病变。对筛查发现的癌前病变采取治疗可预防浸润性癌。HPV疫苗可预防感染,因此也可预防癌前病变和癌症。
目前已发现超过200种HPV类型,包括约40种感染黏膜上皮的类型。有12种类型被确定为致癌(或高危),8~12种类型被确定为很可能或可能致癌。HPV16型进展成癌症的风险最高。几乎所有宫颈癌均归因于HPV感染。在全球范围内,HPV16和HPV18导致了约70%的宫颈癌,以及更高比例归因于HPV的其他癌症。未被归类为致癌的HPV6和HPV11导致了几乎所有肛门生殖器疣和复发性呼吸道乳头状瘤病。
HPV感染通常无症状。无症状HPV感染并无治疗方法,当前治疗方法针对的都是HPV相关疾病。自然感染后的免疫力并不完全,但接种HPV疫苗后,约90%的人可在至少15年内免受HPV感染。
当致癌HPV感染持续存在时,受感染的细胞可能会发生肿瘤性转化。癌前病变系指从HPV复制感染到转化细胞克隆生长的转变。复制型HPV感染会经历一个完整的病毒生命周期,导致病毒产生和释放。在癌前病变细胞中,HPV病毒的癌蛋白会激活细胞周期并抑制细胞凋亡,而细胞凋亡是鳞状上皮细胞更新和防止肿瘤发生所必需的过程。癌前病变保留了许多正常的细胞功能,包括接触抑制,即非癌细胞在接触基底膜时停止增殖。癌前病变细胞有时会消退,但在生长时,通常会周而复始地增大,数年内不会发生侵犯。上皮内肿瘤生长期通常较长,这是宫颈癌筛查能够成功的原因。
腺癌是宫颈内膜腺细胞的癌症,几乎完全由 HPV-16、-18 和 -45 病毒引起。腺癌的病理生理学与鳞状癌不同,后者是由宫颈外口的鳞状细胞引起的。腺癌前病变可能会被筛查和阴道镜检查所遗漏,因此腺癌前病变的检出率和治疗率都低于鳞癌前病变。因此,筛查计划在预防腺癌方面的效果不如鳞癌。
流行病学和危险因素
据估计,大多数性活跃人群在一生中都会感染HPV,但具体比例尚不清楚。因此,HPV检测结果呈阳性只应被视为性活跃的标志。如果机体的免疫系统无法控制HPV持续感染,癌症就会发生。宫颈癌发生风险最重要的因素包括HPV阳性、HPV基因型以及与HPV相关细胞转化有关的细胞学变化。
在美国15~75岁女性中,经年龄调整和子宫切除术校正后的宫颈癌发病率为11.5例/10万人 。据世界卫生组织的数据,我国2020年宫颈癌粗发病率为15.6例/10万人,标化发病率为10.7/10万人。然而,免疫抑制或接触过己烯雌酚的人患宫颈癌前病变和癌症的风险较高。最近的证据提示,体质指数(BMI)较高妇女的宫颈癌筛查效果较差。肥胖妇女的5年癌症风险较高(0.083% vs. 0.056%),但5年癌前病变风险(0.51% vs. 0.73%)低于正常体重和体重偏低的妇女。
HPV 疫苗接种
接种 HPV 疫苗可预防 HPV 感染、癌前病变和癌症。指南建议11或12岁女童常规接种HPV疫苗,接种疫苗的最低年龄可以是9岁。对于未接种过疫苗的人群,建议在26岁之前接种疫苗(补种疫苗)。最好在首次发生性行为之前接种疫苗。疫苗是预防性的,首次性交后效果会下降。大多数研究显示,14岁前接种疫苗的益处最大,随着年龄增长,疫苗接种的效果会下降。27~45岁人群在接种疫苗前应共同决策,因为在人群层面,接种疫苗预计不会是一种有效或具有成本效益的癌症预防方式。
宫颈癌筛查指南目前未考虑疫苗接种情况,因为目前参加筛查的大多数人在青春期早期均未接种过HPV疫苗,而且要求提供青春期疫苗接种记录以确定筛查资格将成为宫颈癌筛查的障碍之一。
宫颈癌筛查建议
在未接受筛查的人群中,一生中患宫颈癌的风险高达 5%。对宫颈癌前病变进行有效筛查和治疗可将终生患病风险降至0.5%以下。建议对无症状者进行定期筛查,以诊断和治疗宫颈癌前病变,从而预防宫颈癌。然而,筛查仅适用于无症状者。出现宫颈癌的可能症状(包括不规则出血、疼痛或阴道分泌物)的人需要进行评估,包括盆腔检查和宫颈细胞学检查。
筛查需考虑的因素
有效的宫颈癌筛查包括以下步骤:(1) 对所有患者进行筛查资格评估,并在有指征时进行筛查(图 2);(2) 根据筛查机构所具备的能力,选择合适的筛查手段:HPV检测或细胞学检查等(见后文)。与单纯细胞学检查相比,HPV检测结果阴性能更准确地表明没有宫颈癌前病变。细胞学检测宫颈癌前病变的灵敏度为50%~70%,而HPV检测的灵敏度则超过90%。此外,当后续几轮HPV筛查结果为阴性后,患癌风险将持续降低。


图2. 宫颈癌筛查指证
普通风险人群的筛查
患宫颈癌的风险在30岁左右开始升高,并在余生持续升高。因此,指南建议25岁~65岁有宫颈的人群(如未接受子宫切除术的女性和变性男性)至少每5年筛查一次。美国预防服务工作组建议,21岁~29岁时只进行细胞学筛查,30岁~65岁时只进行HPV检测、HPV检测与细胞学筛查(共检)或只进行细胞学筛查。
高风险人群的筛查
在普通人群中,高达20%的人曾有过异常结果、癌前病变或癌症或免疫功能低下,需要每隔1年或3年筛查一次(图2)。
停止筛查
以下无症状者不建议进行筛查:(1)年龄小于21岁;(2) 无宫颈(例如子宫切除术后),除非之前已确诊为宫颈癌或癌前病变;(3)年龄>65岁且符合停止筛查标准:近10年内至少连续3次细胞学检测结果阴性或连续2次HPV检测结果阴性(最近一次在近5年内),近10年内无异常结果,近25年内无宫颈癌前病史或无宫颈癌病史,无免疫抑制。在65岁停止筛查前进行充分筛查至关重要。45岁~65岁人群筛查不规范者较为常见,而在64岁~66岁人群中,高达三分之一者不符合停止筛查的条件。约有25%的宫颈癌发生在>65岁女性,她们的死亡率约为年轻女性的2倍,许多在65岁后罹患宫颈癌的人并不符合停止筛查的指南标准。
筛查方法
细胞学检查。细胞学检查是一种应用广泛的筛查方法,但这种方法依赖于细胞学制片技术人员和阅片医生的专业水平,主观性强,可重复性较差。传统宫颈细胞学检查可能会产生大量不满意的涂片,相比之下,液基细胞学克服了制片过程中的部分质量问题,并提供了对单个样本进行分子和细胞学检查的机会。与传统细胞学分析相比,液基细胞学分析检出2级或更高级别宫颈上皮内瘤变(CIN)(CIN2+)和3级或更高级别(CIN3+)的灵敏度相似或更高,特异性和阳性预测值相似或更低。随机对照试验和观察性研究均证实,无论使用传统细胞学筛查还是液基细胞学筛查,宫颈癌发病率和死亡率均可降低。
醋酸目视法。醋酸目视法(VIA)具有成本低廉、对基础设施条件的要求较低以及“即筛即治”的从而减少患者失访的特点,因而在卫生资源条件较差的地区及国家仍有使用。印度的两项随机对照试验显示,与不进行筛查相比,经过一轮或多轮VIA筛查后,宫颈癌死亡率持续显著降低。死亡率降低的原因可能是发现并治疗了癌前病变、浸润性宫颈癌的分期降低(即所发现癌症的分期分布向早期转移)或两者兼而有之。总体而言,VIA可降低与宫颈癌相关的死亡率,并可降低宫颈癌发病率。然而,开展VIA筛查需要对操作者进行适当培训,对筛查结果的解释标准仍需要进一步统一。在采用VIA筛查的地区,建议逐步向HPV检测过渡,这将加速减少宫颈癌疾病负担。
HPV核酸检测
与细胞学分析相比,HPV检测由仪器设备完成,客观性强。此外,还可使用女性受试者自行收集的阴道样本进行HPV DNA检测,因此,HPV检测可将筛查范围扩大至医疗服务资源相对匮乏的人群。荟萃分析显示,与使用临床医生采集的宫颈样本相比,采用女性受试者自行采集的样本,当采用聚合酶链式反应法检测HPV时,对宫颈上皮内瘤变2级以上(CIN2+)或宫颈上皮内瘤变3级以上(CIN3+)的检测具有相似的敏感性和特异性。对于CIN3+的筛查,HPV mRNA检测与HPV DNA检测具有相似的横断面敏感性和更高的特异性,但对于纵向结局的研究数据较少。
在CIN2+检测方面,HPV DNA检测的敏感性高于细胞学分析,而且HPV DNA检测能降低后续筛查中CIN2+的检出率,并能在筛查间隔相同的情况下更大程度地降低宫颈癌发病率。与细胞学检测结果阴性相比,HPV DNA 检测结果阴性后3~10年内CIN3+的风险更低。总体而言,宫颈癌发病率和死亡率的大幅降低所带来的收益超过了与阳性结果和阴道镜检查转诊率增加相关的危害,以及HPV DNA检测可能增加的心理危害。由于HPV DNA检测比细胞学分析的筛查间隔时间更长,因此在进行几轮基于HPV DNA的筛查后,预计获益风险平衡会更偏向于获益。
尽管目前用于筛查的上述方法均可有效降低宫颈癌发病率和死亡率,但考虑到其利弊平衡,只有HPV检测是最有效的。
获益与危害的平衡
宫颈癌筛查的获益需要与可能的危害进行权衡。所有筛查方法都可能会在检查或样本采集过程中引起疼痛或不适;自我取样(由妇女自己采集样本)进行HPV检测可能会减少不适感。宫颈癌筛查还可能产生与筛查过程本身、收到结果以及任何后续诊断和治疗途径有关的焦虑。阳性结果会增加焦虑和痛苦,并可能引发对癌症的担忧;还可能引发羞耻感,尤其是在HPV检测结果呈阳性之后。与后续诊断和治疗相关的潜在身体伤害包括出血、感染和不良产科结果的风险。衡量危害的常用指标是阴道镜检查和治疗的转诊率。假阳性或不满意结果比例较高的检测会带来额外的潜在危害,如增加患者的费用、失访以及对诊疗失去信心。
但总体而言,对于≥30岁女性,采用HPV核酸检测或细胞学分析进行筛查的获益大于危害。对于30岁以下的女性,尤其是在未对HPV阳性女性进行分流检测的情况下,两种筛查技术的价值都不太确定。就VIA而言,在降低宫颈癌发病率和死亡率方面的获益以及与假阳性结果相关的危害,变化很大且取决于观察者;因此,VIA的获益是否始终大于其危害尚不清楚。
筛查结果异常的处理
基于风险管理的新框架
对于当前或既往筛查结果异常者,后续处理措施应根据其癌前病变风险确定。北加州凯泽医疗集团对150多万人进行了长达15年的随访,根据这些人当前和既往细胞学和HPV检测及活检结果,对癌前病变风险进行了精确估算,并经过美国疾病控制和预防中心(CDC)的乳腺癌和宫颈癌早期检测计划的验证。综合风险表可在下面的网址查询:https://dceg.cancer.gov/research/cancer-types/cervix/enduring-guidelines。临床医生采取基于风险的处理策略可减少患者的过度检查,但门诊将更容易看到结果异常者,因为:(1)高风险人群比低风险人群会更频繁地接受筛查;(2)部分患者的阴道镜检查被推迟,这部分人需要在1年后随访;以及(3)由于低风险患者的阴道镜检查推迟,在接受阴道镜检查的患者中,最终诊断为癌前病变的患者比例将会升高。
指南使用CIN3、原位癌或浸润性癌症(统称为CIN3或更严重[CIN3+])的当前风险来判断患者是否需要接受阴道镜检查,或者是否可以在1、3或5年后复查HPV或联合检测。对于当前CIN3+风险<4%者,需要评估3年或5年的CIN3+风险,以确定1年、3年或5年的复检间隔。具体而言,如果患者5年内进展为CIN3+的风险与HPV检测结果为阴性的普通筛查人群相似(即小于0.15%),则患者应在5年后再次接受筛查。如果患者的风险与单纯细胞学筛查结果正常(上皮内瘤变或恶性肿瘤阴性)的普通筛查人群相似(5年CIN3+风险为0.15%~0.54),则患者应在3年后再次接受筛查。如果患者的风险介于3年后复查与需要进行阴道镜检查之间,则应在1年后复查。
当CIN3+风险为4%~24%时,亦即普通筛查人群中HPV阳性、低级别细胞学异常(如HPV阳性、意义不明的非典型鳞状细胞或HPV阳性、持续时间不明的LSIL)的CIN3+风险,建议立即接受阴道镜检查。对于当前CIN3+风险为25%~59%的患者,以及普通筛查人群中 HPV阳性、高级别细胞学异常的患者,建议进行阴道镜检查或切除治疗。对于CIN3+风险≥60%的人群(如HPV16阳性高级别鳞状上皮内瘤变[HSIL]),直接进行切除治疗(快速治疗)比先进行阴道镜检查和活检更可取。如果无法立即进行治疗,则应进行阴道镜检查,以免延误诊断。
阴道镜检查
对于筛查结果异常的患者,阴道镜检查和活组织检查可用于检测癌前病变,并进行治疗,以防止癌症发展。在阴道镜检查中,医生在涂抹3%~5%醋酸后,使用放大镜对宫颈进行评估。癌前病变的细胞通常会形成侧向扩散的高级别病变,在阴道镜检查中可以看到醋酸白斑。接受阴道镜检查的患者中有较高比例会被诊断为癌前病变。在阴道镜检查时,识别异常宫颈上皮并确保对所有醋酸白斑进行针对性活检对于避免漏诊癌前病变非常重要。
根据美国阴道镜检查指南,在非妊娠患者中,所有醋酸白区域均应活检,通常每位患者应活检2~4次。活检次数越多,CIN3+检出率越高,1次活检的检出率约为60%,而2~4次活检的检出率可超过80%。低风险患者可推迟活检,即细胞学检查结果为上皮内瘤变阴性、意义不明的异形鳞状上皮或低级别鳞状上皮内瘤变(LSIL),无HPV16或HPV18感染证据,且无明显异常。除了对所有乙酰白区进行活检外,如果细胞学检查结果为高级别、HPV16或HPV18感染、癌前病变治疗后、CIN2观察期间以及鳞状柱状上皮交界处未完全显露,则建议进行宫颈管内刮片取样;40岁或以上患者首选宫颈管内刮片取样。对于妊娠患者,除非担心会发生癌变,否则应推迟活组织检查,而且宫颈内口刮宫术是禁忌症。
根据活组织检查结果选择后续处理
阴道镜活检结果通常使用Bethesda系统报告为CIN1、2、3,或使用下生殖器鳞状组织术语系统报告为LSIL或HSIL。最近的指南建议将HSIL定义为CIN2或CIN3,以改善风险预测能力。CIN3癌变风险较高,并且通常与致癌HPV基因型相关。建议所有确诊为CIN3、HSIL 或原位癌的非孕妇接受治疗。
对于未妊娠的CIN2患者,也建议接受治疗,但对于考虑未来怀孕的患者,可以选择观察,因为治疗对未来妊娠的影响尚不明确。一项荟萃分析表明,切除术治疗后早产的风险为8.6%,而结果正常者为4.6%。然而,如果将接受过治疗的妇女与之前筛查结果异常但未接受治疗的妇女相比,早产率相似,这表明可能是HPV感染而非治疗导致早产。与CIN3相比,CIN2的异质性更强,常与低危HPV基因型相关,而且可能会自发缓解。30岁以下女性随访2年,HPV16相关CIN2有一半进展为CIN3,而其他HPV基因型相关CIN2进展率不到20%。
CIN1(组织学LSIL)不是癌前病变,无需治疗,更宜采取观察策略。显微镜下的CIN1诊断既不可靠,也无法改变活动性HPV感染病程。人们曾认为对持续存在的CIN1进行治疗可防止其发展为CIN2或CIN3。然而,随后的研究表明,CIN1可由多种基因型HPV引起,反复的CIN1不一定表明病毒持续存在,而且只有8%的患者会在2年内进展为CIN3,因此大多数患者无需治疗。
治疗和预后
癌前病变的治疗包括切除或破坏整个鳞状柱状上皮交界处,并破坏阴道镜检查发现的病变。治疗目的是消除大部分已发生癌前病变的HPV感染细胞,以降低罹患宫颈癌的风险。手术切除和消融均是目前指南推荐的治疗手段。
切除术和消融术后CIN3复发风险在6个月时分别约为1.6%和2.9%,在12个月时分别上升至3.2%和7.2%。在癌前病变治疗后的数十年内,特别是对于50岁以上的人群,罹患浸润性癌症的风险仍然很高。因此,指南建议在65岁之前,每隔3年继续筛查一次,治疗后至少筛查25年,只要个人健康状况良好,可以继续筛查。
1. Lei J, Ploner A, Elfström KM, et al. HPV vaccination and the risk of invasive cervical cancer. N Engl J Med 2020;383:1340-8.
2. Markowitz LE, Unger ER. Human papillomavirus vaccination. N Engl J Med 2023;388:1790-8.
3. Bouvard V, Wentzensen N, Mackie A, et al. The IARC perspective on cervical cancer screening. N Engl J Med 2021;385:1908-18.
4. Perkins RB, Wentzensen N, Guido RS, Schiffman M. Cervical cancer screening: A review. JAMA 2023;330:547-58.











 苏公网安备32059002004080号
苏公网安备32059002004080号


