近期,发布在Nature Review Gastroenterology & Hepatology的一篇综述讨论了造血干细胞亚群在肝纤维化中的双重作用及其对肝癌促进、进展和转移的贡献。研究回顾了肝星状细胞(HSC)和癌症相关成纤维细胞(CAF)亚群之间的转录组学和功能相似性,强调了促进或预防纤维化和癌症的途径,以及这些途径出现的免疫学景观。正在进行的研究见解将产生新的策略,用于开发生物标志物、评估预后以及助力 肝细胞癌(HCC )和肝内胆管癌(iCCA) 预防和治疗探索新疗法。
肝癌是癌症相关死亡的第三大原因,其发病率在全球范围内呈上升趋势。最常见的类型包括肝细胞癌 (HCC) 和肝内胆管癌 (iCCA),分别占所有原发性肝癌的80%~90%和10%~20%。此外,肝脏仍然是肝外肿瘤的主要转移部位,占所有病例的 25%。
肝星状细胞(HSC)是常驻的窦周围维生素 A 储存细胞,在肝脏生理学和纤维生成中起着重要作用。在慢性肝损伤期间,静止的造血干细胞转分化为活化的增殖性纤维化肌成纤维细胞,主要分泌细胞外基质 (ECM)成分。相关的慢性肝脏炎症会增加肿瘤负担,因为超过90%的HCC是在非常晚期的纤维化或肝硬化的背景下出现的。肿瘤微环境(TME)包括癌细胞、癌症相关成纤维细胞(CAF)、驻留和募集的免疫细胞以及嵌入在可变量的重塑ECM中的肿瘤相关内皮细胞(TEC)。除了肿瘤起始外,ECM重塑还可以通过诱导侵袭和转移来促进癌症进展。iCCA 经常表现出致密的结缔组织增生性纤维基质,可能通过与肿瘤细胞的复杂串扰深刻地塑造癌变的进展。癌症相关成纤维细胞(CAFs)在胶原蛋白的沉积中起着至关重要的作用,胶原蛋白是ECM的主要成分之一,因此与肝癌的发生和发展有关。HCC 和 iCCA 都含有大量的 ECM,主要来源于活化的 CAF。
静止的造血干细胞是活化的造血干细胞和肝脏CAF的主要来源。虽然造血干细胞仅占肝细胞的10%左右,它们表达了以前未被重视的显著程度的转录组异质性。此外,还根据其空间地带分布描述了不同的亚群。简而言之,静止的HSC在空间上以相对静态的分布进行分区,而激活的造血干细胞可以在时间依赖性和阶段依赖性疾病中进化为具有不同基因特征和功能的亚型。造血干细胞的特定亚群优先促进纤维化和肿瘤发展,在体内消耗这些特定的HSC亚群可能是一种可行的治疗策略。本文讨论了不同HSC亚群在肝纤维化中的双重作用及其对肝癌促进、进展和转移的新贡献。
HSC 是位于肝细胞和肝窦内皮细胞(LSEC)产生的肝血管之间的 Disse 空间中的常驻肝周细胞。HSC、LSEC和Kupffer细胞(肝脏驻留巨噬细胞)构成了肝脏非实质细胞(NPC)区室的大部分,其中HSC约占正常肝脏中驻留细胞总数的10%。在健康的肝脏中,静止的造血干细胞除了具有维生素A储存外,还具有重要的稳态功能,包括分泌生长因子,促进肝细胞的健康更新和肝血流的血管调节,因为它们具有收缩特性。急性损伤后,造血干细胞在TGFβ1和PDGFB信号传导的驱动下发生剧烈激活,转分化为活化的肌成纤维细胞样造血干细胞,从而产生增加的ECM并有助于组织修复。当损伤是慢性的而不是自限性的(例如,由于慢性病毒感染、酒精或NAFLD),激活的HSC会继续产生过多的ECM以产生疤痕,为肿瘤发展奠定了基础。
单细胞分析揭示了人类和慢性肝病动物模型中HSC亚群的显著细胞异质性。活化的造血干细胞已进一步分为不同的亚群,包括增殖性造血干细胞(pHSC)、炎性造血干细胞(iHSC)、中间活化或血管造血干细胞(vHSC)以及收缩性迁移性造血干细胞 (cmHSC) 和纤维化肌成纤维细胞(myHSC)(图1)。
静止肝星状细胞(qHSC)是原发性和转移性肝癌中纤维化中活化的 HSC(肌成纤维细胞)和癌症相关成纤维细胞 (CAF) 的主要来源。单细胞 RNA 测序分析已证明从 qHSC 过渡到几种激活的HSC和CAF表型。此外,计算机分析显示活化的HSC转录分化为亚型,包括增殖性(pHSC)、炎症性(iHSC)、收缩性和迁移性(cmHSC)以及纤维化肌成纤维细胞 (myHSC)表型。在血管造血干细胞(vHSC)亚群中描述了表达微血管系统基因的其他亚型,但它们的起源尚不清楚。在肝纤维化消退期间出现失活的HSC (dHSC)亚群,其特征是qHSC和活化的HSC之间存在中间基因表达特征。然而,尚未描述该亚型完全转分化为静止表型。同样,CAF 显示出从炎症 (iCAF)到纤维化表型(myCAF)的转录转变,中间亚群包括血管(vCAF)和抗原呈递CAF (apCAF)。由于HSC和CAF在肝纤维发生和癌变过程中具有显着的可塑性,它们不同的亚群在响应特定的慢性炎症和肿瘤微环境时表现出互补或模糊的功能。该图旨在作为基于现有数据的假设框架;某些元素可能需要进一步的实验验证。
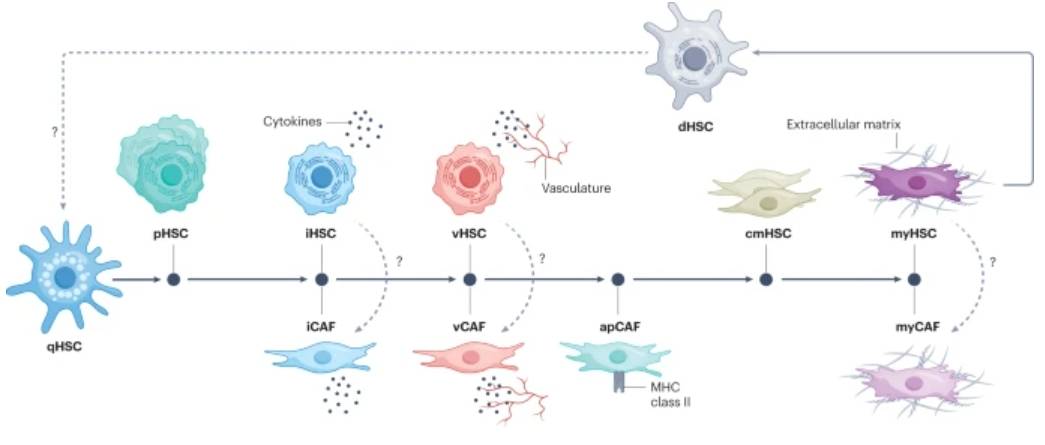
图1:基于单细胞分析的HSC和CAF活化后塑性的假设模型。
HCC和iCCA通常被视为分别起源于肝细胞和胆管细胞的独立肿瘤,因此在组织学和分子特征上存在差异。尽管如此,新兴的基因组分析以及体内遗传谱系追踪研究已经确定了两种肿瘤类型(即肝细胞、胆管细胞和祖细胞)的多种潜在起源细胞,这表明HCC和 iCCA包含原发性肝癌的连续体,其中还包括具有混合组织学和分子特征的亚型。大多数肝细胞癌表现出典型特征,包括基质和/或血管浸润、细胞密度增加、细胞小梁增厚、网状蛋白骨架缺失和假腺体模式。另一方面,iCCA在宏观和微观外观上具有高度异质性,这反映在其组织学分类中。根据受累胆管的大小,常规iCCA可分为小胆管亚型或大胆管亚型,前者的特征是肿块形成生长模式,后者起源于肝内胆管大,粘蛋白生成增加。
潜在的慢性肝脏炎症在肝细胞癌的发病机制中起着重要作用,新的证据表明肝癌发生的病因依赖性、免疫相关机制。HBV和HCV感染会引发免疫反应,从而促进或抑制致癌作用。
肝脏独特的微环境对于支持通过血液或淋巴管从其他器官中播种的肿瘤细胞至关重要。虽然多种原发性肿瘤可能是肝转移的起源,但原发性结直肠癌占转移性肝癌病例的一半。引人注目的是,转移性肝癌的发生频率是原发性肝癌的18~40倍,并且5年生存率大幅降低。活化的造血干细胞还可以通过抑制肿瘤休眠来为肝脏中转移性肿瘤的生长提供宽松的微环境。具体来说,激活的HSC分泌趋化因子CXCL12,该趋化因子通过与自然杀伤细胞上的同源受体CXCR4结合,降低其活性,消除维持转移性乳腺癌休眠以促进转移性生长的制动器。
肿瘤细胞、CAF、免疫细胞和周围TME的其他元素之间的相互作用深刻地影响着癌症的生长。特别是,CAF是TME中最丰富和最关键的成分,它可以通过复杂和动态的机制影响癌细胞。CAFs可以通过直接刺激癌细胞增殖、促进血管生成和重塑微环境来支持肿瘤发生。这些功能可以通过配体-受体相互作用、生长因子和炎性细胞因子的释放和/或ECM成分的沉积来发挥。特别是,CAF介导胶原蛋白、纤连蛋白和蛋白聚糖等的分泌,这些分泌与基质交联酶的分泌一起有助于基质重塑,最终产生支持癌症生长和侵袭并增加组织硬度的“轨道”(图2)。
单细胞RNA测序分析显示,HCC(a 部分)、肝内胆管癌 (iCCA)(b 部分)和肝转移(c 部分)中的癌症相关成纤维细胞 (CAF) 亚群存在显著异质性。肝癌中描述的主要 CAF 亚型是肌成纤维细胞 (myCAF)、炎症 (iCAF) 和血管性 (vCAF)。在HCC中,表达I型胶原(myHSCs)的HSCs会增加肝脏硬度,从而促进肿瘤细胞的增殖。相反,表达细胞因子和生长因子 (cyHSC) 的 HSC(炎性 HSC)通过肝细胞生长因子 (HGF) 及其受体 MET 抑制 HCC 生长。在 iCCA 中,myCAF 产生透明质酸合酶 2,这种酶负责透明质酸的产生,促进肿瘤生长和进展。另一方面,myCAF亚群产生的I型胶原蛋白有助于肝脏僵硬,但对肿瘤生长没有影响。在人类 iCCA 中,vCAF 亚群通过 IL-6–IL-6R 轴促进肿瘤生长。在肝转移中,源自 myCAFs 的 I 型胶原蛋白通过机械抑制肿瘤来抑制肿瘤生长,而透明质酸则促进肿瘤生长。在 iCCA 和转移瘤中,iCAF 通过 HGF-MET 轴促进肿瘤生长。
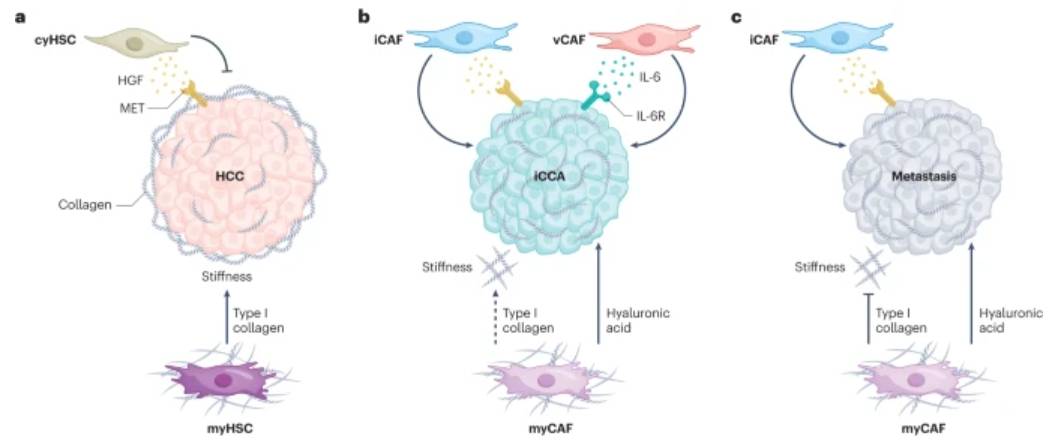
图2:CAF亚群在肝肿瘤微环境中的作用。
CAF还可以通过提供特定的营养物质来支持肿瘤生长,从而支持肝癌。
目前尚无 FDA 批准的肝纤维化治疗方法。慢性肝病对抗纤维化治疗的未满足需求在NASH中最为明显,其中纤维化是唯一与临床结局相关的组织学特征,尤其是肝衰竭和HCC。此外,减轻潜在的肝脏疾病(例如,通过治疗乙型肝炎,丙型肝炎的治愈,NASH患者的减肥手术1或戒酒)可显著改善纤维化消退,这与改善结局有关,对于HBV和HCV感染,可降低HCC的发病率。
直接靶向纤维化细胞的新方法不如病因学导向疗法先进,但可以通过减弱CAF对癌症发展或进展的致瘤作用来影响肿瘤生长。动物模型已经证明,星状细胞可以通过施用 HSC 特异性CD8 T细胞或嵌合抗原受体 (CAR) T 细胞直接消融。
直接抗纤维化策略还试图降低 TGFβ(一种主要的促纤维化细胞因子)的局部活性。由于TGFβ对肝细胞具有很强的抗增殖作用,因此其全身中和作用不安全,因为它会促进癌症。另一种方法是靶向局部调节 TGFβ 活性的其他分子,特别是 HSC 表达的整合素(例如,αV 整合素);事实上,整合素拮抗剂(例如,IDL-2965和PLN-1474)已经在临床试验中用于治疗肝纤维化而还不是肝癌。其他局部抑制TGFβ的新兴方法包括靶向小窝蛋白(内化TGFβ受体),透明质酸合酶2(激活HSC)、CD147(触发造血干细胞收缩、迁移和纤维化基因表达),过氧化氢诱导克隆5(对肌成纤维细胞分化很重要)和半乳糖凝集素 1(促进 HSC 迁移)(图3)。
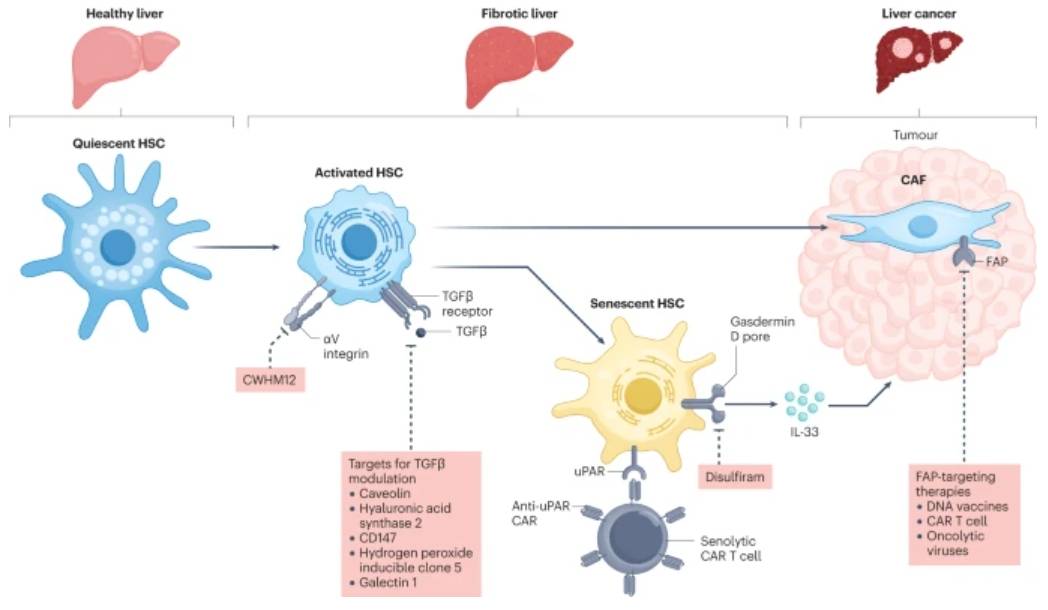
图3:肝星状细胞亚群是非酒精性脂肪性肝炎抗纤维化和抗肿瘤治疗的潜在靶点。
通过免疫疗法对HCC和iCCA的药物治疗取得了渐进的进展,这些免疫疗法可以恢复对肿瘤细胞的免疫细胞杀伤。些方法尚未与针对CAF的治疗相结合,但这种类型的组合可能首先出现NASH相关HCC中,其发病率上升速度快于其他病因的HCC。通过CAF定向疗法改变 TME 的癌症疗法可能是预防和治疗 HCC和iCCA的一种强大的新方法。有迹象表明,这种做法是合理的。
在肝脏中,鉴定CAF的明确来源来源于HCC和肝转移中活化的HSC,并辅以iCCA中的门静脉肌成纤维细胞,这是一项重大进展,可以在此基础上取得进展。预计高度靶向免疫疗法、细胞特异性递送方法、细胞间串扰和稳定表型特异性药物靶点的鉴定将不断完善,这将逐步改变有效预防和治疗肝癌的前景。
Cogliati B, Yashaswini CN, Wang S, Sia D, Friedman SL. Friend or foe? The elusive role of hepatic stellate cells in liver cancer. Nat Rev Gastroenterol Hepatol. 2023 Oct;20(10):647-661. doi: 10.1038/s41575-023-00821-z. Epub 2023 Aug 7. PMID: 37550577; PMCID: PMC10671228.
排版编辑:肿瘤资讯-Emma











 苏公网安备32059002004080号
苏公网安备32059002004080号


