我国是肝癌大国,肝癌是中国第四位常见恶性肿瘤,第二位肿瘤致死病因。近年来系统治疗的发展使肝癌患者预后得到了极大改善,但部分患者预后仍有待提高。我国自主研发的阿可拉定(淫羊藿素软胶囊®)单药在不适合标准治疗的肝癌富集人群的总生存期(OS)长达13.54个月,疗效与安全性获得国家认可,进入2023年国家医保目录,为更广泛的患者带来获益。
阿可拉定作为从淫羊藿属植物中提取的天然化合物,其疗效与作用机制备受关注。2024年1月,《CANCER LETTERS》(IF 9.7)刊发的一篇研究报道了阿可拉定对线粒体自噬-细胞凋亡的调节从而杀伤HCC,明确其可与自噬/线粒体自噬抑制剂协同增效,从机制上进一步阐明了阿可拉定治疗肝癌的作用1。
问道HCC,自主创新点亮生存之光
我国肝细胞癌(HCC)年新发38.9万例,死亡33.6万例,发病人数及死亡人数均位居世界前列,为国民带来了沉重的负担2。我国大多数HCC的病因构成以慢性乙型肝炎病毒(HBV)感染为主,而当前对HCC的一线治疗策略主要为抗血管生成靶向药物单药或联合免疫检查点抑制剂方案,临床中仍有巨大未被满足的需求。
我国自主研发的1.2类创新药阿可拉定基于我国HCC患者特点,将满足AFP≥400 ng/mL、 TNF-α<2.5 pg/mL、IFN-γ≥7.0 pg/mL 三种指标中二种及以上条件人群作为HCC富集人群,并对此展开探索。SNG1705 ICR-1 Ⅲ期临床研究显示阿可拉定对HCC富集人群一线治疗mOS达13.54月,HR 0.43,较华蟾素对照组死亡风险降低57%;中位到疾病进展时间(TTP)有改善的趋势,达3.65个月,HR 0.67,较华蟾素对照组疾病进展降低33%。安全性方面,阿可拉定组≥3级TRAE仅12,1%,远低于华蟾素组26.2%。基于广受认可的疗效和安全性,阿可拉定被纳入2024年新版国家医保目录,以更广泛的可及性助力患者生存获益。
阿可拉定作为从天然药物植物淫羊藿中提取的单体小分子药物,可以下调TNF-α、IL-6、PD-L1表达发挥抗肿瘤作用;还可通过下调巨噬细胞中TNF-α和IL-6的分泌量、降低MDSC细胞比例、提高CD8+T细胞的数量改善免疫微环境;并通过提高miRNA的表达水平而降低AFP mRNA稳定性和翻译活性,抑制AFP表达,对抗HBV对HCC的影响,抑制肿瘤生长。
证道HCC,寻本溯源解析线粒体自噬-细胞凋亡串扰
初窥:阿可拉定抑制肝细胞癌的生长、增殖和迁移
为探究阿可拉定治疗HCC的确切分子机制,研究者使用阿可拉定处理SK-Hep1和Huh7细胞,并对其进行细胞毒性检测、集落形成、HCC细胞伤口愈合试验。结果表明,阿可拉定可抑制HCC细胞的活力(图1A),显著减少HCC细胞的集落形成(图1B-C),在用药12小时或24小时后,显著抑制HCC细胞迁移功能(图1D-F)。进一步分析了阿可拉定处理后的肝细胞癌凋亡表型发现阿可拉定可显著增加HCC细胞凋亡,Western blotting检测发现cleaved caspase3上调(图1I-J)。此外,经阿可拉定处理后肝癌细胞内的自噬标记物增加,观察到LC3-Ⅱ向线粒体转位,提示阿可拉定诱导自噬/线粒体自噬(图1K和图3E)。因此,阿可拉定能有效抑制肝癌细胞的生长、增殖和迁移。
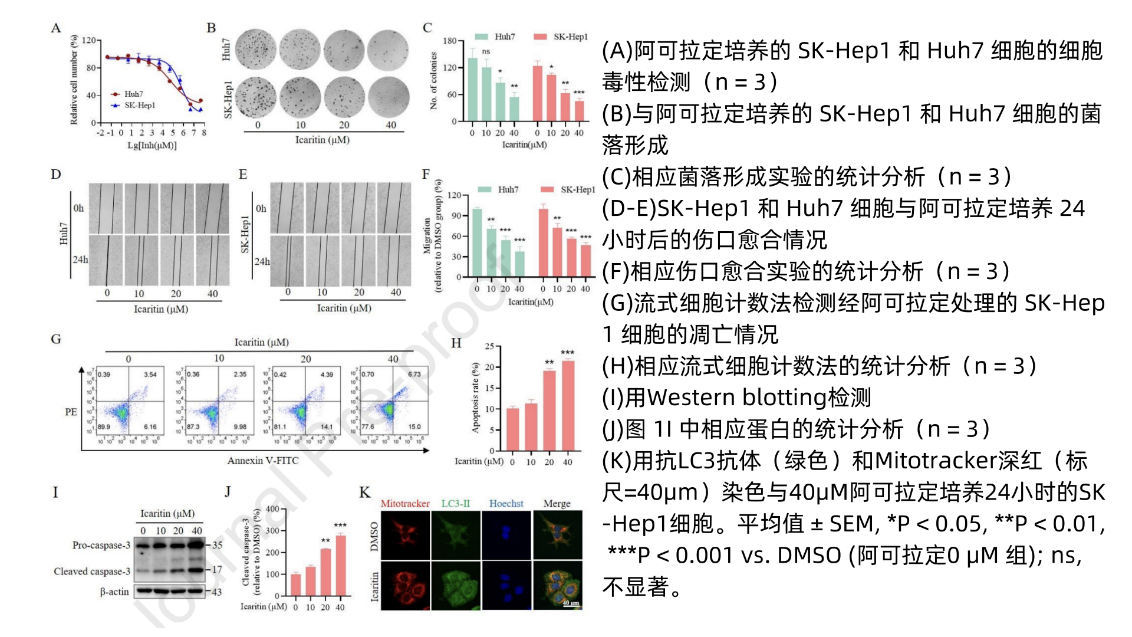
图1 阿可拉定通过促进细胞凋亡抑制HCC细胞的生长增殖和迁移
细究:阿可拉定破坏线粒体稳态,ROS诱导自噬/线粒体自噬
自噬和细胞凋亡的抑癌作用广受认可,前述结果再次显示阿可拉定能有效抑制HCC细胞的生长、增殖和迁移,同时存在调节自噬/线粒体自噬作用。该发现与既往研究中阿可拉定通过调节自噬和细胞凋亡发挥抑癌作用一致4-6。为了探索阿可拉定诱导HCC治疗后自噬-凋亡串扰的机制,通过蛋白质组学在细胞水平上研究了阿可拉定对蛋白质表达的整体影响。结果显示,阿可拉定处理后差异表达蛋白质(DEPs)数量呈剂量依赖性增加(图2A-B)。阿可拉定40μM组DEPs的基因本体(GO)富集显示,线粒体凋亡和自噬相关的通路均被激活(图2C),线粒体凋亡和自噬标志物表达也发生改变(图2D-E)。Western blotting进一步验证了阿可拉定在HCC细胞中诱导了更多的cleaved caspase-3、LC3-Ⅱ和ATG7表达(图1I-J、图2F-G、图3C-D、图5),从而进一步证实了阿可拉定诱导线粒体凋亡和自噬/线粒体自噬机从而抑制HCC细胞生长。
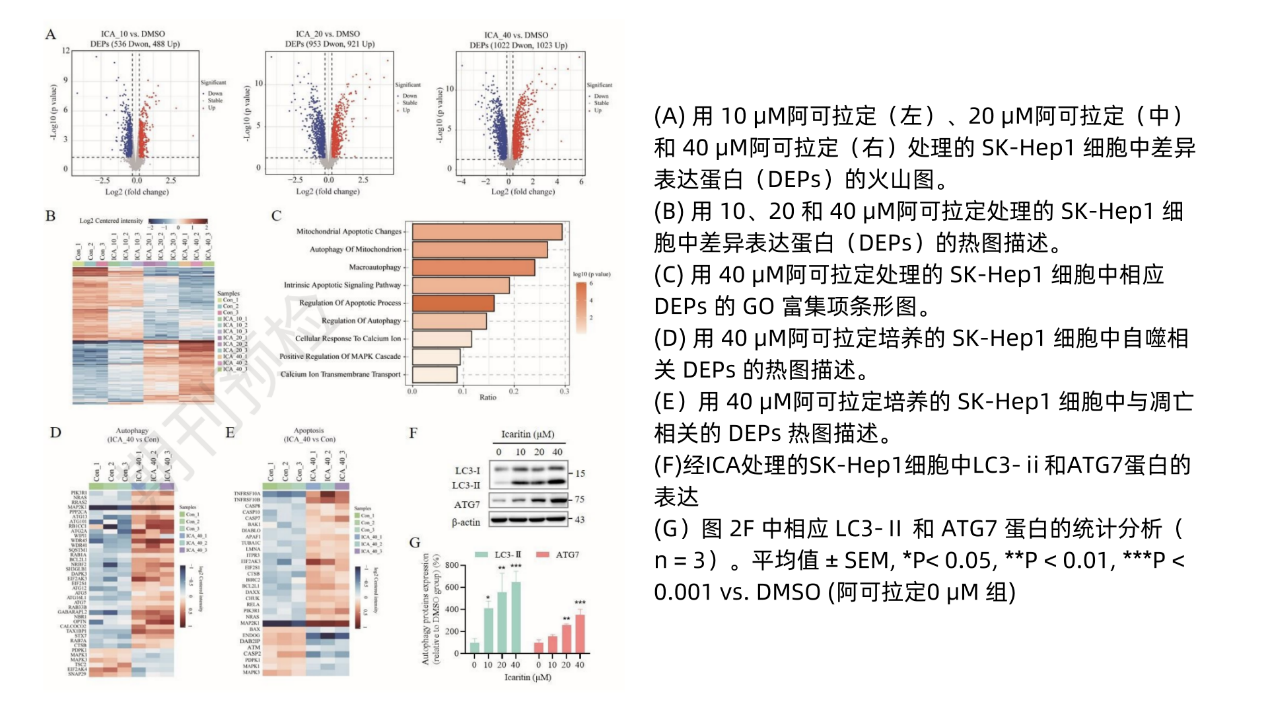
图2 阿可拉定促进HCC细胞线粒体凋亡和自噬
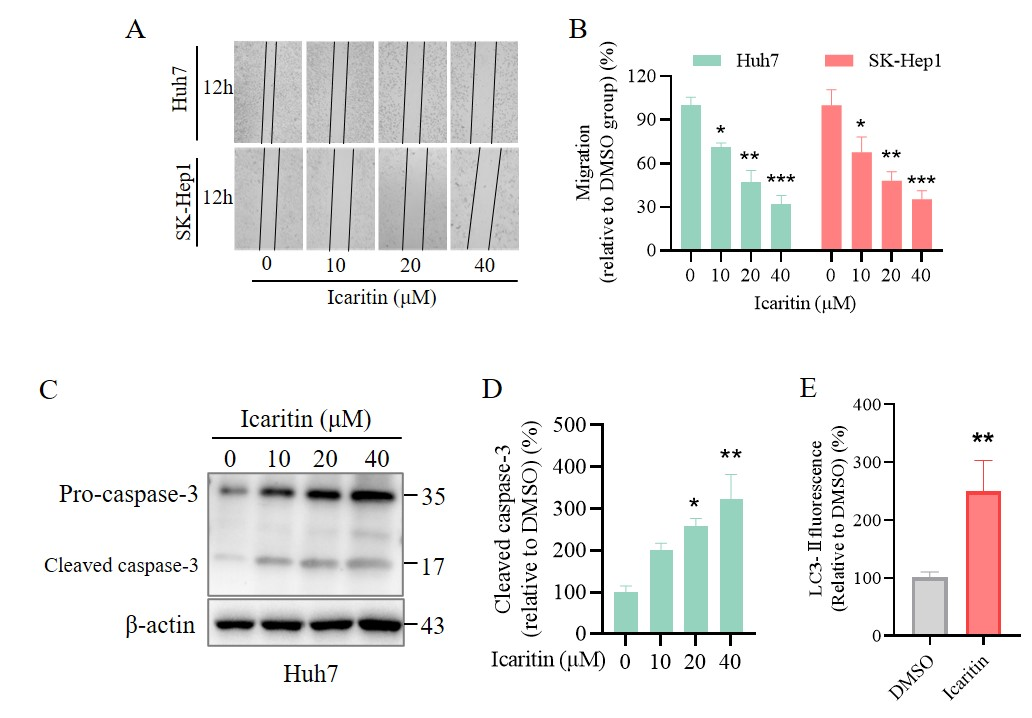
(A) 阿克拉定培养Huh7 和 SK-Hep1 12h 伤口愈合状况
(B) 相应伤口愈合试验的统计分析 (n = 3).
(C) 阿克拉定培养Huh7 24h,Western blotting检测 caspase-3蛋白表达
(D) 图2I的cleaved caspase-3蛋白相应统计分析 (n = 3).
(E) 图2K LC3-Ⅱ 的荧光强度定量分析 (n = 3).
平均值 ± SEM. *P < 0.05, **P < 0.01, ***P < 0.001 vs. DMSO (阿可拉定0 μM 组)
图3. 阿可拉定抑制HCC迁移
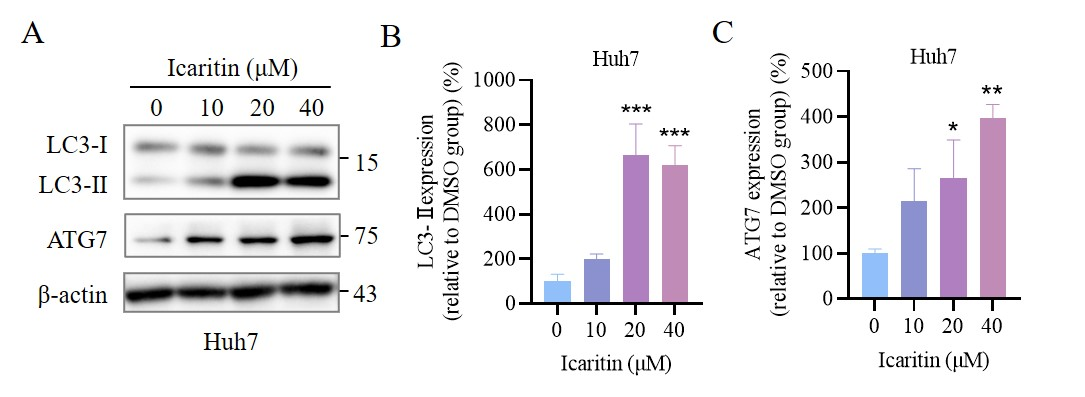
(A) Western blotting 检测阿可拉定培养Huh7细胞的 LC3 and ATG7蛋白表达
(B-C) Western blotting 检测的相应定量分析 (n = 3).
中位值 ± SEM. *P < 0.05, **P < 0.01, ***P < 0.001 vs. DMSO (阿可拉定0 μM 组)
图4 阿可拉定诱导HCC细胞线粒体凋亡和自噬
究其机制,活性氧(ROS)过度积累可能导致氧化应激损伤并诱导自噬/线粒体自噬,而线粒体损伤是细胞内产生ROS的主要原因。研究显示,DMSO组线粒体呈管状结构,而阿可拉定组线粒体形成点状结构,表明线粒体存在分裂和破碎(图5A),电镜观察证实了线粒体网络破坏(图5B)。阿可拉定处理后线粒体膜电位明显受损(图5C),表明其使线粒体去极化。同样,流式细胞术检测到阿可拉定处理导致单体数量增加,FITC荧光强度增强,红色荧光强度降低(图5D-E),表明线粒体膜结构破坏。MitoSOX染色结果清晰表明,阿可拉定增强了mtROS的产生(图5F)。此外,显微镜下ROS染色显示,在阿可拉定影响下,细胞内总体ROS水平提升,且与mtROS正相关(图6G)。由此可见,阿可拉定引起线粒体损伤,提升mtROS和ROS水平,从而诱导自噬/线粒体自噬。这些发现表明阿可拉定可以诱导线粒体功能障碍和mtROS产生。
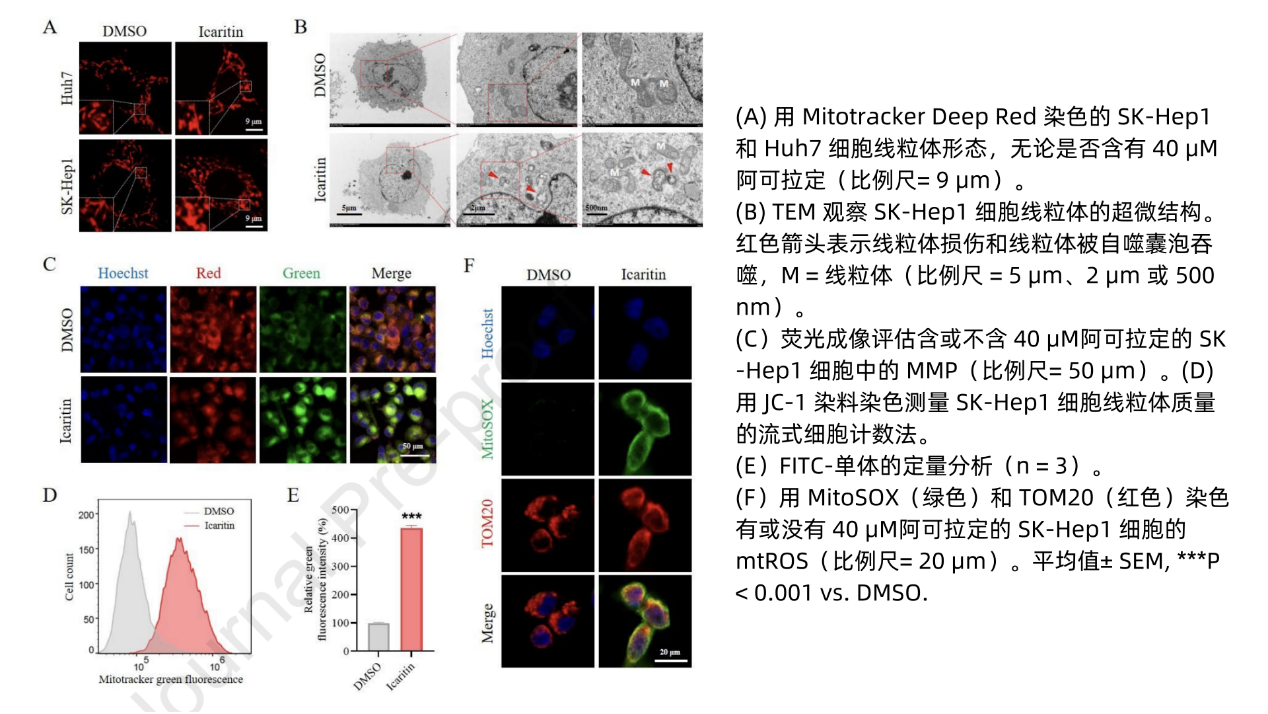
图5 阿可拉定导致HCC细胞线粒体功能障碍和ROS生成
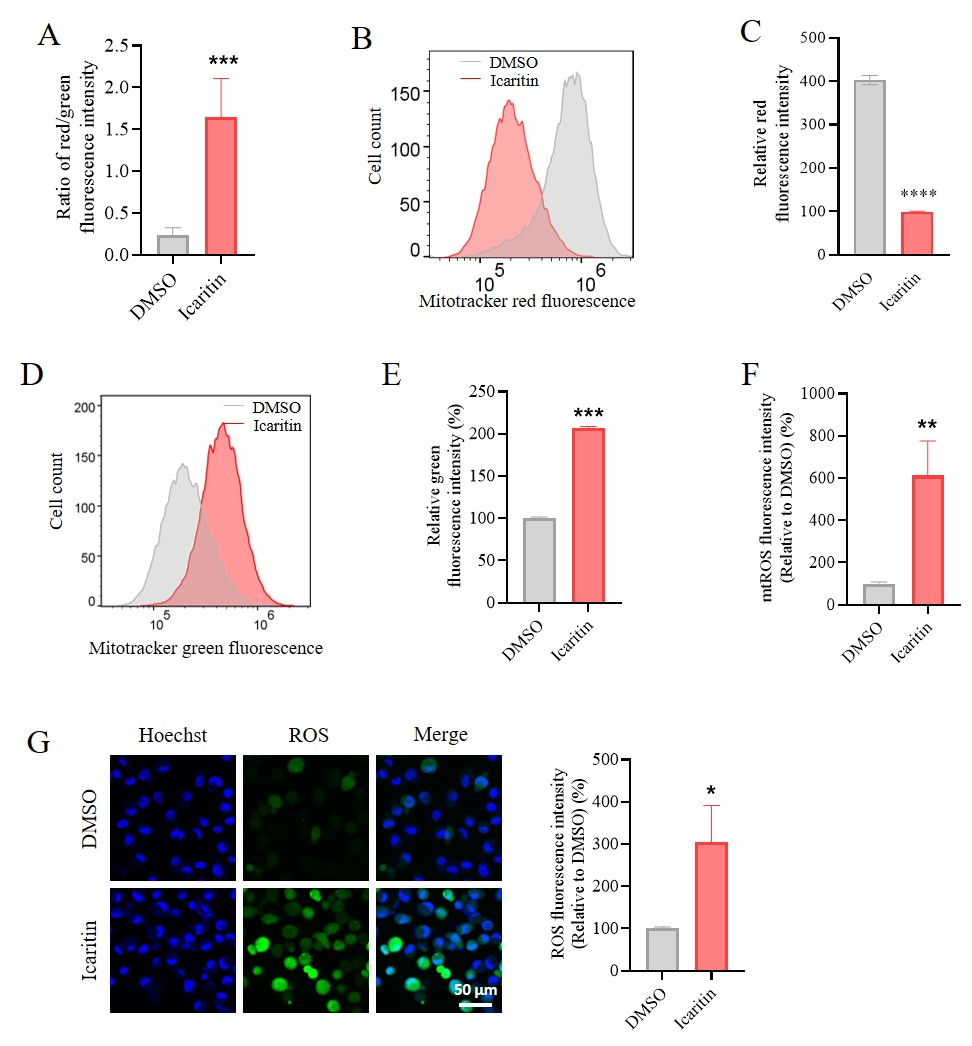
(A) 图6C红色聚集体/FITC单体荧光强度定量分析
(B) 流式细胞术测定SK-Hep1 细胞中JC-1 染色的线粒体质量
(C) 图7B FITC 单体定量分析 (n = 3)
(D) 流式细胞术检测Huh7细胞中JC-1 染色的线粒体质量
(E) 图7D FITC 单体定量分析 (n = 3)
(F) 图6F中阿可拉定诱导的mtROS (n = 3).
(G) ROS染色观察阿可拉定对肿瘤细胞整体ROS水平影响ROS (比例尺 = 50 μm)
中位值 ± SEM. *P < 0.05, **P < 0.01, ***P < 0.001 vs. DMSO (阿可拉定0 μM 组)
图6 阿可拉定诱导HCC细胞线粒体损伤
启迪:打破线粒体自噬-细胞凋亡串扰,联合自噬/线粒体自噬抑制剂协同增效
在阿可拉定对线粒体自噬的调节作用方面:研究者发现阿可拉定可诱导线粒体自噬使MFN1、MFN2、TOM20、HSP60、TiM23等线粒体蛋白降解(图7A-G),且与时间有关(图7H-J),确证了线粒体自噬的存在,与既往研究表现一致。此外,阿可拉定还可使PINK1诱导的Parkin UBL泛素(pSer65-Ub)水平提升,进而辅助线粒体募集自噬受体,促进线粒体自噬。可见阿可拉定某种程度上可作为线粒体自噬诱导剂。

图7 阿可拉定诱导线粒体蛋白降解
阿可拉定诱导线粒体自噬依赖于PINK/Parkin信号通路,在敲除调控线粒体自噬的PINK1/Parkin基因(图8B-C)后,阿可拉定诱导的线粒体蛋白降解受到阻碍(图8D-G)印证了该观点。
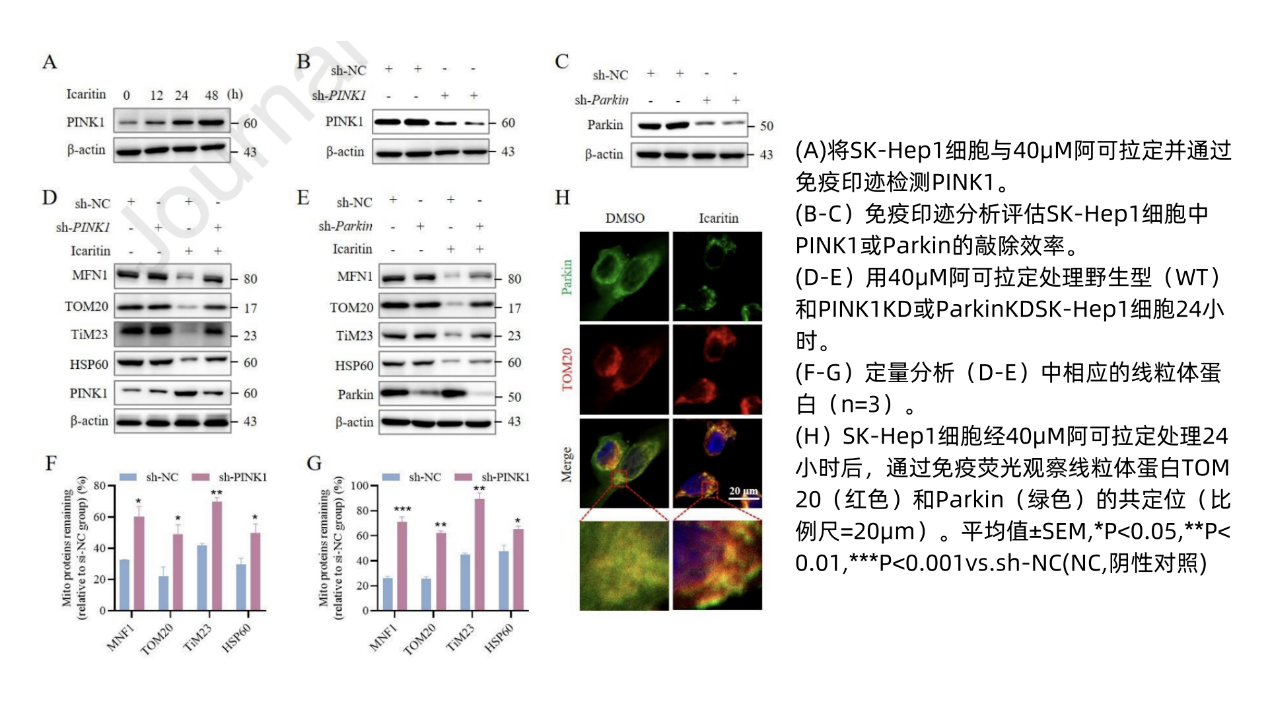
图8 阿可拉定通过PINK1/Parkin通路诱导线粒体自噬
与敲除PINK1/Parkin基因类似,引入自噬/线粒体自噬抑制剂HCQ和/或Wort同样可以逆转阿可拉定诱导的LC3-Ⅱ水平升高和线粒体蛋白降解现象。异种移植模型中对阿可拉定联合自噬/线粒体自噬抑制剂(Wort和/或HCQ)抑制肿瘤生长予以验证(图9D),显示联合治疗较阿可拉定单药更显著地抑制肿瘤生长(图9F-H),增强肿瘤坏死,降低肿瘤细胞Ki-67(图9I),其Caspase-3的显著上调和激活表明了线粒体凋亡的增强(图9I-J),从而在动物模型中证实了阿可拉定与自噬/线粒体自噬抑制剂的协同增效作用。
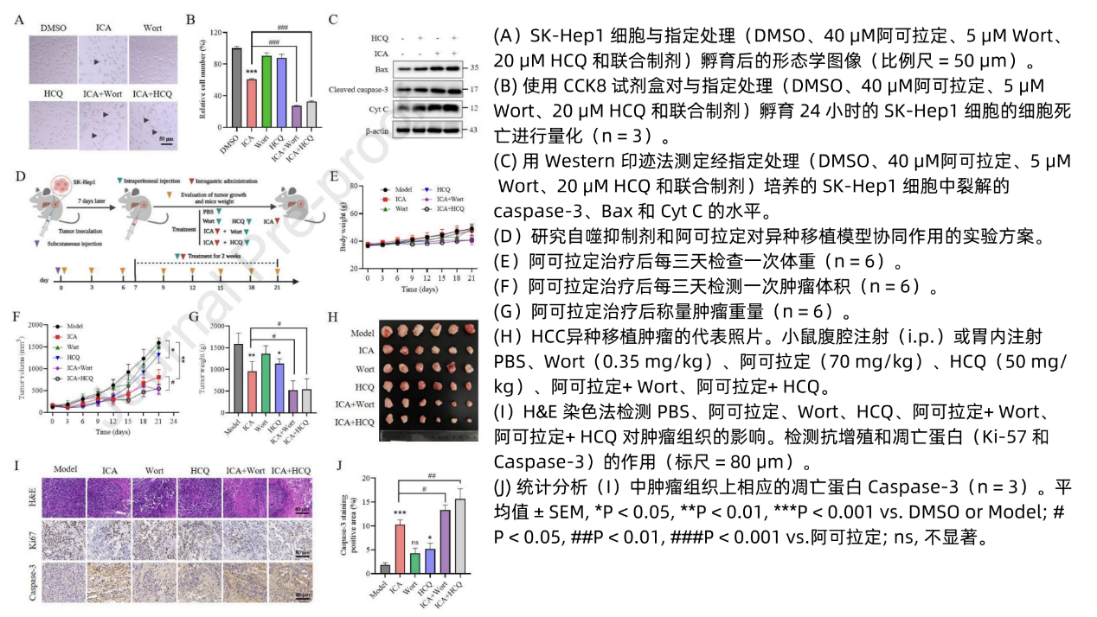
图9 自噬抑制剂增强了阿可拉定的抗癌功效
论道HCC,靶向自噬/线粒体自噬引领研发策略
目前我国已批准阿可拉定用于治疗HCC,并有更多相关临床研究正在开发中。本次研究在再次确证阿可拉定对HCC抑制作用的基础上,进一步剖析了其诱导线粒体自噬-细胞凋亡的具体抗癌作用。阿可拉定使线粒体紊乱、产生mtROS导致自噬/线粒体自噬存在,并通过PINK1/Parkin通路促进线粒体自噬发生。因此,通过敲除PINK1/Parkin可降低线粒体自噬作用,并显著促进阿可拉定诱导的HCC细胞死亡和凋亡;与之类似,联合应用自噬/线粒体自噬抑制剂也可以提升阿可拉定抗癌效果,从而打破线粒体自噬-细胞凋亡串扰,提示了靶向自噬/线粒体自噬是对抗肿瘤细胞耐药性、增强抗癌疗效的新方法。
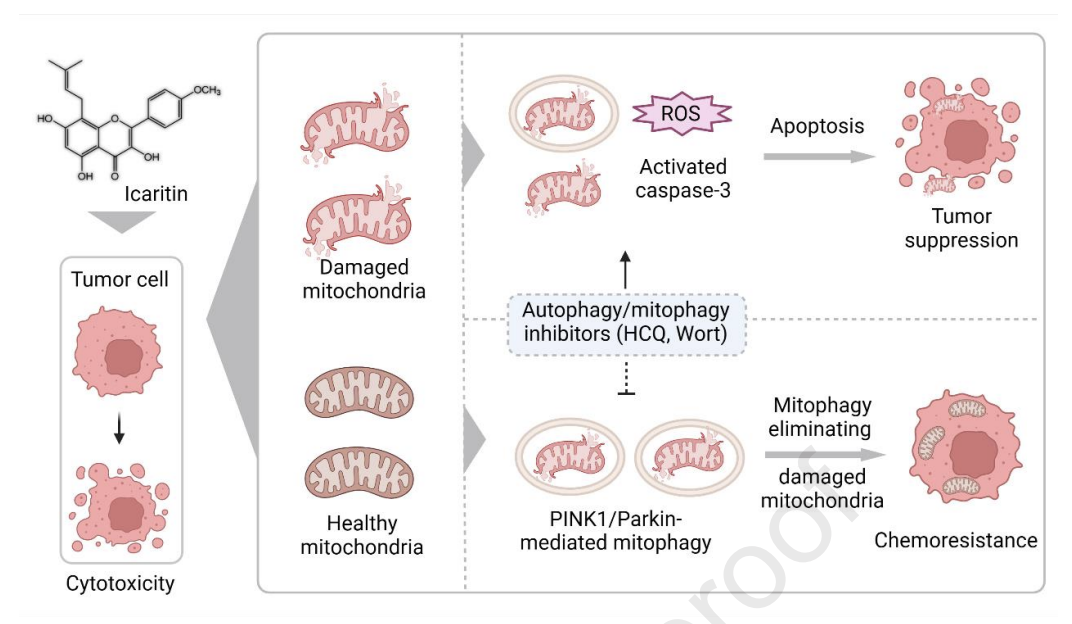
图10 研究摘要图:在HCC中,阿可拉定与自噬/线粒体自噬抑制剂通过PINK1/Parkin通路协同增强抗癌疗效和凋亡效应
排版编辑:Jessica
【1】 Luo P, An Y, He J, et al. Icaritin with autophagy/mitophagy inhibitors synergistically enhances anticancer efficacy and apoptotic effects through PINK1/Parkin-mediated mitophagy in hepatocellular carcinoma. Cancer Lett. Published online January 17, 2024.
【2】Zheng RS, Zhang SW, Sun KX, et al. Zhonghua Zhong Liu Za Zhi. 2023;45(3):212-220.
【3】 SNG1705 ICR-1研究. CSC0 2021 Keynote Speech.
【4】Yu Z, Guo J, Hu M, Gao Y, Huang L. Icaritin Exacerbates Mitophagy and Synergizes with Doxorubicin to Induce Immunogenic Cell Death in Hepatocellular Carcinoma. ACS nano 2020;14:4816-28
【5】Zhou C, Gu J, Zhang G, Dong D, Yang Q, Chen MB, et al. AMPK-autophagy inhibition sensitizes icaritin-induced anti-colorectal cancer cell activity. Oncotarget 2017;8:14736-47.
【6】 Pan XW, Li L, Huang Y, Huang H, Xu DF, Gao Y, et al. Icaritin acts synergistically with epirubicin to suppress bladder cancer growth through inhibition of autophagy. Oncology reports 2016;35:334-42
【7】 Harper JW, Ordureau A, Heo JM. Building and decoding ubiquitin chains for mitophagy. Nature reviews Molecular cell biology 2018;19:93-108
【8】 Degenhardt K, Mathew R, Beaudoin B, Bray K, Anderson D, Chen G, et al. Autophagy promotes tumor cell survival and restricts necrosis, inflammation, and tumorigenesis. Cancer cell 2006;10:51-64.
【9】 Li L, Tan J, Miao Y, Lei P, Zhang Q. ROS and Autophagy: Interactions and Molecular Regulatory Mechanisms. Cellular and molecular neurobiology 2015;35:615-21.
【10】 Onishi M, Yamano K. Molecular mechanisms and physiological functions of mitophagy. The EMBO journal 2021;40:e104705.











 苏公网安备32059002004080号
苏公网安备32059002004080号


