经典霍奇金淋巴瘤(cHL)是一种相对罕见的淋巴系统恶性肿瘤亚型,早期cHL患者具有较高的治愈率和良好的生存率。然而,传统治疗会带来比较严重的长期毒性,如心脏毒性和继发性恶性肿瘤等。因此,许多大型临床试验致力于探讨具有相同疗效的新型治疗策略,同时能减少早期cHL治疗相关的毒性。近期,中山大学肿瘤防治中心李志铭教授团队在Annals of Hematology期刊发表了一项真实世界研究[1],探讨了真实世界中替雷利珠单抗单药治疗未经治早期cHL患者的疗效和安全性。该研究结果显示,替雷利珠单抗单药治疗在早期未经治cHL患者产生了理想的疗效和安全性。本文特将相关内容精编整理,以供学习。

研究目的
回顾真实世界数据,分析替雷利珠单抗单药一线治疗cHL早期患者在真实世界中的疗效和安全性。
研究方法
该研究为单中心、真实世界的回顾性研究。通过筛选2020年1月至2022年12月在本中心接受治疗的所有cHL患者,纳入Ia-IIb期接受替雷单药一线治疗的cHL病理确诊患者。患者多出于对血液系统毒性、继发恶性肿瘤、不孕、心血管疾病、身体状况不佳或个人意愿的考虑,最终决定接受替雷利珠单抗单药治疗。本试验经过伦理批准(B2023-412-01),从每例患者获得了书面知情同意。
治疗开始前制定治疗策略,纳入的所有患者均接受替雷利珠单抗单药治疗,3周/次,固定剂量200mg,30min内静脉滴注,至少给药4次。对诱导治疗有效的患者进行受累野放疗(IFRT)。对替雷利珠单抗单药治疗未达完全缓解(CR)的部分患者选择性予以化疗,化疗方案由医师决定。采用PET-CT确定肿瘤分期,Lugano 2014标准评价疗效,德国霍奇金研究组(GHSG)标准评价预后,CTCAE-V5.0评价AE。
使用中位数、频率和百分比描述连续变量和分类变量。采用χ2检验分析临床特征与EOTM-CR的关系,并将有统计学意义的变量(P<0.05)进一步纳入Logistic cox多因素分析。通过Kaplan-Meier方法计算和估算PFS和OS。
研究结果
该研究共纳入23例早期(Ia-IIb)初治cHL患者,中位年龄29岁,ECOG-1分11例(47.8%),预后不良13例(56.5%),结节性硬化是最常见的病理类型(15例,65.2%),其他基线特征详见表1。
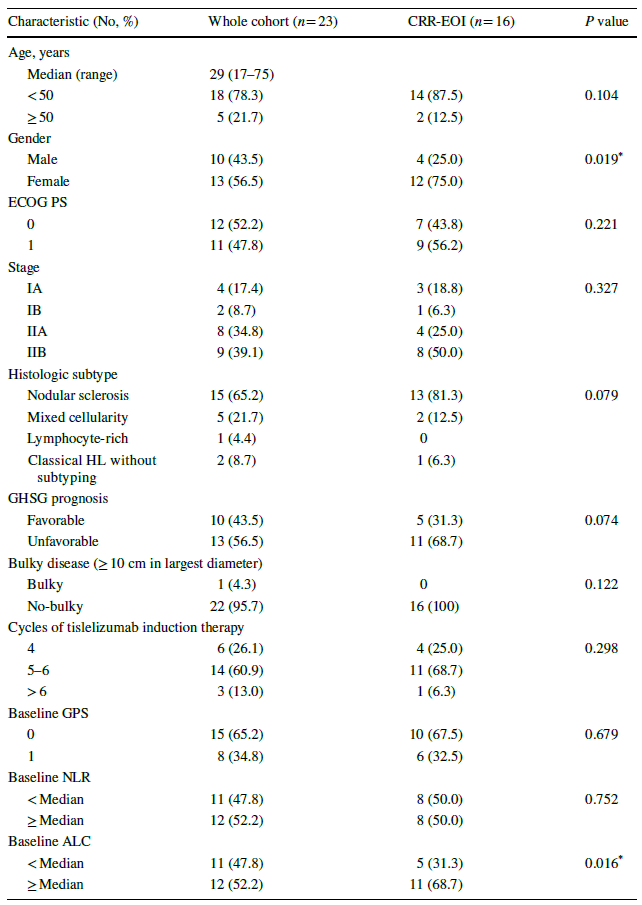
表1 患者基线及疾病特征
替雷利珠单抗单药治疗的中位6周期(4~10周期),给药2剂后进行PET-CT扫描(PET-2),11/23(47.8%)例患者已达到CR。替雷利珠单抗单药治疗结束时(EOTM),22/23(95.7%)例患者达到客观缓解,其中16(69.6%)例CR,6(26.1%)例部分缓解(PR)。在16例EOTM-CR患者中,12例最终接受了IFRT,4例因个人原因拒绝放疗。在6例EOTM-PR患者中,2例接受4周期ABVD方案化疗后行IFRT, 1例接受4周期替雷利珠单抗+AVD方案化疗后行IFRT,其余3例仅接受IFRT,未行其他系统治疗。1例PET-2评估为疾病稳定(SD)的患者在接受4周期替雷利珠单抗治疗后出现疾病进展(PD),随后接受4周期ABVD方案化疗并接受IFRT。本研究中所有患者在治疗结束时均获得CR(图1)。
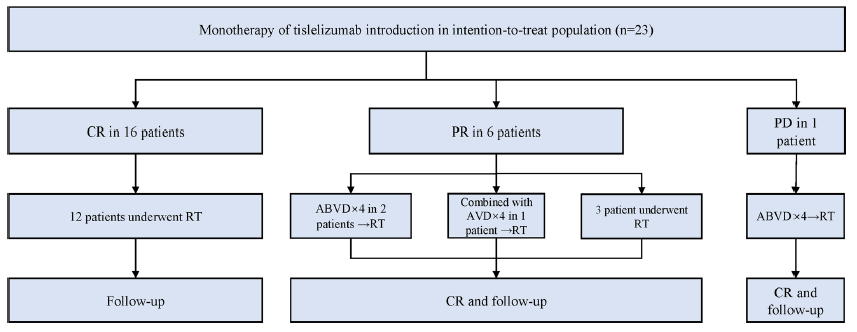 图1 研究流程图
图1 研究流程图
中位随访时间21.3个月(6.9~32.7个月),所有患者均存活。全组患者的中位OS和PFS均未达到。预计2年PFS率和2年OS率分别为95.65%和100%(图2)。在预后不良亚组中,2年PFS率和2年OS率均为100%。
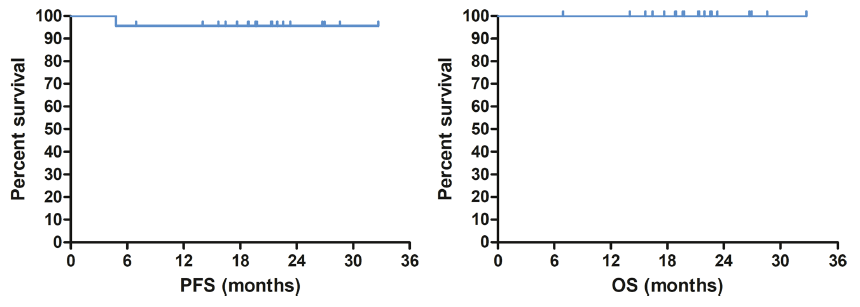
图2 预计2年PFS和OS
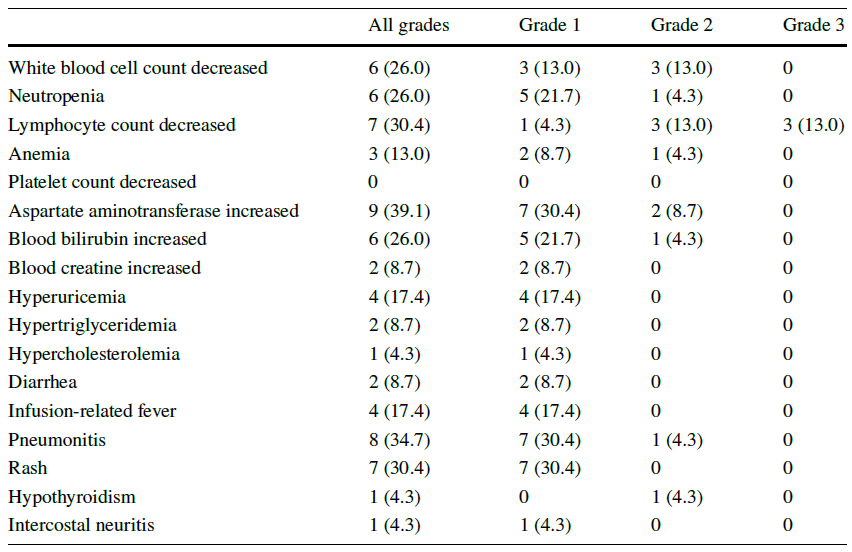
所有治疗相关的不良事件(TRAE)均被记录,详见表2。最常见的TRAEs(≥30%)是天冬氨酸转氨酶升高(39.1%)、肺炎(34.7%),淋巴细胞计数减少(30.4%)和皮疹(30.4%)。3例(13.0%)患者出现3级淋巴细胞计数下降,但无症状。除淋巴细胞计数下降外,未观察到其他3/4级TRAE。此外,无严重AE报告。
表2 不良反应
预后不良亚组中,PET-2时CR率为53.8%,EOTM时CR率为84.6%。在EOTM-CR患者中,女性显著高于男性(92.3% vs. 40%,P=0.019)。根据淋巴细胞绝对计数(ALC)的中位数分组,高ALC组EOTM-CR比例明显高于低ALC组(91.7% vs. 45.5%,P=0.016)。按性别分组计算ALC平均值,女性患者的平均ALC高于男性(1.63±0.55×109/L vs. 1.43±0.56×109/L,P=0.852)。在Logistic cox多因素分析中,性别和ALC均被确定为EOTM-CR的独立显著预测因素(表3)。因此,根据性别和基线ALC划分EOTM-CR亚组(图3),基线ALC高的女性患者EOTM-CR最好(100%),而基线ALC低的男性患者EOTM-CR最差(16.7%)。
表3 多因素分析EOTM-CR预测因子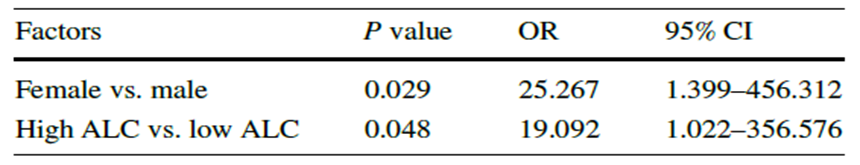
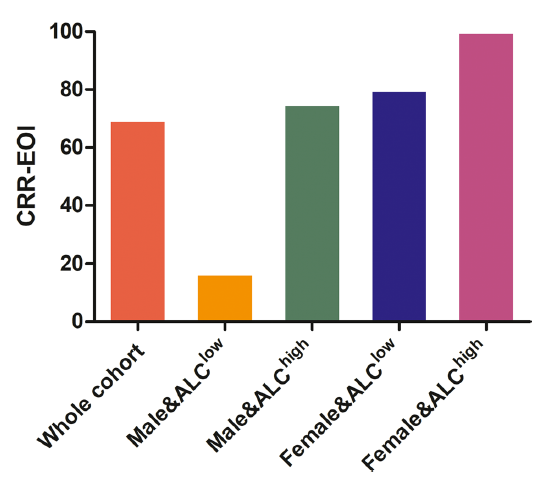
图3 按性别和ALC分组观察治疗结束时的完全缓解率
讨论
作为R/R cHL的突破性治疗,抗PD-1抗体单药治疗在一线cHL中也表现出显著疗效。然而,目前仅有3项前瞻性研究,数据仍有限,真实世界研究的数据也不足[2-4, 7]。据我们所知,这是迄今为止第一项研究替雷利珠单药一线治疗早期cHL的真实世界研究,表明替雷利珠单药治疗早期cHL初治患者可使肿瘤迅速缩小,可能是一种有效且安全的治疗方案。
该研究在接受两剂替雷利珠单抗治疗后扫描PET-CT评估疗效,CRR为46.8%,与既往数据相当[4,7]。在替雷利珠单抗单药治疗结束时,CRR上升至69.6%,所有参与者在治疗结束时均达到CR(100%)。该研究初治患者的EOTM-CR与既往R/R cHL的EOTM-CR一致(69.6% vs. 67.1%)[5,6]。该研究纳入了GHSG预后不良患者(13例,56.5%),同时也纳入了年龄> 60岁的老年患者。早期预后不良患者PET-2和EOTM的CRR分别为53.8%和84.6%,2年PFS率和OS率均为100%。该研究与NU16H08试验[4]和NIVAHL试验[3,7]相比,替雷利珠单抗的单药治疗缓解率似乎高于帕博利珠单抗和纳武利尤单抗。
为了最大限度地降低延迟化疗和疾病进展风险,可在前瞻性试验中设计短疗程抗PD-1抗体单药治疗。在我们的真实世界研究中,替雷利珠单抗单药治疗的中位6周期,73.9%患者接受了超过4剂治疗,部分原因是受到COVID-19大流行的影响。所有Non-EOTM-CR患者经过全部疗程后,最终均达到了持续CR,这与既往试验相似[4,7]。最终有15例患者接受了替雷利珠单抗单药治疗和IFRT的“无化疗治疗方案”,4例患者接受了替雷利珠单抗单药治疗的“无化放疗治疗方案”。中位随访21.3个月,所有患者均生存,体力状态良好。将来无化疗和无放疗的方法可否扩大到更大范围的患者,这是本研究提出的一个有意义的问题,希望在未来前瞻性研究中加以解决。
化疗和放疗的综合治疗(CMT)一直被认为是早期cHL的标准治疗。尽管CMT或化疗在一线治疗中具有较高的缓解率和长期生存,但存在明显毒性,包括严重的骨髓抑制、心血管疾病、心功能障碍、不孕和继发性恶性肿瘤等。因此,如何在cHL患者中研发出一种新型持续缓解和最小毒性的疗法,一直是近些年重要的研究课题。多项研究已探讨了中期PET-CT指导下的化/放疗降阶梯策略的应用价值,并且该治疗模式已被推荐用于治疗某些cHL患者[8-10]。新型生物制剂可与常规疗法结合以避免巩固性放疗,也可尝试作为早期cHL的无化疗和无放疗方案。与大多数早期cHL放/化疗研究不同,本研究的治疗相关不良反应轻微,可耐受。绝大多数事件为1级或2级,未因毒性事件而停药。本研究中的患者TRAE谱与既往R/R cHL研究基本一致。
另外,该研究各亚组缓解率总体一致。在女性和基线ALC高的患者中观察到较高的EOTM-CR,但未发现大肿块或GHSG预后与EOTM-CR相关。女性和基线ALC高均是晚期cHL的良好预后因素,但均未报道对抗PD-1抗体在cHL中的治疗作用产生影响[11]。该研究根据Lugano 2014标准,通过PET-CT扫描确定缓解。由于PET-2时未出现PD,Lugano标准和LYRIC标准在该研究疗效评价的差异可忽略不计。
当然,该研究仍存在一些局限性。首先,基于单中心、小样本回顾性分析不可避免地给统计结果带来了选择偏倚。其次,替雷利珠单抗剂量疗程和挽救性化疗方案存在显著异质性。第三,研究者没有进一步收集和探索分子生物标志物。最后,该研究随访时间相对较短,远期疗效和治疗潜力有待进一步观察。
总体而言,该研究结果显示替雷利珠单抗单药治疗对早期cHL初治患者安全有效。EOTM-CR达到69.9%,2年OS达到100%。安全性方面,毒性较小,没有报告4级TRAE。亚组分析显示,性别和基线ALC水平对替雷利珠单抗单药治疗cHL的潜在预测作用有待进一步探讨。该研究结果支持进一步评估抗PD-1抗体单药治疗的应用价值,以及探索早期cHL的无化疗和无放疗治疗策略。
中山大学肿瘤防治中心内科
广东省抗癌协会淋巴瘤专业委员会主任委员
广东省临床医学学会头颈肿瘤综合治疗专业委员会主任委员
广东省抗癌协会血液肿瘤专业委员会候任主任委员
中国临床肿瘤学会(CSCO)抗淋巴瘤联盟副秘书长、常委
中国抗癌协会淋巴瘤专业委员会常委
中国老年保健协会淋巴瘤专业委员会秘书长、常委
中国临床肿瘤学会(CSCO)头颈肿瘤专家委员会常委
中国抗癌协会青年理事会常务理事
中国医药教育协会淋巴瘤分会常委
中国抗癌协会神经肿瘤专业委员会中枢神经系统淋巴瘤学组副组长
广东省中西医结合学会肿瘤免疫专业委员会副主任委员
广东省健康管理学会生育力保护专业委员会副主任委员
广东省抗癌协会化疗专业委员会常委
广东省临床医学学会咽喉肿瘤专业委员会常委
广东省精准医学应用学会淋巴瘤分会常委
广东省抗癌协会鼻咽癌专业委员会委员
广州抗癌协会淋巴瘤专业委员会副主任委员
1. Peng S, Hang Y, Yu W, et al. Tislelizumab monotherapy in patients with previously untreated early-stage classical Hodgkin lymphoma: a real-world study. Ann Hematol. 2023 Nov 13. doi: 10.1007/s00277-023-05541-7.
2. Ramchandren R, Domingo-Domènech E, Rueda A, et al. Nivolumab for newly diagnosed advanced-stage classic Hodgkin lymphoma: safety and efficacy in the phase II CheckMate 205 Study. J Clin Oncol. 2019. 37:1997–2007. doi.org/10.1200/JCO.19.00315
3. Bröckelmann PJ, Bühnen I, Meissner J, et al. Nivolumab and doxorubicin, vinblastine, and dacarbazine in early-stage unfavorable Hodgkin lymphoma: final analysis of the randomized German Hodgkin study group phase II NIVAHL trial. J Clin Oncol. 2023. 41:1193–1199. doi.org/10.1200/JCO.22.02355
4. Allen PB, Savas H, Evens AM, et al. Pembrolizumab followed by AVD in untreated early unfavorable and advanced-stage classical Hodgkin lymphoma. Blood. 2021. 137:1318–1326. doi.org/10.1182/blood.2020007400
5. Song Y, Gao Q, Zhang H, et al. Tislelizumab for relapsed/refractory classical Hodgkin lymphoma: 3-year follow-up and correlative biomarker analysis. Clin Cancer Res. 2022. 28:1147–1156. doi.org/10.1158/1078-0432.CCR-21-2023
6. Song Y, Gao Q, Zhang H, et al. Treatment of relapsed or refractory classical Hodgkin lymphoma with the anti-PD-1, tislelizumab: results of a phase 2, single-arm, multicenter study. Leukemia. 2020. 34:533–542. https://doi.org/10.1038/s41375-019-0545-2
7. Bröckelmann PJ, Goergen H, Keller U, et al. Efficacy of nivolumab and AVD in early-stage unfavorable classic Hodgkin lymphoma: the randomized phase 2 German Hodgkin study group NIVAHL trial. 2020.
8. Hanel W, Herrera AF, Epperla N. Management of classical Hodgkin lymphoma: a look at up to date evidence and current treatment approaches. Exp Hematol Oncol. 2022. 11:108. doi.org/10.1186/s40164-022-00360-4
9. Fuchs M, Goergen H, Kobe C, et al. Positron emission tomography-guided treatment in early-stage favorable Hodgkin lymphoma: final results of the international, randomized phase III HD16 trial by the German Hodgkin study group. J Clin Oncol. 2019. 37:2835–2845. doi.org/10.1200/JCO.19.00964
10. Radford J, Illidge T, Counsell N, et al. Results of a trial of PET-directed therapy for early-stage Hodgkin’s lymphoma. N Engl J Med. 2015. 372:1598-1607.
doi.org/10.1056/NEJMoa1408 648
11. Li Y, Sun H, Yan Y, et al. Long-term survival rates of patients with stage III-IV Hodgkin lymphoma according to age, sex, race, and socioeconomic status, 1984-2013. Oncologist. 2018. 23:1328–1336. doi.org/10.1634/theoncologist.2017-0541
排版编辑:gunagli











 苏公网安备32059002004080号
苏公网安备32059002004080号


