↑关注专栏,更新不错过
35Club—《文献下午茶》,与您相约在轻松的下午茶时光中,解锁医学经典,启迪科研思路。
12月25-1月7日文献下午茶共更新3篇肺癌领域经典及最新文献解读。让我们一起来回顾都有哪些精彩内容。
解读文献(来源:J Clin Oncol )
Adjuvant Osimertinib for Resected EGFR-Mutated Stage IB-IIIA Non-Small-Cell Lung Cancer: Updated Results From the Phase III Randomized ADAURA Trial
奥希替尼辅助治疗EGFR突变IB-IIIA期NSCLC:III期随机试验ADAURA研究最新结果
解读嘉宾
河南省肿瘤医院-张国伟教授
(第一届35under35优秀青年肿瘤医生)
观点
2020年,ADAURA研究的期中分析结果公布,显示了奥希替尼辅助治疗在DFS上的压倒性优势(主要终点II-IIIA期人群中 DFS HR 0.17; 99.06% CI, 0.11 to 0.26; P<0.001。奥希替尼组与安慰剂组中位DFS分别为未达到和19.6个月,2年DFS率分别为90%和44% IB-IIIA人群中DFS HR 0.20; 99.12% CI, 0.14 to 0.30; P<0.001。中位DFS分别为未达到和27.5个月,2年DFS率分别为89%和52%)。正式将EGFR突变型肺癌的靶向治疗推进到了术后辅助阶段。
2023年1月,JCO发表了ADAURA研究的数据更新(由于在上次期中分析中已达到了统计学显著性,本次并非正式的统计学检验,因此未报告P值),II-IIIA期DFS HR 0.23(95% CI, 0.18 ~ 0.30),中位DFS分别为65.8个月和21.9个月,4年DFS率分别为70%和29%;IB-IIIA期DFS HR 0.27(95% CI, 0.21 ~ 0.34),中位DFS分别为65.8个月和28.1个月,4年DFS率分别为73%和38%。
2023年6月,ADAURA研究又发表了其最终OS数据。两组中位OS均未达到,II-IIIA期患者5年OS率分别为85% vs 73%,HR 0.49(95% CI, 0.33 ~ 0.73),p<0.001;IB-IIIA期患者5年OS率分别为88% vs 78%,HR 0.49(95% CI, 0.34 ~ 0.70),p<0.001。虽然ADAURA研究并未以OS为主要终点,但是进行了序贯统计学检验的设计,以OS作为序贯检验的最后一环,本次分析已经达到了预设的统计学边界(<0.0497)。这应该是我们在NSCLC术后辅助EGFR-TKI领域拿到的第一个有统计学意义的III期临床试验OS阳性结果(既往只有EVAN研究OS阳性,但它是一项只入组了IIIA期患者的II期研究,并且OS只是探索性结果)。综上,ADAURA研究模式在辅助治疗中的地位应该已经牢不可破。但它还是留给了我们一些思考:
1、 ADAURA研究的试验设计与其他EGFR-TKI术后辅助治疗临床试验设计不同,不是用TKI直接对比辅助化疗,而是TKI与安慰剂的对照,它是以下两种情况的结合(1)适合并且愿意接受辅助化疗的患者,辅助化疗后奥希替尼vs安慰剂;(2)不适合或不愿意接受辅助化疗的患者,直接奥希替尼vs安慰剂。所以我们得到的结论应该是:适合并且愿意接受辅助化疗的患者,辅助化疗后进行奥希替尼治疗;不适合或不愿意接受辅助化疗的患者,至少可以接受奥希替尼的辅助治疗。而仍然存疑的问题是:ADAURA研究的生存获益,究竟是来自于TKI代际之间的差异?还是来自于允许化疗之后TKI的试验设计?假如进行一项奥希替尼直接对照辅助化疗的临床试验,结果是否依旧?
2、 虽然OS已经得到了阳性结果,但是,从三年间DFS曲线的变化我们看到(下图1为2020年DFS,图2为2023年DFS),在本次数据更新后,DFS呈现出了像以往所有EGFR-TKI辅助治疗一样的纺锤形,也就是在3年的节点之后,即奥希替尼停药以后,奥希替尼组的DFS获益似乎在逐渐减弱。如果再经过足够长时间的随访,OS曲线是否会出现同样的变化(目前OS的成熟度只有18%)?这似乎向我们提出问题,即便是辅助时间从2年延长到3年,是否仍然并不足够?是否应该进行更长时间或持续的服药,抑或将来有更多证据的时候,根据MRD决定是否停药、何时停药?
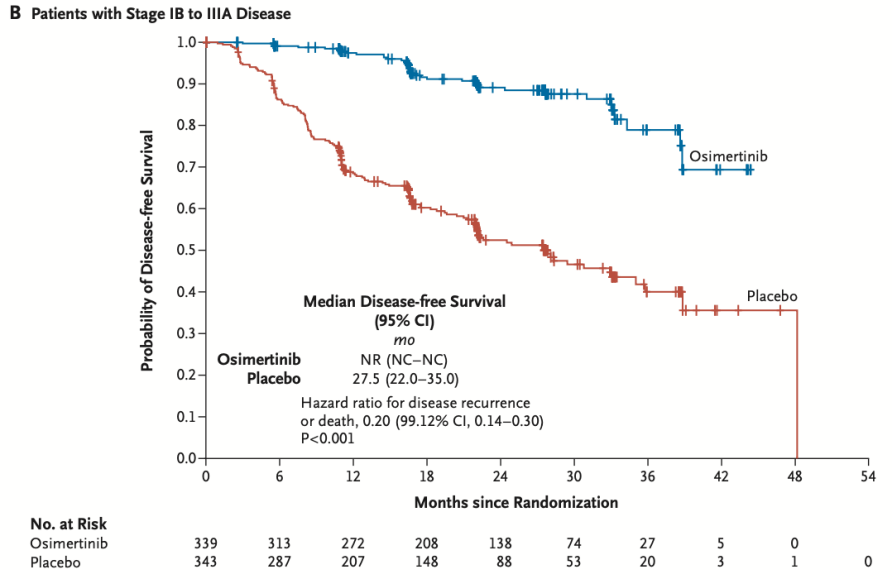
图1
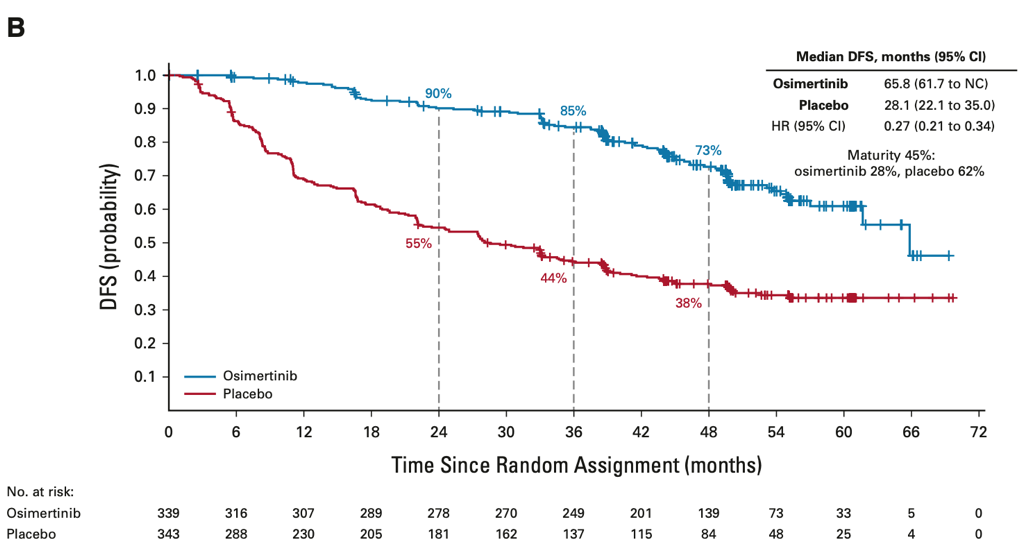
图2
原文传送门
解读文献(来源:N Engl J Med)
Perioperative Durvalumab for Resectable Non-Small-Cell Lung Cancer
可切除NSCLC的围手术期度伐利尤单抗治疗
解读嘉宾
上海交通大学附属胸科医院-邝言斌博士
(第六届35under35优秀青年肿瘤医生)
观点
手术治疗是早期肺癌的主要治疗手段,然而仍有30%-55%患者会在5年内复发,通常肿瘤分期越晚复发率越高。对于肿瘤负荷大的局部晚期NSCLC患者,手术根治切除难度大,复发率更高,围手术期治疗(包括新辅助及辅助治疗)具有重要作用。
AEGEN研究是一项III期、多中心、随机对照临床研究,纳入II-IIIB期(N2)NSCLC患者,随机分组接受度伐单抗或安慰剂联合化疗新辅助治疗4周期,术后度伐单抗或安慰剂维持12周期。主要终点为EFS和病理学完全缓解(pCR)。入组患者802例,修正ITT人群排除了EGFR突变或AlK融合的患者(度伐单抗组366例,安慰剂组374例),两组患者基线均衡,约70%患者III期、50%患者N2分期,33%患者PD-L1表达<1%。该研究达到了主要研究终点,度伐单抗围手术期应用患者获得了显著的EFS延长(HR为0.68(95%CI 0.53-0.88,P=0.004)),并且有更高的pCR率(17.2% vs 4.3%,P<0.001)。安全性可,未对手术切除等产生显著影响。
肿瘤治疗目标是患者更长的生存以及更好的生活质量。抗肿瘤治疗有效很大情况可以改善生活质量以及延长生存。在早期和局部晚期研究中,尤其可手术的患者,患者生存期通常较长,OS数据成熟滞后,通常很多年后才能得到;而肿瘤研究和临床治疗患者有时难以等待6-7年。因此需要替代终点作为疗效的判断,以及药物批准的评价指标。在化疗时代,常将主要病理学缓解(MPR,肿瘤占瘤床<10%)作为替代终点;而随着免疫治疗进入围手术期,更多的患者可以达到完全病理学缓解(pCR,0%肿瘤),因此免疫新辅助治疗的策略也备受瞩目。除了本文介绍的AEGEN研究,目前众多免疫围手术期应用的III期随机对照研究数据也获得了阳性结果,包括CM-816研究(O+化疗新辅助)、KN-671研究(K+化疗新辅助,K辅助维持约1年)、Neotorch研究(特瑞普利单抗+化疗新辅助、特瑞普利单抗辅助维持约1年)、RATIONALE-315研究(替雷利珠单抗+化疗新辅助,替雷利珠单抗辅助维持8周期)、CM-77T(O+化疗新辅助,O辅助维持约1年)。数据上看大多EFS和OS获得延长,MPR和pCR率升高,大多研究应用免疫后的pCR率约20%-30%,RATIONALE-315研究免疫组的pCR率更是达到40.7%。(非头对头研究,不作直接比较,数据可能受到入组人群差异影响)
基于上述多项研究数据公布,对于目前II-IIIB期患者围手术期应用免疫治疗可以更积极的去评估和考量。当然,随着新的治疗策略出现,新的问题也有出现。比如有人认为CM-816研究(术前新辅,术后不辅助)EFS的HR值不比围手术期免疫夹心模式(术前新辅、术后辅助)研究数据低,是不是不应该术后辅助治疗?什么样的患者适合在围手术期应用免疫?EGFR/ALK突变是否应用?患者术后病理显示pCR是否术后仍然辅助治疗?pCR患者是否还需要手术?众多问题未来仍有待更多研究数据和临床实践的经验来回答。
原文传送门
解读文献 (来源:Nat Rev Clin Oncol)
At the crossroads of immunotherapy for oncogene-addicted subsets of NSCLC
致癌基因驱动NSCLC免疫治疗的十字路口
解读嘉宾
广东省人民医院-许子宜博士
(第六届35under35优秀青年肿瘤医生)
观点
尽管目前的研究证据指向PD-1/PD-L1抑制剂可能对驱动基因突变阳性的NSCLC疗效有限,但考虑到不同基因亚型的NSCLC生物学行为差异较大,特定驱动基因改变介导的肺癌可能对免疫治疗的敏感度有较高的异质性,因此在临床决策中尤应慎重考虑。比如,携带BRAF基因或KRAS和TP53共突变的NSCLC最能从ICI治疗中获益,而EGFR突变、ALK或ROS1重排的NSCLC最可能出现PD-L1和TMB低水平,最终导致肿瘤微环境中免疫浸润减少,对ICI产生原发性耐药。目前对于驱动基因阳性NSCLC的免疫治疗疗效数据多来自回顾性的免疫单药研究,尚未有前瞻性的基于ICI的联合治疗疗效数据报道。这主要是因为携带常见驱动基因突变的患者通常被临床研究排除在外,或研究设计中不要求进行全基因组测序。本综述的作者认为,了解并熟知NSCLC的基因组学和免疫表型有助于筛选最可能从免疫治疗中获益的患者人群,联合使用针对免疫抑制机制的相关药物可能提高肿瘤的免疫原性,从而改善驱动基因阳性NSCLC对ICI治疗的敏感度。在此背景下,这篇综述总结了关于NSCLC各种致癌驱动基因作用于TME及影响ICI应答的现有证据,对ICI应用于不同突变类型肺癌的临床问题提供了很好的汇总,有助于临床决策。此外,作者讨论了可能的突破口,以克服由致癌基因引起的ICIs的原发性耐药,对未来的临床研究和转化医学提供了思路。
从临床数据来看,常见于不吸烟患者的驱动基因突变对于ICI的敏感度较低,临床疗效较差,比如无论是常见还是罕见的EGFR突变NSCLC患者,经TKI治疗失败后接受PD-1/PD-L1抑制剂单药治疗的效果不显著,总生存期相较于后线多西他赛治疗无改善(OAK研究)。同样,HER2突变、ALK或ROS1重排的NSCLC患者对免疫单药治疗的反应不佳,RET融合NSCLC对免疫单药治疗的疗效在不同的回顾性研究数据中存在争议。对于不吸烟患者常见的驱动基因突变,仍应优先考虑靶向治疗,只有在RET重排、HER2突变的一线靶向药物不可及或效果不明确的情况下,一线仍应选择免疫联合化疗;对于TKI治疗失败的后线治疗也仍可将ICI单药治疗作为可选策略之一。而对于常见于吸烟患者的驱动基因改变比如KRAS突变的生物学异质性较强,携带KRAS和TP53共突变的NSCLC患者可以从单药抗PD-(L)1治疗中获益,而伴有STK11和/或KEAP1共突变的KRAS突变型患者预后通常较差。不同驱动基因在塑造肿瘤微环境中发挥着重要作用,其中可能有与ICI耐药相关的机制。比如,在小鼠模型上发现的致癌信号通路激活损害肿瘤的免疫原性,从而通过几个关键过程促进对ICI的耐药,包括T细胞排斥、诱导调节性T细胞和髓系抑制细胞、IFNγ信号功能失调和PD-L1表达增加等。驱动基因突变促进TME中的免疫抑制性细胞因子,也可导致ICI耐药。免疫代谢异常和T细胞启动和共刺激受损也同样可能导致免疫抑制。由此看来,联合治疗可能是克服免疫耐药的重要途径,比如,靶向治疗可能促进抗PD-(L)1单抗引发的抗肿瘤免疫反应,从而协同ICI作用,具有一定的理论基础,也在小鼠模型上得到初步验证,但在临床试验中观察到的联合治疗毒性较大,疗效不甚理想;ICI联合化疗和抗血管生成治疗的证据最早来自于IMPOWER150研究,在其亚组分析中,KRAS和TP53共突变的NSCLC患者从化疗联合免疫治疗加贝伐珠单抗治疗中的获益最大,而KRAS和STK11/KEAP1共突变亚组不论何种治疗方式其生存获益相似;与化疗联合贝伐珠单抗相比,具有经典EGFR突变的亚组接受撕咬联合治疗的PFS和OS显著延长。其余的联合治疗靶点还包括耗竭T细胞的共抑制受体和标志物CTLA4、LAG3和TIM3,还有共刺激分子,例如OX40、CD27、CD28、CD137和GITR,相关的靶向治疗药物也正在开发中,包括双特异性抗体或其他结构的T细胞受体结合剂等。随着免疫逃逸途径的不断发现,未来可能会有更多成功的转化,有助于制定更有效的联合治疗策略。
原文传送门
诚邀35under35青年医生报名
↓请添加35under35班长微信↓

*首批暂时开放肺癌、乳腺癌领域,后续将陆续开放其他瘤种
在这个《文献下午茶》的共享时光里,我们期待您的参与和分享。让我们一起在品茗文献的同时,领略医学的魅力,感受学术的快乐。我们相信,每一次的解读和讨论,都将是一次领域知识的盛宴,也是一次专业思维的碰撞。











 苏公网安备32059002004080号
苏公网安备32059002004080号


