近期,Journal of the National Cancer Institute杂志发表了美国国家癌症研究所(NCI)结直肠-肛门工作组关于直肠癌未来临床试验设计的共识建议:
在化疗前或化疗后使用长程放疗(LCRT)的全程新辅助治疗(TNT),以及化疗后使用短程放疗(SCRT)作为临床试验的对照组;
需要在试验设计中更多地强调让患者参与治疗方案的选择;
尽可能地识别出那些可能或不太可能从非手术治疗(NOM)或微创手术中获益的患者;
研究循环肿瘤DNA(ctDNA)检测对制定治疗方案和随访监测计划的效用;
需要确定适当的研究终点,并需要意识到进入NOM试验组的患者在数据管理方面所面临的挑战。

方法
首先,由4个专家课题组分别确定了与直肠癌试验设计相关的4个共识领域:1)SCRT和TNT的使用;2)整合患者意见;3)直肠癌试验相关亚组;4)直肠癌临床试验特有的研究设计要素(表1)。
表1. 共识领域

随后针对这4个共识领域,先后召开了两次线上会议进行讨论并投票(两次投票分别有38名和29名专家参与)。
投票采用1~9分制,1表示完全不同意,9表示完全同意。集中趋势通过中位数得分来衡量,7~9分表示同意(支持),4~6分表示中立,1~3分表示不同意(不支持)。70%的受访者得分在任意3分范围内,即为达成共识。
结果
放疗和新辅助治疗
关于临床试验对照组的选择,专家组一致同意使用LCRT的TNT。会议达成共识,不支持新辅助LCRT后手术再进行辅助治疗的旧标准(表2)。专家组还一致同意按照RAPIDO试验中报告的顺序使用SCRT,作为对照组的选择之一。
表2. 放疗和辅助化疗

对于TNM分期为T1-2 N1-2或T3 N any的患者,诱导化疗后进行LCRT与初始LCRT后进行巩固化疗的意见相对一致。对于使用新辅助LCRT,然后进行手术和辅助化疗的旧标准,尚未达成共识。对于环周切缘受累的T3或T4患者,在第一轮投票中,在治疗方案的给药顺序方面,TNT无论放在哪一步都获得了一致支持,而SCRT后进行巩固治疗(RAPIDO方案)则在第二轮投票中获得了一致支持。
关于NOM研究的对照组选择,在第一轮投票中就支持LCRT和巩固化疗达成了共识,在第二轮投票中就支持诱导化疗和LCRT达成了共识。在NOM研究的对照组中,无论是诱导化疗还是巩固化疗,SCRT均未获得支持。同样,作为NOM研究的对照组,新辅助长程化疗后进行手术评估然后进行辅助治疗的旧标准也未获得支持。
根据汇总数据的权重,专家组一致倾向于在所有疾病类别中采用TNT。虽然有些人担心T3N0患者在TNT试验中的比例不高,可能会被过度治疗,但其他专家认为TNT在改善T3N0期预后方面的益处大于毒性风险。此外,与病理检查相比,临床淋巴结阳性的特异性被认为是较低的。
患者意见
在提高患者对试验设计的参与度以及在试验设计中征求患者偏好信息方面达成了强烈共识。对于是否有必要纳入有关放疗和手术后可能出现性功能障碍的咨询,也达成了共识(表3)。在研究设计、审查和批准的各个阶段纳入患者权益倡导者(patient advocates)也得到了共识支持。
表3. 整合患者意见(所有项目均达成共识)

“整合患者偏好是提高患者参与度、改善直肠癌和肛门癌试验收益的下一个前沿领域”这一说法得到了专家组的大力支持。对于临床医生不感兴趣、患者缺乏相关知识、甚至患者恐惧都可能阻碍患者参与试验的观点也得到了支持。部分专家还强调了患者权益倡导者在试验设计各个阶段的作用。
直肠癌试验相关亚组
会议确定了直肠癌试验中值得关注的患者亚组:早期/局部晚期/转移性疾病患者、基于年龄的患者人群、易感人群、接受适应性治疗的患者和基于ctDNA的患者(表4)。
表4. 直肠癌试验相关亚组确定
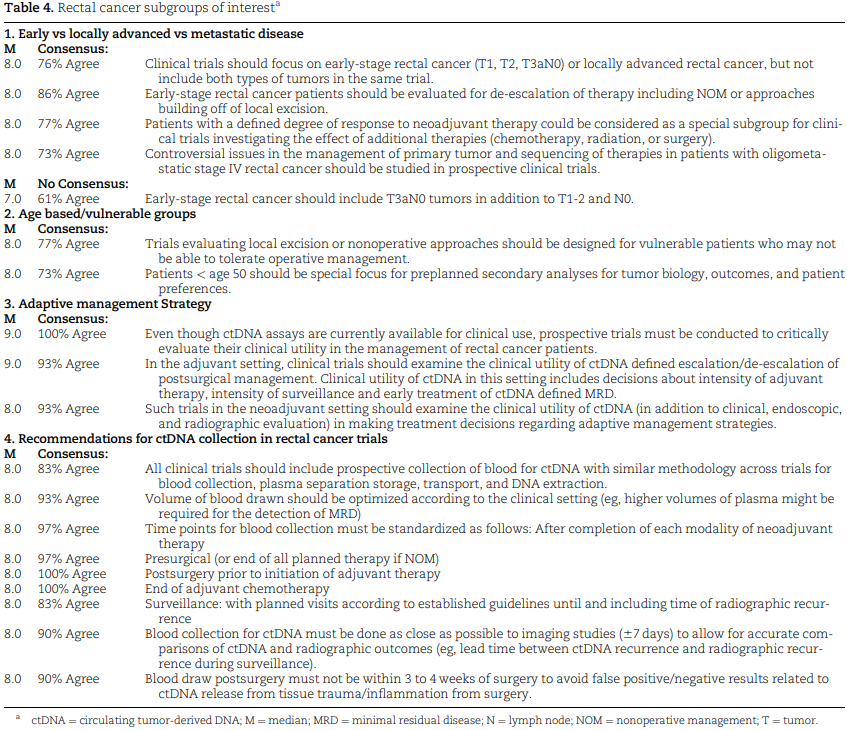
有人认为,早期直肠癌患者应与局部晚期肿瘤患者分开研究,但对于早期直肠癌的定义中是否应将T3aN0患者与T1-2N0患者一并纳入,并未达成共识。专家组认为,早期患者和可能无法耐受或不愿接受手术治疗的患者有必要在试验中选择非手术治疗或局部切除方案。此外,专家组还认为,临床试验的重点应该是疗效较好的患者,特别是对新辅助治疗反应良好的患者和寡转移性疾病患者。年轻患者(定义为年龄小于50岁)也被建议作为临床试验的重点研究人群,因为更好的功能预后往往是这一亚组的主要关注点。
在研究适应性治疗模式的临床试验中,专家组一致认为应使用对新辅助治疗的反应程度进行评估。专家组一致支持在临床试验中对ctDNA进行前瞻性评估,重点是新辅助治疗和辅助治疗。在新辅助治疗方面,专家组支持研究ctDNA是否与影像学、内窥镜和/或临床因素相关,以及这些相关性如何影响适应性治疗策略的决策。专家组还达成共识,支持评估ctDNA在决策过程、辅助治疗强度、监测强度和早期治疗已确定的微小残留病变(MRD)中的作用。专家组一致认为,临床试验应检查ctDNA在确定手术前后治疗升级/降级方面的临床实用性。且ctDNA的采集、容量、血浆储存、运输和DNA提取方法必须标准化。
此外,会议还就ctDNA采血时间点的标准化达成了共识:在每种新辅助治疗方式结束后、手术前后以及监测期间。最后,专家组就ctDNA研究性采血的时间达成了共识,即在CT扫描后7天内进行ctDNA研究性采血,以便进行准确的相关性分析;在手术后3~4周内进行ctDNA研究性采血,以防止因组织创伤而出现假阳性/阴性结果。
直肠癌试验特有的研究设计要素
设计要素的共识建议重点关注以下几方面:1)纳入和排除标准;2)治疗方面的质量保证;3)Ⅱ/Ⅲ期临床试验的研究终点;4)患者自报告结局;5)评估临床完全缓解(cCR)和NOM的允许范围和方法;6)试验规定的随访监测(表5)。
表5. 直肠癌特有的试验设计要素

对于一项随机Ⅱ/Ⅲ期临床试验,在治疗开始后3年内避免造口术是一个合适的终点,这一点得到了一致认同。专家组普遍认为,应收集所有临床试验入组患者的患者自报告结局指标数据,尤其是与身体功能相关的数据。使用癌胚抗原、横断面成像和结肠镜检查的监测策略获得了高度的一致支持。最后,专家组一致认为,在新辅助治疗试验中,NOM是一种不可忽视的替代疗法,需要向参与临床试验的患者说明NOM的潜在获益和风险。
对于入排标准的标准化已达成高度共识,其中包括肿瘤位置和外科医生保留括约肌的可能性、使用磁共振成像作为术前局部分期的首选方式、明确临床阳性淋巴结转移(通过放射成像)的定义,以及允许研究者确定既往恶性肿瘤是否会干扰主要和次要结局的评估。
关于Ⅱ期和Ⅲ期直肠癌试验的合适的临床研究终点,对于3年括约肌保留率和3年无造口术生存率方面有高度共识,而2年无造口术生存率的共识度为中。对于Ⅱ期和Ⅲ期直肠试验的次要终点,支持R0切除率、病理完全缓解、cCR和3年括约肌保留率的共识度较高。对于使用新辅助治疗反应评分和肿瘤消退等级作为中间研究终点存在分歧,而对于使用病理边缘终点则持中立态度。对于患者自报告结局测量指标,与会者高度一致认为应在早期时间点(1~3 个月)和后期时间点(3~5 年)收集这些测量指标,并应纳入与治疗期间生活质量、肠道、泌尿和性功能以及饮食变化相关的指标。
对于新辅助治疗试验,考虑到患者cCR率较高且不愿继续手术切除,专家组对于应向患者告知有关NOM的现有数据并向其提供这种方法;分析计划应明确如何处理选择NOM的患者;对这些患者实施结构化监测计划,包括收集内窥镜照片,用于教育和培训,并统一cCR的定义也达成了高度共识。
总结
专家组在与未来直肠癌治疗临床试验设计相关的几乎所有关键要素上达成了重要共识。
在所有4个共识领域都达成了共识,即放疗和新辅助治疗、患者意见、特殊亚组以及直肠癌特有的试验设计要素。这些共识将为设计新的直肠癌最佳治疗研究方案提供指导。
Hagen F Kennecke, Rebecca Auer, May Cho, et al; NCI Rectal-Anal Task Force consensus recommendations for design of clinical trials in rectal cancer;JNCI: Journal of the National Cancer Institute;https://doi.org/10.1093/jnci/djad143.
排版编辑:Mathilda











 苏公网安备32059002004080号
苏公网安备32059002004080号


