肝门部胆管癌(又称Klatskin瘤)恶性程度高,治疗复杂,预后较差。肿瘤好发于左右肝管汇合处,常累及左右肝管或肝总管甚至胆总管,患者往往失去外科切除机会。内科治疗以吉西他滨联合铂类为指南推荐的一线方案,然而有效率仍然较低。更为困难的是,肝门部胆管癌常合并阻塞性黄疸,常规化疗因患者胆红素指标较高而受限。此外,已有临床数据表明,酪氨酸激酶抑制剂(TKI)联合免疫检查点抑制剂是一种有前景的选择。今年ASCO大会上公布了一项探索性研究,评估胆道支架联合腔内放射性粒子条序贯仑伐替尼+PD-1抑制剂治疗肝门部胆管癌的临床价值。【肿瘤资讯】特邀中山大学肿瘤防治中心微创介入治疗科高飞教授对该研究进行解读。
中山大学附属肿瘤医院微创介入治疗科行政副主任、主诊教授、主任医师、博士生导师,中山大学肿瘤学博士、美国Rochester大学博士后、首批广东省杰出青年医学人才。
治疗领域:擅长肝癌合并门静脉高压症微创介入治疗(尤其疑难门静脉高压症TIPS术、复杂门静脉闭塞性疾病介入开通)、实体肿瘤射频(微波)消融及粒子植入、复杂恶性梗阻性黄疸胆道支架植入及腔内近距离治疗。
作为发起人与执行主席连续主办八届“南方TIPS论坛”。主张肝癌合并门静脉高压症的积极干预,以期改善患者生活质量与预后。以第一或通讯作者在《Radiology》、《Eur Radiol》等杂志发表SCI论文60余篇,并连续10年为《Eur Radiol》特约审稿人。主持国家自然科学基金面上项目、广东省自然科学基金等十余项课题研究。获得首届国之名医•青年新锐、CCI 2019中国介入新锐、Research Fellowship of URMC (USA) 、2019年中国静脉介入新锐、2019年中华介入明日之星。兼任中国医师协会介入医师分会青年副主任委员、白求恩基金会介入诊疗专委会副主任委员、国家卫健委能建中心介入专委会门脉高压学组副组长、中国抗癌协会肿瘤微创治疗专业委员会常委&青年副主任委员、中国抗癌协会肿瘤介入专业委员会青年副主任委员、广东省抗癌协会肿瘤微创治疗专业委员会候任主任委员、广东省医学会介入医学分会青年副主任委员等。先后获得中国抗癌协会科技进步二等奖、广东省科技进步一等奖等。
研究方法
本研究回顾性地纳入2020年1月至2022年12月中山大学肿瘤防治中心微创介入治疗科收治的21例肝门部胆管癌并阻塞性黄疸患者。所有患者均经外科评估无手术切除指证。先根据术前计算机治疗计划系统(TPS)确定125I粒子植入数目及剂量分布,常规PTCD术前准备,进行胆道支架+125I粒子条植入。评估手术相关结果,包括支架引流成功率和手术相关并发症。此外,分析成功行胆道支架引流和序贯全身抗肿瘤治疗患者的生存情况。支架引流成功定义为血清总胆红素水平在4周内下降幅度超过术前的75%。主要并发症是指导致死亡或严重不良反应的并发症。将支架植入至死亡或随访结束的时间定义为患者生存时间。
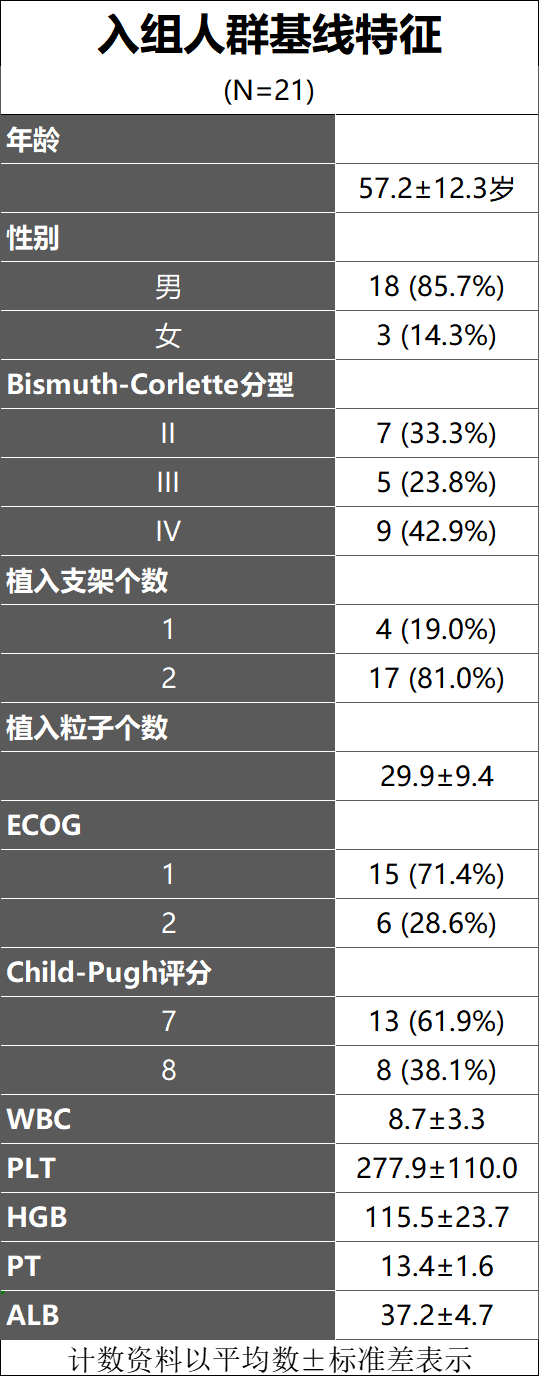
研究结果
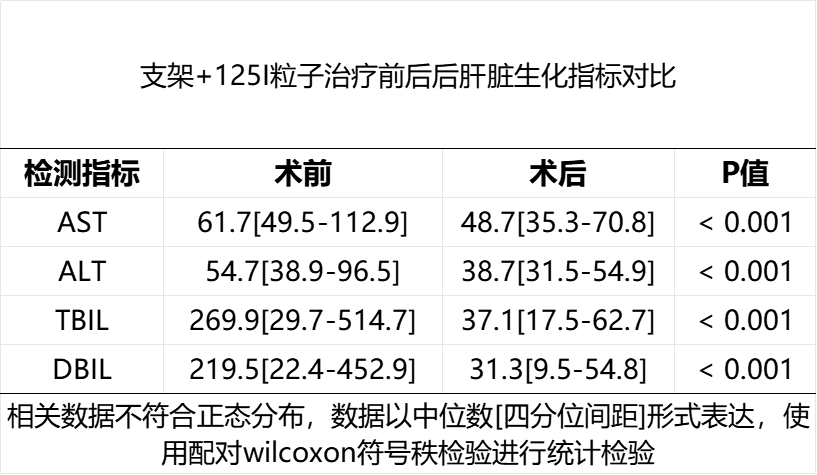
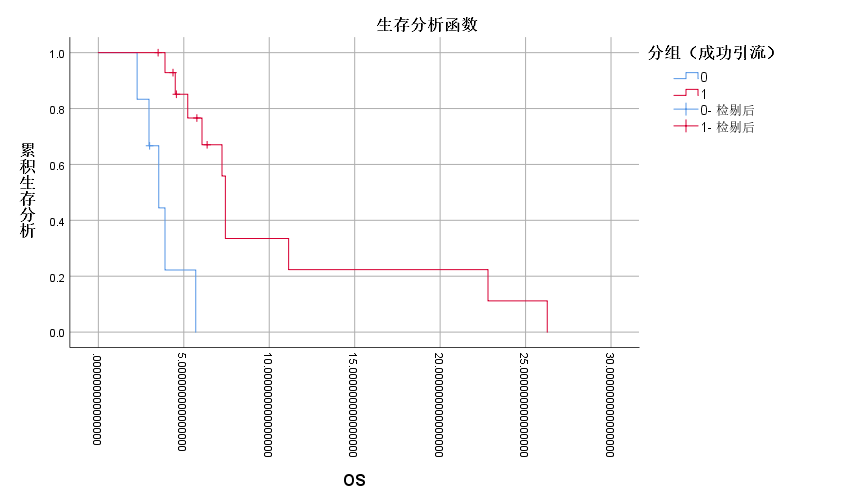
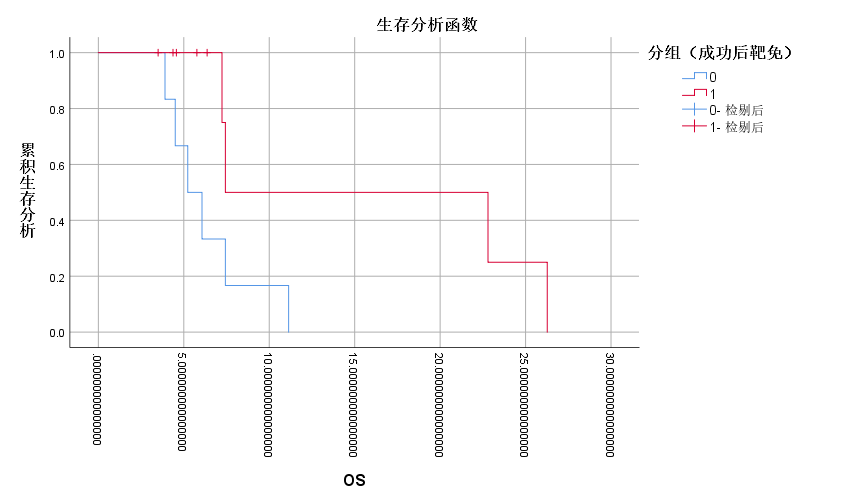
15例(71.4%)患者在接受胆道支架引流联合125I粒子条植入后4周胆红素较术前下降超过75%。在安全性方面,21例患者均未出现死亡、大量出血等严重并发症,5例(23.8%)发生轻微并发症,其中胆管炎1例(4.8%),轻中度腹痛4例(19%),经对症支持治疗后均明显改善。21例患者的中位生存时间(median overall survival, mOS)为6.1个月。成功胆道支架引流的患者(n=15)的mOS显著优于失败的患者(n=6)(7.4个月 Vs. 3.5个月,P<0.001)。有效支架引流及放射性粒子条植入后序贯仑伐替尼+PD-1单抗组(n=9)的mOS显著优于姑息治疗组(n=6)(7.4个月 vs. 5.2个月,P=0.028)。
恶性黄疸来势汹汹,支架植入开辟生机
肝门部胆管癌因其易侵犯左右肝胆管导致阻塞性黄疸发生率高、肿瘤治疗效果差。胆道内肿瘤生长侵犯所致的黄疸又进一步制约了常规化疗的应用,使得患者的预后难以改善。有研究报告该类型相较于其它部位胆管癌患者生存时间显著缩短(mOS:4个月 vs. 6个月,P<0.001)1。
对于肝门部恶性阻塞性黄疸,有效的治疗方式往往是双侧胆道引流或支架植入,即在影像设备的引导下将引流管留置胆道或将支架植入胆管狭窄段使得胆汁能够引流出体外或经肠道排泄。在胆道引流操作,存在经皮经肝穿刺引流(PTCD)和经内镜逆行胰胆管造影(ERCP)两种途径。目前研究表明在肝门部恶性阻塞性黄疸中,PTCD途径较ERCP途径操作更为简易、并发症更少、退黄效果更显著。相较于双侧胆管引流,胆道双支架植入避免保留体外引流管,有助于降低胆道感染发生率、提升患者生活质量2, 3。
支架狭窄难解决,小小粒子来帮忙
由于胆管癌腔内侵袭性生长的特性及胆道自身的纤维增生,支架的再狭窄制约了其临床应用,也限制了对肝门部胆管细胞癌的全身系统治疗4。而125I作为碘的放射性同位素,在衰变过程中可以释放高能的γ射线近距离杀伤肿瘤。为了防止或降低支架再狭窄的发生,125I粒子植入被联合应用于恶性黄疸患者腔内肿瘤的近距离治疗。高飞教授团队曾有研究报道使用125I粒子联合胆道支架植入的患者其支架通畅时间要显著长于单纯接受胆道支架植入的患者(289天 vs. 88天,P=0.001)5,表现出了对支架再狭窄良好的控制效果,为后续的系统抗肿瘤治疗创造条件。
支架粒子步步为营,系统治疗再放光彩
尽管团队还证明125I粒子联合胆道支架植入可以显著延长患者生存时间(221天 vs. 78天,P=0.001)5,但在解决黄疸和腔内肿瘤近距离治疗之后,仍需联合及时的系统抗肿瘤治疗,以进一步延长患者生存时间。目前,胆管癌一线、二线化疗方案有效率仍有待提高,虽然二线针对FGFR融合或重排的靶向药物有较大突破,但总体突变比例较低。因此,探索更优的系统治疗方案的研究也在如火如荼地开展,其中仑伐替尼在此领域已经展现出了理想的应用前景。多项基础研究显示仑伐替尼可以通过Gadd45a、AZGP1等蛋白质相互作用抑制肿瘤的细胞的去分化和增殖6, 7。
一项II期前瞻性临床研究已经证明了仑伐替尼在胆管细胞癌二线治疗领域的潜力(mOS:7.35月)8。同时,随着肿瘤免疫治疗的开展,越来越多有关仑伐替尼联合PD-1单抗的研究也在进一步开展,其中一项纳入103例胆管细胞癌的真实世界队列研究表明仑伐替尼联合PD-1单抗对于进展期肝内胆管癌的治疗效果良好,一线治疗组中位生存时间达12个月,后线治疗中也是达到了11个月。基于上述研究,我们在胆道充分引流后将仑伐替尼于PD-1单抗联合应用于肝门部胆管癌患者,最终也显示出了良好的治疗效果。
另辟蹊径践行生命至上,循序渐进拯救每位患者
在肝胆恶性肿瘤的非外科治疗中,大多数诊疗指南均将姑息性支持治疗作为患者的推荐治疗方案。但在临床实践中,此类晚期患者仍表现出了对积极治疗的期望和对生命的渴望。基于生命至上、救死扶伤的理念,高飞教授团队开展了本项研究以期探索改善肝门部胆管癌并阻塞性黄疸患者生活质量、延长生存期。四联治疗从胆道支架引流开始一步步解决患者临床症状、改善患者肝功能,治标兼顾治本,进而联合系统治疗延长患者生存,为该类患者的治疗提供一种新的理念和方案。期待有更多的研究提供方法治疗黄疸及腔内肿瘤,也同样期待有前瞻性的研究去发现更好的系统抗肿瘤方案。
文中研究结果在ASCO 2023年会上发表,并收录于会议论文集:
Fu XB and Mu MY and Qi H and Jiang WW and Chen ZX and Gao F. Biliary intervention combined with lenvatinib+ PD-1 inhibitor of Klatskin tumor complicated with malignant obstructive jaundice. Journal of Clinical Oncology, 41,16_suppl, e14620-e14620,doi = 10.1200/JCO.2023.41.16\_suppl.e14620
排版编辑:Jessica
1. Zhang X, Liu H. Klatskin Tumor: A Population-Based Study of Incidence and Survival. Med Sci Monit. 2019 Jun 17;25:4503-4512. doi: 10.12659/MSM.914987. PMID: 31204730; PMCID: PMC6597140.
2. Tang Z, Yang Y, Meng W, Li X. Best option for preoperative biliary drainage in Klatskin tumor: A systematic review and meta-analysis. Medicine (Baltimore). 2017 Oct;96(43):e8372. doi: 10.1097/MD.0000000000008372. PMID: 29069029; PMCID: PMC5671862.
3. Pu LZ, Singh R, Loong CK, de Moura EG. Malignant Biliary Obstruction: Evidence for Best Practice. Gastroenterol Res Pract. 2016;2016:3296801. doi: 10.1155/2016/3296801. Epub 2016 Feb 11. PMID: 26981114; PMCID: PMC4766322.
4. Nam HS, Kang DH. Current Status of Biliary Metal Stents. Clin Endosc. 2016 Mar;49(2):124-30. doi: 10.5946/ce.2016.023. Epub 2016 Feb 25. PMID: 26911896; PMCID: PMC4821525.
5. Sheng Y, Fu X, Wang G, Mu M, Jiang W, Chen Z, Qi H, Gao F. Safety and efficacy of self-expandable metallic stent combined with 125I brachytherapy for the treatment of malignant obstructive jaundice. Cancer Imaging. 2023 Apr 4;23(1):33. doi: 10.1186/s40644-023-00551-0. PMID: 37016400; PMCID: PMC10071611.
6. Yan X, Wang D, Ning Z, Meng ZQ. Lenvatinib inhibits intrahepatic cholangiocarcinoma via Gadd45a-mediated cell cycle arrest. Discov Oncol. 2023 Feb 23;14(1):26. doi: 10.1007/s12672-023-00631-4. PMID: 36821012; PMCID: PMC9950313.
7. Deng L.; Bao W.; Zhang B.; Zhang S.; Chen Z.; Zhu X.; He B.; Wu L.; Chen X.; Deng T.; Chen B.; Yu Z.; Wang Y.; Chen G.AZGP1 activation by lenvatinib suppresses intrahepatic cholangiocarcinoma epithelial-mesenchymal transition through the TGF-β1/Smad3 pathway. Cell Death and Disease (2023) 14:9 doi: 10.1038/s41419-023-06092-5
8. Ueno M.; Ikeda M.; Sasaki T.; Nagashima F.; Mizuno N.; Shimizu S.; Ikezawa H.; Hayata N.; Nakajima R.; Morizane C.Phase 2 study of lenvatinib monotherapy as second-line treatment in unresectable biliary tract cancer: primary analysis results.BMC Cancer (2020) 20:1. doi: 10.1186/s12885-020-07365-4
9. Chao J, Wang S, Wang H, Zhang N, Wang Y, Yang X, Zhu C, Ning C, Zhang X, Xue J, Zhang L, Piao M, Wang M, Yang X, Lu L, Zhao H. Real-world cohort study of PD-1 blockade plus lenvatinib for advanced intrahepatic cholangiocarcinoma: effectiveness, safety, and biomarker analysis. Cancer Immunol Immunother. 2023 Nov;72(11):3717-3726. doi: 10.1007/s00262-023-03523-2. Epub 2023 Oct 3. PMID: 37787790.











 苏公网安备32059002004080号
苏公网安备32059002004080号


