2023年12月1日,Lancet Oncology在线发表了LEAP-002的最新结果,这项全球多中心Ⅲ期随机对照试验旨在探索帕博利珠单抗联合仑伐替尼(以下简称“K+L”)vs.仑伐替尼(以下简称“L”)一线治疗晚期肝细胞癌(以下简称“HCC”)患者的疗效及安全性。结果显示,尽管“K+L”在早期试验中表现出良好的抗肿瘤活性,但在本试验中,“K+L”未能显著改善晚期HCC一线患者的总生存期(PFS)及无进展生存期(PFS)1。据悉,该研究的通讯作者为美国西奈山伊坎医学院Tisch癌症研究所Josep M Llovet。其中,中国南京天印山医院秦叔逵院长、湖南省肿瘤医院许若才教授、复旦大学附属中山医院任正刚教授担任本文共同作者。
抗血管生成治疗并非所有患者适用,LEAP-002聚焦“K+L”vs.“L”
肝细胞癌患者确诊时大多已是晚期,免疫或靶向治疗或可延长其生存。现有获批的晚期HCC一线药物包括口服酪氨酸激酶抑制剂(TKI)索拉非尼、仑伐替尼、多纳非尼(仅中国),以奥沙利铂为基础的化疗方案(仅中国),抗程序性死亡受体蛋白-配体1(PD-L1)单抗联合抗血管内皮生长因子(VEGF)抗体替雷利珠单抗+贝伐珠单抗,PD-L1单抗联合细胞毒性T淋巴细胞受体4(CTLA-4)单抗度伐利尤单抗+tremelimumab,信迪利单抗+贝伐珠单抗类似物(IBI305,仅中国),抗程序性死亡受体-1(PD-1)单抗联合抗血管内皮生长因子受体2(VEGR2)单抗卡瑞利珠单抗+雷莫西尤单抗(仅中国)。
REFLECT 3期试验证实在既往未经治疗的不可切除HCC患者中,仑伐替尼在OS方面非劣效于索拉非尼,并在PFS、至进展时间(TTP)、客观缓解及生活质量的延迟恶化方面表现出具有临床意义、显著的改善。基于此,仑伐替尼被指南推荐用于不适宜接受阿替利珠单抗或贝伐珠单抗的晚期HCC标准一线治疗。
基于KEYNOTE-244试验,帕博利珠单抗获美国食品药品监督管理局(FDA)加速批准用于既往索拉非尼经治的晚期HCC患者。KEYNOTE-240试验证实帕博利珠单抗具有支持性获益-风险数据,然而并未达到预设的OS及PFS显著性。KEYNOTE-394是一项在亚洲进行的类似试验,表明帕博利珠单抗可显著延长OS及PFS。在KEYNOTE-244试验的前线队列中,帕博利珠单抗亦表现出可耐受的抗肿瘤活性及具有前景的OS获益。
在KEYNOTE-524 1期试验中,“K+L”显示出具有前景的一线抗肿瘤活性,客观缓解率(ORR)为36.0%,中位缓解持续时间(DOR)为12.6个月,中位OS为22.0个月,中位PFS为8.6个月,安全性可控。除此之外,“K+L”在肾细胞癌和子宫内膜癌的3期临床试验中显示出生存获益。
因此,研究者开展了LEAP-002研究,旨在探索“K+L”对比“L”在晚期HCC患者一线治疗的疗效及安全性。LEAP-002初步结果已于去年9月份在欧洲内科学肿瘤学会(ESMO)大会上公布,此次,研究者在Lancet Oncology公布了最新结果。
试验详情及结果
LEAP-002试验是一项全球、多中心、双盲的3期试验,入组了来自全球172个医疗中心的≥18岁的先前未接受过系统治疗的晚期HCC患者。入组患者接受1:1随机分配至接受“K+L”(L:<60kg为8mg,≥60kg为12mg;K:200mg;3周)或“L”(L:200mg,3周),并依据地理位置、门静脉大血管侵犯/肝外扩散程度、甲胎蛋白水平、ECOG体能状态进行分层。
患者至多接受35个周期(约2年)的药物治疗或直至独立中央审查机构评估的毒性不耐受、疾病进展。本研究不允许疾病进展后交叉用药,但可接受后续抗肿瘤治疗同时停止试验干预。
随机化后每9周进行一次CT或MRI扫描,随访期间每12周进行一次盲态独立审查委员会基于RECIST1.1的肿瘤缓解及疾病进展评估。在第1个周期内每2周进行一次安全性评估,自第2个周期后每个周期进行一次评估。在基线时、每个治疗周期的第1天(直至第10个周期)、后续每个治疗周期的第1天(直至1年或治疗结束)进行生活质量问卷评估。研究者还进行了免疫原性事后分析以检测“K”的抗药抗体。
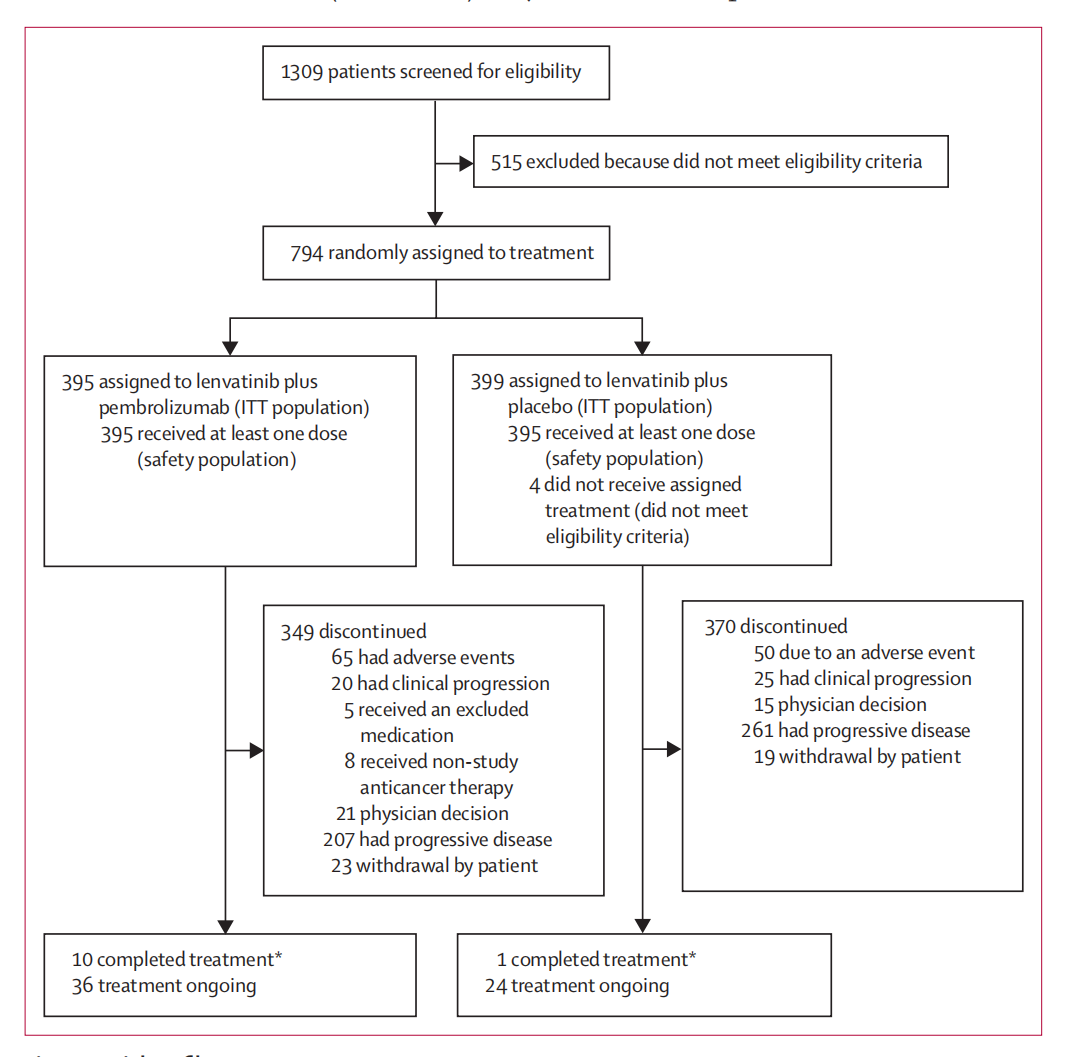 图1.试验概况
图1.试验概况
本试验的双主要终点为OS和PFS。次要终点为盲态独立审查中央机构确证性ORR、DOR、疾病控制率(DCR)、至进展时间(TTP)、安全性。探索性终点为研究者审查的PFS、ORR、TTP。健康相关生活质量评估亦为探索性终点,后续另有文章加以报道。
结果显示,在2019年1月17日至2020年4月28日期间,共1,309例患者接受筛查,794例患者最终入组,其中K+L为395例,L组为399例。随机化至最终分析(2022年1月21日)的中位时间为32.1个月。两组患者的基线特征较为平衡。中位年龄为66.0年,19%为女性患者。794例患者中,最终每组有395例患者接受了最后一剂药物治疗。数据截止时,K+L组和L组各有36/395例(9%)患者和24/395例(6%)仍在接受特定治疗。
表1.患者基线特征

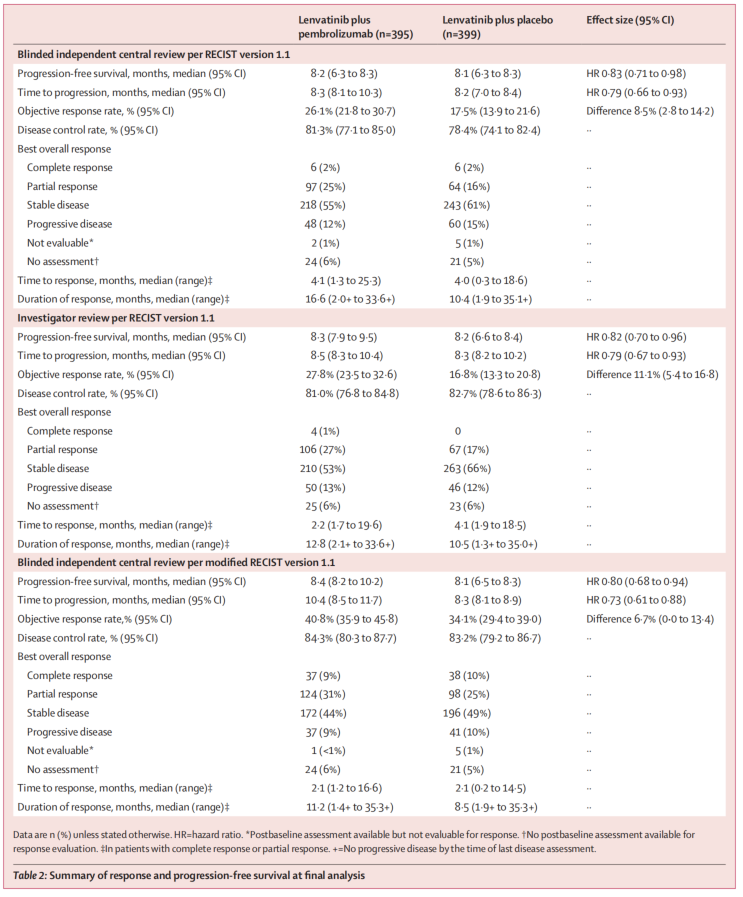
截止最终分析时,共534例患者死亡,其中K+L组为252例,L组为282例(HR=0.84,分层对数秩P=0.023,未达到单侧p=0.019的优效性临界值)。K+L组和L组的中位OS为21.2个月vs.19.0个月,这与预设亚组分析结果一致。
随机化至首次中期分析的中位时间为17.6个月,K+L组和L组的中位OFS分别为8.2个月和8.0个月(HR=0.87,分层对数秩P=0.047,未达单侧P=0.002的优效性临界值)。在最终的事后分析中,PFS的HR为0.83。K+L组和L组的中位DOR分别为8.6个月和9.5个月。
表2.疗效数据
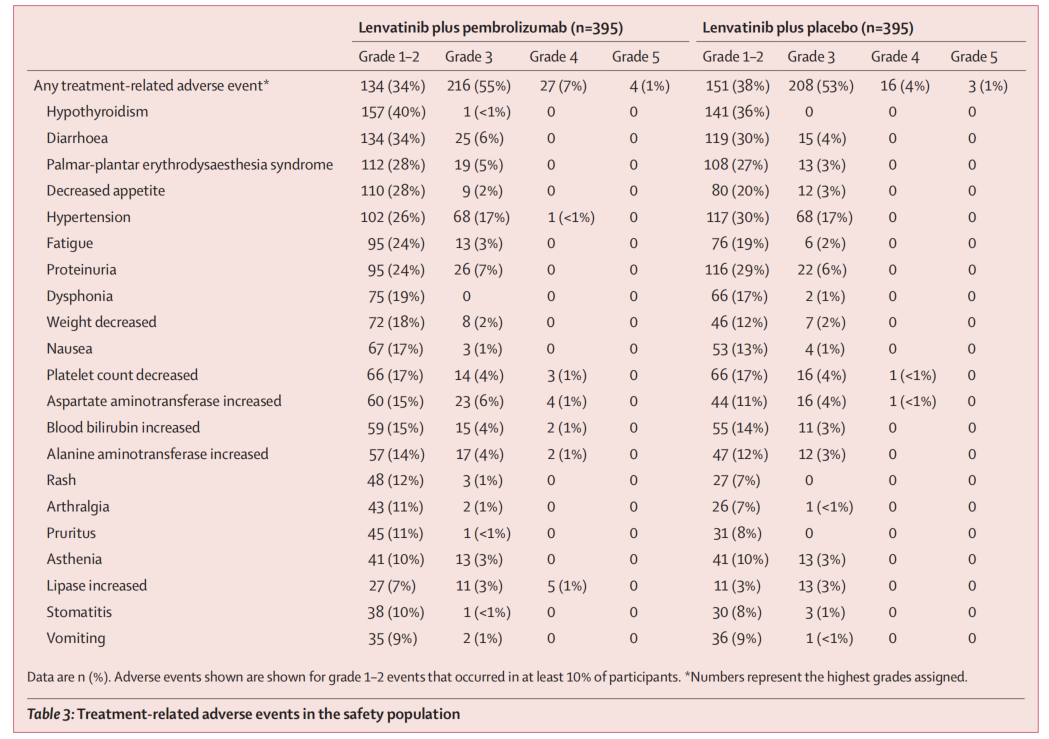
K+L组和L组的治疗相关不良事件发生率分别为381/395例(96%)和378/395例(96%)。两组均最为常见的治疗相关不良事件包括高血压(171例/43% vs.185例/47%)、腹泻(158例/40%vs.141例/36%)。最常见的3-4级不良事件为高血压(69例/17%vs.68例/17%)、天冬氨酸转氨酶升高(27例/7%vs.17例/4%)和腹泻(25例/6%vs.15例/4%)。治疗相关严重不良事件在K+L组和L组分别为99例(25%)和65例(16%),治疗相关死亡事件分别为4例(1%)和3例(1%),其中K+L组为胃肠道出血(1例)、肝肾综合征(1例)、肝性脑病(2例),L组为脑血管意外(1例)、胃肠道出血(1例)和肝肾综合征(1例)。
表3.安全性数据
312例患者的免疫原性或帕博利珠单抗抗药抗体数据可用,8例(3%)患者出现治疗后出现抗药抗体阳性,其中,1例(<1%)患者的抗体具有中和能力。研究者尚未观察到抗药抗体的存在与帕博利珠单抗暴露量之间的相关性。
由此,研究者得出结论:在KEYNOTE-524 1期试验中,K+L在晚期HCC一线治疗中表现出具有明显的抗肿瘤活性,但此次在对比安慰剂联合“L”的3期试验中,K+L治疗患者的OS、PFS均未有显著改善。因此,该结果不支持“K+L”用于临床实践。
研究解读及启示
仑伐替尼单药与仑伐替尼+免疫检查点抑制剂(ICI)的联合治疗在OS及PFS方面无显著差异,研究者对于这一结果列举了诸多潜在解释。
①治疗及安全性管理经验的有效普及:本试验中仑伐替尼单药治疗的患者OS长于预期,达到19.0个月,而REFLECT试验中为13.6个月。潜在原因包括:自REFLECT试验后,治疗持续时间有所延长,有效的二线治疗被广泛使用;且医生处理不良事件方面积累了更多经验。
②双盲设计避免选择偏倚。在LEAP-002试验中,仑伐替尼暴露时间更长可能源于双盲设计,这避免了既往3期试验中“广为诟病”的选择偏倚。
③ORR未能转化为生存数据:在LEAP-002试验中,尽管仑伐替尼单药治疗的ORR为17.5%,帕博利珠单抗联合仑伐替尼治疗的患者ORR为26.1个月,但两者的OS曲线第1年后才开始分离。
④TKI+抗VEFG治疗与TKI+PD-1单抗治疗机制不同:TKI联合抗VEGF单抗具有显著的免疫调节作用,可将免疫“冷肿瘤”转化为“热肿瘤”,从而扩大免疫检查点应答人群。仑伐替尼联合帕博利珠单抗可增加肿瘤内CD8+T细胞数量、减少调节性T细胞数量,改变肿瘤微环境。小部分患者体内治疗后出现抗药抗体阳性,但对于帕博利珠单抗的治疗无影响。既往有研究显示,阿替利珠单抗联合贝伐珠单抗治疗晚期HCC患者后抗药抗体阳性率升高与临床预后不佳相关。
⑤试验组停药率高、不良事件更严重。本试验中,仑伐替尼、帕博利珠单抗治疗观察到的不良事件发生率与严重程度与既往报道一致。联合治疗组因治疗相关不良事件停药发生率较高为18%(71/395例),而仑伐替尼组为11%(42/395例)。原因可能包括:与联合治疗组相比,仑伐替尼组的3-4级不良事件比例更高、严重不良事件更高。
本试验存在一定局限性,排除了门静脉主干侵犯(Vp4)的患者,该因素与不良预后相关,该类患者的中位OS短于1年。然而,该排除标准在包括REFLECT、HIMALAYA、REATIONALE-301和SHR-1210-Ⅲ-301在内的3期临床试验中较为常见。此外,与REFLECT、HIMALAYA相比,LEAP-002中门静脉大血管侵犯患者的比例相对较低,可能对研究结果产生影响。
“塞翁失马,焉知非福。”LEAP-002试验刷新了仑伐替尼单药一线治疗晚期HCC患者的最新数据,获得迄今为止的最长OS,并进一步支持仑伐替尼单药作为该类患者的一线治疗选择。尽管K+L治疗未显著改善晚期HCC患者的OS及PFS,但也为研究者提供了其他的研究思路,例如,在中期HCC患者中评估K+L联合经动脉化疗栓塞(TACE)的疗效及安全性。LEAP-012是一项正在进行的3期试验(NCT04246177),旨在评估帕博利珠单抗联合仑伐替尼及TACE对比TACE在中期HCC患者中的疗效。
1.Llovet, J. M. et al. Lenvatinib plus pembrolizumab versus lenvatinib plus placebo for advanced hepatocellular carcinoma (LEAP-002): a randomised, double-blind, phase 3 trial. The Lancet Oncology 24, 1399–1410 (2023).
排版编辑:肿瘤资讯-Astrid











 苏公网安备32059002004080号
苏公网安备32059002004080号


