尽管不可切除的胆道癌的治疗取得了一定进展,但其预后仍然较差,同时目前暂未有关于胆道癌患者主要死亡原因的报道。该项研究1对143例不可切除的胆道癌患者进行回顾性评估,根据实验室数据、影像学检查等对患者主要死亡原因进行了分类,并分析了每个主要死因的生存率。研究发现晚期胆道癌患者的主要死亡原因是胆管炎、恶病质、肝功能衰竭、与肿瘤进展相关的其他原因以及肿瘤相关并发症。
研究简介
胆道癌是涉及胆道各个部位的癌症,包括肝内胆管和肝门周围胆管、胆囊、远端胆管树和法特壶腹2。不可切除的胆道癌的治疗主要为全身化疗,由基于吉西他滨的两种或三种药物联合组成3-5。然而,尽管近年来不可切除的胆道癌治疗取得了相当的进展,但其预后仍然很差。据报道,胆道癌在日本的生存率仅次于胰腺癌6。尽管如此,此前关于胆道癌患者主要死亡原因的报道却很少。既往一项研究探索了肝内胆管癌患者的主要死亡原因,并将其大致分为癌症和非癌症原因7。本研究旨在阐明无法切除的胆道癌患者的主要死亡原因。
研究结果
人口统计学和临床特征
本研究回顾性分析了无法切除的胆管癌患者。这项研究于2010年8月至2020年3月在日本东京国家全球健康与医学中心进行,研究分析了2021年9月30日死亡的胆管癌患者的主要死因。根据死亡日期前30天内的实验室数据、影像学结果和患者的医疗记录,将主要死亡原因分为(i)与肿瘤进展相关的主要原因,如(a)肝衰竭、(b)胆管炎、(c)恶病质;(ii)与肿瘤进展相关的其他原因,例如转移;以及(iii)并发症,如肾衰竭、心力衰竭、肺炎和手术并发症。
在纳入的143例不可切除的胆道癌患者中,有 126 例患者在观察期间死亡。 在这126例患者中,有18例患者因死亡日期前30天内没有实验室数据记录而被排除,其余108例患者进行了分析(图1)。诊断为不可切除胆道癌的患者特征如表 1 所示。患者中位年龄为 75 岁(范围:43-99 岁)。其中,化疗组52例患者(91.2%)和最佳支持治疗组33例患者(64.7%)的ECOG评分为0或1。关于原发肿瘤部位,29例为肝内胆管癌患者(26.9%),27例为肝门周围胆管癌患者(25.0%),36例为胆囊癌患者(33.3%),13例为远端胆管树胆管癌患者(12.0%),3例为壶腹癌患者(2.8%)。病理肿瘤类型方面,83例患者(76.9%)为腺癌,21例患者(19.4%)无法获得肿瘤组织。51例患者(47.2%)未接受其他抗癌治疗,20例患者(18.5%)在全身化疗前接受了原发灶切除术。
 图1 患者筛选流程图
图1 患者筛选流程图
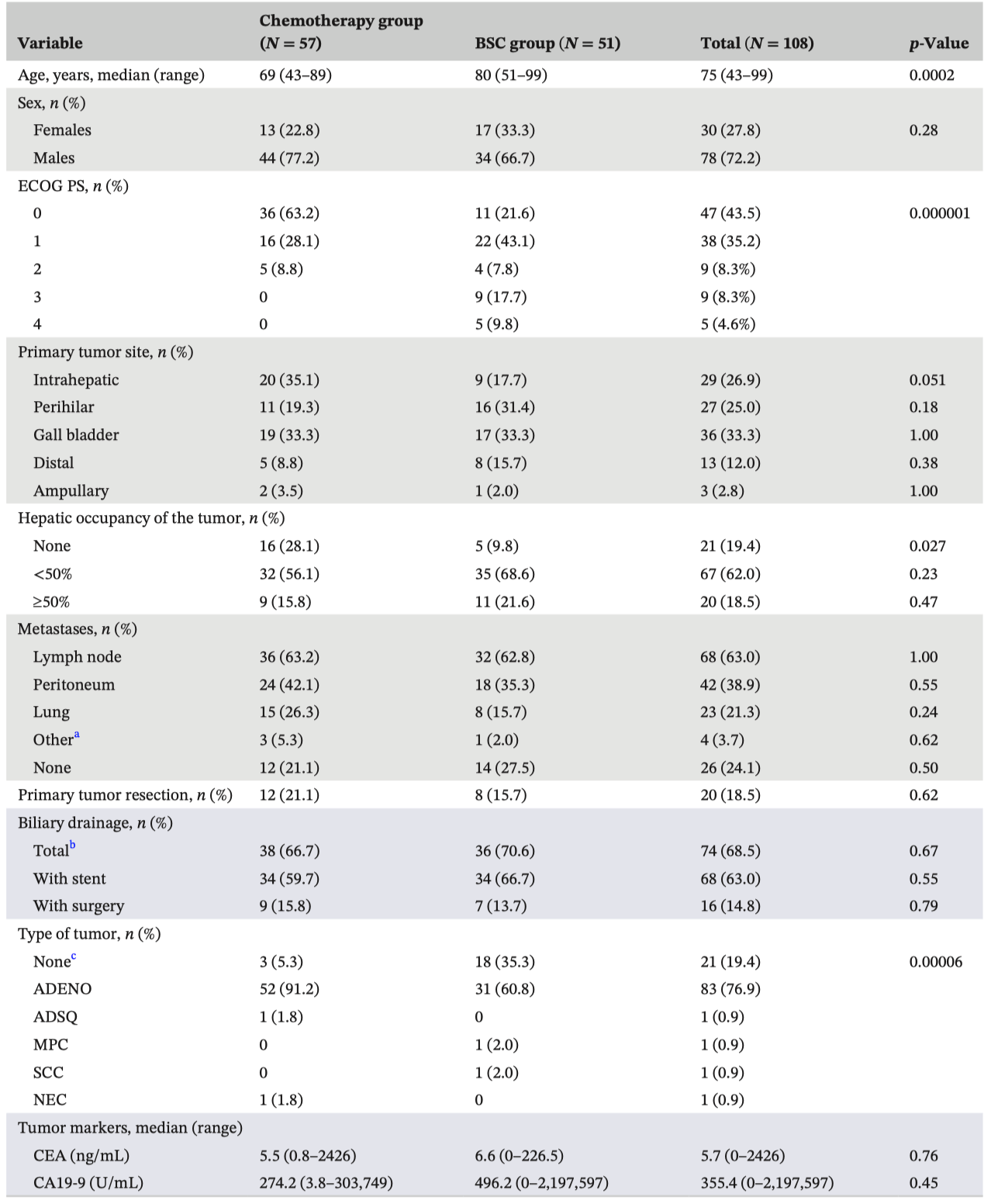 表1 患者诊断时临床特征
表1 患者诊断时临床特征
接受化疗组以及最佳支持治疗组的患者特征比较显示,最佳支持治疗组患者年龄较大,ECOG评分较差,肝脏肿瘤病变较多,并且包括了更多的组织病理学未诊断的患者。
主要死亡原因
患者主要死因如表2所示,最常见的主要死因是胆管炎,占33例(30.6%),其次是恶病质,占22例(20.4%),肝功能衰竭占10例(9.3%)。在18 例 (16.7%) 患者中发现了与肿瘤进展相关的其他主要原因。 25 例(23.2%)患者的死亡原因是并发症。化疗组及最佳支持治疗组之间主要死因方面没有显著差异。
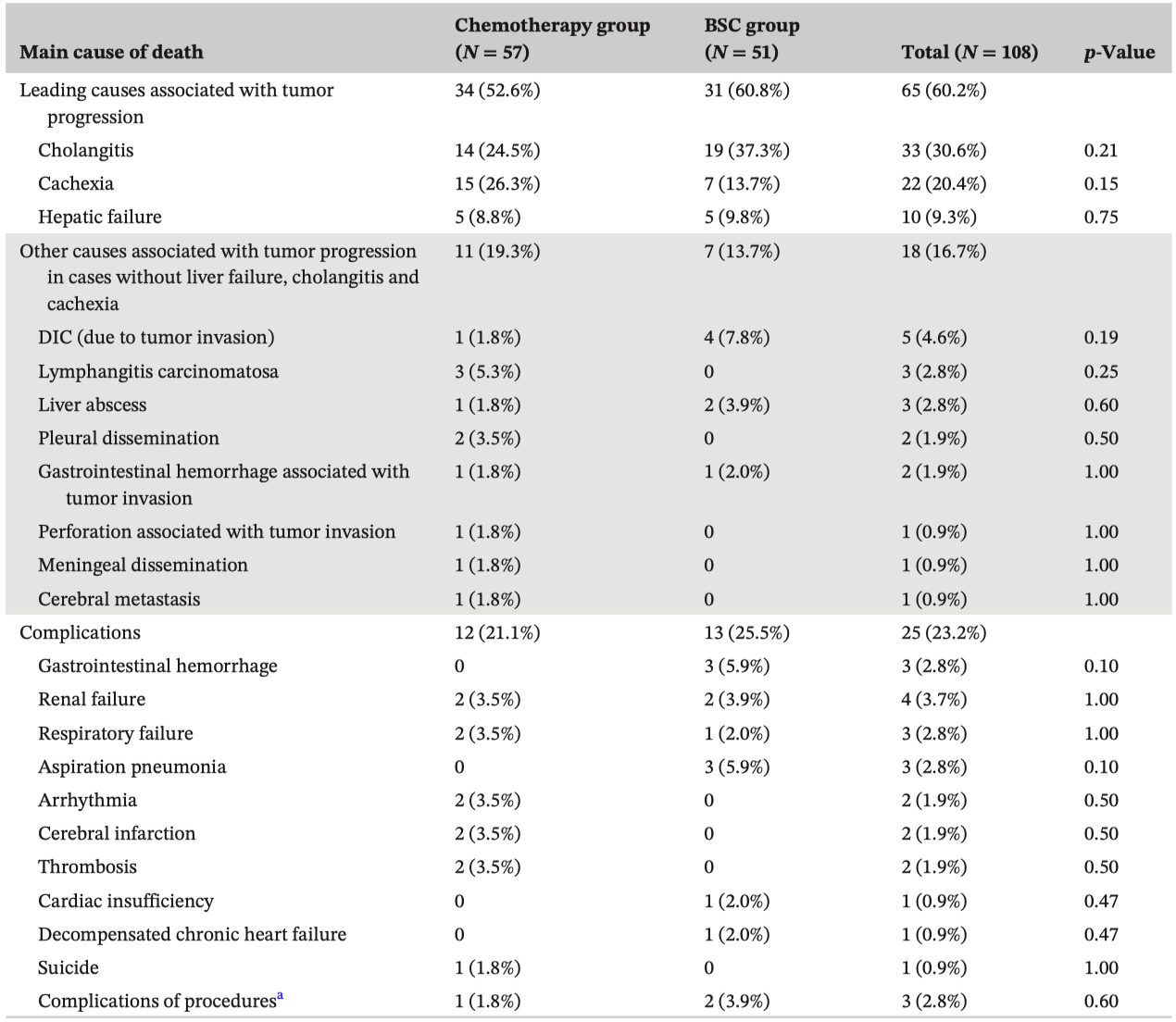 表2 患者主要死因
表2 患者主要死因
在未被诊断为以恶病质或胆管炎为主要死因的患者中,28例(40.6%)患有恶病质,36例(52.2%)患有胆管炎,其中18例(26.1%)同时患有恶病质和胆管炎。根据主要死因分层的患者临床特征显示,在主要死因为肝功能衰竭的患者中,肝脏肿块体积>50%的患者明显较多,腹膜播散的患者则明显较少。原发肿瘤部位与主要死亡原因没有相关性。
生存分析
总生存期定义为癌症诊断日期与死亡日期之间的间隔。如图2所示,化疗组的中位总生存为334.0天,最佳支持治疗组为75.0天。按主要死因分析的生存期在化疗组和最佳支持治疗组中均显示出显著的差异,在化疗组中恶病质的总体生存为453.0天,胆管炎为 499.0 天,肝衰竭为 567.0 天,其他原因导致肿瘤进展为 205.0 天,化疗组并发症为 327.5 天(p = 0.003)。在最佳支持治疗组中,恶病质为219.0天,胆管炎为69.0天,肝衰竭为34.0天,因其他原因导致肿瘤进展为93.0天,出现并发症为56.0天(p = 0.014)(图3和4)
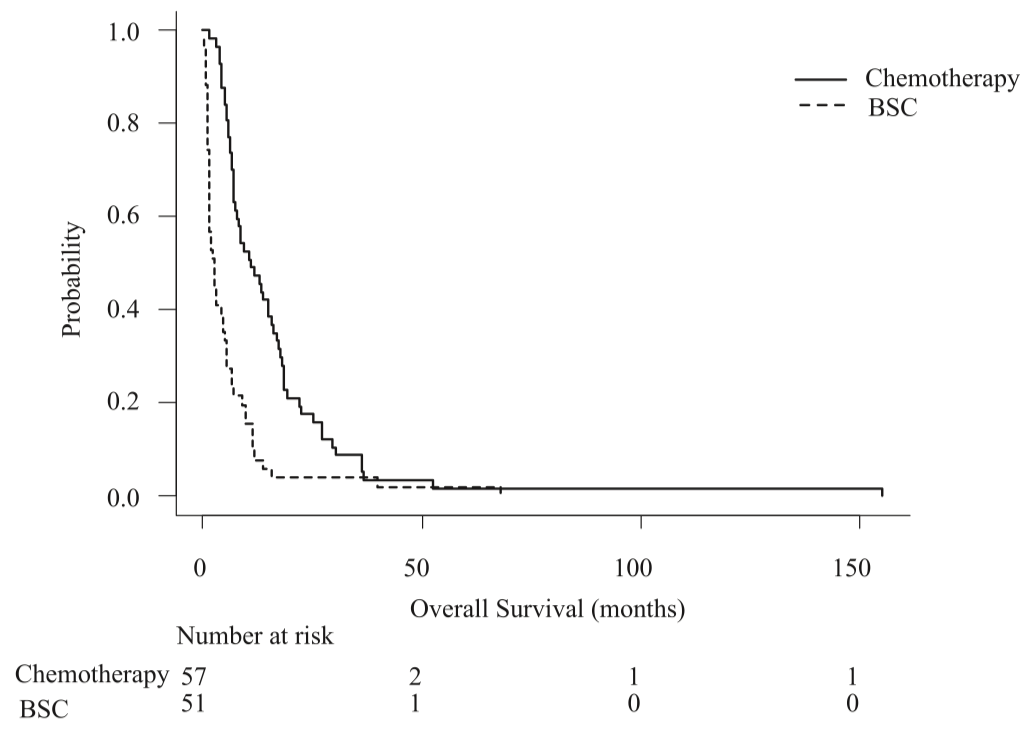 图2 Kaplan-Meier曲线显示接受最佳支持治疗的患者与接受化疗的患者的总生存率
图2 Kaplan-Meier曲线显示接受最佳支持治疗的患者与接受化疗的患者的总生存率
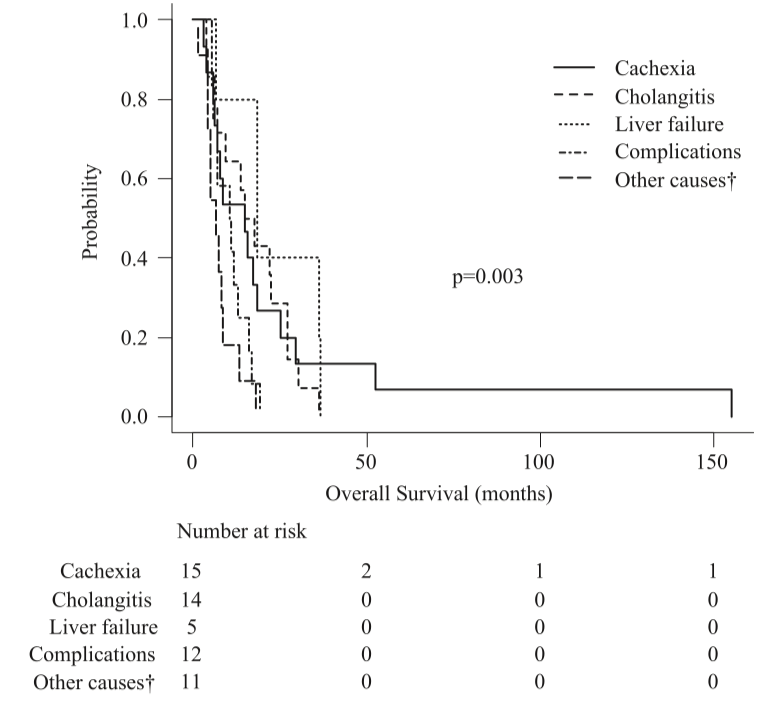 图3 Kaplan-Meier曲线显示化疗组根据死亡原因的总生存率
图3 Kaplan-Meier曲线显示化疗组根据死亡原因的总生存率
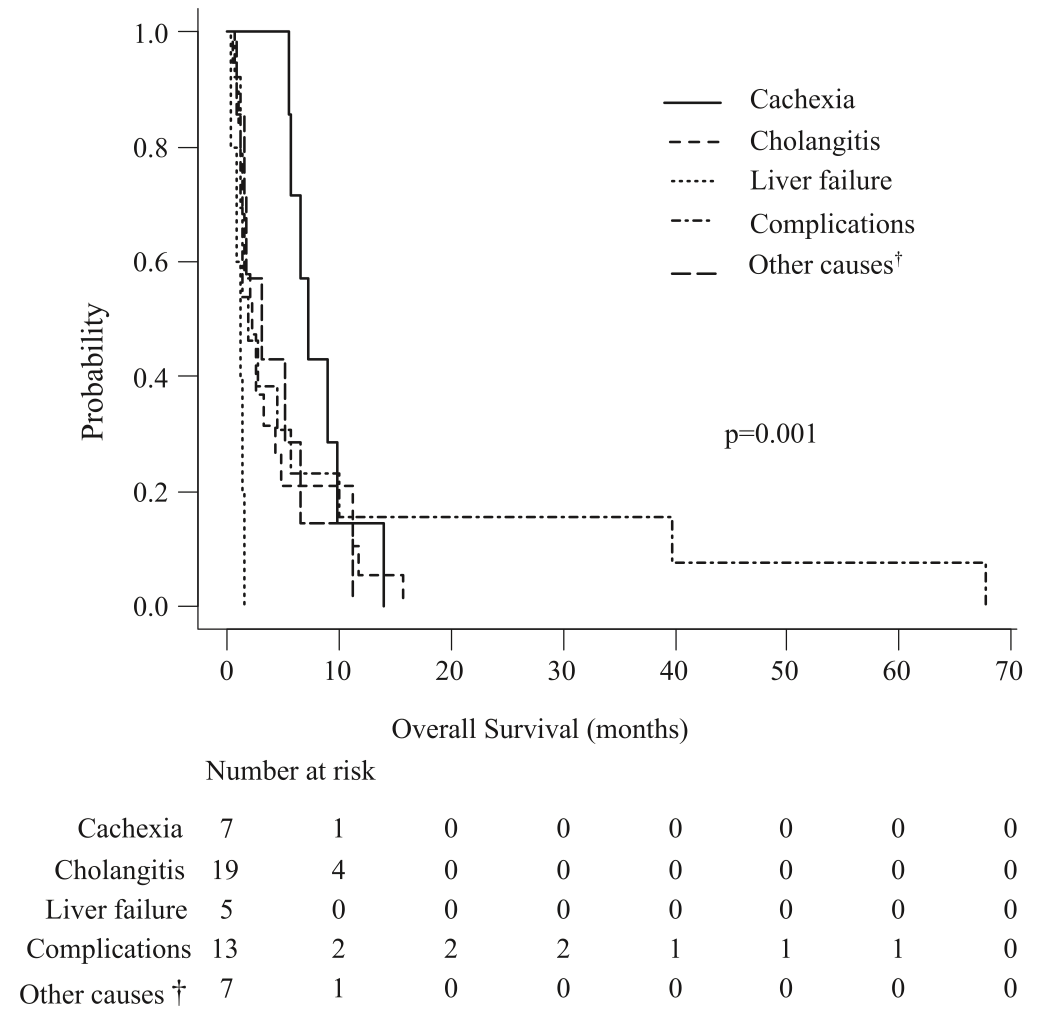 图4 Kaplan-Meier曲线显示最佳支持治疗组根据死亡原因的总生存率
图4 Kaplan-Meier曲线显示最佳支持治疗组根据死亡原因的总生存率
在多变量分析中,化疗组患者,特别是那些以肿瘤进展为主要死因的患者,其生存时间比以胆管炎为主要死因的患者要显著更短(p = 0.043)。在最佳支持治疗组的多变量分析中,以肝功能衰竭为主要死因的患者的生存时间短于以恶病质和胆管炎为主要死因的患者(p = 0.003、0.013)
研究讨论
Shahid等人研究指出胆管癌患者预后不良主要原因是恶病质、肝功能衰竭和胆管炎,然而没有详细的数据支持8。在本研究中,研究者评估了无法切除的胆道癌患者的主要原因。如何确定胆道癌患者的单一主要死亡原因往往十分困难,因为患者常合并有多种其他疾病或状况。
本项研究结果显示,胆道癌患者主要死亡原因为胆管炎(30.6%),其次是恶病质(20.4%)、肝功能衰竭(9.3%)、与肿瘤进展相关的其他原因以及并发症。研究还发现胆管炎 (40.6%) 或恶病质 (52.2%) 是许多胆道癌患者临终时的潜在病症。此外,化疗组和最佳支持治疗组之间主要死因的患病率和分布没有显著的差异。这一结果表明,死亡的主要原因可能不受患者是否接受化疗的影响。 然而,由于这是一项回顾性研究,这一研究结果可能受到一定偏倚影响。
此前的一项研究显示,癌症患者的主要死亡原因是感染(36%),其次是出血/血栓栓塞(18%),最后是恶病质,仅占1%9。在该项研究中,胆管炎非常常见,研究者认为这是胆道癌特有的疾病,尽管在某些情况下根据诊断标准可能很难准确诊断胆管炎。同时,较多的患者被诊断为恶病质,Sun等人的报道表明35.9%的晚期癌症患者和50%的肝胆管癌患者被诊断出恶病质10。
本项研究中中位总生存比既往报道要短3-5,11,12,这可能是由于纳入了更多的ECOG评分较差、年龄较大以及接受单一疗法治疗的患者。这项研究还分析了每种主要死因的生存率。多变量分析显示,在主要死因是“肿瘤进展的其他原因”的患者中,化疗组患者的总体生存显著缩短。此外,肝衰竭的患者在最佳支持治疗组中总体生存最短,但在化疗组中总体生存往往相对较长。 这一结果表明,肝衰竭是胆道癌末期最严重的疾病,因此治疗以减缓肝衰竭的发生可能是晚期胆道癌患者的最终目标。
同时,这项研究也存在一定的局限性。首先,这是一项回顾性观察性研究,由于体重值缺失以及未测量肌肉量和脂肪量,恶病质患者的实际数量可能远高于本项研究显示的数量。其次,这是一项单中心研究,患者数量有限。由于预测主要死亡原因被认为是决定治疗策略所必需,因此有必要进行一项多中心前瞻性研究,以更准确地确定胆道癌的主要死亡原因。总而言之,晚期胆道癌患者的常见死亡原因是胆管炎、恶病质、肝功能衰竭、与肿瘤进展相关的其他原因以及并发症。化疗组中各死因的总体生存存在明显差异。在胆管炎、恶病质、肝功能衰竭、其他与肿瘤进展相关的原因以及胆道癌并发症中,与肿瘤进展相关的其他原因显著缩短了化疗组患者的生存期,而肝衰竭则往往会降低最佳支持治疗组胆道癌患者的生存期。
1 Kimura-Seto, K. et al. Main causes of death in advanced biliary tract cancer. Cancer Med 12, 10889-10898, doi:10.1002/cam4.5794 (2023).
2 de Groen, P. C., Gores, G. J., LaRusso, N. F., Gunderson, L. L. & Nagorney, D. M. Biliary tract cancers. N Engl J Med 341, 1368-1378, doi:10.1056/nejm199910283411807 (1999).
3 Valle, J. et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med 362, 1273-1281, doi:10.1056/NEJMoa0908721 (2010).
4 Morizane, C. et al. Combination gemcitabine plus S-1 versus gemcitabine plus cisplatin for advanced/recurrent biliary tract cancer: the FUGA-BT (JCOG1113) randomized phase III clinical trial. Ann Oncol 30, 1950-1958, doi:10.1093/annonc/mdz402 (2019).
5 Ioka, T. et al. Randomized phase III study of gemcitabine, cisplatin plus S-1 versus gemcitabine, cisplatin for advanced biliary tract cancer (KHBO1401- MITSUBA). J Hepatobiliary Pancreat Sci 30, 102-110, doi:10.1002/jhbp.1219 (2023).
6 Nakagawa-Senda, H., Hori, M., Matsuda, T. & Ito, H. Prognostic impact of tumor location in colon cancer: the Monitoring of Cancer Incidence in Japan (MCIJ) project. BMC Cancer 19, 431, doi:10.1186/s12885-019-5644-y (2019).
7 Elgenidy, A., Afifi, A. M. & Jalal, P. K. Survival and Causes of Death among Patients with Intrahepatic Cholangiocarcinoma in the United States from 2000 to 2018. Cancer Epidemiol Biomarkers Prev 31, 2169-2176, doi:10.1158/1055-9965.Epi-22-0444 (2022).
8 Khan, S. A., Thomas, H. C., Davidson, B. R. & Taylor-Robinson, S. D. Cholangiocarcinoma. Lancet 366, 1303-1314, doi:10.1016/s0140-6736(05)67530-7 (2005).
9 Ambrus, J. L., Ambrus, C. M., Mink, I. B. & Pickren, J. W. Causes of death in cancer patients. J Med 6, 61-64 (1975).
10 Sun, L., Quan, X. Q. & Yu, S. An Epidemiological Survey of Cachexia in Advanced Cancer Patients and Analysis on Its Diagnostic and Treatment Status. Nutr Cancer 67, 1056-1062, doi:10.1080/01635581.2015.1073753 (2015).
11 Yonemoto, N. et al. A multi-center retrospective analysis of survival benefits of chemotherapy for unresectable biliary tract cancer. Jpn J Clin Oncol 37, 843-851, doi:10.1093/jjco/hym116 (2007).12 Ji, J. H. et al. Chemotherapy versus Best Supportive Care in Advanced Biliary Tract Carcinoma: A Multi-institutional Propensity Score Matching Analysis. Cancer Res Treat 50, 791-800, doi:10.4143/crt.2017.044 (2018).
*材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批编码:CN-125305
有效期至:2024/12/5
排版编辑:肿瘤资讯-小葛











 苏公网安备32059002004080号
苏公网安备32059002004080号


