化疗是晚期胆道癌的重要治疗手段之一,然而其疗效欠佳。如何预测化疗疗效对临床实践有着关键意义。最近多项研究表明,早期肿瘤缩小(ETS)和缓解深度(DpR)是反映各种癌症化疗疗效的有效指标。而在这项研究中1,研究者使用JCOG1113临床研究的数据评估了ETS和DpR与临床结果的关联,发现对于晚期胆道癌患者,吉西他滨联合S-1(GS组)不劣于吉西他滨联合顺铂(GC组)。研究者认为ETS和DpR是有效的预测疗效工具,可用于早期评估治疗效果。
研究背景
胆道癌包括肝内胆管癌、肝外胆管癌、胆囊癌和Vater壶腹癌。胆道癌的发病率和病因因地域而异。总体而言,胆道癌的发病率在亚洲国家普遍较高,而在西方国家相对较低2。
尽管根治性切除术是胆道癌唯一可能治愈的治疗方法,但患者在诊断时常常处于疾病晚期,无法达到根治。此外,接受根治性切除的患者同样常出现复发3。因此,大多数胆道癌患者需要行化疗治疗。根据既往随机对照试验的结果,吉西他滨联合顺铂(GC)是不可切除胆道癌的标准治疗方案4,5。与需要至少3小时水合的GC方案相比,吉西他滨联合S-1(GS)不需要水合。同时,与GC方案相比,GS方案治疗过程中血小板减少症和胃肠道毒性较少。因此,日本临床肿瘤学组(JCOG)肝胆胰肿瘤学组进行了一项随机III期试验(JCOG1113),证实了GS方案在晚期胆道癌患者的总生存方面不劣于GC方案6。根据这一结果,GS被视为晚期胆道癌的一种可选治疗方案。
早期肿瘤缩小(ETS)和缓解深度(DpR)被认为是反映化疗抗肿瘤效果的治疗标志物,已被报道与多种癌症的生存相关7-12。一项III期研究的后续分析显示,ETS与接受吉西他滨加奥沙利铂联合或不联合厄洛替尼治疗的晚期胆道癌患者的生存率之间存在关联13。在本研究中,研究者使用JCOG1113研究的数据来评估ETS和DpR与晚期胆道癌患者临床结果的关联性。
研究结果
该研究共包括了354例纳入JCOG1113的患者,患者按照第6周肿瘤减少是否≥20%被分为未达到ETS组和达到ETS组,另外,患者还以最大DpR是否≥40%分为低DpR组和高DpR组,患者纳入流程图如图1所示。在JCOG1113研究入组的354例患者中,289例患者具有可测量病灶。在具有ETS数据的277例患者中,77例患者(27.8%)在第6周达到了ETS≥20%。GC组和GS组分别有25.4%和30.4%的患者符合达到ETS组的标准(图1A)。在230例具有可用DpR数据的患者中,52例患者(22.6%)在12周内达到了DpR≥40%。GC组和GS组中达到高DpR组标准的患者比例分别为21.2%和24.1%(图1B)。
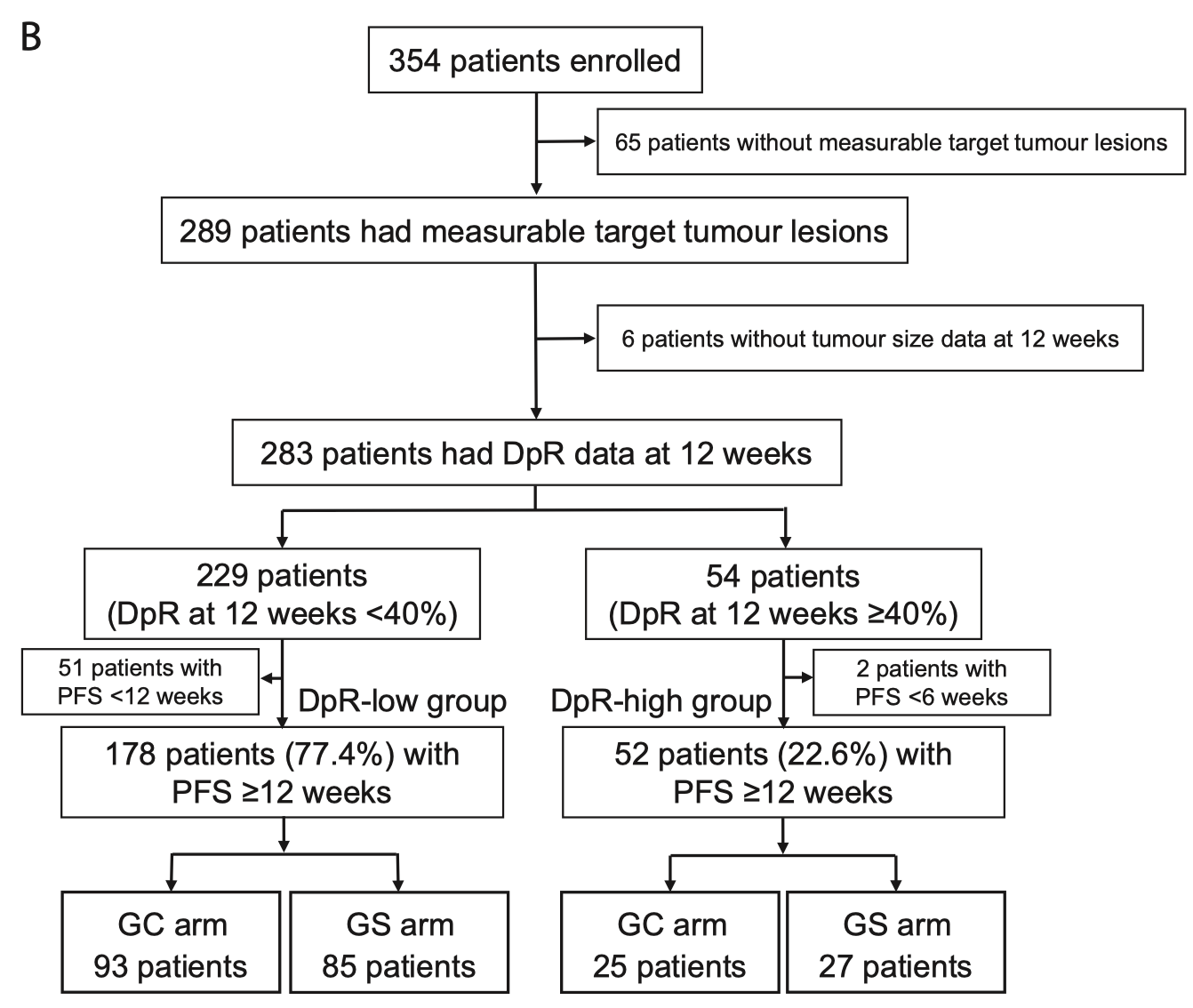
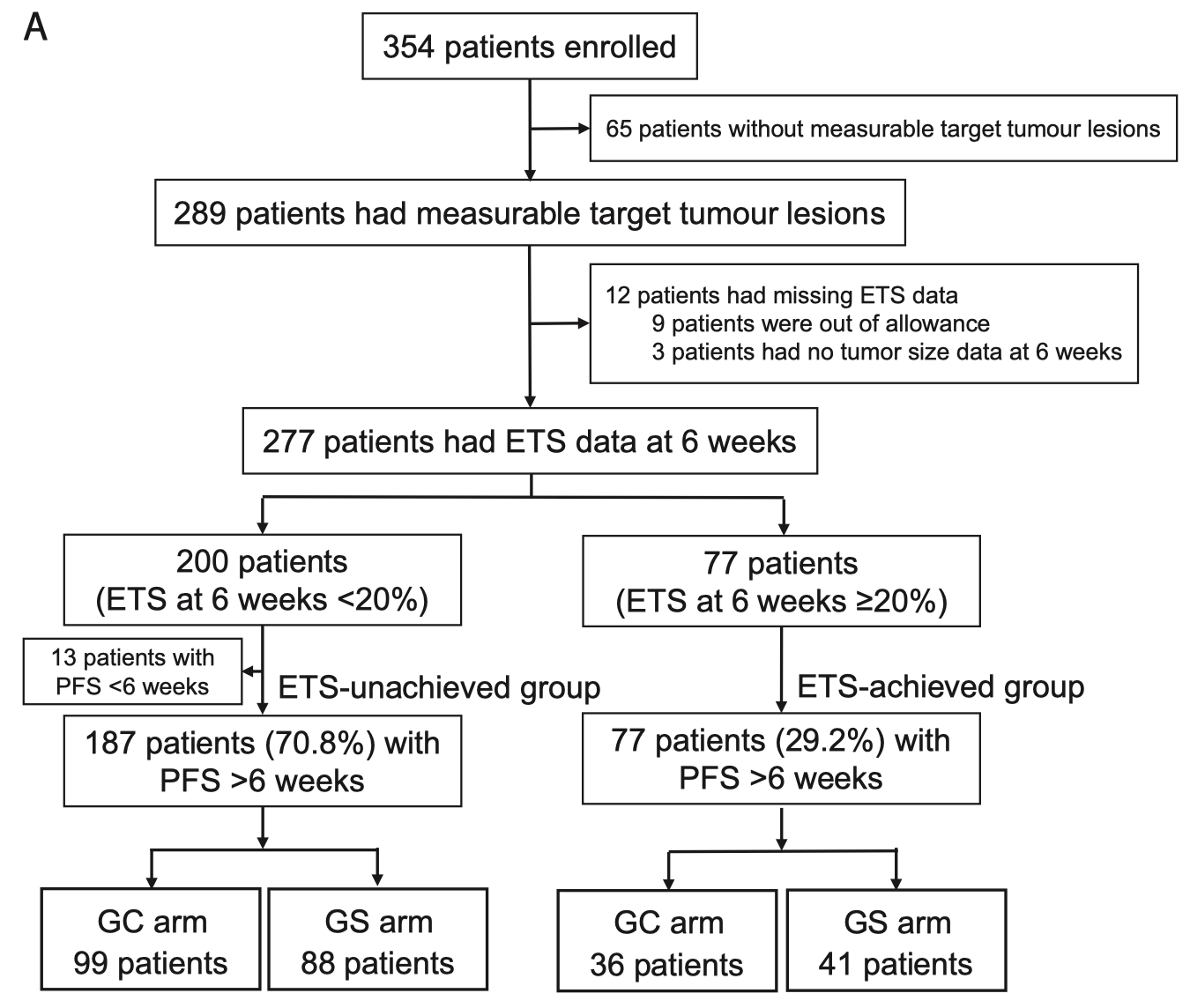 图1(A)未达到ETS组和达到ETS组分组流程图;(B)低DpR组和高DpR组分组流程图。
图1(A)未达到ETS组和达到ETS组分组流程图;(B)低DpR组和高DpR组分组流程图。
患者临床特征如表1所示。在达到ETS组中,GS组患者的可测量目标病灶直径大于GC组患者。入组后第6周的总体缓解、根据RECIST1.1版的最佳总体缓解以及最大肿瘤缩小的持续时间如表2所示。
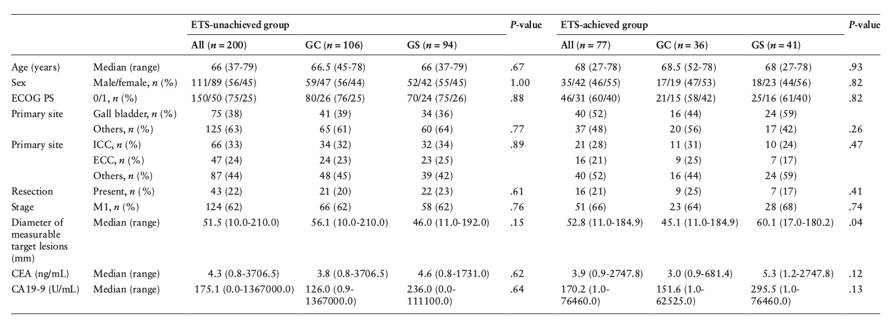 表1 未达到ETS组和达到ETS组患者临床特征
表1 未达到ETS组和达到ETS组患者临床特征
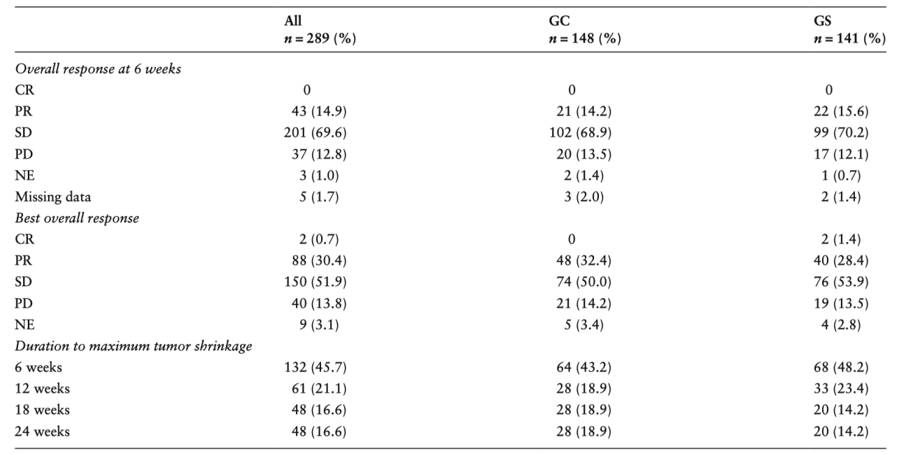 表2 患者总体缓解、最佳总体缓解以及最大肿瘤缩小的持续时间情况
表2 患者总体缓解、最佳总体缓解以及最大肿瘤缩小的持续时间情况
PFS和OS的多变量分析
基于ETS的PFS和OS多变量分析结果显示,达到ETS组的PFS和OS的HR分别为0.70(95%CI,0.52-0.93,P=0.01)和0.60(95% CI,0.44-0.81,P<0.01)。基于DpR的PFS和OS多变量分析结果显示,高DpR组的PFS和OS的HR分别为0.67(95%CI,0.48-0.94,P=0.02)和0.64(95%CI,0.46-0.90,P<0.01)。
ETS和DpR对GC和GS组PFS和OS的影响
研究发现,是否达到ETS是影响GC组PFS的预后因素(HR,0.64;95%CI,0.43-0.95)。而ETS对OS影响的HR在GC组中为0.67(95% CI,0.44-1.03),在GS组中为0.95(95%CI,0.64-1.42)。
高DpR同样被被认为是影响GC组PFS的预后因素(HR 0.63;95%CI,0.40-0.998)。DpR对OS影响的HR在GC组中为0.69(95%CI,0.43-1.11),在GS组中为0.88(95% CI,0.56-1.37)。
ETS对缓解持续时间的影响
研究发现达到ETS组的缓解持续时间比未达到ETS组更长。ETS对DoR影响的HR为0.76(95% CI,0.26-2.37)
ETS对PFS和OS预测的准确性
图2显示了ETS用于在12周评估PFS以及36周评估OS的能力的时间依赖性ROC曲线。ETS预测GC组中12周PFS和36周OS的曲线下面积分别为0.72和0.74。
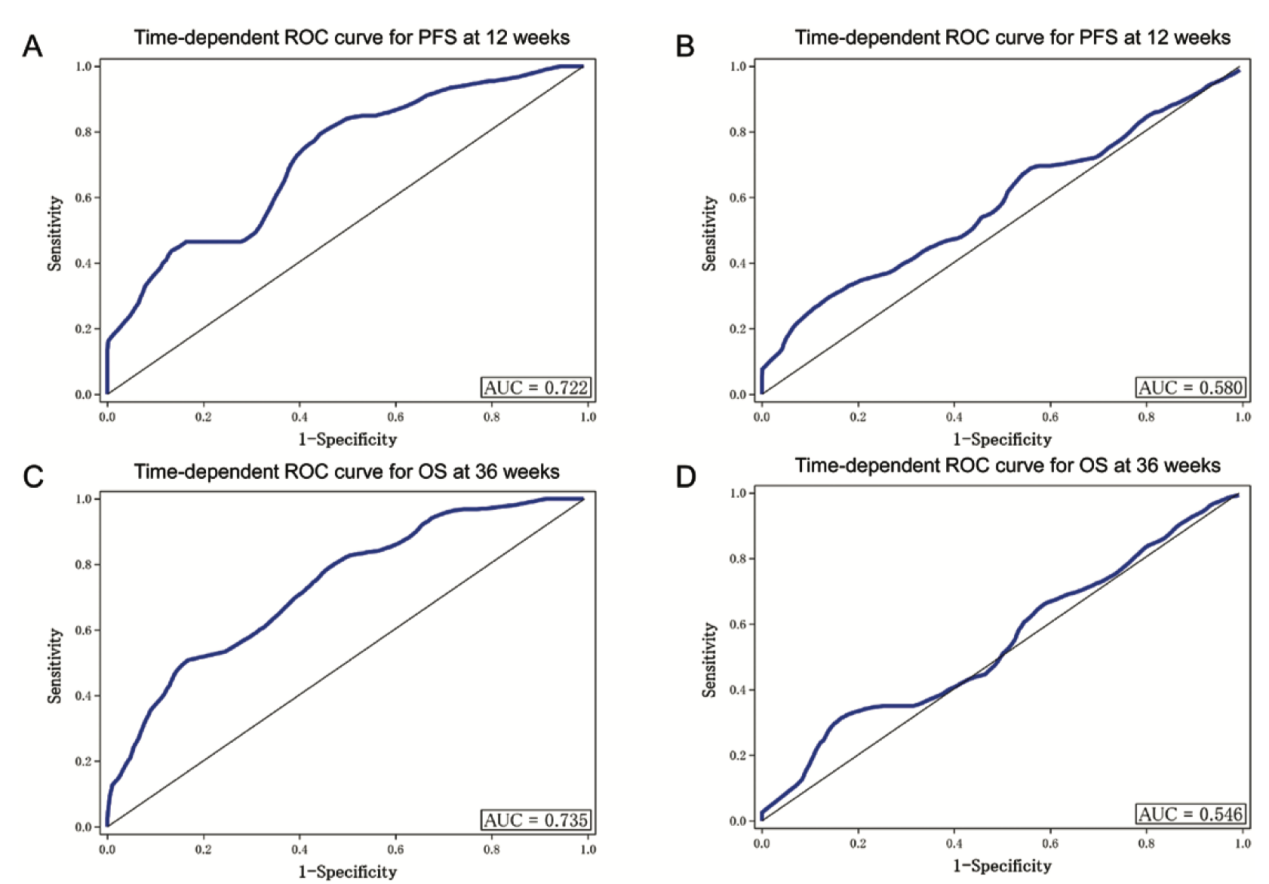 图2 ROC曲线分析评估ETS预测GC和GS组12周PFS和36周OS的能力。(A) GC组12周PFS的时间依赖性ROC曲线。(B)GS组12周PFS的时间依赖性ROC曲线。(C)GC组36周OS的时间依赖性ROC曲线。(D)GS组36周OS的时间依赖性ROC曲线。
图2 ROC曲线分析评估ETS预测GC和GS组12周PFS和36周OS的能力。(A) GC组12周PFS的时间依赖性ROC曲线。(B)GS组12周PFS的时间依赖性ROC曲线。(C)GC组36周OS的时间依赖性ROC曲线。(D)GS组36周OS的时间依赖性ROC曲线。
在达到ETS组中,属于GC组的大多数患者在12周后没有出现疾病进展。相反,GS组中大约25%的患者在12周时出现疾病进展,其中包括达到ETS组中的一些患者。此外,GS组中ETS程度与36周OS之间未发现统计学关联。根据ETS,与GC组相比,GS组的PFS和OS的HR接近1.0。
研究讨论
该研究是首篇评估ETS和DpR与接受GC或GS治疗的晚期胆道癌初治患者生存率之间关系的研究。通过多变量分析,研究者证明第6周的ETS和12周内的DpR与入组后的PFS和OS相关。当根据体能状态和肿瘤标志物等预后因素进行调整时,达到ETS组的患者进展和死亡风险分别降低了30%和40%。此外,在达到ETS组中,属于GC组的大多数患者在12周后没有出现疾病进展。
尽管针对晚期胆道癌的姑息化疗,包括二线化疗逐渐发展14-17,其预后仍然不佳。而且,临床上约有50%的患者由于肿瘤进展后身体状况不佳而没有接受二线化疗18。该研究认为ETS是晚期胆道癌患者治疗中一个有价值的预后因素。总体而言,这项研究表明应该对肿瘤进展的迹象进行更仔细的评估,特别是对于未到达ETS的患者。
既往的临床试验的汇总分析显示,根据RECIST标准所评估的缓解率与肿瘤进展时间和OS之间存在相关性19。RECIST是评估抗肿瘤效果的全球标准,其通常用于决定是否应继续化疗。然而,在RECIST中,没有定义评估肿瘤缩小(包括完全或部分缓解)的时间点。事实上,在JCOG1113研究中,入组后6周的总体缓解(14.9%)与最佳总体缓解(31.1%)之间存在明显差异。另外,ETS可在肿瘤治疗初期时进行评估,例如在治疗后6周。ETS在评估化疗反应和预后方面具有比RECIST更早评估的优势。在RECIST评估时,达到最大收缩所需的时间可能很长且不可预测,事实上在这项研究中,即使在18周后,依然有大约30%的患者出现这样的情况。因此在这方面ETS可能比RECIST标准更具优势。ETS作为临床决策工具,对于接受GC化疗方案的患者可能具有更大价值。在该研究中,研究者发现大多数接受GC化疗方案治疗并达到ETS的患者,在12周时并未出现肿瘤进展。在制定监测间隔和后续治疗时机,尤其是转化手术或其他局部治疗时,确保肿瘤在相对较长时间内不会进展的临床信息具有重要价值。
DpR是用来评价肿瘤缩小的常用指标之一。据报道,在转移性结直肠癌中,接受抗表皮生长因子受体抗体治疗的患者中,DpR高的患者比例高于接受抗血管内皮生长因子抗体治疗的患者,这种差异可能会影响随后的病程7。这项研究的结果表明,医生可能不需要根据局部晚期、肿瘤高负荷等因素来决定是否使用GC或GS化疗方案,因为两方案在肿瘤缩小效果方面没有明显的差异。因此,由于GS用药的便利性,其可被用做于晚期胆道癌的治疗选择。这项研究同样具有一定的局限性。首先,这是一项探索性分析,统计效力不足。由于探索性分析中的亚组分析,应谨慎地解释ETS对GC和GS组的影响。这意味着该分析包含许多偏倚。例如,在患者特征中,GS组的可测量病灶直径大于GC组。因此,需要进一步研究以确定GC和GS治疗之间是否存在差异。其次,本研究仅限于根据RECIST评估具有可测量病变的患者,而在无可测量病变的患者中无法评估ETS和DpR。第三,本研究分别将PFS<6周和<12周的患者排除在了ETS和DpR分析之外。最后,晚期胆道癌患者ETS的最佳截止值和时间点依然存在争议。尽管该研究对ETS采用了20%的临界值,但一项显示ETS与晚期胆道癌中PFS和OS相关的研究采用了10%作为临界值13。此外,之前的胃肠道癌症研究中DpR的临界值也各不相同20。因此,在晚期胆道癌中,将20%作为ETS临界值,以及将40%作为DpR的临界值需要进一步研究来确认。
1 Okano, N. et al. Early Tumor Shrinkage and Depth of Response as Predictors of Survival for Advanced Biliary Tract Cancer: An Exploratory Analysis of JCOG1113. Oncologist, doi:10.1093/oncolo/oyad220 (2023).
2 Ouyang, G. et al. The global, regional, and national burden of gallbladder and biliary tract cancer and its attributable risk factors in 195 countries and territories, 1990 to 2017: A systematic analysis for the Global Burden of Disease Study 2017. Cancer 127, 2238-2250, doi:10.1002/cncr.33476 (2021).
3 Ishihara, S. et al. Biliary tract cancer registry in Japan from 2008 to 2013. J Hepatobiliary Pancreat Sci 23, 149-157, doi:10.1002/jhbp.314 (2016).
4 Valle, J. et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med 362, 1273-1281, doi:10.1056/NEJMoa0908721 (2010).
5 Okusaka, T. et al. Gemcitabine alone or in combination with cisplatin in patients with biliary tract cancer: a comparative multicentre study in Japan. Br J Cancer 103, 469-474, doi:10.1038/sj.bjc.6605779 (2010).
6 Morizane, C. et al. Combination gemcitabine plus S-1 versus gemcitabine plus cisplatin for advanced/recurrent biliary tract cancer: the FUGA-BT (JCOG1113) randomized phase III clinical trial. Ann Oncol 30, 1950-1958, doi:10.1093/annonc/mdz402 (2019).
7 Heinemann, V. et al. Early tumour shrinkage (ETS) and depth of response (DpR) in the treatment of patients with metastatic colorectal cancer (mCRC). Eur J Cancer 51, 1927-1936, doi:10.1016/j.ejca.2015.06.116 (2015).
8 Piessevaux, H. et al. Use of early tumor shrinkage to predict long-term outcome in metastatic colorectal cancer treated with cetuximab. J Clin Oncol 31, 3764-3775, doi:10.1200/jco.2012.42.8532 (2013).
9 Cremolini, C. et al. Early tumor shrinkage and depth of response predict long-term outcome in metastatic colorectal cancer patients treated with first-line chemotherapy plus bevacizumab: results from phase III TRIBE trial by the Gruppo Oncologico del Nord Ovest. Ann Oncol 26, 1188-1194, doi:10.1093/annonc/mdv112 (2015).
10 Nishina, T. et al. Early tumor shrinkage and depth of response in patients with advanced gastric cancer: a retrospective analysis of a randomized phase III study of first-line S-1 plus oxaliplatin vs. S-1 plus cisplatin. Gastric Cancer 22, 138-146, doi:10.1007/s10120-018-0845-7 (2019).
11 Kaga, Y. et al. Early tumor shrinkage as a predictor of favorable outcomes in patients with advanced pancreatic cancer treated with FOLFIRINOX. Oncotarget 7, 67314-67320, doi:10.18632/oncotarget.12007 (2016).
12 Vivaldi, C. et al. Early Tumor Shrinkage and Depth of Response Evaluation in Metastatic Pancreatic Cancer Treated with First Line Chemotherapy: An Observational Retrospective Cohort Study. Cancers (Basel) 11, doi:10.3390/cancers11070939 (2019).
13 Kim, S. T. et al. Tumour shrinkage at 6 weeks predicts favorable clinical outcomes in a phase III study of gemcitabine and oxaliplatin with or without erlotinib for advanced biliary tract cancer. BMC Cancer 15, 530, doi:10.1186/s12885-015-1552-y (2015).
14 Ioka, T. et al. Randomized phase III study of gemcitabine, cisplatin plus S-1 versus gemcitabine, cisplatin for advanced biliary tract cancer (KHBO1401- MITSUBA). J Hepatobiliary Pancreat Sci 30, 102-110, doi:10.1002/jhbp.1219 (2023).
15 Abou-Alfa, G. K. et al. Pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: a multicentre, open-label, phase 2 study. Lancet Oncol 21, 671-684, doi:10.1016/s1470-2045(20)30109-1 (2020).
16 Abou-Alfa, G. K. et al. Ivosidenib in IDH1-mutant, chemotherapy-refractory cholangiocarcinoma (ClarIDHy): a multicentre, randomised, double-blind, placebo-controlled, phase 3 study. Lancet Oncol 21, 796-807, doi:10.1016/s1470-2045(20)30157-1 (2020).
17 Marabelle, A. et al. Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results From the Phase II KEYNOTE-158 Study. J Clin Oncol 38, 1-10, doi:10.1200/jco.19.02105 (2020).
18 Okano, N. et al. The Modified Glasgow Prognostic Score in Patients with Gemcitabine-refractory Biliary Tract Cancer. Anticancer Res 38, 1755-1761, doi:10.21873/anticanres.12412 (2018).
19 Eckel, F. & Schmid, R. M. Chemotherapy in advanced biliary tract carcinoma: a pooled analysis of clinical trials. Br J Cancer 96, 896-902, doi:10.1038/sj.bjc.6603648 (2007).
20 Xie, X., Li, X. & Yao, W. A narrative review: depth of response as a predictor of the long-term outcomes for solid tumors. Transl Cancer Res 10, 1119-1130, doi:10.21037/tcr-20-2547 (2021).
*材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批编码:CN-125307
有效期至:2024/12/5
排版编辑:肿瘤资讯-小葛











 苏公网安备32059002004080号
苏公网安备32059002004080号


