 【丁培荣教授讲难治性肠癌】系肿瘤资讯于2023年8月开展的专栏,本专栏将具有代表性的难治性肠癌病例讨论部分搬到网络进行连载,旨在为全国肿瘤医生提供一个学习平台,深化对难治性肠癌诊断和治疗的理解,将最新的科学研究和临床证据结合到日常实践中,最终造福为广大的肿瘤患者。
【丁培荣教授讲难治性肠癌】系肿瘤资讯于2023年8月开展的专栏,本专栏将具有代表性的难治性肠癌病例讨论部分搬到网络进行连载,旨在为全国肿瘤医生提供一个学习平台,深化对难治性肠癌诊断和治疗的理解,将最新的科学研究和临床证据结合到日常实践中,最终造福为广大的肿瘤患者。
导读
1)病例简介:本文报告一例BRAF突变的肝曲结肠癌并腹膜后淋巴结及肝多发转移患者的治疗经过。通过BRAFi+EGFRi+mFOLFOX6双靶+化疗的方案治疗后,肿瘤逐步缩小,并获得了手术切除达到NED的机会,且术后病理为pCR。
病史简介
1)病史摘要:
a) 初诊时间:2022年11月
b) 患者,男,31岁,因“右上腹痛1个月”就诊
c) 2022-10-18 出现右腹疼痛,无腹胀、腹泻、恶心、呕吐及肛门停止排便排气等不适,经对症处理后缓解,2022-10-26 外院行胸腹盆 CT示:肝曲结肠癌并不完全梗阻伴周围淋巴结转移、肝脏多发转移:右肺上叶尖段实性结节,考虑 MIA 与局灶炎症鉴别: 右下外基底段实性小结节,转移待排。未行肠镜检查。
d) 既往史: 10年吸烟史,余无特殊。
e) 家族史:父亲、爷爷患肾癌,具体不详。
查体:KPS 100分,浅表淋巴结(-),腹软,无压痛、反跳痛,无肌紧张。未触及腹部包块。肝脾肋下未触及。肠鸣音4次/分,肛门指检(-)。
2)初诊印象:
1) 肝曲结肠肿物伴淋巴结、肝多发转移
2) 肺结节性质待查
完善检查
1)实验室检查
2022-11-01肿瘤标志物:CEA 0.66ng/mL; CA199 15030 U/mL[Microsof1]
2)肠镜检查
2022-11-01 肠镜提示:近升结肠肝曲见菜花状肿物环腔生长,表面凹凸不平,肿物堵塞肠腔,无法继续进镜,质脆易出血。余结肠见多枚息肉,较大者位于降结肠,分叶状,直径约1.5cm,表面粗糙充血,未予处理(图1)。病理诊断: (近肝曲肿物活检)镜下形态符合中至低分化腺癌。 免疫组化:MLH1(+),PMS2(+),MSH2(+),MSH6(+),MGMT (+)。
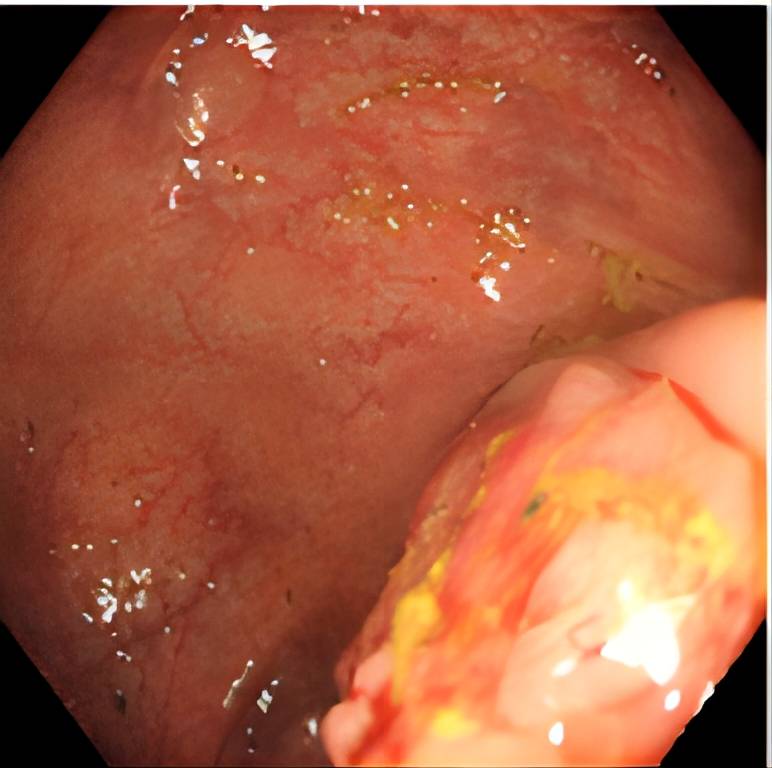
图1. 肠镜提示肝曲结肠环周肿物,堵塞肠腔,内镜不能通过。
3)影像学检查
2022-11-04 胸腹盆平扫+增强CT提示:结肠肝曲管壁增厚,考虑结肠癌。邻近结肠系膜区、肠系膜根部淋巴结,考虑转移。食管旁、双侧膈脚后、腹腔及腹膜后多发淋巴结,考虑转移可能。肝内多发结节、肿块,考虑转移瘤。右肺上叶尖段部分实性结节,性质待定,建议抗炎治疗后复查。左肺上叶前段磨玻璃结节,增殖灶?建议随诊。左肺上叶及右肺下叶小结节,考虑增殖灶可能(图2)。
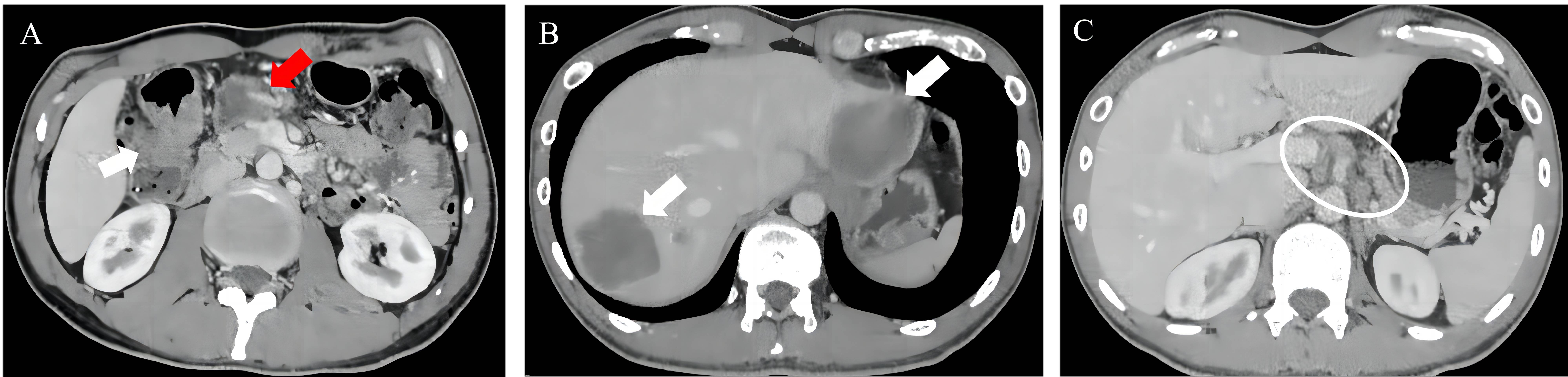
图2. 治疗前CT检查,图A白色箭头示肝曲环周病灶,红色箭头示肠系膜根部巨大转移淋巴结;图B白色箭头示肝内多发转移灶;图C示腹膜后多发淋巴结,考虑转移。
2022-11-04 肝脏MR普美显增强提示:结肠肝曲肠壁明显增厚,考虑结肠癌。上述病变周围、肠系膜根部、胸下段食管旁、双侧膈脚后、贲门旁、胃左、肝总动脉旁、腹腔干、腹主动脉旁多发肿大淋巴结,考虑转移。肝多发病变,考虑转移(图3)。
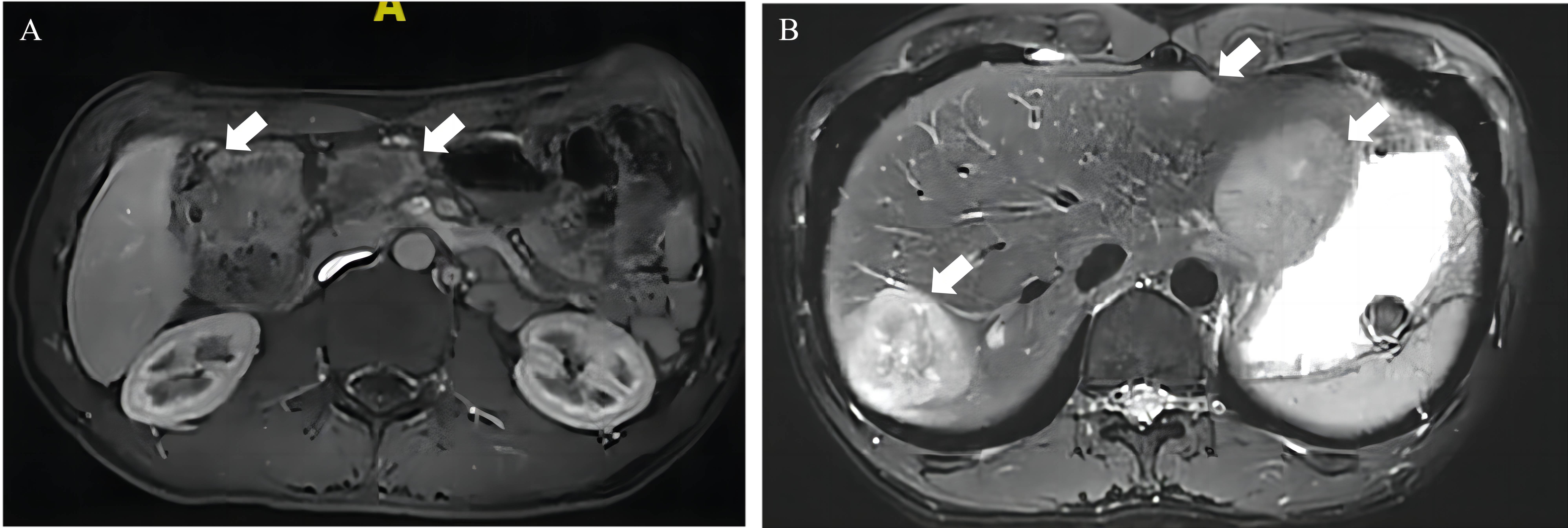
图3. 治疗前上腹部MR普美显增强检查,图A左侧箭头示肝曲环周病灶,右侧箭头示肠系膜根部巨大转移淋巴结;图B箭头示肝内多发转移灶。
4)基因检查
2022-11-14二代测序检测(Gene+Seq-2000)结果: 肿瘤突变负荷低 (TMB-L,1.92Muts/Mb,3%),微卫星稳定(MSS),相关基因变异: BRAF p.V600E EX15 突变。
诊断
1)肝曲结肠中至低分化腺癌并淋巴结、肝多发转移 IVB 期,BRAF V600E突变,MSS,TMB-L
2)肺部结节 性质待查
丁培荣教授查房分析
1) 意见:
a) 患者为肝曲结肠癌淋巴结、肝多发转移,基因检测提示BRAF突变。既往研究及我们的经验提示BRAF突变型晚期结直肠癌预后非常差,常规化疗有效率低,且一旦耐药后,进展非常迅速。指南推荐一线治疗为化疗+抗VEGFR治疗,目前小样本研究显示三药FOLFOXIRI+贝伐珠单抗ORR最高,中位OS可达17个月,但耐受性较差,超过80%的患者出现≥3级的化疗毒性。一线进展后二线可以考虑使用VIC方案或根据BEACON研究直接采用双靶方案BRAFi+EGFRi。
b) 该患者非常年青,有强烈的治疗意愿,目前身体情况好,KPS100分,但环周肿瘤,已经有不全肠梗阻表现,使用贝伐珠单抗风险高。
c) 2022年ASCO报告了BREAKWATER研究的早期结果,采用双靶BRAFi+EGFRi+两药化疗方案治疗BRAF突变型晚期结直肠癌结果令人非常鼓舞,尽管目前样本量还较少,生存数据尚未报告,但ORR超过了60%。
d) 结合患者情况,和目前的研究数据,推荐患者采用双靶BRAFi+EGFRi+FOLFOX方案治疗。
初始治疗
1)一线治疗方案选择:
2022-11-18至2023-05-16 因康奈菲尼不可获得,使用达拉非尼 150mg bid+西妥昔单抗 500mg/㎡ d1+mFOLFOX6方案(奥沙利铂150mg d1+LV 700mg d1+5-Fu 700mg d1+5-Fu 4g cvc 46h,q2w),每两个月评价,主要副反应:口腔溃疡I度及神经毒性I度
2)一线治疗评价:
a) C3后评价PR2022-12-23我院CT及MR提示:结肠肝曲管壁增厚,较前减轻,考虑结肠癌治疗后改变。 邻近结肠系膜区、肠系膜根部淋巴结,考虑转移,较前缩小。食管旁、双侧膈脚后、腹腔及腹膜后多发淋巴结,较前缩小。肝内结节、肿块,考虑转移瘤,较前缩小(图4)。
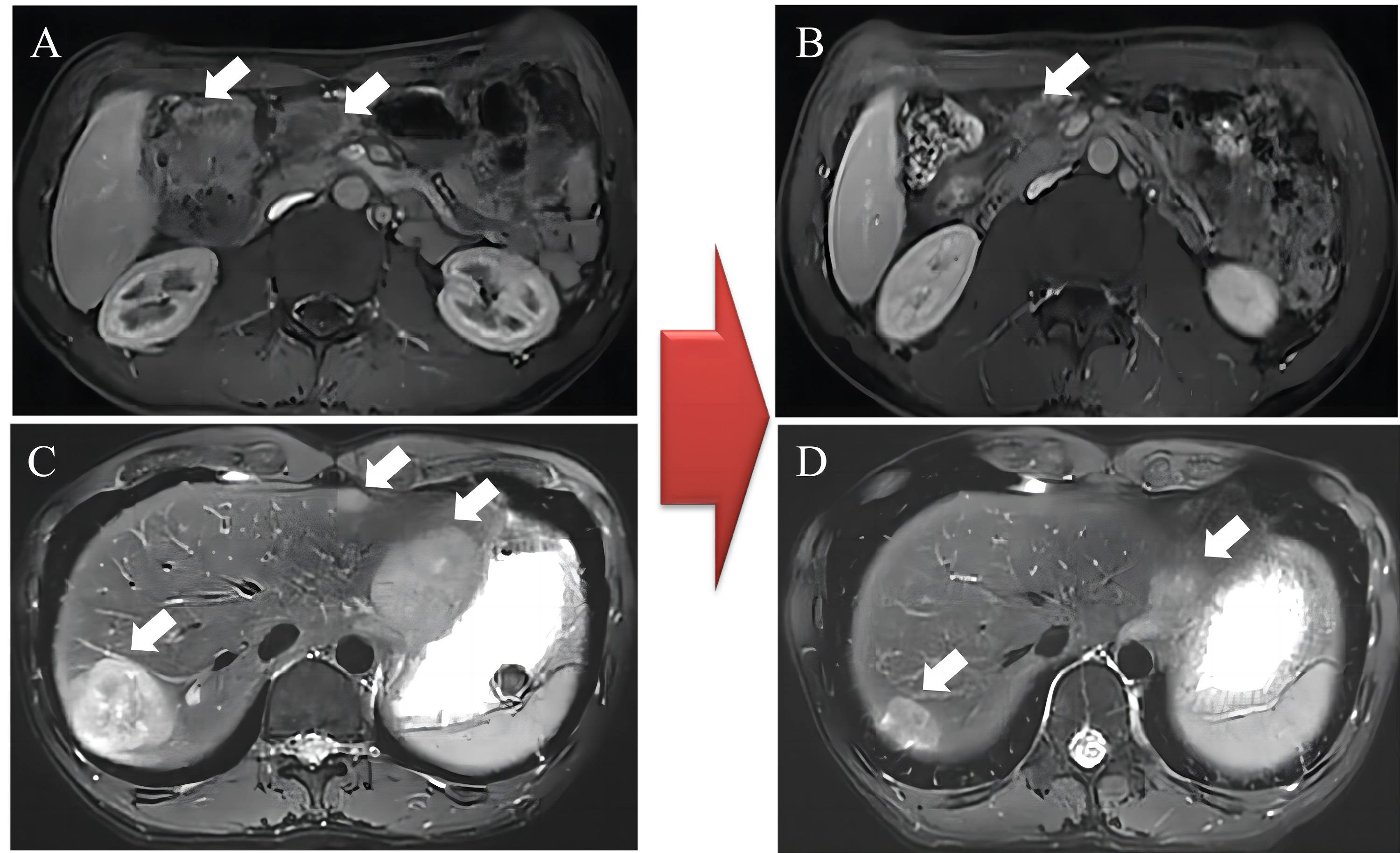
图4.图示C3后复查,肝曲结肠肠壁增厚,较前缩小;病变周围、肠系膜根部、腹腔干、腹主动脉旁多发淋巴结,较前减少、缩小;肝多发病变,考虑转移,较前减少、缩小。A、C示治疗前MR检查, B、D示3个疗程治疗后MR检查,箭头指示病灶。
b) C8后评价PR 2023-03-14我院CT及MR提示:结肠肝曲管壁增厚,较前减轻,考虑结肠癌治疗后 改变。 邻近结肠系膜区、肠系膜根部淋巴结,考虑转移,较前缩小。腹腔及腹膜后多发淋巴结,较前缩小、减少。肝内结节,考虑转移瘤,较前缩小(图5)。
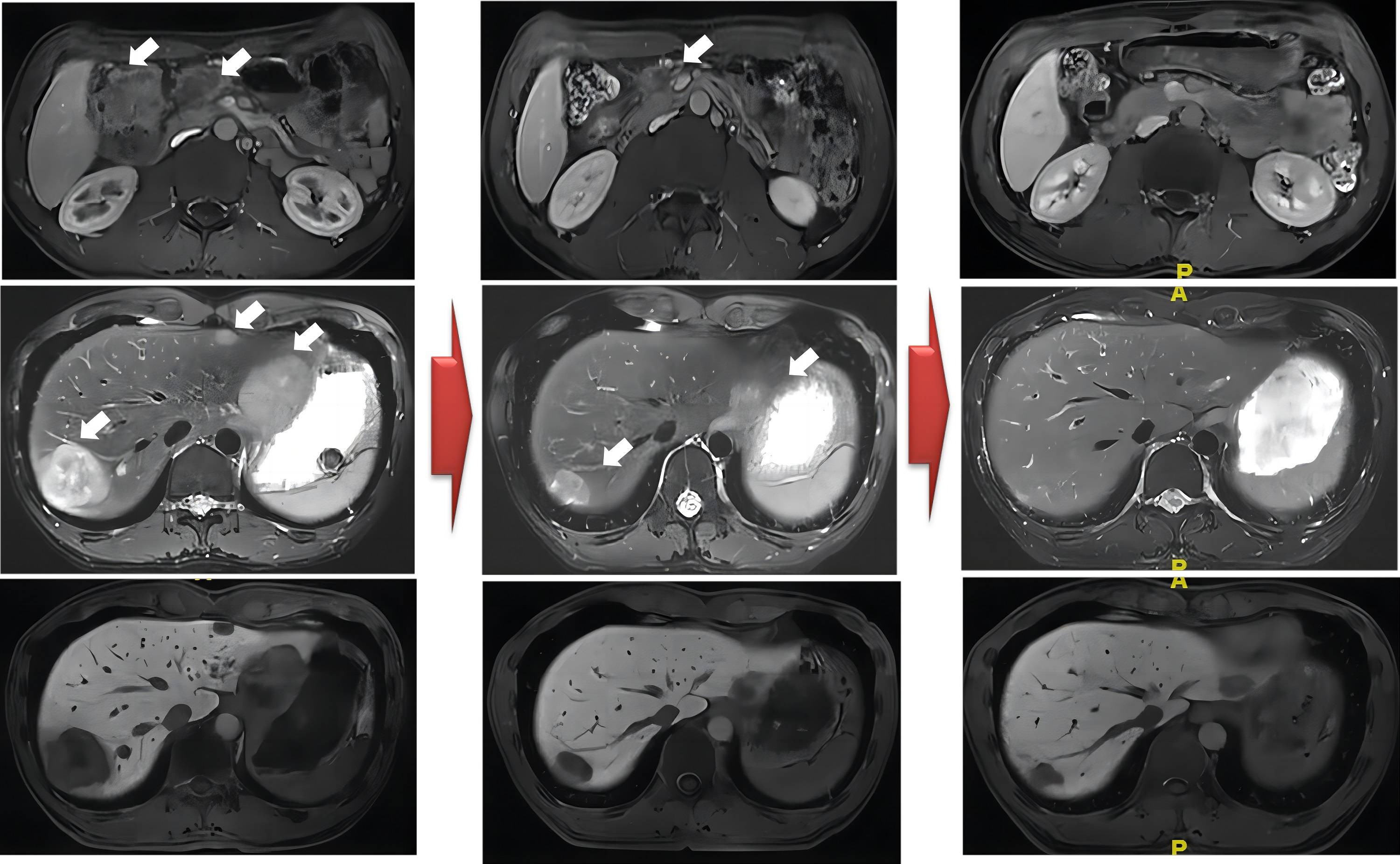
图5.C8后复查,肝曲结肠病灶及系膜根部巨大淋巴结已不明显,肝多发病变较前明显减少,缩小。
c) C12后评价PR 2023-05-19我院CT及MR提示:结肠肝曲管壁稍增厚,较前减轻,考虑结肠癌治疗后改变。邻近结肠系膜区、肠系膜根部淋巴结,考虑转移,大部分已显示不清。肝多发转移瘤,较前稍缩小。
d) 肿瘤标志物变化及主要毒副反应:CEA 一直不高,CA199持续下降,C8后降至正常(图6);主要毒副作用为1-2级口腔溃疡及1-2级皮疹和手足综合征,对症治疗后均可缓解。
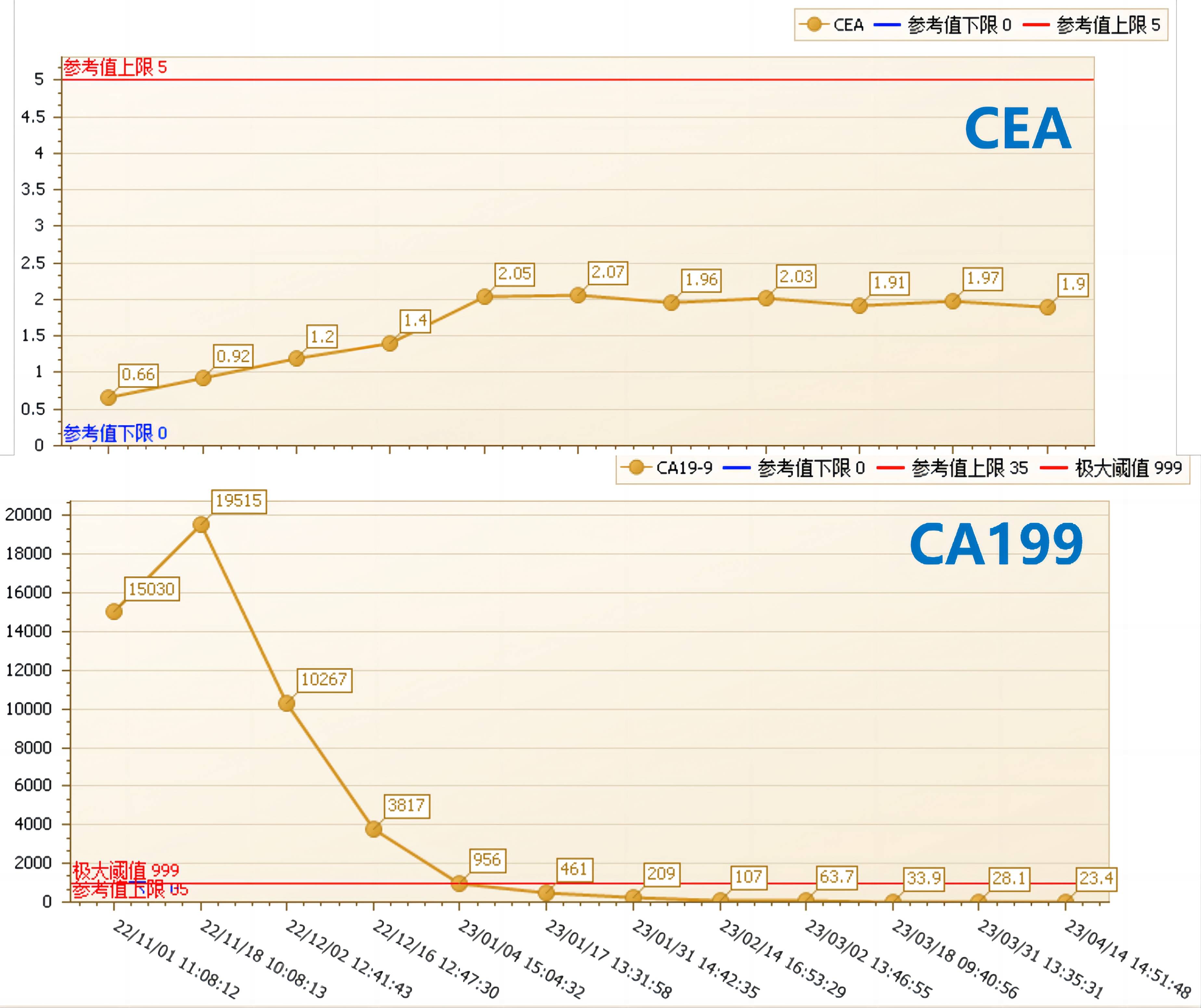
图6. 肿瘤标志物变化,CEA 一直不高,CA199持续下降,C8后降至正常。
丁培荣教授查房分析2
1) 意见:患者已行12程治疗,目前一般情况尚可,双靶+化疗,整体耐受可,未见明显外周神经毒性。复查提示原发灶及肝转移灶均较前逐渐明显缩小及减少,腹腔及腹膜后多发淋巴结均未见明显转移征象,肿瘤标志物恢复正常。目前可考虑局部治疗,原发灶+肝转移灶切除,探查腹膜后淋巴结,必要时可考虑腹膜后淋巴结放疗,争取达到NED;既往经验提示该类患者一旦停止化疗有迅速进展可能,需告知患者术后早期进展可能,若不考虑手术,可行达拉非尼+西妥昔单抗+5-Fu维持化疗;目前患者手术意愿较强,与患者及家属充分沟通后,考虑行手术探查,争取NED,侯床手术期间再行原方案化疗一程,衔接手术。
手术治疗
1) 手术:2023-07-07 全麻下行右半结肠切除+肝转移瘤切除+肝肿物微波消融术,术中探查未见明确腹膜后淋巴结,术后标本剖视:肝曲结肠见浅溃疡样疤痕,呈治疗后明显退缩改变,根部未及明确肿大淋巴结;肝结合术中B超可探及5枚结节,S2、S7结节行手术切除,余行微波消融(图7)。
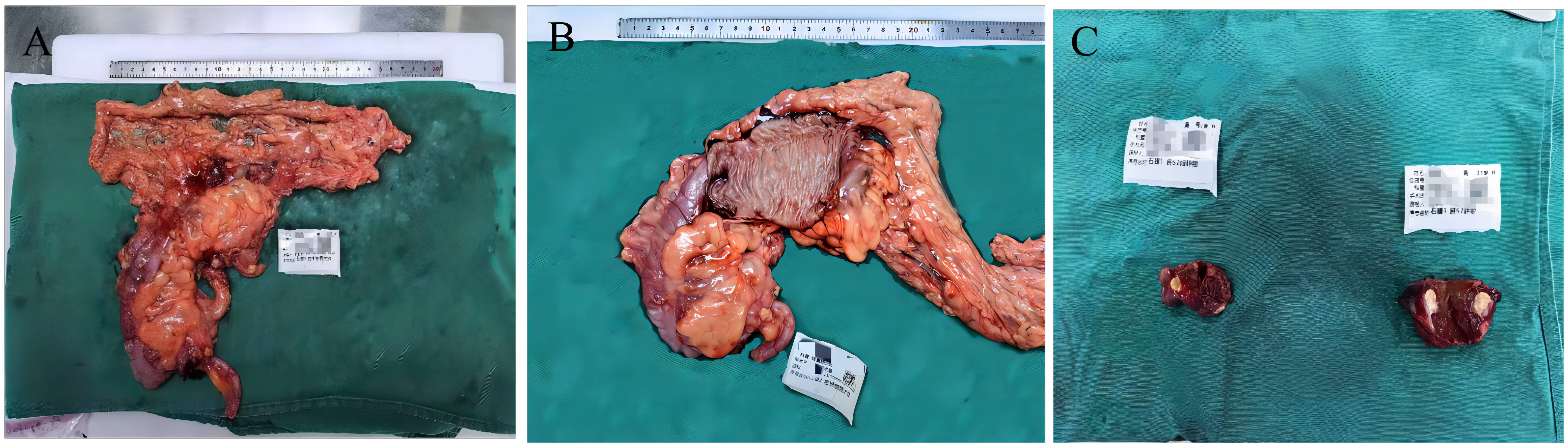
图7. 术后标本,A、B示右半结肠切除后标本,原发灶见浅溃疡样疤痕;C示切除后肝S2、S7转移结节。
2) 术后病理提示:原发灶及肝转移灶均为pCR。
(右半结肠大体):镜下送检肠粘膜局灶可见上皮缺损,周围腺上皮呈轻度不典型增生改变,可见纤维组织增生,淋巴细胞、浆细胞等炎症细胞浸润,结合病史,符合治疗后改变,未见癌残留,TRG 0级,淋巴结(0/14)。
(肝S2及S7肿物):镜下:肝组织中见胶原纤维组织增生、淋巴细胞浸润、泡沫细胞及多核巨细胞形成,结合病史,符合治疗后改变;未见明确肿瘤残留。
后续治疗
患者已行13程达拉非尼+西妥昔单抗+FOLFOX方案化疗,术后病理pCR,周围神经毒性1度,计划后续行达拉非尼+西妥昔单抗+5-Fu化疗3-6个月,术后3个月复查CT,密切随访。
病例小结
1)诊疗时间轴(图8)
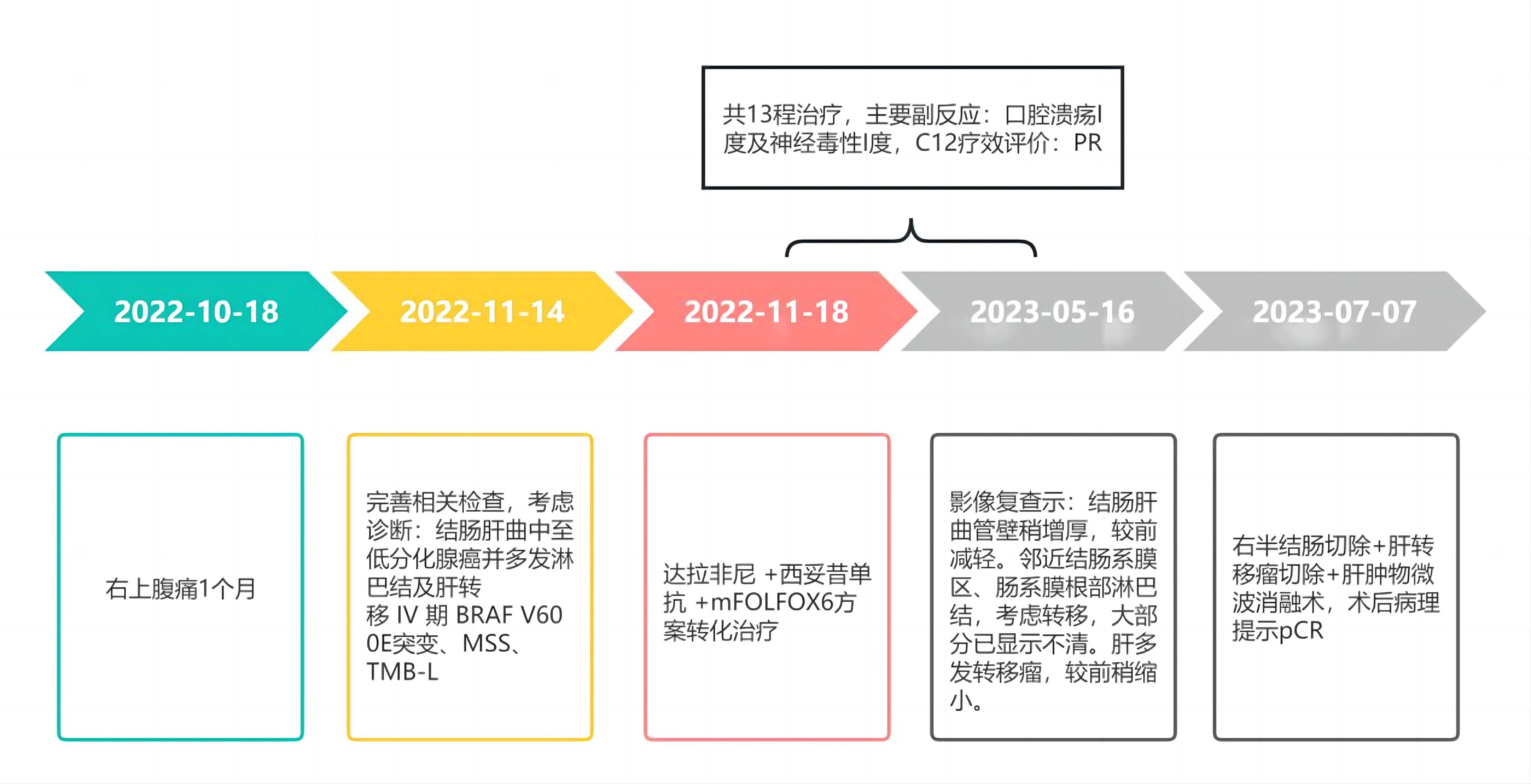
图8. 患者诊疗时间轴。
2) 诊治心得:
本病例初诊的时候即为晚期结肠癌,基因检测发现为BRAF V600E突变,这部分人群整体预后较差,是晚期结直肠癌重要的负向预后因子,预后远低于野生型患者。RAF蛋白是RAS-RAF-MEK活化的细胞外信号调节激酶,在MAPK/ERK信号通路中起着关键作用。目前报道的晚期结直肠癌BRAF突变率大约在8%-15%,除去MSI-H的患者,我国报告的发生率大概在5%左右,其中大部分为V600突变,该突变导致15号外显子第600位密码子的缬氨酸被替代,使其蛋白活性上调超过500倍,导致RAF/丝裂原活化蛋白激酶(MAPK)信号通路持续性激活,最终引起肿瘤细胞分化增殖、代谢、生长的改变。
随着在BRAF突变晚期结直肠癌人群中的不断探索,发现单用BRAF抑制剂在肠癌中可导致ERK对于EGFR的负反馈,再激活MAPK通路,从而抑制肿瘤细胞凋亡,促进肿瘤迁移增殖和血管生成,因此单药治疗的疗效不佳。通过靶向MAPK通路中的多个靶点,同时阻断EGFR和BRAF,理论上可克服这种负反馈性激活以获得更有效的抗肿瘤效果,相应的多靶点联合研究应运而生。
BEACON研究是首个探索使用BRAF/MEK抑制剂联合抗EGFR单抗后线治疗BRAF V600E突变型转移性结直肠癌患者的Ⅲ期研究(NCT02928224),结果表明三靶组和双靶组与对照化疗组相比均能显著改善患者的OS,并提高ORR。康奈非尼联合西妥昔单抗组mOS达到9.3个月,对照组为5.9个月;两组客观缓解率(ORR)分别为20%和1.8%。与标准化疗联合西妥昔单抗相比,康奈非尼联合西妥昔单抗显示出更优的疗效及可接受和可管理的安全性。三靶组和双靶组疗效无显著差异,但MEK抑制剂的加入增加了毒性,基于此,NCCN指南仅推荐双靶向方案用于BRAF V600E突变mCRC的二线及以上治疗,2021年CSCO指南新增BRAF抑制剂+西妥昔单抗±MEK抑制剂作为RAS野生/BRAF V600E突变型mCRC的二线治疗选择。该研究团队在二线及后线取得初步效果后,又开展了ANCHOR CRC研究,将BRAF抑制剂+EGFR抑制剂+MEK抑制剂用在了晚期 BRAF突变肠癌的一线治疗,ORR达到了47.4%,疾病控制率接近95%。中位PFS 5.8个月,OS达到 18.3个月。三靶治疗在一线取得了不错的OS,但DFS较短,个人考虑是一线进展后二线的化疗在其中也有重要的作用,而该团队的研究者随后提出的BREAKWATER研究似乎也佐证了这个猜想。2022年ASCO该团队报告了BREAKWATER研究的早期结果,采用双靶BRAFi+EGFRi+两药化疗方案治疗BRAF突变型晚期结直肠癌,结果令人非常鼓舞,尽管目前样本量还较少,生存数据尚未报告,但一线治疗ORR接近70%,DCR接近100%。
本例患者初诊生物学行为符合典型的BRAF V600E突变的表现,通过双靶联合治疗的策略获得了成功的转化,最终病理完全缓解,目前处于NED状态。这一病例让我们看到了双靶联合化疗为BRAF突变的晚期结直肠癌患者带来了新的希望,同时我们也非常期待Eric Van Cutsem教授的ANCHOR CRC研究以及后续的BREAKWATER研究为BRAF V600E突变患者的一线及后线治疗策略提供进一步的指导。相信随着研究的推进和新药新方案的研发,这类难治患者的预后会越来越好。
排版编辑:肿瘤资讯-HYC











 苏公网安备32059002004080号
苏公网安备32059002004080号


