多学科诊疗模式在肿瘤患者综合治疗中具有重要地位,通过联合肿瘤内科,肿瘤外科,放疗科,影像科、病理科以及其他相关科室对患者病情进行综合评估、分析及讨论,以共同制定科学、合理、规范的治疗方案,可以有效提高肿瘤患者的生存率,改善其生存质量。
第一场中国胸部肿瘤大会诊于2月25日举行。




本场大会诊病例


1.
病例介绍
▶病史概要
家族史:其父肠癌病史。
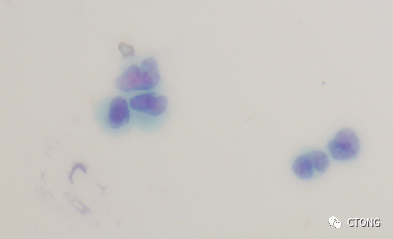
2019-02-19于我院行左锁骨上淋巴结活检,病理:转移性腺癌。免疫组化:肿瘤细胞 CK7(+++),TTF1(+++),免疫表型支持为肺来源。PDL1(22C3):TPS 10%+。
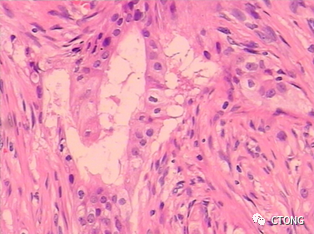
图1. 左锁骨上淋巴结示腺癌浸润
诊断:右上肺腺癌cT4(IpsiNod)N3M1a (对侧肺、胸膜)IVA期。
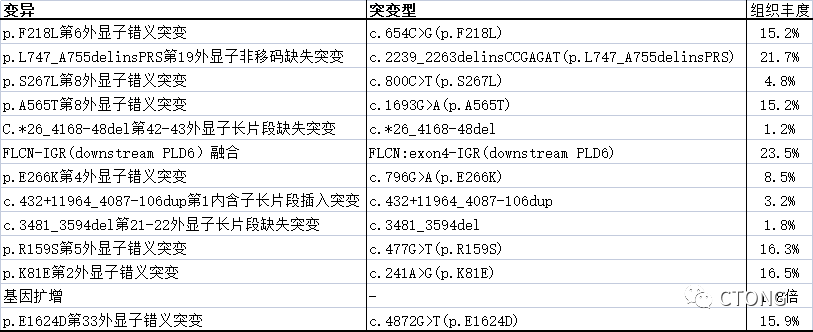
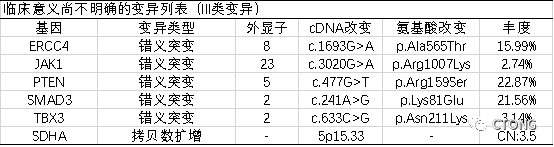
表1. NGS检测结果
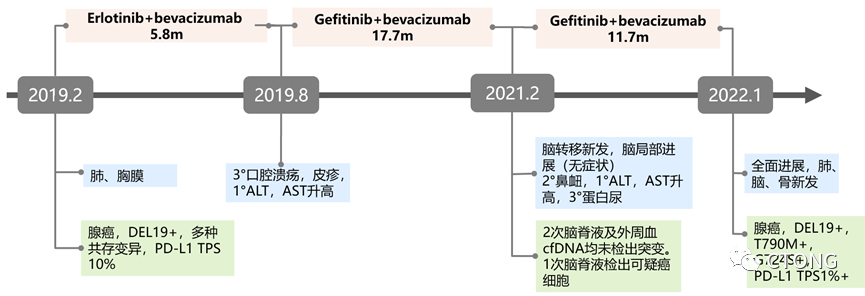
▶治疗经过
一线厄洛替尼+贝伐珠单抗(A+T),疗效评价部分有效(partial response,PR),出现3°口腔溃疡,皮疹;1°ALT,AST升高,予恩替卡韦,护肝治疗。
再活检明确耐药机制
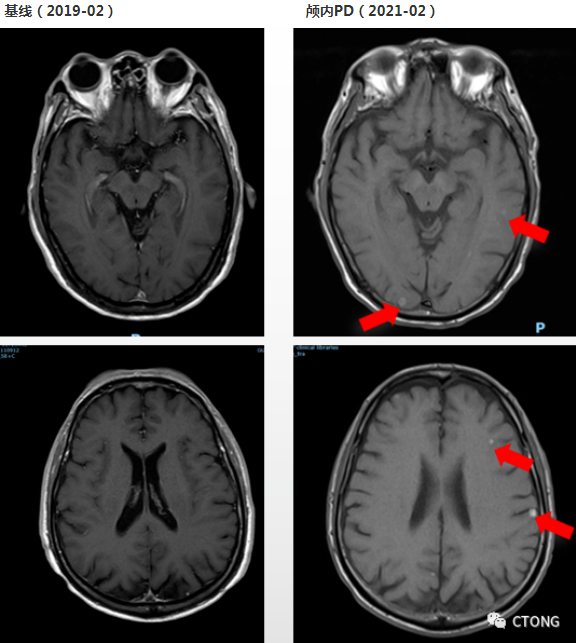
▪2021年2月,2021年3月先后两次行腰椎穿刺,送脑脊液NGS未见突变,脑脊液液基薄层细胞检测(TCT)1次未见癌细胞,1次见可疑癌细胞。送检外周血NGS未见突变。综上因脑脊液见癌细胞,结合临床考虑脑膜转移。
▪考虑患者为无症状脑及脑膜转移,遂继续吉非替尼+贝伐珠单抗治疗。
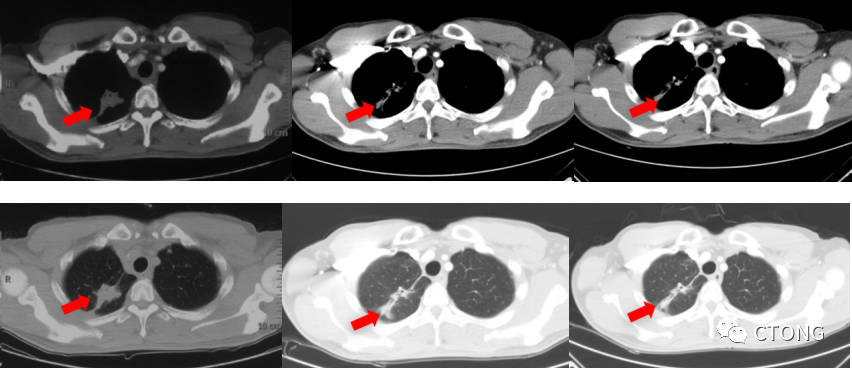
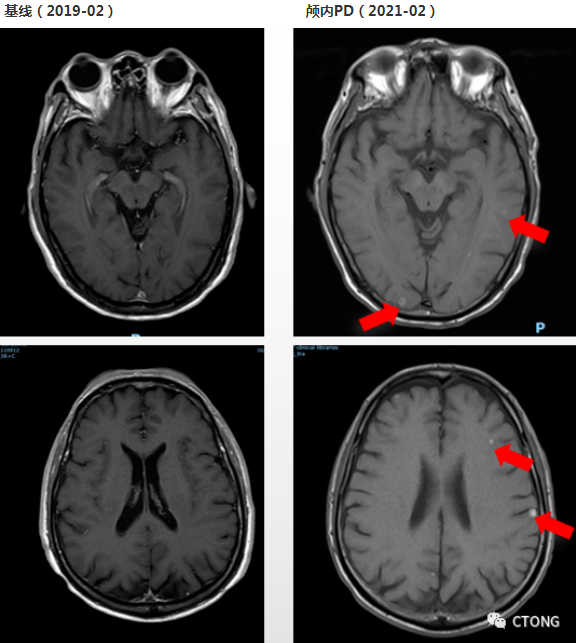
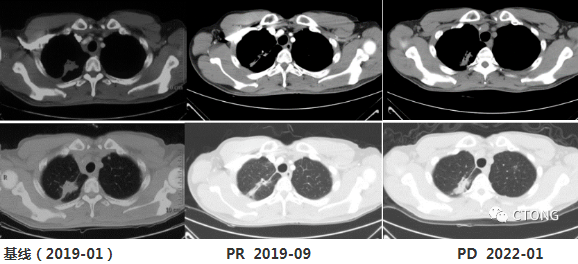
2022-1月复查评价PD,全面进展(原发灶增大,脑转移增多,新发胸骨及C7转移)
A.
C.
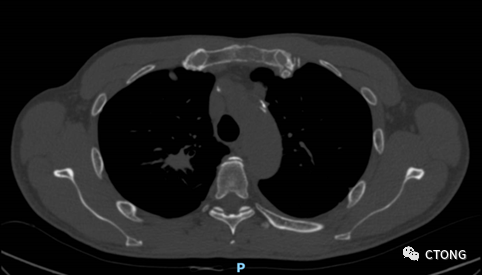
再活检明确耐药机制
右上肺肿物穿刺病理:肺浸润性腺癌,PDL1 : TPS 1%+, MET FISH(-);
2022-2-24组织520 gene panel NGS:EGFR DEL19 突变 (AF 24.41%),EGFR T790M 突变(AF 15.99%), EGFR 18 号外显子 G724S突变(AF 5.79%),及多种共突变。

病史小结
▶治疗时间轴
2.
病史补充
谢淑飞(广东省人民医院影像科副主任医师):
该患者的基线影像学未见明确的骨转移,目前影像学可见明确的骨转移病灶,呈溶骨性破坏,提示进展;颅内病灶逐渐增大,稍微增多,进展缓慢。
张永昌(湖南省肿瘤医院肿瘤内科副主任医师):
患者3°蛋白尿是24小时的尿蛋白定量吗?
不是,该患者的3°蛋白尿为尿常规中白蛋白+++或++++。
临床上患者尿常规中白蛋白+++时,若检测24小时尿蛋白定量,50%的可能出现<1g。这个可能需要完善的。患者使用贝伐珠单抗的过程中,有完善心脏彩超关于心脏EF值的评估和射血分数的评估吗?
患者基线时心脏EF值和射血分数的评估是正常的。
目前专家推荐使用贝伐珠单抗患者应每两个月进行一次心脏彩超检查,评估贝伐珠单抗的心脏充血性心力衰竭的毒性。
患者目前全面进展,颅内病灶增多,患者现在是否出现颅内相应的症状?
目前患者没有任何颅内转移症状表现的,没有恶心呕吐,没有肢体乏力,也没有头晕头痛等不适。
患者先后完善两次腰穿检查,脑脊液压力高不高?
不高。
请问病理科的颜主任,患者一次脑脊液可疑癌细胞能明确脑膜转移吗?
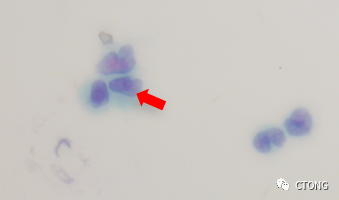
纠正病史汇报中的一个地方,患者由于毒性不耐受而非进展,将特罗凯换成易瑞沙,此种情况不能算成PFS1。患者的病例小结:该患者A+T模式治疗,总PFS为35.2个月,现出现毒副作用、疾病进展、脑膜转移,耐药样本检出 EGFR T790M 突变、EGFR G724S 及其他共存变异,所以目前我们应该如何处理?
3.
问题讨论
⌛ 问题一:
A. 是 B.否 C.不确定
投票结果:
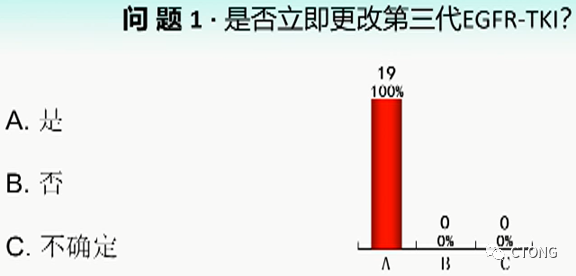
个人选择立即更改第三代EGFR-TKI。第三代EGFR TKIs第一它能透过血脑屏障,第二对于 EGFR 19del,它是优选。
吴一龙:
大家意见一致,在这个问题的基础上,该患者出现EGFR 18号外显子 G724S突变,是否会干扰医生诊疗的选择?
张永昌:
EGFR 19 deletion 可分为两种类型,EGFR 19 deletion 和EGFR 19 deletion-insertion,我们之前发表在European Journal of Cancer的研究提示1,30多例 EGFR 19 deletion-insertion 患者接受了奥希替尼治疗,mPFS=5m , OS=10m,这可能提醒我们,在制定更换方案的治疗决策时,需要考虑患者deletion类型以及伴随突变类型,虽然目前没有循证医学证据指导临床医生应该做什么决策,但是我们可以考虑更好的选择。
个人选择double剂量的奥希替尼或伏美替尼,第一点我们之前的研究提示EGFR19 deletion-insertion 患者使用奥希替尼疗效不佳1,同时我们的前期工作提示药物剂量需要再上一个台阶;第二点患者目前有脑转移,奥希替尼与伏美替尼在我们研究团队建的人源肿瘤异种移植(PDX)分别有差异的,但现在还不清楚具体机制是什么。
黄振华:
个人首先考虑第三代TKI,选择使用80mg标准剂量,患者现一代TKI治疗后进展,既往的临床研究double剂量考虑是TKI耐药后不存在T790M 突变的病人,或者出现脑膜转移。病理科的颜主任详细分析且明确了患者脑膜转移,对于脑膜转移病人,80mg剂量开始是有效的,后续疗效不佳时可再考虑double剂量。
董忠谊:
2018年Nature Communication一篇研究提到EGFR 18 号外显子 G724S 突变是T790M 突变使用奥希替尼后耐药出现的突变2。个人考虑,这个突变对于现在使用奥希替尼为原始突变而非耐药后突变,denovo突变对奥希替尼的疗效有影响吗?
个人支持先单药奥希替尼再评估其疗效,用事实证明这些伴随基因的影响是否值得改变单药标准治疗的决策。
⌛ 问题二:
若改用第三代TKI,是否继续联合贝伐珠单抗?
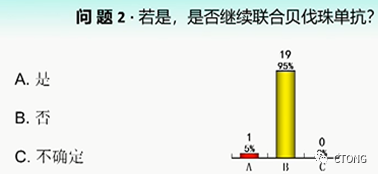
个人考虑继续联合贝伐珠单抗,主要有三点,第一,患者A+T治疗获益非常长时间,个人认为这应该来自于两类药物的合力。
⌛ 问题三:
对进展病灶(原发灶,转移灶)是否进行局部处理?
投票结果
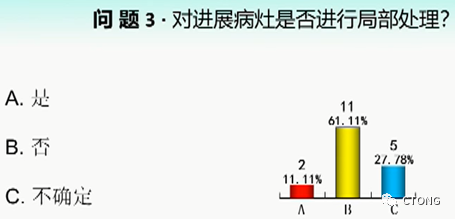
今年2月份四川省人民医院在JNCI发表了一项头对头的临床试验7,EGFR mutation病人接受EGFRTKI+放疗,这个研究取得了阳性的结果且伦理委员会提前终止研究。虽然我个人对研究有三个问题,已写comment,目前未得到最后的结果,但该研究提示EGFRTKI联合局部治疗有效。同时我们杨农主任团队进行的一项纳入300例患者的研究,包括TKI治疗和免疫治疗病人,发现病灶缩小时行放疗比病灶增大时疗效更好。局部治疗的原则是一定在全身病灶控制稳定的情况下再进行。
对于该患者,请问张永昌主任是否同意行鞘内注射?
个人不同意行局部处理。患者有两次颅内进展的时间点,第一次颅内出现新发病灶,当时没有靶向药物可用的情况下放疗科医生很容易选择进行放疗;现在第二次颅内进展,明确出现T790M 突变,患者有对应的靶向药物使用,个人不推荐进行鞘内注射。
吴一龙:
第一,SINDAS研究设计和研究发表时的主要观察终点不同,研究设计主要观察终点是PFS,研究发表时由于提前达到终点,研究发表时改为PFS率。第二,研究入组后骨转移患者占到73%,个人认为该人群存在非常大偏倚。Meta分析和Review的文献报道中骨转移病人一般不会超过60%。第三,该研究OS为25.5个月,与它同期发表的几篇文章比较,OS相差较大,文章并没有披露研究后面的细节。
目前靶向治疗和免疫治疗时代,肿瘤外科医生有更多的机会参与到晚期病人的治疗中。对于这种晚期病人的进展,病灶的局部治疗什么时候介入?总的原则应该是在全身病灶控制的情况下外科医生再介入,可能会给病人带来最大的PFS获益。这个病人目前全面进展,个人觉得应该从全身治疗考虑,患者目前无症状,局部处理可以往后,而且NGS检测提示有效靶点T790M突变。后续根据全身治疗后复查情况再决定是否干预。
吴一龙:
SINDAS研究是我们中国的骄傲,由四川省人民医院团队牵头,今年年初在JNCI发表,引起较多评论,其中包括张永昌主任提到的comments,最大的一个问题是为什么这些病人OS和PFS如此短?研究结束时间太早,EGFR突变病人第一次进展后往往仍有许多药物选择。希望数据能够进一步的补充,但是该研究已经告诉我们,EGFR突变病人一开始TKI+局部治疗,PFS明确获益。
我提出一个疑问,关于奥希替尼联合贝伐珠单抗,现在已经观察到几项I期或II期研究,包括WJOG8715L研究、WJOG9717L研究,一线使用时是奥希替尼+贝伐珠单抗,二线使用时研究纳入的人群是T790M阳性病人,但是纳入人群早期一线是单纯靶向治疗,虽然总体的PFS、OS获益不显著,我们也注意到它的IPFS实际上多方获益的,对于脑症状明显的病人,是否应该考虑?第二个问题,一线A+T模式而不是单纯靶向的情况下,贝伐珠单抗跨线治疗是否有意义?这也需要进一步探讨的。
△上述内容由讨论现场录音整理,经与会专家确认
4.
MDT小结
2. Fassunke J, Müller F, Keul M, et al. Overcoming EGFR(G724S)-mediated osimertinib resistance through unique binding characteristics of second-generation EGFR inhibitors. Nature communications 2018;9:4655.
3. Zhang Y, Zeng L, Zhang X, et al. Clinical and molecular feature-based nomogram model for predicting benefit from bevacizumab combined with first-generation EGFR-tyrosine kinase inhibitor (TKI) in EGFR-mutant advanced NSCLC. BMC medicine 2021;19:245.
4. Akamatsu H, Toi Y, Hayashi H, et al. Efficacy of Osimertinib Plus Bevacizumab vs Osimertinib in Patients With EGFR T790M-Mutated Non-Small Cell Lung Cancer Previously Treated With Epidermal Growth Factor Receptor-Tyrosine Kinase Inhibitor: West Japan Oncology Group 8715L Phase 2 Randomized Clinical Trial. JAMA Oncol 2021;7:386-94.
5. Jiang T, Zhang Y, Li X, et al. EGFR-TKIs plus bevacizumab demonstrated survival benefit than EGFR-TKIs alone in patients with EGFR-mutant NSCLC and multiple brain metastases. European journal of cancer (Oxford, England : 1990) 2019;121:98-108.
6. Soo RA, Han JY, Dafni U, et al. A randomised phase II study of osimertinib and bevacizumab versus osimertinib alone as second-line targeted treatment in advanced NSCLC with confirmed EGFR and acquired T790M mutations: the European Thoracic Oncology Platform (ETOP 10-16) BOOSTER trial. Annals of oncology : official journal of the European Society for Medical Oncology 2022;33:181-92.
7. Wang XS, Bai YF, Verma V, et al. Randomized Trial of First-Line Tyrosine Kinase Inhibitor With or Without Radiotherapy for Synchronous Oligometastatic EGFR-Mutated NSCLC. Journal of the National Cancer Institute 2022.
以上信息转自CTONG官方微信平台
-End-











 苏公网安备32059002004080号
苏公网安备32059002004080号


