在2021成功举办“广东大会诊”的基础上,为了汇聚更大范围内的专家智慧,更广泛地推广肺癌多学科专家诊疗模式,广东省医学会肺部肿瘤学分会及广东省临床试验协会/中国胸部肿瘤研究协助组(GACT/CTONG)牵头,于2022年2月起组织开展“中国胸部肿瘤大会诊”活动。我们邀请全国各地胸部肿瘤治疗领域各专业专家组成会诊决策团队,每个月定期针对有代表性的肺癌疑难病例进行多学科会诊,集众人智慧之利剑,拾循证医学之护盾,为中国肺癌诊治攻坚任务贡献力量。

本期大会诊病例

01
病例介绍
▶病史概要
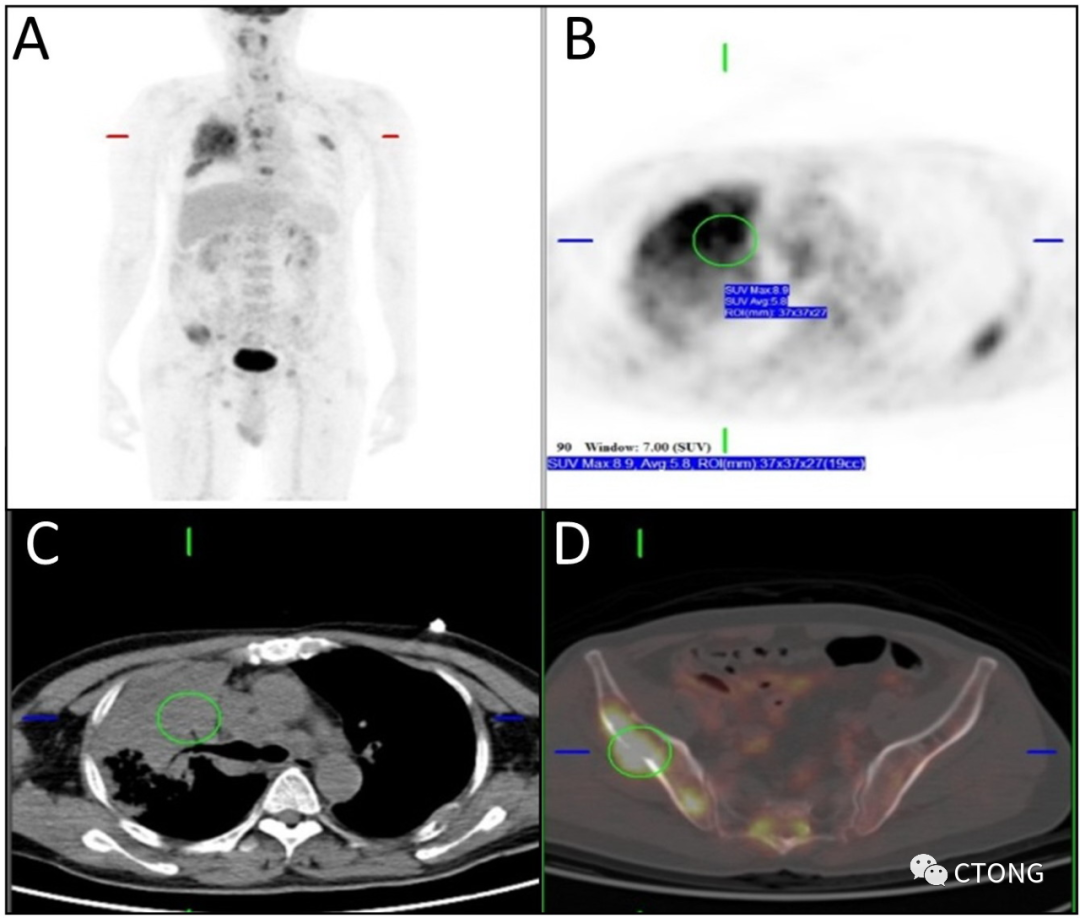
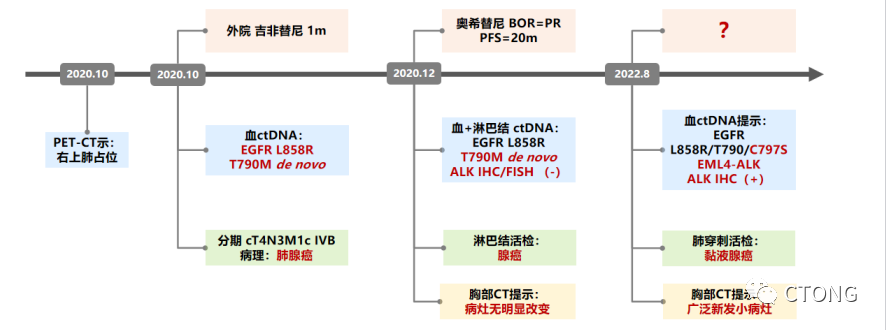
2020年10月 因反复咳嗽伴胸痛院外就诊。PET/CT提示:右上肺占位(图1)。
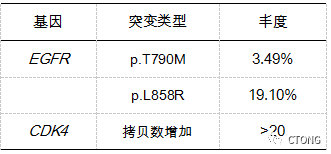
2020-10-29 完善气管镜活检:(右上叶)浸润性腺癌;(右中叶)衬覆纤毛柱状上皮的粘膜组织,其中见少量异型腺体,为腺癌细胞。因组织标本不足,院外行外周血ctDNA检测,结果见(表1)。
诊断:右上肺腺癌 cT4N3M1c (脑、骨、肾上腺、皮下结节) IV期。
外院2020-10-31 至 2020-12-18日服用吉非替尼治疗,患者症状无缓解,完善CT疗效评价SD(图2)。
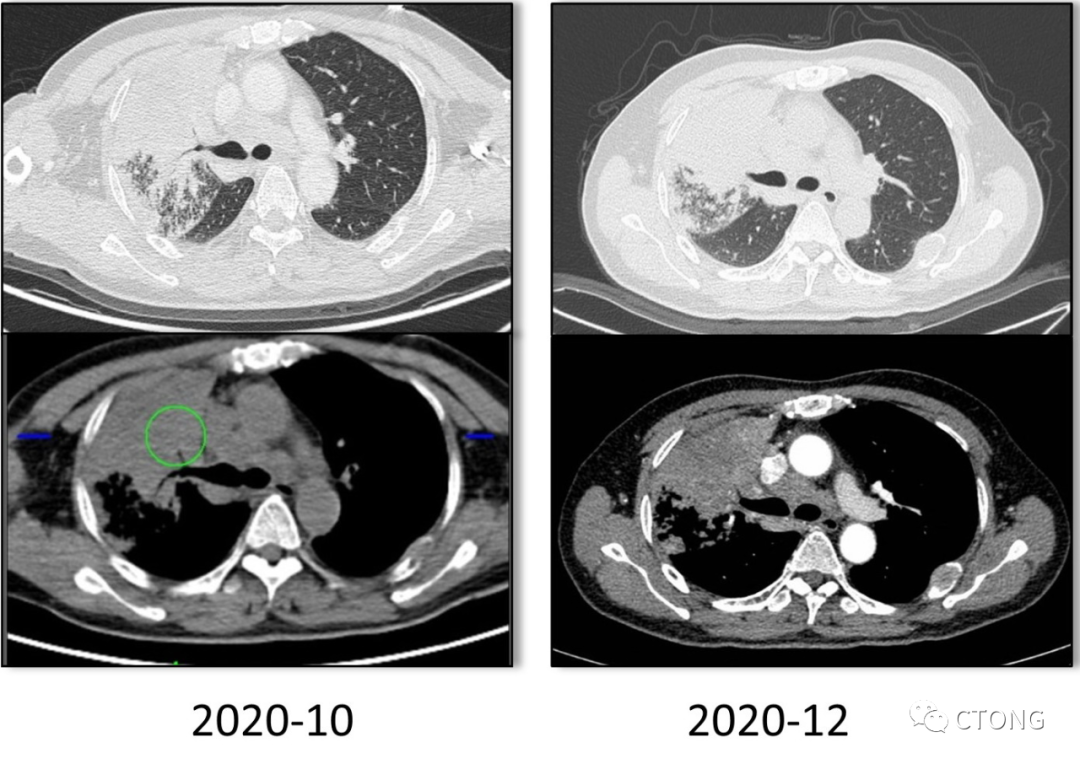 图2. 吉非替尼治疗前后胸部CT对比无明显变化
图2. 吉非替尼治疗前后胸部CT对比无明显变化
2020-12-08 入广东省人民医院肺一科行左侧锁骨上淋巴结活检。病理结果:(左锁骨上淋巴结)转移性腺癌,考虑肺来源。组织及外周血二代测序(NGS)提示:EGFR L858R T790M (de novo)(表2)。
表2. 组织及外周血NGS检测
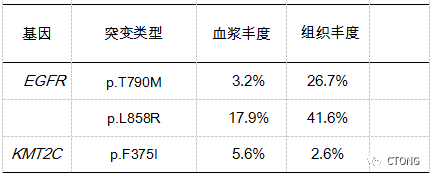
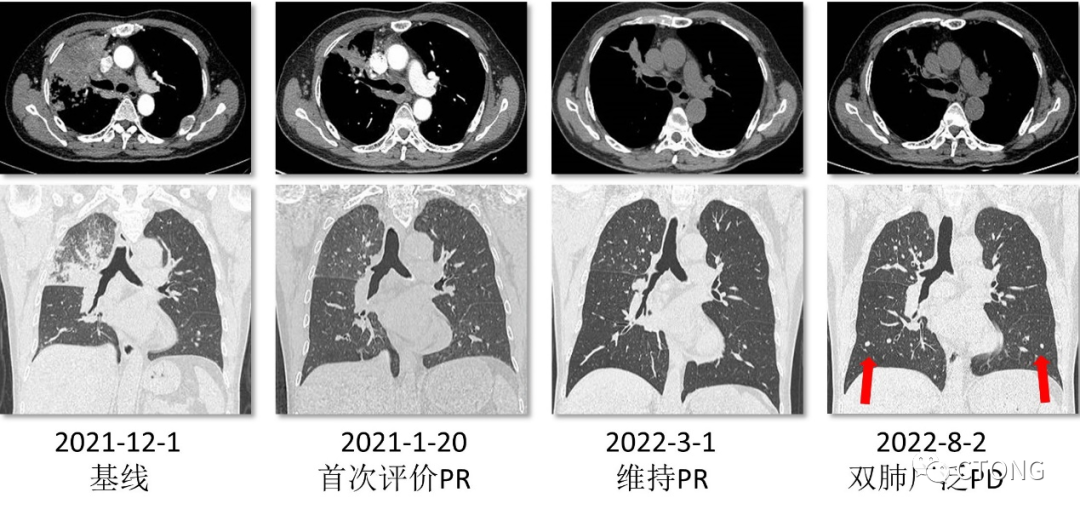 图3. 胸部CT复查结果,箭头示新发转移结节
图3. 胸部CT复查结果,箭头示新发转移结节
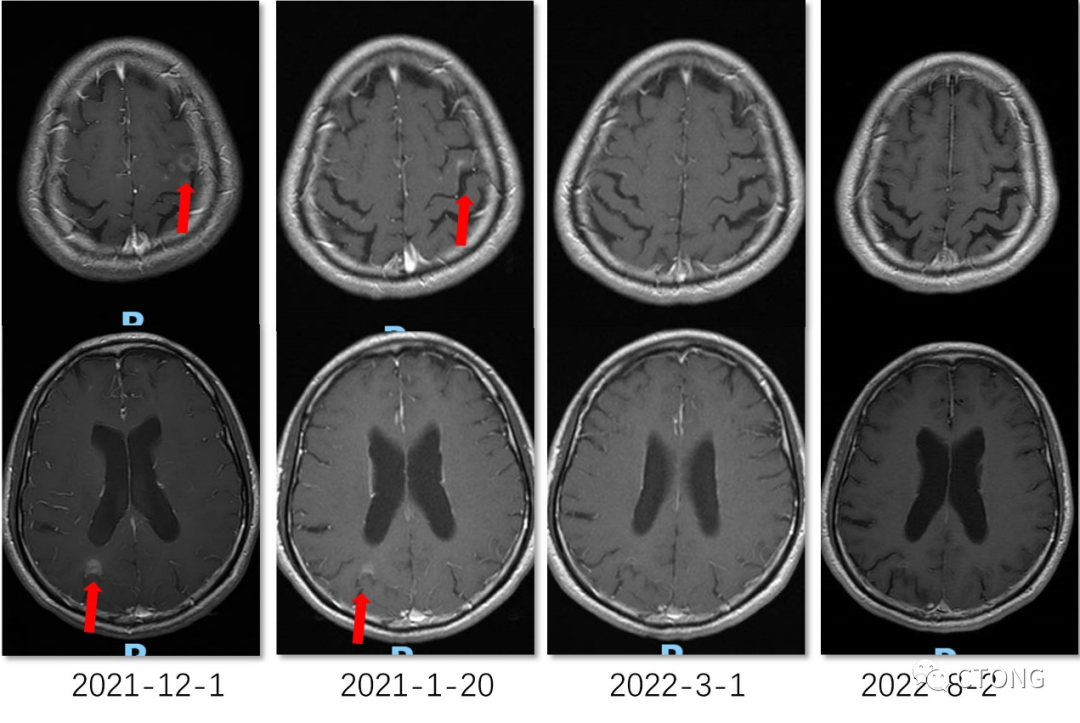 图4. 定期复查头颅MR,未见复发
图4. 定期复查头颅MR,未见复发2022-08 我院 10 Gene Panel 血基因检测结果(表3)。免疫组化结果:(肺)ALK(D5F3)(阳性),ALK(D5F3)阴性对照(-)。
表3. 外周血NGS检测
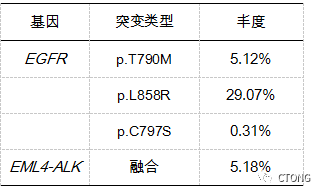
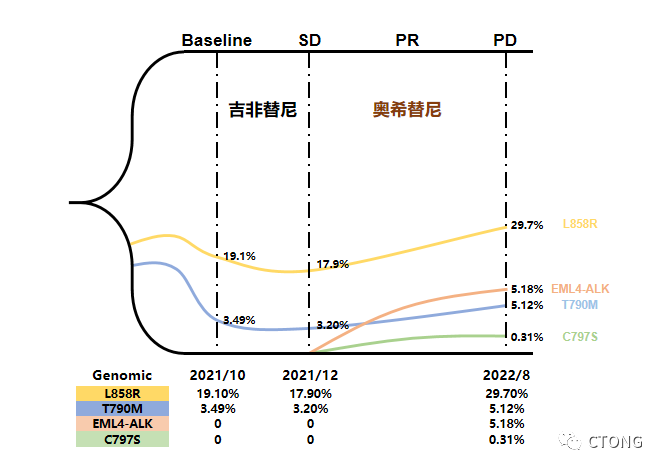
图5. 基因丰度示意图
02
病史补充
颜黎栩医生:
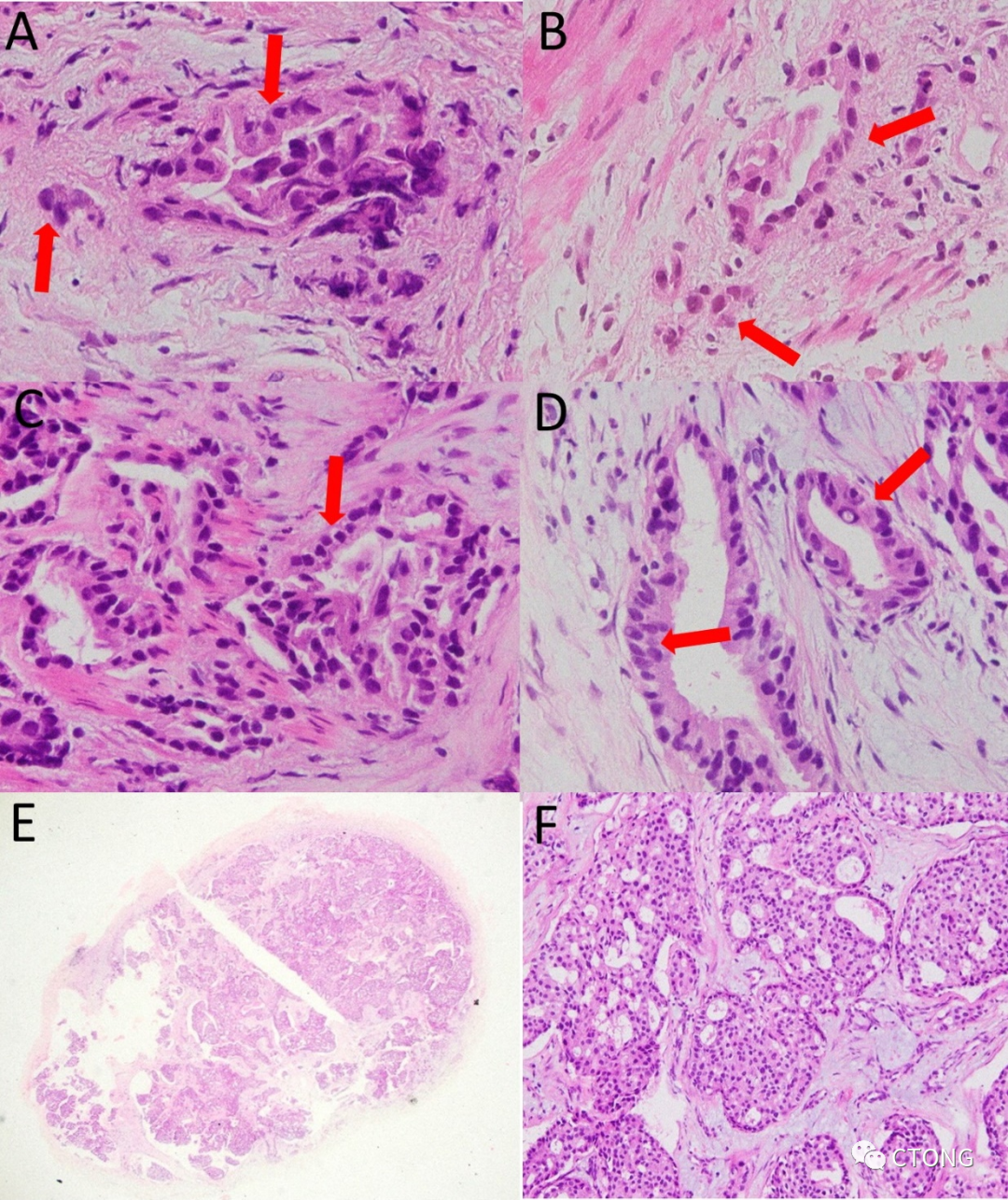 图6. HE染色片 AB 右上肺穿刺物;CD 右中肺穿刺物;EF 左锁骨上淋巴结活检
图6. HE染色片 AB 右上肺穿刺物;CD 右中肺穿刺物;EF 左锁骨上淋巴结活检
2020-12-08送检,左锁骨上淋巴结免疫组化:TTF1(+++),Napsin A(+++)。ALK D5F3 免疫组化结果:ALK(D5F3)(阴性),ALK(D5F3)阴性对照(阴性)。ALK FISH结果:ALK基因无断裂。
2022-08-15送检,右肺中叶,结果示:结合病史,符合肺腺癌。(肺浸润性黏液腺癌)(白箭头:肿瘤细胞浆内含有粘液,黄箭头:细胞外粘液湖)免疫组化结果示:VentanaALKD5F3(阳性)(图7)。此次因为穿刺标本肿瘤细胞<5%,未达到NGS标准,只做了血液ctDNA检测。
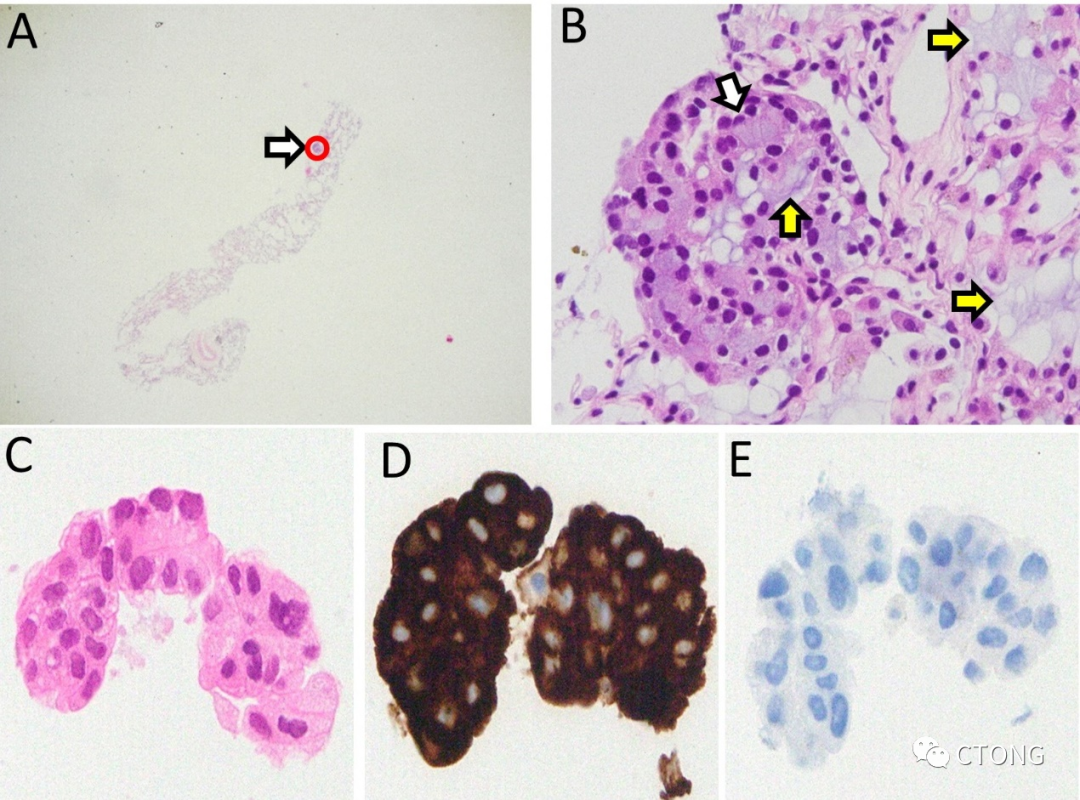 图7. 右中肺穿刺组织,A. HE染色片×20;B. HE染色片×600;C. HE;D. ALK D5F3;E. ALK NC
图7. 右中肺穿刺组织,A. HE染色片×20;B. HE染色片×600;C. HE;D. ALK D5F3;E. ALK NC各次病理组织的基因检测结果见(图8),需要强调的是,浸润性非黏液腺癌与浸润性黏液腺癌不同,是独立的病理类型,文献、书籍和临床病理工作中“浸润性非黏液腺癌”往往被写作“浸润性腺癌”。“浸润性黏液腺癌”的诊断被部分病理医生忽视,被诊断为“浸润性腺癌”,从而存在浸润性黏液腺癌被忽视的问题。
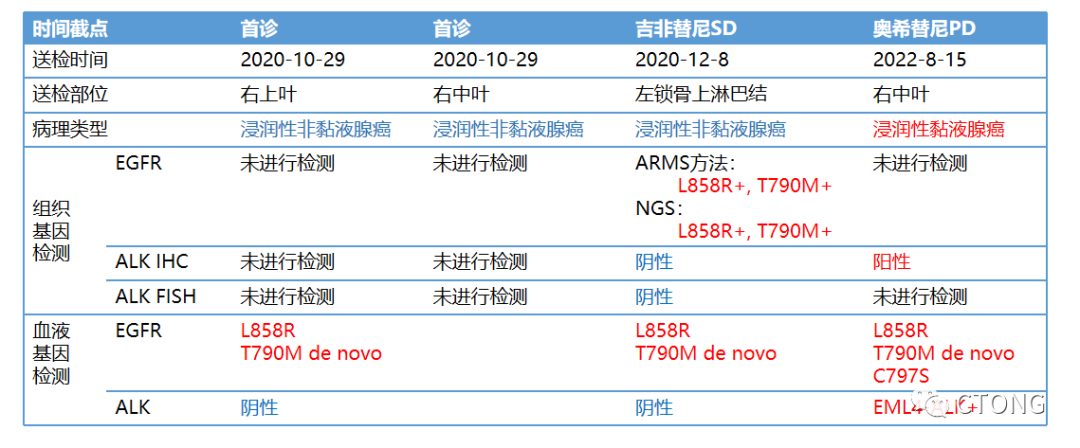 图8. 各次标本基因检测汇总
图8. 各次标本基因检测汇总
吴海军医生:
从影像学角度出发,患者8月新发的广泛小结节,影像学上符合小叶中心结节与淋巴管周围结节,符合肿瘤血行播散途径的分布特征。
03
病例讨论


问题1. 本例血液NGS检出EML4-ALK融合,提示:
D. 不确定
投票结果:
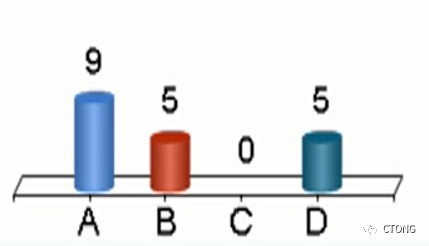
周清医生:
我选择的是B。其实在听完颜黎栩医生对浸润性非黏液腺癌与浸润性黏液腺癌的介绍后,而且目前尚未有文献发现浸润性非黏液腺癌与浸润性黏液腺癌能够互相转化,我有点动摇,有点想选择A。但是如果患者一开始就有两种克隆亚型,存在EML4-ALK融合,在我们只使用了奥希替尼,PFS仍有20个月,这是不太可能的。
众所周知,ALK融合是非常强的驱动基因,它的发病有年龄早,转移快的特点。在未使用ALK抑制剂的情况下,20个月过后,患者仅出现多发肺内小结节,这种情况是极其罕见的。而且,ALK融合本身就是EGFR抑制剂的其中一种耐药机制。所以,根据病程特点,我仍然选择B。
潘燚医生:
我同意周清医生的观点。第一,患者之前的基因检测都未发现有EML4-ALK融合。第二,患者2022-3维持PR,2022-8出现广泛新发小结节,短时间进展十分迅速,而之前20个月保持稳定。这与一开始就存在EML4-ALK融合,并不符合。
董嵩医生:
我选择的是A,混合型肺癌。有可能在早期EML4-ALK融合的亚型数量非常少,这时候我们进行检测,有很大可能检测不到EML4-ALK融合。而患者目前出现双肺多发小结节,符合血行转移的特点。所以我觉得有这么一种可能性,就是一开始存在两种克隆亚型,但只是未能检测出EML4-ALK融合。
邬麟医生:
我选择“不确定”。支持B的原因是EML4-ALK融合就是第三代EGFR抑制剂的耐药机制。不支持B的原因是在存在旁路激活EML4-ALK融合耐药的情况下,很少同时存在EGFR通路的耐药机制,本例患者还发现了c797S的突变。支持A的原因是在刚刚吴海军医生提到的三月份肺部结节,我觉得更像是原发灶而非转移灶,它中间有点空边缘有毛刺不是很圆,而八月份该结节增大且出现双肺多发转移。不确定是因为,基因检测结果未知。8月进行的仅是血液检测,而非局部病灶检测。新出现的基因突变类型无法判断是从某个病灶中独有的。如果新发现的小结节做NGS发现仅有EML4-ALK融合,那么就支持混合型肺癌。支持两方的原因都有,所以我选择不确定的。
刘安文医生:
我选择“不确定”。因为在使用奥希替尼的情况下,病人其他转移灶控制得十分稳定,肺部新发的小结节也全出现在肺的中外带,更符合转移的特征。该病人的情况,我会想的更复杂一点,会不会有其他部位肿瘤转移肺内的可能?
胡毅医生:
我选择的是混合型肺癌。我支持董嵩医生的观点,有可能存在两种克隆时,最开始表现出来的是优势克隆的生物学特征,所以我们使用奥希替尼,疗效PR。后面经过时间演化,EML4-ALK融合的生物学特征显现出来,表现为肺内多发转移,进展迅速。当然我也同意周清医生的观点,ALK融合是非常强的驱动基因。但我觉得是有这种可能性的。
孙浩医生:
我选择的是混合型肺癌。第一,关于三月份的结节是否为第二原发病灶?在我与颜黎栩医生讨论学习的过程中,我得知黏液性腺癌有一个非常特别的转移方式,即重力相关的黏液气道内播散。所以存在一种可能,右上肺病灶通过黏液气道内播散,在右中肺形成了一个新的病灶,它与血行转移不一致。第二,右上肺原发病灶在获得EML4-ALK融合后,表现出黏液性腺癌的病理特征。尽管尚无文献报道,但同为肿瘤干细胞分化出来的不同克隆亚型,我觉得仍有这种可能。综上,我选择的是混合型肺癌。
李荣医生:
我选择“不确定”。我的理由是双方都有支持的理由,新出现的c797S的突变就是第三代EGFR抑制剂的常见耐药机制。而EML4-ALK融合出现的时间点有待商榷。
刘哲峰医生:
对于原发突变,我们能发现多种伴随突变。但对于耐药后的,能否同时共存两种耐药机制呢?
张嘉涛医生:
如果右中肺穿刺的结果是仅有EML4-ALK融合,那就能证明答案是混合型肺癌。如果右中肺穿刺的结果是不仅有EML4-ALK融合还有EGFR L858R突变,那答案就是B。因为目前穿刺标本数量不够,所以我们没法下结论。
颜黎栩医生:
如果数量足够,我们可以只用EGFR L858R抗体,这样能够直接证明EGFR L858R与EML4-ALK融合突变同时存在。另外,对于混合型的定义,病理学上是存在两种不同病理类型即可定义为混合型肺癌,不管分子型是否相同,这与临床定义是不一样的。
吴一龙医生:
目前,现有的知识将耐药机制分四大类,第二大类就包括c797S的突变、MET扩增、基因融合等。一线使用三代EGFR TKI的c797S突变比二线使用药物的概率小很多,基因融合包括ALK融合、RET融合等。但ALK融合中经典的EML4-ALK融合十分罕见,目前文献报道的仅有一两例。现在耐药机制的研究仍然在进展当中。
这个病例拿出来讨论,也是为了让我们知道耐药机制的探索仍在进行。关于这个问题的选择,我同意是独立克隆。因为浸润性非黏液腺癌与浸润性黏液腺癌是完全不同的病理类型。至于该克隆是一开始就已经出现还是后面经过药物治疗后产生目前无法得知,我同意大家的分析,如果一开始就有EML4-ALK融合,病人的治疗效果是不会这么好。病人的影像学与病理学特征出现了分离,影像学表现为典型的血行播散,而病理学则表现为浸润性黏液腺癌。
为了探究清楚,我们可以进行一下工作:第一,淋巴结转移灶只能反应原发灶中的优势克隆,不是所有克隆亚型都有,所以确定原发病灶是否有EML4-ALK融合十分重要。第二,为了科研需求,右中肺病灶可以做手术取出,明确其基因构成。这能帮助填补耐药机制的知识空白。
E. 其他
投票结果:
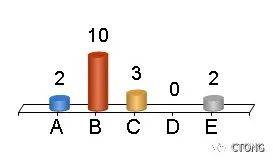
周清医生:
我选择布加替尼。第一,患者目前已检测出c797S,说明已经对奥希替尼产生了耐药;第二,患者目前病灶较小,其余病灶稳定,新发病灶检测出EML4-ALK融合,因此选择布加替尼,针对EML4-ALK融合给药。而且布加替尼对多个靶点起效,同样对于T790M与L858R也有效。虽然布加替尼对c797S的抑制效果不明,但是目前c797S的突变丰度最低,以ALK驱动为主,所以我选择布加替尼。如果下一步治疗效果不好,再考虑布加替尼联合西妥昔单抗,这也是目前针对c797S和ALK融合最有效的方案。
孙浩医生:
我同意周清医生的看法。患者目前在EGFR通路上,已经发展出c797S耐药,后续肯定也会继续发展。布加替尼是ALK和EGFR双靶抑制剂,考虑到单药的毒副作用更小,所以选择布加替尼不联合EGFR抑制剂更合适。
刘哲峰医生:
我选择的是A,但如果是布加替尼联合西妥昔单抗,我肯定毫不犹豫的选择这个选项。我纠结的是B和C,即是否联用奥希替尼,但目前出现了c797S耐药后,继续使用奥希替尼无疑是画蛇添足的。但布加替尼单药不加西妥昔单抗是否能够有效抑制,是没有数据的。所以我选择A,排除了其他选项,含铂化疗为指南推荐,它肯定是可以选择的。
吴海军医生:
原发灶与转移灶基因类型是否完全一致?我对治疗不太熟悉,该患者转移灶使用奥希替尼控制效果不错,原发灶却进展。是否能奥希替尼加上化疗来控制原发灶?转移灶是否依然可以使用奥希替尼控制?
刘思阳医生:
李荣医生:
杨善兰医生:
我选择的是B,布加替尼对于我们基层医院可及性很低,而且目前其余病灶在使用奥希替尼的情况下控制得很稳定。综合考虑,我会选择奥希替尼加ALK抑制剂。
邬麟医生:
我选择的是奥希替尼加ALK抑制剂。第一个问题,大部分人选择了混合型肺癌,在目前转移灶控制良好,而肺内新发病灶明确有EML4-ALK融合,但不能确定是否有c797S突变的情况下,使用奥希替尼加ALK抑制剂是最合理的选择。
林劼医生:
我选择的是B,但是听完大家的分析后,我觉得这四个答案都不错。无论是从可及性考虑还是耐药机制考虑,都是正确的。
吴一龙医生:
我的选择是A,含铂化疗。在临床实践中,当治疗措施失败时,应当考虑标准治疗然后再看病人的具体特点。这个病人无论是第二克隆还是继发耐药,都算是耐药,这时候的标准治疗就是含铂化疗。但该患者具有特殊性,我们应该考虑这个问题来设计对其进行个体化治疗,第一,耐药不可能全是EML4-ALK融合引起的,可能部分病灶出现c797S突变,部分病灶出现EML4-ALK融合,如果出现了c797S突变,继续使用奥希替尼是不合理的。但c797S突变一般而言发展非常缓慢,但ALK驱动的会发展非常快,再这种情况下可选择ALK抑制剂先治疗一段时间,通过疗效判断新发小结节的情况,如果大部分病灶消失只剩下小部分病灶,说明是两种情况并存,这时候再考虑含铂化疗或者参加其他临床实验。
周清医生:


△上述内容由讨论现场录音整理,经与会专家确认
04
MDT小结
患者后续治疗方案:含铂化疗或先使用布加替尼,根据疗效再选择后续治疗。
05
吴一龙医生评述


上述的耐药机制主要是发生在EGFR信号通路上,因此也称为在靶耐药,而更常见的耐药机制是为脱靶耐药,主要有旁路激活、驱动突变等,如本例的ALK融合。这类有明确而活性很高的靶向药物可作用的靶点,就给我们的治疗决策添加了个体化的选择。尽管二线标准化疗的循证医学证据远高于根据耐药靶点选择相应的靶向药物,但靶向药物因其可能的有效率高(在这种情况下的有效率不明朗)、明确的副作用低和使用方便而更受欢迎,但毕竟缺乏高级别的循证医学证据。因此,决策时要充分掌握每一个细节如突变丰度、伴随突变情况、耐药出现时间、之前的治疗方案等综合平衡来决定。选择这样的治疗一定要充分的知情同意,同时注意积累疗效和安全性的证据。
06
追踪随访
2022-9-5 在我院行右上肺楔形切除+右下肺楔形切除
2022-11 陈华军主任门诊改为布格替尼联合奥希替尼治疗。
07
会诊专家

林 劼 昆明医科大学第二附属医院
吴一龙 广东省人民医院 广东省肺癌研究所
周 清 广东省人民医院 广东省肺癌研究所
杨彦龙 汕头市中心医院
赵 荆 华中科技大学同济医学院附属同济医院
吴海军 广东省人民医院


文稿整理 | 曾康辉(广东省肺癌研究所)
指导 | 董 嵩(广东省肺癌研究所)
责编 | Icy
以上信息转自CTONG官方微信平台
-End-











 苏公网安备32059002004080号
苏公网安备32059002004080号


