翻译:陈锦霞a,余平元a;审校:雷蕾b
a中国科学院大学附属肿瘤医院-温州医科大学联合培养硕士研究生;b中国科学院大学附属肿瘤医院乳腺内科
引用此文:Rodrigo Nalio Ramos, et al. Tissue-resident FOLR2+macrophages associate with CD8+T cell infiltration in human breast cancer. Cell. 2022 Mar 31;185(7):1189-1207.e25. doi: 10.1016/j.cell.2022.02.021.
摘要
巨噬细胞浸润作为实体瘤的一个特征,与患者生存率降低和对治疗的耐药性相关。肿瘤相关巨噬细胞的表型和功能存在异质性,特定亚群可能在肿瘤进展和抗肿瘤免疫作用中发挥不同作用。本研究分别从健康乳腺和乳腺原发肿瘤中鉴定出组织驻留的FOLR2+巨噬细胞群,该细胞群在肿瘤基质的血管周围区域与 CD8+ T细胞存在相互作用;前者能在体外有效启动效应CD8+ T细胞。肿瘤FOLR2+巨噬细胞密度高与患者生存延长有关。该研究强调了肿瘤相关巨噬细胞亚群的特定作用,并为基于巨噬细胞的癌症治疗中的亚群靶向治疗干预提供新思路。
引言
巨噬细胞是乳腺肿瘤微环境的主要细胞成分。肿瘤中巨噬细胞浸润的程度与不良的临床结果相关。事实上,肿瘤相关巨噬细胞(TAM)通过促进血管生成、提供肿瘤生长因子和促进肿瘤细胞的侵袭和转移发挥促癌作用。TAMs还发挥免疫抑制功能,从而防止NK和T淋巴细胞对肿瘤细胞的破坏。因此,靶向TAM的招募、生存和功能已成为一个主要的治疗目标。尽管目前TAMs主要被认为具有促癌作用,但有几项研究强调了TAMS在特定疾病阶段或器官中起到保护作用。具有促肿瘤和抗肿瘤相反功能的不同巨噬细胞群可能共存于同一肿瘤内。因此,确定巨噬细胞间的异质性程度是合理设计巨噬细胞靶向治疗的前提。巨噬细胞的异质性可能源于(1)不同的旁路激活状态,(2)定义巨噬细胞生态位的组织或肿瘤相关线索的印记,(3)不同的TAM个体发生起源(成年单核细胞与胚胎祖细胞),以及(4)肿瘤诱导的循环单核细胞的系统性修饰。在人类乳腺癌(BC)中,已用CD14、CSF1R或CD68等标记物评估巨噬细胞的浸润。然而,CD14和CSF1R也标记未分化的单核细胞,而CD68在吞噬细胞中的表达尚未被完全表征。其他标记如CD163、TIE2、MRC1/CD206或Marco已被用于评估TAM表型异质性。前期单细胞RNA测序(scRNA-seq)研究结果已经推翻旁路激活是导致TAM异质性的主要原因的观点。综上所述,TAM入侵人乳腺癌的表型和功能多样性仍有待阐明。在这里,研究者对从转移性淋巴结(LNs)和原发乳腺肿瘤中分离的肿瘤相关CD14+HLA-DR+细胞进行scRNA-seq,以评估CD14+间隔区内的细胞异质性。鉴定了两种不同表型的巨噬细胞群:(1)表达触发受体的TREM2+巨噬细胞,触发受体由髓系细胞-2(TREM2)和骨桥蛋白(SPP1)基因表达而来;(2)表达叶酸受体2(FOLR2)、透明质酸受体(Lyve-1)和甘露糖受体C型(MRC1/CD206)基因的FOLR2+巨噬细胞。研究者发现TREM2+和FOLR2+TAMs在人和小鼠BC之间的进化上是保守的。TREM2+巨噬细胞在健康乳腺组织中的表达很低,但随着肿瘤的发展而增加。相比之下,他们发现FOLR2+巨噬细胞是组织驻留巨噬细胞(TRM),它们在癌症发生之前就聚集于健康乳腺腺体(MG)中。FOLR2+巨噬细胞的特定基因特征与 BC 患者更好的生存率相关。FOLR2+巨噬细胞与主要抗肿瘤免疫细胞因子(包括CD8+ T细胞)的特征也呈正相关。研究进一步证明,FOLR2+巨噬细胞位于肿瘤间质中靠近血管的位置,并与CD8+ T细胞聚集在一起。这种FOLR2+巨噬细胞/CD8+ T细胞共定位与良好的临床预后相关,提示这种新表征的巨噬细胞亚群具有抗肿瘤作用。
结果
APOE表达定义了乳腺癌中的TAMs
为了明确地识别乳腺肿瘤中的TAM,研究者试图定义使其区别于浸润性CD14+CD1c-单核细胞、CD14+CD1c+炎性DC/DC3或CD14-CD1c+cDC2的特定特征。首先,他们量化了匹配的原发肿瘤的单核吞噬细胞—非转移性和转移性淋巴结—这些细胞来自一组未接受治疗的luminal型乳腺癌患者(表S1)。与匹配的非转移性LNs相比,转移性LNs中的CD14单核细胞/巨噬细胞数量增加最为显著(图1A和S1A)。CD14+细胞浸润与LNs肿瘤侵袭程度相关(图1B)。接下来,他们试图以无偏倚的方式描述整个肿瘤浸润性CD14细胞内的异质性。为此,他们通过分选CD11c+HLA-DR+细胞的FACS从转移性淋巴结、原发肿瘤和未经治疗的luminal乳腺癌患者的血液中分离出单核吞噬细胞,并进行scRNA-seq(图1C;表S1)。研究者使用SEURAT流程处理数据(图1D)并且合并了来自所有患者约18000个髓样细胞(图1D和S1B)。基于Louvain图形聚类分析确定了4类单核吞噬细胞簇和细胞周期群(mKI67,TOP2A和CDC20)和“应激”细胞群(HSPA1A 和HSPB1)(图S1C;表S2)。簇0 (c0) 以定义CD14+CD16单核细胞(S100A8、S100A9、S100A12、和VCAN)的标记物的选择性表达为特征(图1D和1E;表S2)。簇1 (c1) 以定义 CD1c+DCs的基因为特征,而簇4(c4)被定义为CD14-CD16+单核细胞。簇2(c2)被确定为TAM,因为它选择性地高表达TAM(图1F;Azizi等人,2018年)。簇2高表达APOE、APOC1、C1QA和C1QC,使之与单核细胞区别开来(图1E和S1D)。研究者证明了APOE同源表达选择性地将TAM与CD14+单核细胞和CD1c+DCs区分开来(图1F)。没有其他常用的标记(CSF1R、CD68、CD14)实现这种区分(图1F)。接下来,研究者验证了在CD1c-CD14+细胞中区别巨噬细胞/TAMs和单核细胞的蛋白表达。APOE和CCR2染色可获得最佳的单核/巨噬细胞分辨能力(图1G和S1E)。研究者分析了CCR2+单核细胞和APOE+巨噬细胞在luminal乳腺癌和无肿瘤组织中CD14+细胞的贡献。他们发现,随着肿瘤负荷的增加APOE+巨噬细胞出现频率增加,而CCR2+单核细胞频率下降(图1G)。最后,研究者发现APOE+细胞定位在转移性LNs和原发性肿瘤内部和靠近肿瘤病灶(图1H和S1F)。总之,本研究表明APOE是从luminal乳腺癌原发肿瘤和转移性淋巴结中识别出巨噬细胞的特异性标记物。
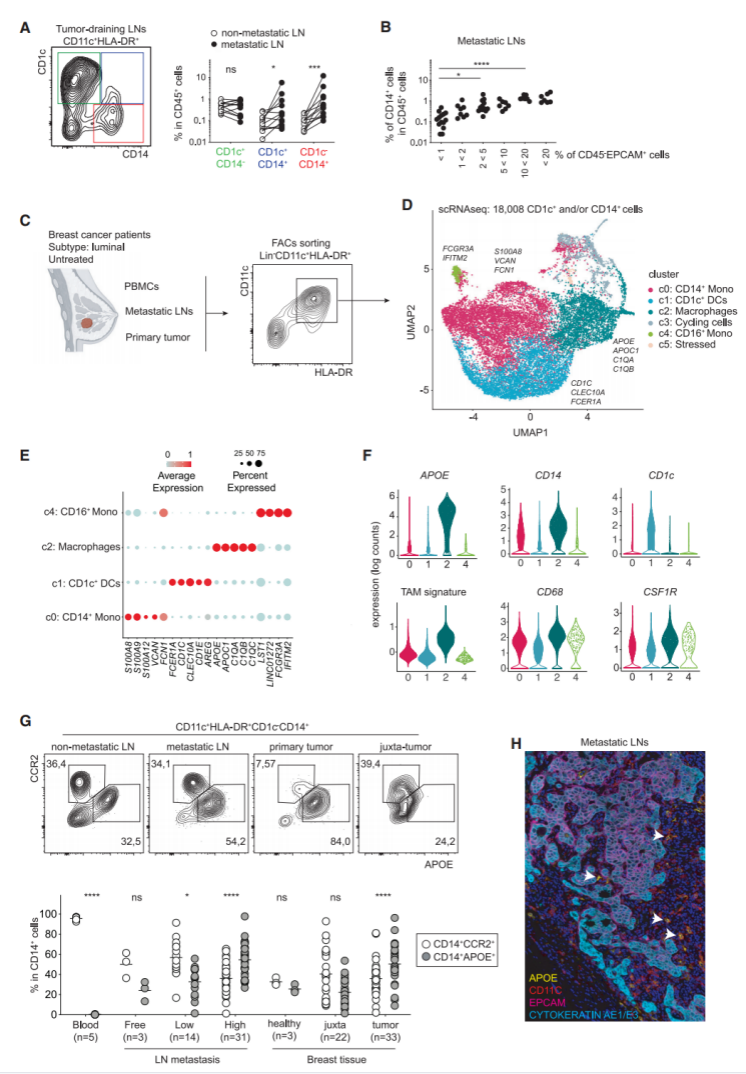
图1:APOE表达确定乳腺癌中肿瘤相关巨噬细胞:(A)患者匹配的非转移性和转移性淋巴结中髓系细胞的流式细胞分析结果(n=13);(B)55例转移性LN患者CD14+细胞流式细胞分析结果;(C)BC患者骨髓细胞scRNA-seq技术函数处理结果(n=6);(D)来自血液、转移性淋巴结和原发肿瘤(n=18,008个细胞)的scRNA-seq数据的UMAP。描述了来自每个簇的代表性基因;(E)前五个最显著的跨簇基因表达。圆圈大小表示一簇中表达某一基因的细胞的百分比。颜色代表了每个基因的平均表达;(F)选定的感兴趣基因的表达分布;(G)CD14+CCR2+单核细胞和CD14+APOE+巨噬细胞在健康或转移性淋巴结和乳腺组织中的流式细胞术分析;(H)具有代表性的转移性LN中APOE+巨噬细胞和EPCAM+CK+肿瘤细胞的免疫荧光图像。
单细胞RNA测序揭示了APOE+巨噬细胞的两个亚群
研究者接下来研究了APOE+TAMs的异质性。基于Louvain图的聚类识别出3个TAMs簇(图2A、S2A和S2B)。层次聚类分析显示,与簇2(c2)相比,簇0和1(c0和c1)在转录上彼此更接近(图2B)。为了进一步探索在APOE+巨噬细胞中发现的转录异质性,研究者运用单细胞调控网络推断和聚类分析(SCIENIC)来研究每个巨噬细胞簇的基因调控网络(调节子)。层次聚类分析结果表明,c0和c1共有大约一半的调控子,包括CEBPB和BHLHE41,而C2主要呈现独特的调控子,如NR1H3和MAF(图2C;表S2)。差异表达基因(DEG)分析表明,FOLR2、SEPP1、SLC40A1、MRC1和LYVE1将c2与c0、c1区分开来(图2D;表S2)。相反,TREM2、SPP1和ISG15将c0、c1与c2区分开来(图2D;表S2)。总之,上述结果表明FOLR2是c2的特异标记,而TREM2定义c0和c1(图2E)。最终,研究者认为APOE+TAMs由两类不同细胞组成:TREM2+巨噬细胞和FOLR2+巨噬细胞。
接下来,研究者希望通过前瞻性分离这些细胞群体进行bulk转录组分析来验证这一发现。他们寻找了在这两个群体之间有差异表达的表面蛋白,但未能在组织分离后的TAMs细胞表面检测到TREM2。此外,他们发现了c1(TREM2high巨噬细胞)特异性表达并染色为CADM1阳性(图2F、2G和S2C)。流式细胞术分析FOLR2和CADM1的表达,发现CD11c+HLADR+XCR1-CD1c-CCR2-CD14+巨噬细胞群体中相互排斥的表达模式(图2G)。研究者通过FACS分选从原发肿瘤和转移性LNs中分离出FOLR2+CADM1-和FOLR2lowCADM1+巨噬细胞(图S2D)。FOLR2+CADM1-巨噬细胞呈典型的巨噬细胞形状,并充满空泡。相比之下,FOLR2lowCADM1+巨噬细胞体积更小,形态更接近单核细胞(图2G)。FOLR2+CADM1-巨噬细胞、FOLR2lowCADM1+巨噬细胞和CD14+CCR2+单核细胞分别进行了bulk RNA测序(图2H-2J;表S1)。层次聚类显示,来自原发肿瘤和转移性LNs的FOLR2+CADM1-巨噬细胞聚集在一起,远离FOLR2lowCADM1+巨噬细胞或CD14+CCR2+单核细胞(图2H)。研究者证实了scRNA-seq结果:来自转移性LNs或原发肿瘤的FOLR2+巨噬细胞与FOLR2lowCADM1+巨噬细胞、CD14+CCR2+单核细胞相比,表达更高水平的FOLR2、SEPP1、SLC40A1和LYVE1(图2I和S2E)。来自原发肿瘤的FOLR2lowCADM1+巨噬细胞与CD14+CCR2+单核细胞聚集在一起(图2H),但特异性表达的TREM2和scRNA-seq分析中c1 (C3,FN1和SPP1)过表达的基因(图2J)。其中一些表型差异通过转移性LNs的CD14+CCR2-巨噬细胞的CyTOF谱证实。LYVE1、MRC1/CD206和CD163在巨噬细胞群体中共同表达,与表达CADM1+的巨噬细胞不同(图2K)。综合上述研究结果,乳腺TAMs包括两个群体,它们通过TREM2/CADM1和FOLR2的互斥表达而可被区分。
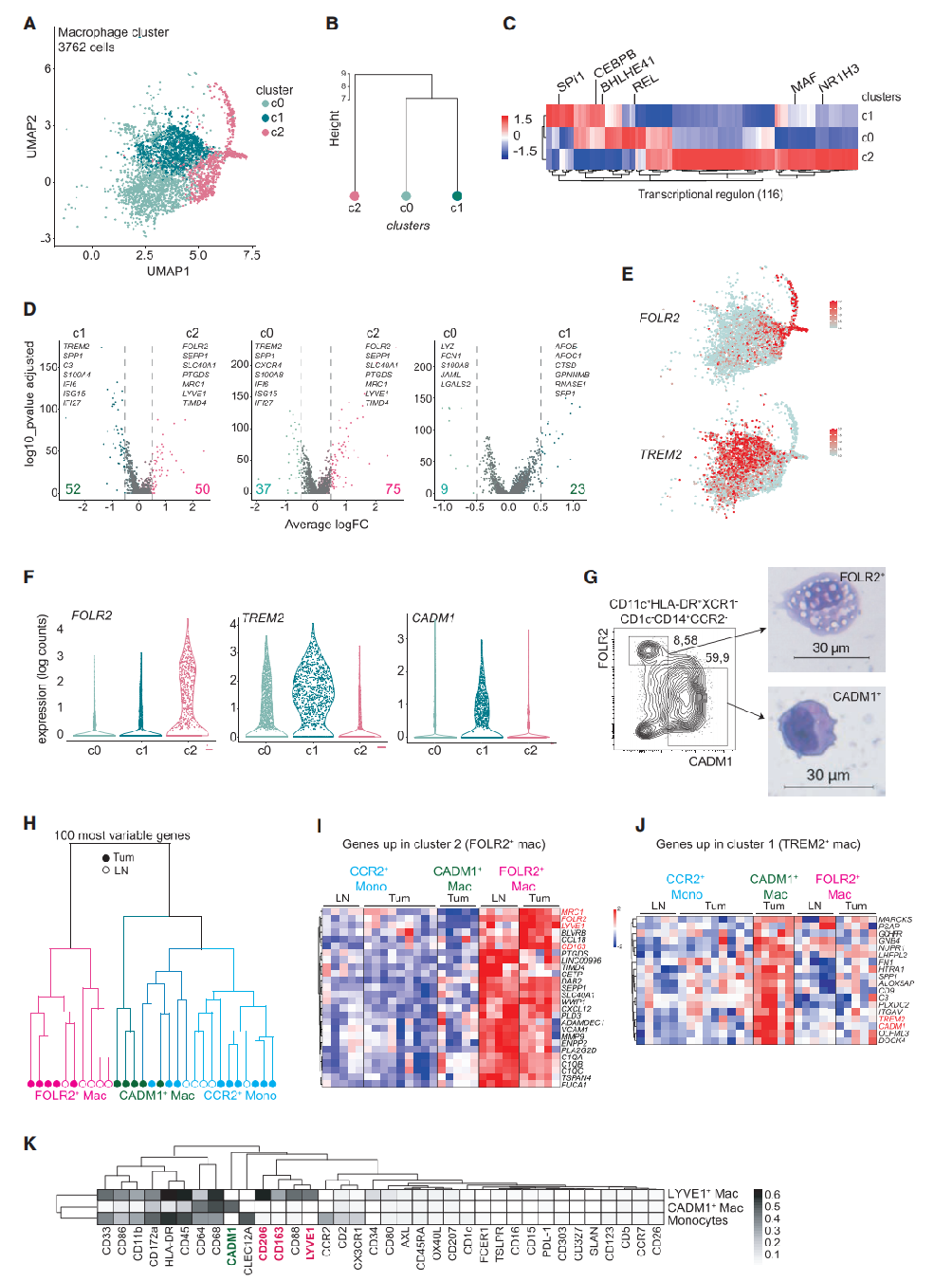
图2:单细胞RNA测序显示了APOE+巨噬细胞的两个亚群:(A)UMAP可视化的APOE+巨噬细胞(n=3,762个细胞);(B)基于平均基因表达量(1200个基因)的c0、c1和c2的层次聚类;(C)差异预测转录调控基因的热图和层次聚类;(D)火山图显示了每个簇之间的DEG。描绘了Top25中选定的基因;(E)UMAP显示在APOE+巨噬细胞中TREM2和FOLR2的互斥表达;(F)FOLR2、TREM2和CADM1在APOE+巨噬细胞簇中的表达分布;(G)从转移性LNs和原发肿瘤中分离出的FOLR2+和CADM1+巨噬细胞的代表性流式细胞术图和细胞自旋图像;(H)利用从转移性LNs和未治疗的luminal BC(n=12例患者)中分离的FOLR2+巨噬细胞、CADM1+巨噬细胞和CCR2+单核细胞的bulk RNA-seq中100个最可变的基因进行层次聚类;(I、J)从scRNA-seq数据集中选择的FOLR2+(c2)和TREM2high(c1)巨噬细胞之间的DEG热图,并应用于FOLR2+巨噬细胞、CADM1+巨噬细胞和CCR2+单核细胞的bulk RNA-seq;(K)CD14+CCR2+单核细胞、CD14+CCR2-CD68+CYVE1+巨噬细胞和CD14+CCR2-CD68+CADM1+巨噬细胞的蛋白表达分析(n=6例患者)。
FOLR2+巨噬细胞是组织驻留的巨噬细胞
最近一项研究确定TREM2+巨噬细胞浸润是一个与癌症发展相关的事件。上述数据表明它们在乳腺肿瘤中与CD14+CCR2+单核细胞的转录很接近(图2H)。这些结果表明,TREM2+CADM1+巨噬细胞来自于肿瘤进展过程中循环单核细胞的浸润。FOLR2+巨噬细胞的起源尚不清楚,研究者想知道它们是否对应于乳腺TRMs(即存在于健康乳腺中)或肿瘤招募的单核细胞来源的巨噬细胞,如TREM2+巨噬细胞。为了解决这个问题,研究者通过流式细胞术定量分析了健康组织和luminal乳腺肿瘤病变中的FOLR2+巨噬细胞。最终发现,在APOE+巨噬细胞中,FOLR2+巨噬细胞在健康组织和癌旁组织中富集(图3A)。在肿瘤进展过程中,FOLR2+巨噬细胞在APOE+巨噬细胞中被FOLR2-巨噬细胞(包括TREM2+巨噬细胞)相对稀释(图3A)。然而,FOLR2+巨噬细胞在肿瘤病变中的数量并没有减少,因为在健康组织和肿瘤组织中,它们在总存活细胞中的频率保持不变(图S3A)。通过分析癌症基因组图谱(TCGA)数据库中不同亚型(Her2+,三阴性BC[TNBC],luminal)的BC样本,在转录水平上也证实了FOLR2+巨噬细胞在邻近正常组织与肿瘤病变中富集(图3B和S3B)。相反,与肿瘤邻近的正常健康组织相比,TREM2转录在乳腺肿瘤病变中富集(图3B和S3B)。免疫组化(IHC)分析显示,FOLR2+巨噬细胞存在于所有亚型的BC中(图3C)。对FOLR2+巨噬细胞的Bulk RNA-seq(图2J)和CyTOF(图2K)分析显示,FOLR2+巨噬细胞特异性表达LYVE1和MRC1/CD206,这两种细胞都是血管周围(PV)巨噬细胞的标记物。肿瘤切除标本的共聚焦成像显示,FOLR2+CD206+巨噬细胞确实位于肿瘤和邻近组织的CD31+血管附近(图3D和S3C)。总之,这些结果表明,FOLR2+巨噬细胞是与健康MGs相关的PV TRMs。
接下来,研究者分析了小鼠模型中健康或恶性MGs中的巨噬细胞亚群,从而能够对稳定状态和肿瘤进展期间的免疫细胞群体进行纵向分析。在一组已发表的对来自健康MGs的造血细胞进行的scRNA-seq数据集中,研究者确定了一个共同表达FOLR2、MRC1和LYVE1的TRMs子集,就像人类FOLR2+巨噬细胞一样(图S3D)。这些细胞与先前描述的MRC1+LYVE1+ TRMs相一致(图S3G)。研究者又对CD45+CD3-CD19-B220-NKP46-细胞进行了scRNA-seq,该细胞分离自MMTV-PyMT (PyMT)原位模型的乳腺肿瘤,其形态与人类luminal BC非常相似(图3E和S3E)。排除了受污染的淋巴细胞、Ly6c2+单核细胞(c3)、Ly6c2-Nr4a1high单核细胞(c6)、循环细胞(c4)和高核糖体基因含量的细胞(c1)(图S3E)。在剩下的Fcgr1+细胞中,鉴定出了3个巨噬细胞簇,其中有2个表达Cadm1(c0和c1)(图3E)。此外,还鉴定了一个离散的Folr2+Mrc1+巨噬细胞群体(c2)。小鼠和人的FOLR2+巨噬细胞共享FOLR2、MRC1、LYVE1和MAF的表达(图3F;表S3)。另一方面,Cadm1+Cx3cr1+小鼠巨噬细胞(c0和c1)与人CADM1+TREM2high巨噬细胞相似(c1,图2A),并共享CADM1、HAVCR2、IFI44的表达(图3F;表S3)。值得注意的是,与人类巨噬细胞相比,Trem2的表达模式在小鼠中更为明显(图S3F)。为了探究人和小鼠FOLR2+巨噬细胞之间的相似性,在每个细胞的水平上对同源基因进行了相似性分析(图3G;表S3)。这一无偏性分析证实了小鼠Folr2+巨噬细胞与人FOLR2+巨噬细胞的基于标记物的比对。相反,Cadm1+Cx3cr1+小鼠巨噬细胞(c0和c1)与CADM1+TREM2+人巨噬细胞具有高度的相似性。因此,可以得出结论,FOLR2+巨噬细胞在小鼠和人的luminal乳腺肿瘤之间是进化保守的。
此后,研究者通过定量分析健康同窝小鼠(WT)、前病变PyMT小鼠、肿瘤病变、早期癌和晚期癌中的MG巨噬细胞,纵向分析了FOLR2+和CADM1+巨噬细胞在肿瘤发展过程中的动态变化。研究者发现在健康MG(WT)中,FOLR2+巨噬细胞约占巨噬细胞总数的80%(图3H和S3I)。在20周龄的PyMT小鼠的晚期癌病变中,FOLR2+巨噬细胞的频率随着癌进展而逐渐减少,达到一个10%-20%的最少量(图3H、S3H和S3J)。相反,在20周大的PyMT小鼠中,癌的发展伴随着CADM1+巨噬细胞的新生扩增,占总巨噬细胞的80%(图3H)。总之,FOLR2+巨噬细胞代表了在晚期癌中一个进化上保守的TRM亚群。
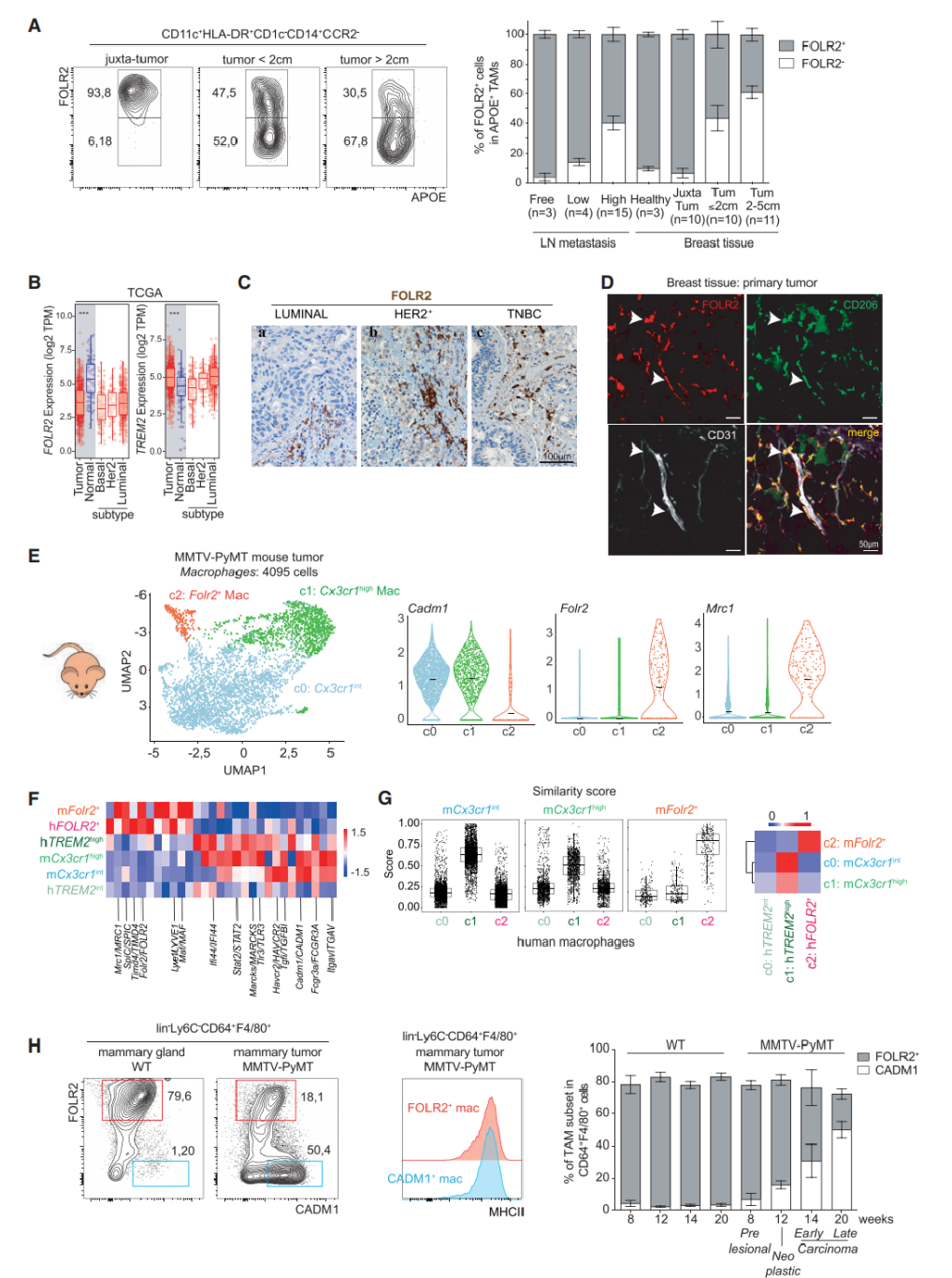
图3:FOLR2+巨噬细胞是组织驻留的巨噬细胞:(A)通过流式细胞术对不同BC患者组织中FOLR2+APOE+和FOLR2-APOE+巨噬细胞的代表性等高线图和定量分析;(B)TCGA数据库中BC患者肿瘤芯片中FOLR2和TREM2 mRNA表达;(C)FOLR2免疫组化结果;(D)具有代表性的BC组织共聚焦免疫荧光图像。白色箭头表示FOLR2+CD206+巨噬细胞与CD31+血管共定位;(E)从23周龄PyMT小鼠(n=2)的乳腺肿瘤中分离出的Fcgr1+巨噬细胞(n=4,095个细胞)的UMAP。Cadm1、Folr2和Mrc1在Fcgr1+巨噬细胞中的表达分布;(F)显示小鼠和人类巨噬细胞亚群中表达的基因同源热图;(G)相似度评分(Seurat v3)。图中显示了每个小鼠巨噬细胞簇的预测得分(图3D)应用于每个人类巨噬细胞簇(图2A)。每个点代表一个单元格。预测得分均值的热图;(H)通过流式细胞术定量分析肿瘤发展过程中的FOLR2+和CADM1+乳腺巨噬细胞。显示了无肿瘤和荷瘤小鼠(20周龄)乳腺组织中巨噬细胞的代表性等高线图。从乳腺肿瘤中分离的FOLR2+和CADM1+巨噬细胞表达MHC-II。条形图代表了WT乳腺(n=16)或肿瘤(n=16)中巨噬细胞亚群的定量分析。
FOLR2+巨噬细胞与BC患者的生存率增加相关
巨噬细胞通常被认为可以促进肿瘤生长和抑制抗肿瘤免疫。这一点在小鼠模型中尤其明显。在人类中,巨噬细胞通常与不良预后和较高的肿瘤分级相关。然而,临床研究通过使用树突状细胞、单核细胞和巨噬细胞的共享标记物(CSF1R、CD68、MRC1/CD206和CD163等)来探讨巨噬细胞与患者生存之间的关联(图S2F和S2G)。因此,FOLR2+巨噬细胞是否与BC患者较差的生存率同样相关?为此,研究者定义了基因特征,可以推断出整体肿瘤转录组中总巨噬细胞或FOLR2+巨噬细胞亚群的丰度。三个基因(C1QA、C1QB和C1QC)定义了一个巨噬细胞的核心特征,与本研究中确定的3个巨噬细胞簇共享(图2A和4A),足以将巨噬细胞与其他白细胞谱系区分开来(图4A和4B;表S2)。三个基因(FOLR2、SEPP1和SLC40A1)分别将FOLR2+巨噬细胞与其他巨噬细胞和其他白细胞谱系区分开来(图4A和4B;表S2)。LYVE1由于其再内皮细胞的表达而不被包括在基因特征中。分析这些基因特征在luminal BC的整体转录组中的表现。根据之前的报道,研究者发现最高水平的巨噬细胞浸润与较差的总生存率相关(图4C和S4A)。相反,高FOLR2基因特征与总生存率的增加相关(图4C和S4A)。FOLR2基因特征与患者临床结果之间的关联在一个独立的、使用相同的截断值BC患者队列中得到了证实(图S4B)。研究者还从CPTAC数据集分析了52例ER+/HER2-合并BC患者中FOLR2蛋白表达与患者预后之间的关系,发现FOLR2蛋白的丰度与较好的生存率呈正相关(图4C)。随后,研究者想直接评估FOLR2+巨噬细胞的细胞密度是否与良好的临床结果相关。为此,使用多光谱成像分析了来自两个回顾性和独立的BC患者队列的肿瘤组织微阵列。对肿瘤进行FOLR2、细胞角蛋白(CK)和4’,6-二胺基-2-苯林多尔(DAPI)染色,并计算FOLR2+巨噬细胞的细胞密度(图4D)。使用最佳表现阈值作为截断值,发现FOLR2+巨噬细胞密度与患者生存期呈正相关(图4E)。由于FOLR2+巨噬细胞是健康MG中的一个组织常驻群体,因此FOLR2 mRNA的丰度可能与较小的肿瘤相关。为了检验这是否可能是一个混杂因素,分析了不同分期和分级的乳腺肿瘤中FOLR2 mRNA的表达水平,发现FOLR2的表达没有显著差异,而在晚期肿瘤中略有增加(图S4C)。此外,对根据不同临床参数调整的FOLR2基因特征的预后价值的多变量分析显示,FOLR2基因特征是与luminal BC患者更好的生存相关的独立预后因素(图S4D、S4E和S4F)。总之,这些结果表明,FOLR2基因特征和FOLR2+巨噬细胞丰度与BC患者更好的预后相关。
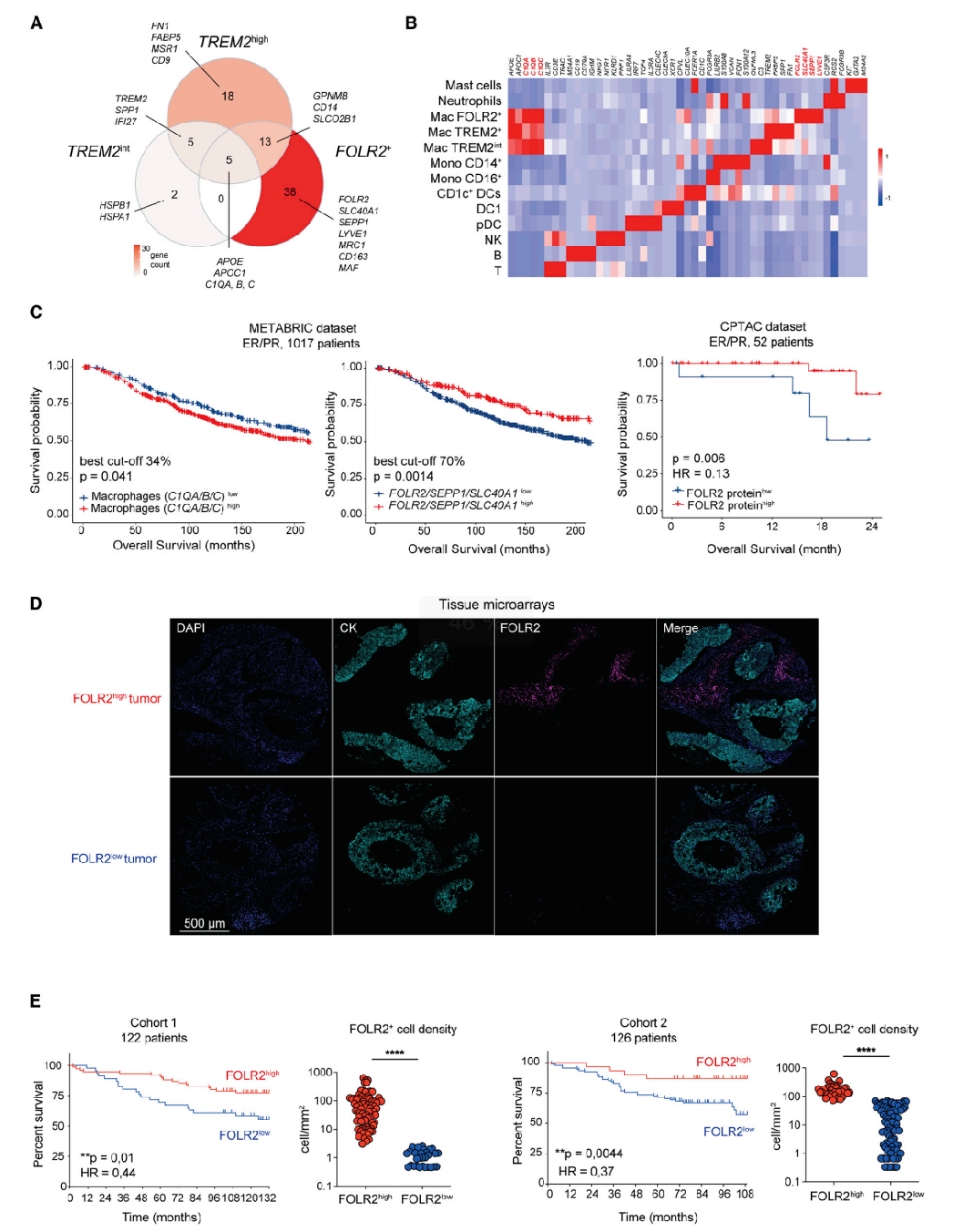
图4:FOLR2+巨噬细胞与乳腺癌患者的生存率增加相关:(A)韦恩图显示了每个APOE+巨噬细胞簇的特异性和共同的DEG(log2(FC)>0.75)(图2A);(B)热图显示了从BC患者中分离的CD45+细胞的在已发表的scRNA-seq数据集中,区分肿瘤浸润性免疫细胞群的特异性基因的平均表达;(C) METABRIC luminal BC队列(1017例患者)中巨噬细胞基因特征(C1QA/C1QB/C1QC)和FOLR2+TAM基因特征(FOLR2/SEPP1/SLC40A1)的Kaplan-Meier生存曲线;根据最佳截止值,将患者分为高表达组和低表达组;CPTAC luminal BC队列中FOLR2蛋白的表达生成的Kaplan-Meier生存曲线(n=52);根据25%的界限,将患者分为高表达组和低表达组;(D)来自组织芯片的多重免疫荧光的代表性图像显示FOLR2high(上)和FOLR2low(下)谱;(E)通过对两个独立队列肿瘤的多光谱分析,计算出FOLR2+巨噬细胞密度的Kaplan-Meier生存曲线(队列1:FOLR2highn=76, FOLR2lown = 46;队列2:FOLR2highn=36;FOLR2lown=90);图中显示了肿瘤中FOLR2+巨噬细胞密度的定量分析情况;根据最佳p值截止值,将患者分为高细胞密度组和低细胞密度组。
FOLR2+巨噬细胞位于肿瘤间质中,并在肿瘤中与TREM2+巨噬细胞空间上分离
前述已经证明了FOLR2+巨噬细胞是MG TRMs。此外,最近的研究表明,在健康人体组织中发现了表达FOLR2的巨噬细胞。那么是否可以检测到跨癌症类型的FOLR2+巨噬细胞呢?为了解决这个问题,研究者分析了在80个不同人类肿瘤组织学切片中FOLR2+细胞的空间分布(表S1)。在这些癌症中都发现了FOLR2+巨噬细胞(图5A和S5A)。空间分布定量分析显示,FOLR2+细胞在肿瘤间质中一致存在,很少浸润肿瘤巢(图5A和S5B)。对不同癌症类型的系列切片进行了FOLR2和TREM2染色,结果显示FOLR2和TREM2通常是在空间上分离的(图5B)。TREM2+巨噬细胞浸润或定位于肿瘤巢附近,而FOLR2+巨噬细胞主要定位于肿瘤间质(图5B)。这种空间分布见于肝细胞癌(图5Ba)、肺癌(图5Bb)和胰腺癌(图5Bc)。在一些癌症中,TREM2+细胞在肿瘤间质和肿瘤巢中都被发现(图5Bd和S5C),而FOLR2+细胞仍然位于肿瘤间质中。总之,这些结果表明,FOLR2+和TREM2+巨噬细胞在各种癌症类型的肿瘤微环境中的特定位置相关。
为了定量评估FOLR2+和TREM2+巨噬细胞在乳腺肿瘤中的空间分布,对122例患者的肿瘤组织芯片进行了多光谱成像(图4D)。通过其CK的表达来鉴定肿瘤巢(图S5D)。对肿瘤区域(肿瘤巢CK+vs肿瘤间质CKNEG)、FOLR2+和TREM2+细胞的空间分布进行自动分类(图S5D)。与IHC结果一致,FOLR2+巨噬细胞位于肿瘤间质中,距离肿瘤巢平均距离95μm(图5C和S5E)。相比之下,TREM2+巨噬细胞出现在肿瘤巢内和肿瘤巢附近的浸润边缘(平均距离47μm,图S5E)。肿瘤巢穴周围的TREM2+巨噬细胞经常形成细胞簇(见IFs图S2C、S5E和S5F)。所以与TREM2+巨噬细胞相比,FOLR2+巨噬细胞主要位于肿瘤间质中,离肿瘤巢更远(图5C)。在队列1和队列2的组织微阵列中(图4D和4E),TREM2+细胞密度无重复性,且与生存显著相关(图S5G)。有趣的是,TREM2或TREM2基因特征mRNA水平在TCGA整个肿瘤转录组数据集与更差的生存相关(表S4),肾透明细胞癌(KIRC)、胰腺癌(PAAD)、低级别胶质瘤(LGG)和肝癌细胞癌(LIHC)(表S4;图S5H)。为了检测肿瘤间质中FOLR2+和TREM2+巨噬细胞丰度是否与临床结果相关,研究者分析了通过激光捕获显微解剖BC瘤周间质生成的微阵列数据集,发现FOLR2基因特征与更好的生存率密切相关,而低FOLR2基因特征表达者的临床结果较差(图5D)。相反,TREM2基因特征高表达的患者生存概率降低,高表达的患者被认为是预后较差的患者组(图5D)。
总之,FOLR2+和TREM2+巨噬细胞在肿瘤微环境中是空间分离的,它们在肿瘤间质中的丰度与BC患者的不同临床结果相关。
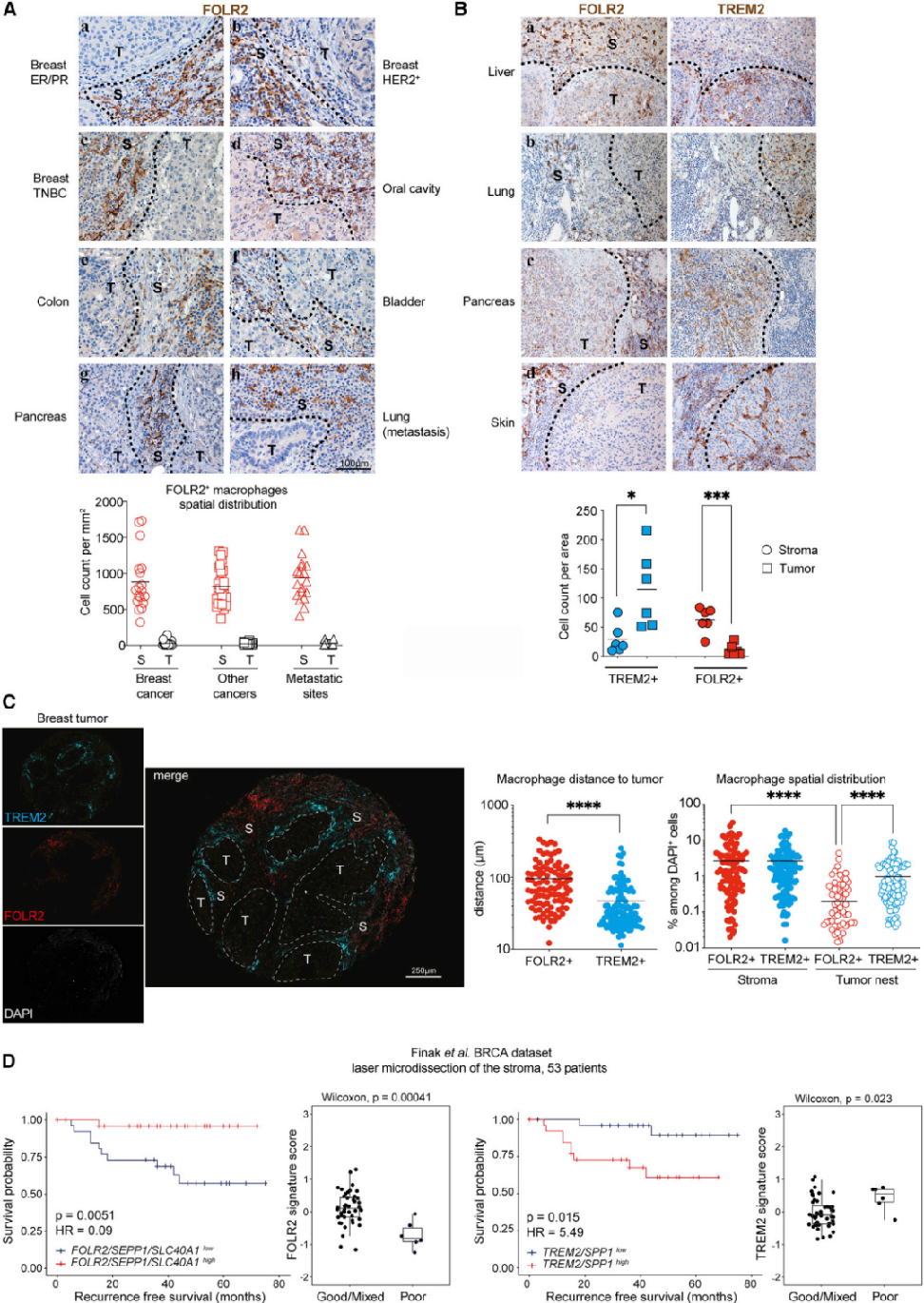
图5:FOLR2+巨噬细胞与TREM2+巨噬细胞在空间上分离:(A-C)乳腺癌(a-c)、口腔(d)、结肠(e)、膀胱(f)、胰腺(g)、肺(h)中FOLR2染色的切片。虚线表示浸润性边缘;定量分析80个肿瘤切片中FOLR2+巨噬细胞在肿瘤间质(S)与肿瘤巢(T)中的空间分布;(B)FOLR2+TAMs和TREM2+TAMs在人原发性癌中的空间分布。连续切片来自6例原发癌,包括1例肝细胞(a)、肺(b)、胰腺癌(c)和黑色素瘤(d)染色。定量分析10个肿瘤切片中FOLR2+(S)和TREM2+与肿瘤巢(T)中巨噬细胞的空间分布;(C)BC组织芯片多重免疫荧光的代表性肿瘤斑点显示TREM2+(青色)和FOLR2+(红色)巨噬细胞的空间分布。虚线表示浸润性边缘;定量分析FOLR2+或TREM2+巨噬细胞到肿瘤巢的距离。对122例患者的肿瘤间质(S)与肿瘤巢(T)中FOLR2+和TREM2+巨噬细胞的空间分布进行定量分析;(D)Finak等人的luminal ER/PR BC队列(n=53例患者)中FOLR2+巨噬细胞基因特征(FOLR2/SEPP1/SLC40A1)和TREM2+巨噬细胞基因特征(TREM2/SPP1)的Kaplan-Meier生存曲线。预后良好/混合与不良患者组的特征定量分析。
FOLR2+巨噬细胞在CD8+ T细胞浸润的肿瘤中富集,并在整个肿瘤中与淋巴样聚集物共定位
为了进一步了解功能,研究者使用FOLR2基因特征或FOLR2单独表达,将FOLR2+巨噬细胞与肿瘤微环境中其他免疫和基质细胞类型的丰度相关联(图6A;表S4),发现FOLR2基因特征(或FOLR2基因)与已知的抗肿瘤免疫参与者如CD8+T细胞、DCs、B细胞和三级淋巴结构(TLSs)呈正相关(图6A和S6A)。相比之下,TREM2+巨噬细胞基因特征或单独表达TREM2与T细胞、CD8+T细胞、NK细胞或B细胞并不相关(图6A)。此外,在同一肿瘤中,FOLR2在整体肿瘤转录组中的最高表达水平与多个淋巴细胞谱系的协调浸润和TLS的一个基因特征相一致(图6B)。当根据TREM2转录本水平对患者进行分层时,没有发现相关性(图6B)。研究者又分析了在整个肿瘤转录组中与FOLR2(或TREM2)表达呈正相关的所有基因中所代表的基因通路(图S6B),发现FOLR2在肿瘤中的表达与各种免疫途径之间有很强的相关性,包括TCR和PD-1信号通路和抗原加工。研究者还分析了FOLR2+巨噬细胞与CADM1+TREM2+巨噬细胞在bulk RNA-seq数据集中富集的基因通路,发现趋化性和免疫应答调节的功能模块是FOLR2+巨噬细胞中富集的基因通路(图6C和S6C)。总之,这些结果表明,FOLR2+巨噬细胞是抗肿瘤免疫开始的免疫环境的一部分。
CD8+ T细胞与包括BC在内的各种癌症类型的生存率较好相关,FOLR2+巨噬细胞是否与肿瘤浸润性CD8+ T细胞存在相互作用?研究者对肿瘤切除样本使用共聚焦显微镜,发现位于CD31+血管附近的FOLR2+巨噬细胞与CD8+ T细胞聚集物密切相关(图6D)。为了证实FOLR2+巨噬细胞和CD8+ T细胞之间的空间关联,对之前的组织微阵列患者队列中的CD8+和FOLR2+细胞进行了染色,并计算了它们各自的细胞密度。FOLR2+和CD8+细胞密度在BC亚型之间以及在肿瘤分期和分级之间均无显著差异(图S6D和S6E)。然而,FOLR2+巨噬细胞含量高的肿瘤的CD8+ T细胞密度明显高于FOLR2+巨噬细胞含量低的肿瘤(图6E和S6F)。TREM2+细胞的丰度与CD8+细胞的浸润之间没有显著的相关性(图S5F和S6F)。在TLS中也可以检测到FOLR2+巨噬细胞(图S6G)。总之,这些结果表明,基质相关的FOLR2+巨噬细胞是肿瘤巢附近淋巴样聚集物的结构成分。
为了进一步研究FOLR2+巨噬细胞是否与CD8+ T细胞有效地结合,对新鲜的人BC病变进行了共聚焦活体成像,用抗CD8、FOLR2和EPCAM的荧光偶联抗体对肿瘤病变中的内源性CD8+ T细胞、FOLR2+巨噬细胞和EPCAM+肿瘤细胞进行染色,随后通过延时显微镜对细胞动力学进行成像(图6F),可以观察到FOLR2+巨噬细胞定位于肿瘤间质内,并形成了一个具有活性膜皱褶的固态细胞网络(视频S1)。这与CD8+T细胞在FOLR2+缺失的肿瘤区域具有更高的运动性形成对比(图6F;视频S2和S3)。研究者得出的结论是,CD8+T细胞与FOLR2+巨噬细胞建立了长期的相互作用,这种行为可能促进T细胞的激活。与此结果相一致,FOLR2在整个肿瘤转录组中的表达与T细胞中控制细胞毒性功能的基因(GZMA、GZMB、GZMK、PFR1、KLRB1和KLRD1)呈正相关,而与T细胞功能障碍的基因如LAG3不相关(图6G)。TREM2的表达与CD8+ T细胞细胞毒性功能的基因无显著相关性。
此前已有人提出,肺肿瘤间质或胸膜和腹膜腔中的TAMs可以阻挡T细胞到达肿瘤,并可能对抗肿瘤免疫产生负面影响。在其他研究中,抗原提呈细胞和T细胞之间的长期相互作用先于T细胞的激活,因此可能促进T细胞免疫。为了评估CD8+ T细胞/巨噬细胞的相互作用是否在BC中转化为良好的临床结果,对T细胞浸润肿瘤中CD8+ T细胞和巨噬细胞亚群之间的细胞相互作用进行了定量空间分析。为此,对<60例BC患者的肿瘤进行了多重成像,其中CD8+ T细胞的密度高于50个CD8+ T细胞/mm²。研究者定量分析了FOLR2+或TREM2+巨噬细胞周围(距离<30μm)的CD8+T细胞百分比,并根据与这两个巨噬细胞亚群密切接触的CD8+ T细胞的“高”或“低”百分比对患者进行分层,发现与FOLR2+巨噬细胞接触的CD8+ T细胞与BC患者的预后更好相关,而CD8 T细胞与TREM2+巨噬细胞相互作用的情况则不是这样(图S6H)。因此,研究者得出结论:肿瘤浸润性CD8+ T细胞与FOLR2+巨噬细胞相互作用,并且这种作用与CD8+ T细胞激活、患者生存呈正相关。
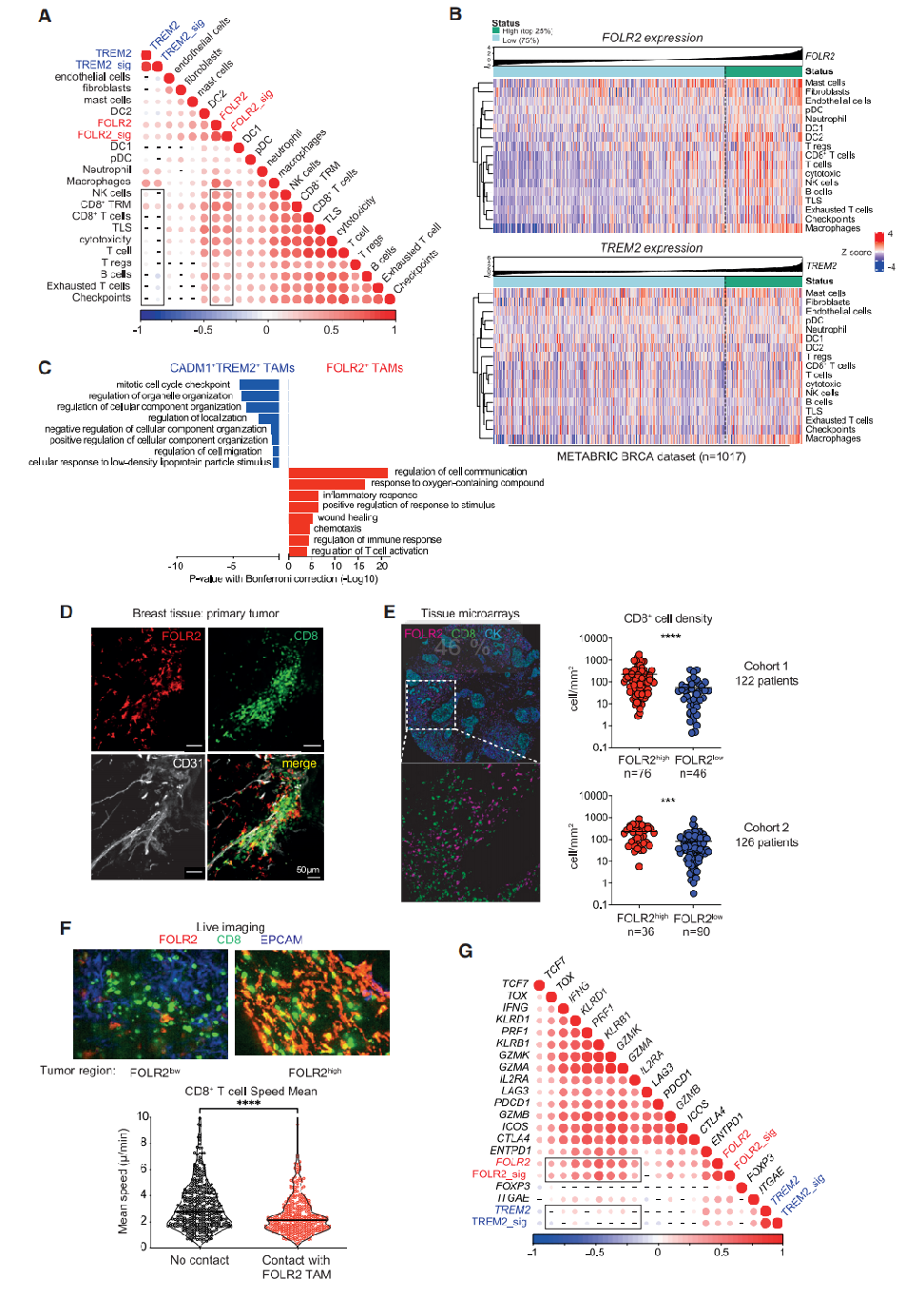
图6:FOLR2+巨噬细胞在CD8+ T细胞浸润的肿瘤中富集,并在整个肿瘤中与淋巴样聚集物共定位:(A和B)相关图(A)和热图(B)分析METABRIC数据集中FOLR2和TREM2基因与免疫细胞基因特征的关联(n=1017例患者);(C)从BC原发肿瘤中分离的FOLR2+和CADM1+TREM2+巨噬细胞的bulk RNA-seq中基因通路的差异富集分析;(D)具有代表性的共聚焦免疫荧光图像,在原发性BC中,FOLR2+巨噬细胞与CD31+血管和CD8+ T细胞共定位;(E)具有代表性的组织芯片的多重免疫荧光图像显示CD8、FOLR2和细胞角蛋白(CK)蛋白的表达。显示FOLR2+细胞密度高或低的肿瘤中CD8+ T细胞的密度图(见图4E);(F)经FOLR2(红色)、CD8(绿色)和EPCAM(蓝色)染色的BC肿瘤切片的共聚焦图像。FOLR2+巨噬细胞高密度或低密度的肿瘤区域的代表性图像。内源性CD8+ T细胞与FOLR2+巨噬细胞接触与否的平均速度图;(G)在METABRIC数据集中分析FOLR2和TREM2基因与T细胞激活、细胞毒性功能或衰竭基因的相关图(共1017例患者)。
FOLR2+巨噬细胞对肿瘤生长存在反应,并获得T细胞启动能力
新生肿瘤已被证明与TRMs进行细胞间交流,进而促进肿瘤的生长、运动性和侵袭性。为了探讨FOLR2+巨噬细胞的功能特征,研究者转向了PyMT BC小鼠模型。首先,健康MG的FOLR2+巨噬细胞是否会对发展中的肿瘤有反应?为此,使用bulk RNA-seq分析了从健康和中小型肿瘤小鼠MG中分离的FOLR2+巨噬细胞(图7A、7B和S7A)。使用10000个最可变基因进行的主成分(PC)分析显示,从乳腺肿瘤中分离出来的FOLR2+巨噬细胞以肿瘤大小依赖的方式改变其转录组谱,从PC2轴的变化可以看出(图7A)。有趣的是,CADM1+巨噬细胞的转录组不受肿瘤大小的影响,而是与FOLR2+巨噬细胞单独聚集在一起。研究者发现从同一肿瘤中分离出来的FOLR2+和CADM1+巨噬细胞之间有6139个DEG。他们得出的结论是FOLR2+巨噬细胞对发展中的肿瘤有反应,但仍然是与CADM1+巨噬细胞可分离的细胞实体。在乳腺肿瘤的FOLR2+巨噬细胞和健康的MG FOLR2+巨噬细胞之间有1356个DEG。在这些DEG中,乳腺肿瘤FOLR2+巨噬细胞表达了参与正向调控免疫系统过程的基因,包括B细胞和T细胞趋化剂(Ccl6 to 9,Ccl12,Cxcl2,Cxcl13,Cxcl14和Cxcl16)、粘附分子(Icam1、Vcam1和Fn1)和溶酶体蛋白(Ctse和Rab32)(图7B和7C)。相比之下,从健康MG中分离出来的FOLR2+巨噬细胞在调节代谢过程的基因(Igf1、Srebf2和Abcd2)中富集(图7B和7C)。因此这些数据显示,FOLR2+ TRMs对肿瘤的发展有反应。
肿瘤中巨噬细胞的激活通常被称为“促炎/M1”,而不是“抗炎/M2”。为了检测乳腺肿瘤FOLR2+和CADM1+巨噬细胞亚群是否具有这种功能特化,分析了这两个巨噬细胞亚群中定义M1或M2基因特征的基因的表达,发现乳腺肿瘤FOLR2+和CADM1+巨噬细胞同时表达个体M1和M2基因(图7D)。例如,FOLR2+巨噬细胞表达Cd80、Cd40和Il6(M1基因)与Cd163、Mrc1和Il10(M2基因)。CADM1+巨噬细胞表达Cd86、Cxcl9和Il12b(M1基因)与Vegfa、Cd276和Tgfb3(M2基因)。这说明巨噬细胞在肿瘤微环境中的激活不符合体外M1/M2极化模型,揭示了肿瘤微环境中巨噬细胞激活的复杂性。有趣的是,乳腺肿瘤FOLR2+和CADM1+巨噬细胞亚群表达了不同的功能基因集,这些基因可能与T细胞激活有关(图7D和S7B)。因此,为了直接检测巨噬细胞亚群的T细胞激活潜能,建立了两种检测方法,使用从同一肿瘤中分离出的FOLR2+和CADM1+巨噬细胞,并与CD8+ T细胞共培养。首先,建立了一种T细胞抑制实验,将纯化的TAMs与多克隆激活的CD8+ T细胞共培养,显示FOLR2+巨噬细胞没有显示出抑制活性,相反,FOLR2+巨噬细胞改善了CD8+ T细胞的增殖和分化(CD62L的缺失和CD44和CD25的上调)(图S7C)。CADM1+巨噬细胞也没有抑制CD8+ T细胞的活化,但它们促进效应T细胞分化的能力弱于FOLR2+巨噬细胞(图S7C)。在之前的研究中免疫抑制活性仅限于MHCⅡNEG肿瘤相关髓系细胞。相反,MHCⅡ+ TAMs并没有发挥T细胞抑制作用。研究者发现CADM1+和FOLR2+ TAMs都表达了高水平的MHCⅡ(图3H),这与它们缺乏免疫抑制活性相一致。由于FOLR2+和CADM1+巨噬细胞都不能强烈抑制T细胞的扩增,研究者建立了一种抗原特异性T细胞引物实验。将纯化的FOLR2+和CADM1+巨噬细胞装载OTI特异性SIINFEKL肽、洗涤、随后与初始OTI CD8+ T细胞共培养。与从同一肿瘤中分离出来的CADM1+巨噬细胞相比,FOLR2+巨噬细胞对幼稚T细胞表现出更高的诱导能力,包括激活、扩增、多功能性(IL-2、IFN-g和TNF-a)和细胞毒性功能(颗粒酶B的表达)(图7E和7F)。此外,研究者发现从健康MGs中分离的FOLR2+巨噬细胞不能有效激活OTI CD8+ T细胞,而从乳腺肿瘤中分离的FOLR2+巨噬细胞可以诱导T细胞的扩张和分化(图7E)。这些结果证实了FOLR2+巨噬细胞在肿瘤发展过程中被激活,并获得了启动CD8+ T细胞的能力。总之,这些数据提供了证据表明FOLR2+巨噬细胞的行为不像免疫抑制细胞。相反,肿瘤相关的FOLR2+巨噬细胞是一种强大的抗原提呈细胞,显示出触发CD8+ T细胞激活的功能能力。
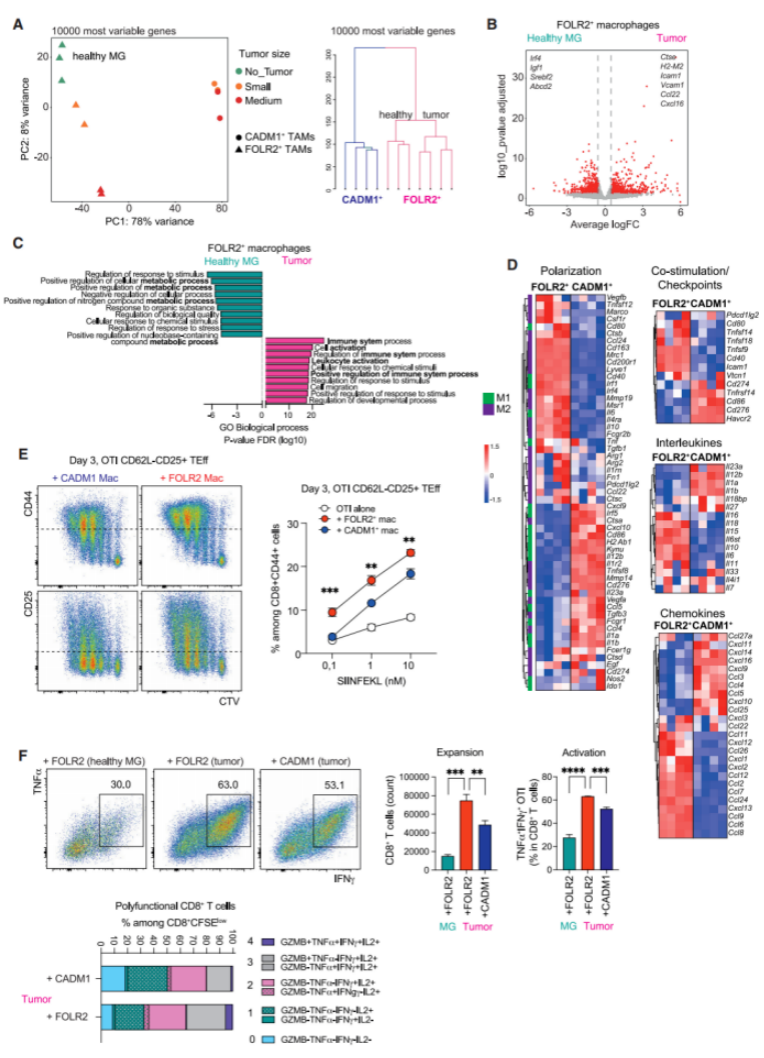
图7:FOLR2+巨噬细胞对肿瘤生长存在反应,并获得T细胞启动能力:(A)从健康乳腺(MG)或中小型肿瘤分离的FOLR2+巨噬细胞和从相同的肿瘤、22周龄PyMT小鼠或年龄匹配的同伴分离的CADM1+巨噬细胞的bulk RNA-seq中,主成分分析和层次聚类的10000最变量基因表达。每个相同颜色的点对应着一个重复的样本;(B)火山图显示从健康MG或乳腺肿瘤中分离出的FOLR2+巨噬细胞之间的DEG;(C)从健康MG或乳腺肿瘤中分离的FOLR2+巨噬细胞之间基因通路的差异富集(如A中分离的bulk RNA-seq);(D)从同一肿瘤中分离的FOLR2+和CADM1+巨噬细胞之间选择基因的热图(如A中的bulk RNA-seq);(E和F)SIINFEKL OVA肽标记的FOLR2+或CADM1+巨噬细胞与CTV标记的幼稚OTI CD8+ T细胞共培养:(E)3天后,用流式细胞术检测T细胞的增殖和活化情况。代表性点图是用1nM肽标记的巨噬细胞获得的数据;(F)流式细胞术检测细胞内GZMB、TNF-a、IL-2和IFN-g的表达;代表性点图是用1nM肽标记的巨噬细胞获得的数据;右图的数据代表在与用1nM SIINFEKL标记的不同的巨噬细胞群共培养3天后,OTI T细胞计数和IFN-γ+TNF-α+CD8+ T细胞的百分比(%)。
讨论
研究者鉴定了一个进化保守的表达TRM2的群体,存在于人类和小鼠健康MG中。人类FOLR2+巨噬细胞表达MRC1和LYVE1,并与健康未产小鼠成年MG中描述的小鼠MRC1+ TRMs一致。在小鼠中,MRC1+ TRMs产生于胎儿前体,通过Csf1rMer-iCre-Mer或Cx3Cr1Cre-ERT2小鼠的基因标记得到证明,并通过自我再生在成年小鼠中局部维持。MRC1+ TRMs与一小部分单核细胞来源的导管内CX3CR1highMRC1- TRMs共存,后者在哺乳期的组织重塑过程中扩张。有趣的是,大多数侵袭乳腺肿瘤的小鼠巨噬细胞在转录上与健康的导管内CX3CR1highMRC1- TRMs转录一致。总之,这些发现突出了MG巨噬细胞亚群内的个体发生和功能多样性。在这里,研究者鉴定了FOLR2+人巨噬细胞作为小鼠MRC1+乳腺TRMs的同源物,并且发现,人FOLR2+巨噬细胞代表了健康乳腺组织中主要的巨噬细胞群体,因此符合MG TRMs。相反,CADM1+TREM2+巨噬细胞在健康组织中稀缺,而在原发肿瘤中增加,并且人CADM1+TREM2+巨噬细胞与小鼠单核细胞来源的CX3CR1highMRC1- TAMs结合。研究者对人类CADM1+TREM2+巨噬细胞的bulk RNA-seq分析表明,它们的转录与CCR2+单核细胞转录接近,进一步表明其起源于单核细胞。CADM1+TREM2+巨噬细胞可能与最近在多种癌症类型中发现的TREM2+巨噬细胞一致。
最近的研究强调了小鼠TRMs的致瘤作用。例如,胚胎来源的TRMs的消耗延缓了胰腺癌中肿瘤病变的进展。然而,其对总生存率的影响尚未得到评估。此外,卵巢癌中CD163+ TRMs的消耗也减少了上皮细胞向间充质细胞的转化和肿瘤的整体生长。CD169+肺泡巨噬细胞在体外促进肺癌细胞上皮细胞向间充质细胞的转化。在小鼠PyMT BC中,MHCⅡ+ CD11b+MRC1+ TRMs尽管被进入的单核细胞来源的TAMs稀释,但在乳腺肿瘤的发展中持续存在。在独立BC模型中,致癌前TRM体内消耗并不影响T细胞激活或肿瘤生长,但增加了早期癌细胞扩散。FOLR2+巨噬细胞类似于Frankil等人描述的MRC1+ TRMs。研究者没有发现FOLR2+巨噬细胞有任何T细胞抑制活性。相反,他们发现FOLR2+ TRMs在与肿瘤发展相关的激活后,获得了启动幼稚CD8+ T细胞形成多功能效应物(颗粒酶B+,IFNg+,TNF-a+)的能力。
FOLR2+巨噬细胞表现出稳态PV巨噬细胞(LYVE1、MRC1和TIMD4)的转录特征。因此,研究者发现一些FOLR2+巨噬细胞位于人体组织中的CD31+血管附近。在小鼠中,各种研究已经确定了PV巨噬细胞是跨器官的。在小鼠模型中,一个表达血管生成素受体TIE2的PV巨噬细胞的前肿瘤亚群与血管生成和肿瘤扩散有关。然而,研究者不赞成FOLR2+巨噬细胞对应TIE2+巨噬细胞的假设,原因有二:①没有发现FOLR2+巨噬细胞中TIE2表达;②TIE2+ PV巨噬细胞区别于炎性促血管生成的TIE2+单核细胞。
最近的一项研究发现了一个与人肝癌相关的潜在免疫抑制FOLR2+ TAMs亚群。为了探究FOLR2+巨噬细胞在大型BC数据集中的功能,研究者设计了一个基因特征,使其能够推断FOLR2+巨噬细胞在BC体转录组中的丰度。他们发现FOLR2+ TAMs的丰度与BC患者更好的预后相关。通过显示免疫荧光评估的FOLR2+巨噬细胞的细胞密度与BC患者生存率的增加呈正相关,从而验证了这一发现。之后发现FOLR2+(而非TREM2+)巨噬细胞丰度与肿瘤浸润性CD8+ T细胞、B细胞和树突状细胞呈正相关。此外,通过共聚焦成像发现,FOLR2+巨噬细胞与CD8+ T细胞聚集物共定位在内皮细胞附近。通过多光谱成像验证了FOLR2+巨噬细胞与CD8+ T细胞丰度之间的相关性:FOLR2+ TAMs高度浸润的肿瘤病变显示出明显更高的CD8+ T细胞密度。通过对新鲜的人类肿瘤切片的实时成像,发现肿瘤浸润性CD8+ T细胞与FOLR2+ TAMs有长期的相互作用。由于CD8+ T细胞在包括BC在内的许多癌症中浸润与更好的生存概率相关,这些结果表明FOLR2+ TAMs参与了抗肿瘤免疫的发生。这是有效抗肿瘤免疫反应的关键事件之一,因此,需要进一步研究FOLR2+ TAMs对肿瘤浸润淋巴细胞的调节机制。
研究缺陷
我们仍然需要一种用于造成FOLR2+ TAMs在体内的特异性缺失,同时不影响其他单核/巨噬细胞亚群的工具来明确FOLR2+ TAMs对肿瘤免疫的特殊作用。此外,还需要在除乳腺癌以外的其他癌种中验证FOLR2+ TAMs的类似功能。本研究发现单纯内分泌治疗且FOLR2基因特征评分较高的luminal BC患者的生存率显著提高。此外,调整既往报道的BC预后因素后,FOLR2基因特征仍是一个重要的预后因素。需要进一步研究FOLR2基因特征与其他可用分层方法的基准之间的不同点,并确定其在特定临床相关的患者亚组中的作用。基于FOLR2与CD8+ T细胞的显著相关性,以及其对肿瘤浸润淋巴细胞和细胞毒细胞的良好预后预测能力,未来研究应该着眼于探究FOLR2+TAMs是否具有独立于CD8+ T细胞影响预后的能力。
专家简介
陈锦霞
余平元
中国科学院大学附属肿瘤医院-温州医科大学联合培养硕士研究生
雷蕾
中国科学院大学附属肿瘤医院乳腺内科 副主任医师 医学博士
美国密西西比大学癌症中心访问学者
中华医学会肿瘤学分会乳腺学组青年委员
浙江省抗癌协会乳腺癌专委会青年委员
浙江省医学会肿瘤内科分会秘书
浙江省康复医学会肿瘤专业委员会青年委员
浙江省康复医学会肿瘤专业委员会淋巴水肿治疗学组委员
在国际会议壁报交流10余项;发表SCI论文20余篇;主持及参加省部及以上课题10余项;参编学术专著数本。














 苏公网安备32059002004080号
苏公网安备32059002004080号


