
孙同辉, 芦梓楠, 宋海涛, 等. 曲妥珠单抗辅助治疗对T1N0M0期人表皮生长因子受体2阳性乳腺癌远期生存影响的真实世界研究[J]. 中华肿瘤杂志, 2023, 45(1):101-107.
DOI: 10.3760/cma.j.cn112152-20220308-00158.
目的
探讨曲妥珠单抗辅助治疗对人表皮生长因子受体2(HER-2)阳性早期乳腺癌患者预后的影响。
方法
研究为回顾性研究,选取2010年1月至2019年12月就诊于新疆医科大学附属肿瘤医院并接受手术的HER-2阳性T1N0M0期乳腺癌患者,根据是否接受曲妥珠单抗治疗将患者分为治疗组和对照组。采用倾向性评分匹配(PSM)平衡两组间患者基线特征差异造成的混杂偏倚,Cox比例风险模型分析影响无病生存的危险因素,Kaplan-Meier法估计PSM前后两组患者的3、5年无病生存率和总生存率。
结果
HER-2阳性T1N0M0期乳腺癌患者291例,其中T1a期21例(7.2%),T1b期61例(21.0%),T1c期209例(71.8%)。PSM前,治疗组132例,对照组159例,PSM前全组患者的5年无病生存率为88.5%,5年生存率为91.5%。PSM后,治疗组103例,对照组103例,PSM后全组患者的5年无病生存率为86.0%,5年生存率为88.5%。PSM前,治疗组和对照组患者的肿瘤大小、组织学分级、脉管是否侵犯、Ki-67指数、术后是否化疗、术后是否放疗差异均有统计学意义(均P<0.05);PSM后,治疗组和对照组患者的临床病理特征差异无统计学意义(均P>0.05)。多因素分析显示,组织学分级(HR=2.927,95 CI:1.476~5.805,P=0.002)、脉管侵犯(HR=3.410,95 CI:1.170~9.940,P=0.025)、月经状态(HR=3.692,95 CI:1.021~13.344,P=0.046)、是否化疗(HR=0.238,95 CI:0.079~0.720,P=0.011)是无病生存的独立影响因素。PSM后,治疗组患者5年无病生存率为89.2%,对照组为83.5%(P=0.237);治疗组患者5年生存率为96.1%,对照组为84.7%(P=0.036)。
结论
术后曲妥珠单抗靶向治疗可以降低HER-2阳性T1N0M0期乳腺癌患者的复发转移风险。
【关键词】乳腺肿瘤;人表皮生长因子受体2阳性;曲妥珠单抗;倾向评分匹配
乳腺癌是女性人群中最常见的恶性肿瘤,占女性恶性肿瘤的30%,且发病率每年持续增加约0.5%,居女性恶性肿瘤死因的第2位。约15%~20%的乳腺癌过表达人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2),HER-2过表达与较高的复发转移和死亡率相关,即便早期诊断,预后也很差。随着医学进步,恶性肿瘤的综合治疗使实际死亡人数比预期因肿瘤死亡人数大幅减少。曲妥珠单抗是第1个被美国食品药品监督管理局批准用于抗HER-2靶向治疗的药物,能显著改善HER-2阳性乳腺癌患者的预后。早期曲妥珠单抗联合化疗用于治疗HER-2阳性晚期乳腺癌,随着一些国际多中心大型临床试验的开展和结果公布,目前曲妥珠单抗已用于早期乳腺癌和新辅助治疗中,且对长径>1 cm和(或)腋窝淋巴结阳性的早期患者辅助治疗效果确切。对于在临床上越来越多通过健康体检或早期筛查发现、长径<1 cm、无腋窝淋巴结转移的HER-2阳性小肿瘤患者,是否也可以从曲妥珠单抗靶向治疗中获益,目前还存在较大争议。本研究中,我们通过对新疆医科大学附属肿瘤医院2010—2019年HER-2阳性T1N0M0期乳腺癌患者术后3年和5年无病生存率和总生存率的数据分析,以真实世界的高质量随访数据反应中国西部地区近10年来乳腺癌早期诊治的效果。
资料与方法
1.临床资料:
选取2010年1月至2019年12月于新疆医科大学附属肿瘤医院治疗的HER-2阳性T1N0M0期乳腺癌患者,收集患者的临床病理和预后资料。纳入标准:(1)接受手术治疗的初诊女性乳腺癌患者;(2)T1N0M0期且HER-2阳性;(3)初发单侧、单病灶乳腺癌;(4)未接受术前新辅助治疗。排除标准:(1)合并其他系统恶性肿瘤;(2)接受除曲妥珠单抗之外其他靶向药物治疗;(3)临床诊治及生存随访资料不完整;(4)入院未签署患者知情同意等医疗文书。按照美国癌症联合委员会癌症分期第8版,根据病灶可测量最大长径将T1期进一步细分为T1a期(≤0.5cm),T1b期(>0.5~1.0 cm),T1c期(>1.0~2.0 cm)。2010年1月至2019年12月期间我中心初诊乳腺癌13 963例,按照纳排标准选取291例HER-2阳性T1N0M0期乳腺癌患者。
2.HER-2结果判定标准:
HER-2阳性即免疫组化(immunohistochemistry,IHC)染色结果为3+,或HER-2 2+时荧光原位杂交检测结果HER-2/CEP17比值≥2.0且平均HER-2拷贝数/细胞≥4.0,HER-2 0和1+则被判定为阴性。所有病理结果至少由2名病理医师审查,并得出一致结论。
3.治疗方案:
手术后接受曲妥珠单抗辅助治疗的患者为治疗组,未接受曲妥珠单抗辅助治疗的为对照组。治疗组患者曲妥珠单抗主要为3周静脉给药方案,初始曲妥珠单抗的负荷剂量为8 mg/kg,然后以6 mg/kg的维持剂量每3周1次,持续1年。
4.随访计划:
以门诊复查、住院和病案室专人电话随访等方式相结合随访,患者出院满1年后进行首次生存随访,随访截至2020年12月31日,随访时间为5~120个月,中位随访时间为48个月。治疗后5年内随访周期为每年1次,5年后随访周期为每2年1次,直至死亡事件发生时终止随访。完全随访指:(1)随访至死亡;(2)随访满10年仍存活;(3)随访时长在5~10年之间且近2年内有过随访记录;(4)随访时长不满5年且在近1年内有过随访记录。287例患者接受过至少1次随访,随访覆盖比例达98.6%(287/291),其中278例患者末次随访时间符合完全随访要求,完全随访比例达95.5%(278/291)。
5.疗效评价指标:
疗效评价指标为3年、5年无病生存率和3年、5年总生存率。无病生存率定义为手术之日至首次局部、远处复发转移或死亡(若患者在复发前死亡)患者人数占全组患者的比例;总生存率是指从手术之日到肿瘤相关死亡的患者占全组患者的比例。复发转移的患者需根据复发位置,使用适当的影像学(超声、CT、磁共振成像及正电子发射计算机断层扫描)或活检等技术对患者进行评估,从初始评估之日起计算转移进展时间,没有记录复发的患者以最近1次肿瘤评估证据为准。死亡定义为与乳腺癌有关或其他原因导致的无法治疗的疾病引起的死亡。
6.统计学方法:
用R 4.0.0分析数据。计数资料的比较采用χ2检验,生存分析采用Kaplan-Meier法和Log rank检验,影响因素分析采用Cox比例风险回归模型。检验水准α=0.05。采用倾向性评分匹配(propensity score matching, PSM)对混杂因素调整,创建术后可比队列,匹配的变量为辅助曲妥珠单抗治疗以外的生存相关影响因素,卡钳值设定为0.1,以1∶1最邻近法匹配。
结果
1.临床病理特征:
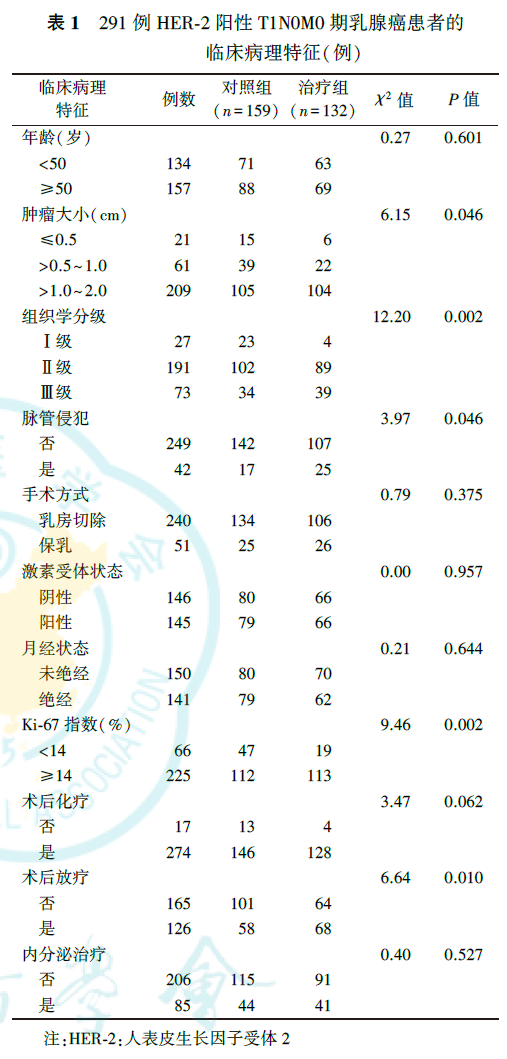
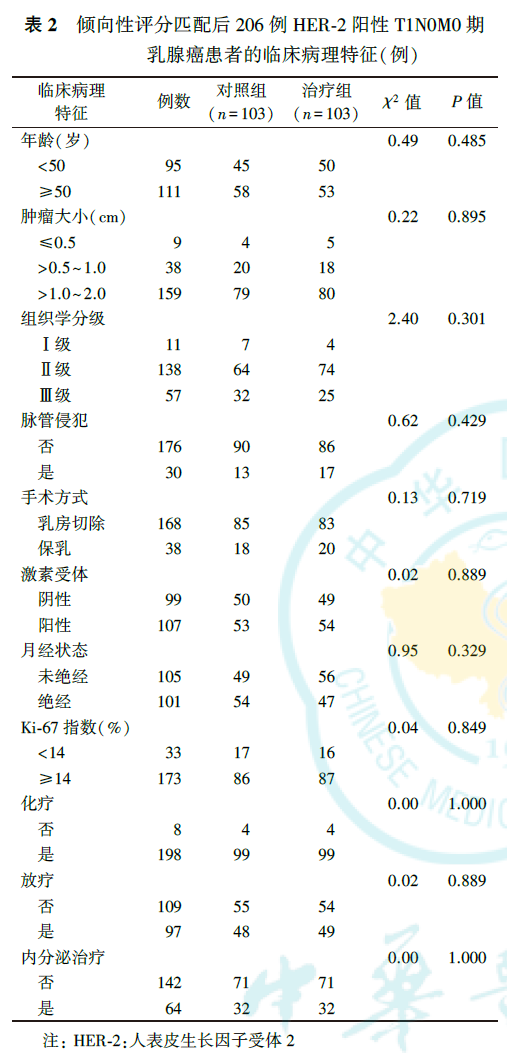
291例HER-2阳性T1N0M0期乳腺癌患者年龄为23~78岁,平均年龄为50岁;T1a期21例(7.2%,其中16例合并导管原位癌伴有微浸润),T1b期61例(21.0%),T1c期209例(71.8%)。291例患者中,治疗组132例(45.4%),对照组159例(54.6%);274例(94.2%)接受术后辅助化疗。治疗组中同时行辅助化疗128例(97.0%),对照组中行辅助化疗146例(91.8%)。治疗组和对照组患者的肿瘤大小、组织学分级、脉管是否侵犯、Ki-67指数、是否放疗差异均有统计学意义(均P<0.05,表1)。PSM后,治疗组(n=103)和对照组(n=103)患者的临床病理特征差异无统计学意义(均P>0.05,表2)。
在2017年曲妥珠单抗进入国家医保目录前(2010—2016年),186例T1N0M0期乳腺癌患者接受术后曲妥珠单抗治疗的仅占22.0%(41例),2017年及以后,105例乳腺癌患者接受曲妥珠单抗治疗的占比为86.7%(91/105)。全组291例患者中,接受曲妥珠单抗治疗的占比为45.4%(132/291)。
2.影响因素分析:
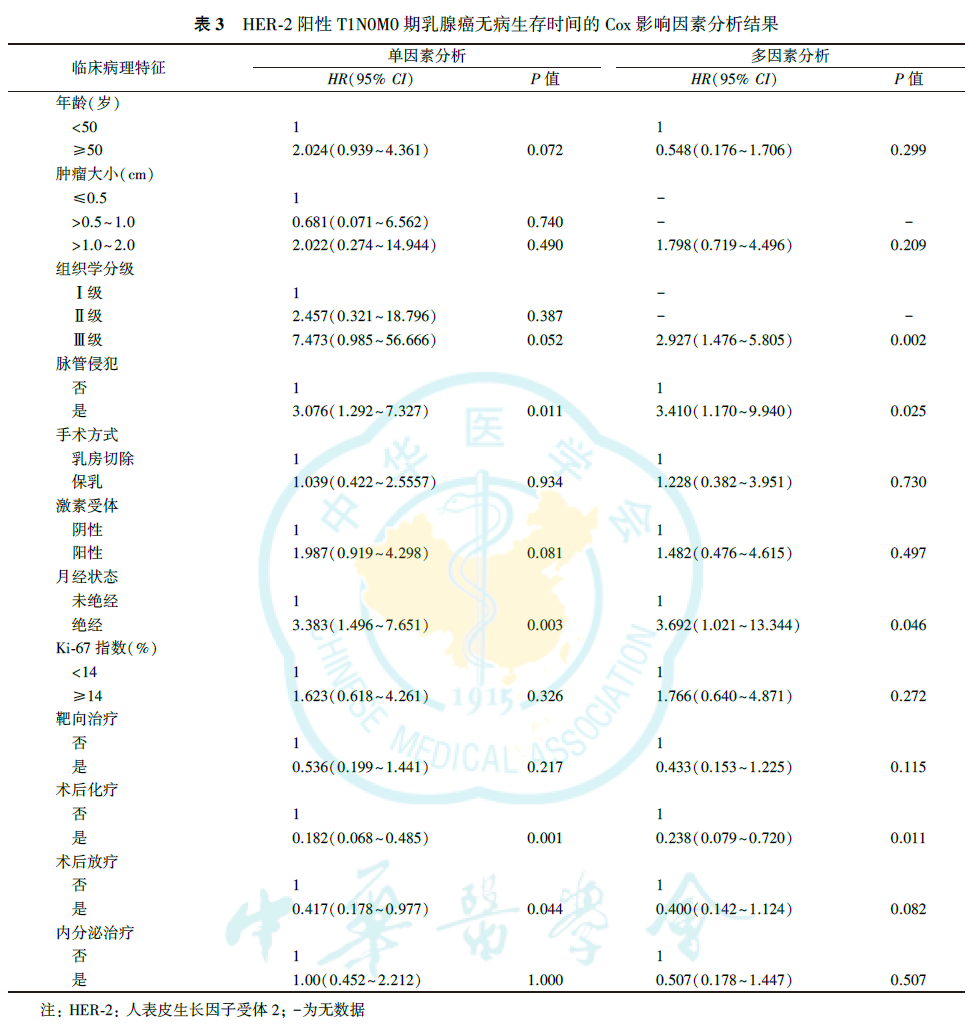
Cox单因素分析显示,脉管侵犯(P=0.011),月经状态(P=0.003),术后是否化疗(P=0.001)、术后是否放疗(P=0.044)与患者无病生存有关(表3)。虽然组织学分级在单因素分析中未显示统计学意义,但是考虑到临床上组织学分级为重要的预后影响因素,因此也纳入多因素分析,结果显示,组织学分级(P=0.002)、脉管侵犯(P=0.025)、月经状态(P=0.046)、术后是否化疗(P=0.011)是无病生存时间的独立影响因素(表3)。
3.预后:
291例患者中,死亡和复发转移29例。至随访结束死亡18例。PSM前,全组患者的3年无病生存率和3年生存率为别为94.6%和95.4%,5年无病生存率和5年生存率为别88.5%和91.5%。
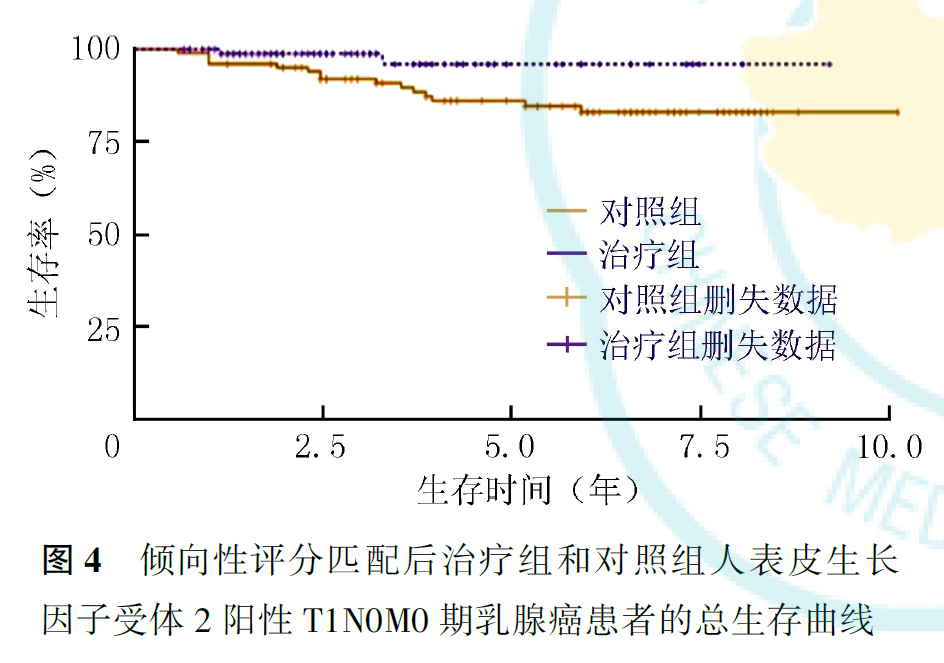
PSM前,治疗组患者的3年无病生存率和3年生存率为别为95.5%和98.0%,5年无病生存率和5年生存率为别91.3%和96.8%(P无病生存率=0.210,P生存率=0.048;图1、图2,表4)。PSM后,对照组和各治疗组各103例,死亡和复发转移25例。PSM后全组患者3年无病生存率和3年生存率为别为93.5%和94.1%,5年无病生存率和5年生存率为别86.0%和88.5%(图3、图4)。PSM后结果同样显示,5年生存率能从术后辅助靶向治疗中获益(P无病生存率=0.237,P生存率=0.036,表4)。
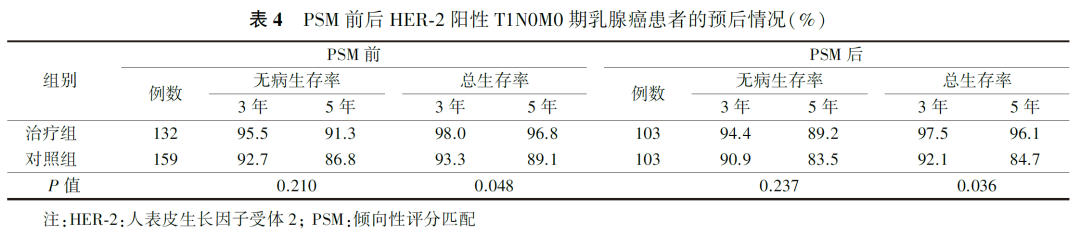
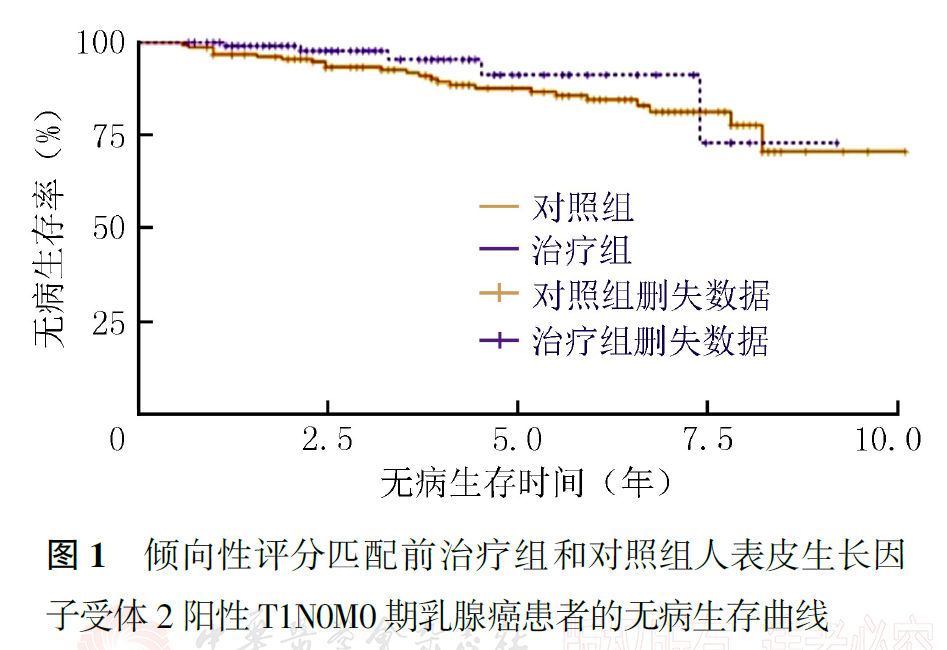
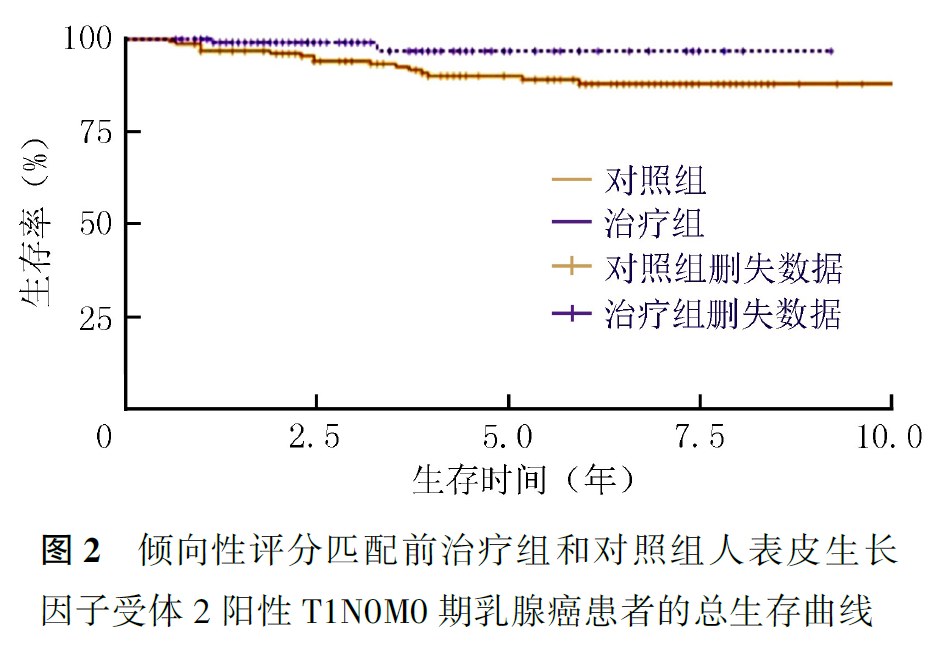
讨论
随着基于雌激素受体、孕激素受体、HER-2检测分子分型的临床应用,乳腺癌的治疗已进入了分类治疗的精准时代,其中HER-2过表达患者均能从抗HER-2治疗中获益。但在临床实践中,针对无区域腋窝淋巴结转移及远隔脏器转移的、肿瘤长径≤2.0 cm的T1期尤其是T1a、T1b期的小肿瘤患者,因肿瘤负荷较小、病期较早等复发风险较低、总体预后较好,以及考虑到药物可及性与卫生经济学的因素,针对HER-2阳性小肿瘤患者的靶向治疗还存在争议,临床上仅少部分合并高危因素的经济条件较好的患者接受了术后辅助曲妥珠单抗治疗,尤其是在2017年曲妥珠单抗纳入国家医保目录之前。
早期乳腺癌国际专家共识指出,HER-2阳性早期乳腺癌均可从抗HER-2靶向治疗中获益,但是专家共识对于腋窝淋巴结无转移的小肿瘤患者,尤其是T1a期乳腺癌是否抗HER-2靶向治疗仍存在较大分歧。2021年NCCN指南也指出,具有pT1a和pT1b期肿瘤且为pN0期的患者即使HER-2扩增或过表达,其预后也不确定。目前尚无研究该类人群的随机试验,该组患者是否使用曲妥珠单抗治疗,必须在权衡曲妥珠单抗的已知不良反应(如心脏不良反应)和不确定的绝对获益后决定。有研究提示,HER-2阳性小肿瘤也有较高的复发风险和转移潜力,临床上针对此类乳腺癌的治疗更应根据生物学亚型并结合肿瘤大小综合决策治疗方案。
NSABP31、NCCTGN9831、BCIRG006、HERA等一些关键性大规模Ⅲ期随机对照临床试验奠定了辅助曲妥珠单抗治疗为HER-2阳性乳腺癌标准治疗的基石地位。尤其在APT研究中入组了HER-2阳性早期乳腺癌患者406例,其中T1abN0M0期患者占比49.5%,随访3年无病生存率为98.7%,无复发生存率为99.2%,而T1a、T1b期患者3年无病生存率更是高达99.5%,且未发现T1a和T1b期患者生存差异存在统计学意义。这项前瞻性非随机的单臂试验说明术后辅助曲妥珠单抗靶向治疗对肿瘤≤1 cm的HER-2阳性早期乳腺癌患者的有效性和安全性,但该试验并没有探究影响HER-2阳性早期乳腺癌患者预后的危险因素和获益人群。本研究对291例接受和未接受曲妥珠单抗治疗1年的T1N0M0期HER-2阳性乳腺癌患者的临床特征和与5年生存状况进行了分析,了解曲妥珠单抗在真实诊疗环境中对不同个体长期生存的潜在影响。术后辅助曲妥珠单抗治疗的益处在整个队列中体现在无病生存率和总生存率改善,并且这种获益在调整混杂因素前后中是一致的。由于条件限制,国内外尚需更多前瞻性研究来证明HER-2阳性小乳癌患者从抗HER-2靶向治疗中获益。
本研究通过对我中心10年291例HER-2阳性小肿瘤接受或未接受曲妥珠单抗靶向治疗1年两组患者的临床病理特征和3年和5年生存的进行了分析,了解曲妥珠单抗在真实诊疗环境中对不同个体远期生存的潜在影响,结果显示,HER-2阳性T1N0M0期乳腺癌接受术后辅助曲妥珠单抗治疗在整个队列中均提示无病生存率和总生存率的改善,并且这种获益在调整混杂因素前后是一致的,通过我们单中心的真实世界数据为HER-2阳性小肿瘤临床诊疗决策提供证据支持。
本研究为中国西部新疆维吾尔自治区单中心的真实世界数据,部分患者因肿瘤较小、病期较早、临床复发风险较低或卫生经济原因、患者意愿或临床评估后未行靶向治疗,因此采用PSM法,每位接受曲妥珠单抗治疗的患者与未接受曲妥珠单抗治疗的具有相似基线特征的患者匹配,以减少因组间特征差异导致的结果偏倚。我们的真实世界研究也有一定的局限性。首先,考虑到T1期HER-2阳性初发无转移的患者样本量较小,对亚组分析(T1a、T1b期)的能力可能不足,将来需要国内外更多前瞻性临床试验更进一步研究;其次,2016—2019年入组的部分患者随访时间未满5年,其5年生存率可能存在偏差;治疗和对照组随访结束生存者在随后的10年内,无病生存患者在5年内复发概率较低,整个队列中终点事件数量少。接受术后辅助曲妥珠单抗治疗的患者中,部分初始联合化疗,虽做出匹配调整,但不同的化疗方案可能会对结局产生一定影响。此外,曲妥珠单抗在2017年纳入国家医保目录前后,本中心数据显示HER-2阳性早期乳腺癌患者接受术后辅助曲妥珠单抗靶向治疗占比提升显著,提示卫生经济学和药物可及性因素对患者临床决策的结果产生一定的影响,也是临床诊疗中不可忽视的重要考虑因素。
总之,因无法确定差异是否与样本量、治疗本身和选择偏倚有关,针对肿瘤长径<5 mm的HER-2阳性早期乳腺癌患者是否能够从接受抗HER-2靶向治疗中得到远期生存获益还需要更多的国内外临床试验来证实,临床医师也需要结合药物可及性、充分考虑患者的经济条件和获益/风险比,同时也希望有更多的诸如基因检测或可量化的风险评估工具来智能辅助临床医师治疗决策。
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


