陈丽昆教授团队开展的卡瑞利珠单抗联合化疗一线治疗非鳞NSCLC脑转移患者的前瞻性多中心研究成果在线发表于Journal of Thoracic Oncology
2023年2月2日,由中山大学附属肿瘤医院陈丽昆教授团队发起,联合广州医科大学附属第一医院、梅州市人民医院、汕头大学附属肿瘤医院、广东省中医院、广州市红十字会医院和南方医科大学南方医院共同参与的一项多中心、单臂、II期临床研究,卡瑞利珠单抗联合化疗一线治疗EGFR/ALK阴性非鳞NSCLC脑转移患者研究结果正式在线发表于Journal of Thoracic Oncology (IF:20.121)[1],研究结果显示卡瑞利珠单抗联合培美曲塞+卡铂的颅内客观缓解率(intracranial objective response rate,iORR)为51.5%,疾病控制率(iDCR)为87.5%,展示出良好的颅内疗效。中位随访12.5个月,1年iPFS率为41.9%,1年OS率为71.2%,安全性良好,并改善了神经认知功能和生活质量。

肺癌是最容易发生脑转移的实体肿瘤,约占所有脑转移瘤的40%。初诊晚期非小细胞肺癌(NSCLC)中约20%发生脑转移, 25-40%的患者在整个病程某个阶段会出现脑转移,严重影响患者的预后[2]。
对于驱动基因阳性的NSCLC脑转移,针对EGFR和ALK通路的小分子酪氨酸激酶抑制剂(TKIs)对脑转移的控制相较于传统化疗具有明显的优势[3-4]。然而,约占半数的晚期NSCLC无法检出驱动基因,或无相应的靶向治疗,这些患者的内科治疗手段包括传统的化学治疗,以及近年来新发展的抗血管生成治疗及免疫治疗。针对PD-1/PD-L1的免疫监测点抑制剂已广泛用于晚期驱动基因阴性非小细胞肺癌的一线及二线治疗。但由于临床研究入组条件的限制,这些药物对NSCLC脑转移患者颅内肿瘤客观缓解率(iORR)和总体客观缓解率(ORR)的数据多来自于前瞻性研究中小样本量的亚组分析、回顾性研究、或真实世界研究[5-7]。仅有2项前瞻性研究,其中一项是帕博利珠单抗单药用于驱动基因阴性NSCLC脑转移患者,仅PD-L1表达阳性的18例患者iORR为29.7%,PD-L1表达阴性人群iORR为0%[8]。另一项研究是阿替利珠单抗联合化疗治疗驱动基因阴性非鳞NSCLC脑转移人群的iORR为40%[9]。前瞻性研究的证据较为有限,值得进一步探索。
本研究是一项单臂II期多中心临床研究,纳入既往未接受系统治疗,脑部靶病灶未接受放疗的驱动基因阴性、非鳞非小细胞肺癌脑转移患者,探讨卡瑞利珠单抗联合培美曲塞/卡铂一线治疗的有效性和安全性。符合入排标准的患者接受卡瑞利珠单抗200mg q3w+卡铂 AUC 5+培美曲塞500mg/m2 q3w治疗4个周期后,继续卡瑞利珠单抗200mg q3w+培美曲塞500mg/m2 q3w维持治疗,直至疾病进展、不可耐受的毒性或死亡。主要终点为可评估人群(治疗后有至少一次影像学评估)颅内客观缓解率,次要终点包括PFS, OS和安全性,探索性终点包括生活质量和神经认知功能评估,以及PD-L1表达水平与疗效的相关性。

2020年4月至2022年5月,本研究共纳入45例非鳞NSCLC脑转移患者,中位年龄59岁,13例(28.9%)基线有脑转移症状。截至2022年8月30日,中位随访时间12.5个月,13例患者(28.9%)仍在接受治疗。40例可评估人群中,5例 (12.5%) CR,16例 (40.0%) PR,14例 (35.0%) SD,iORR为52.5%,iDCR为87.5%。颅外ORR为47.5%,颅外DCR为90.0%。
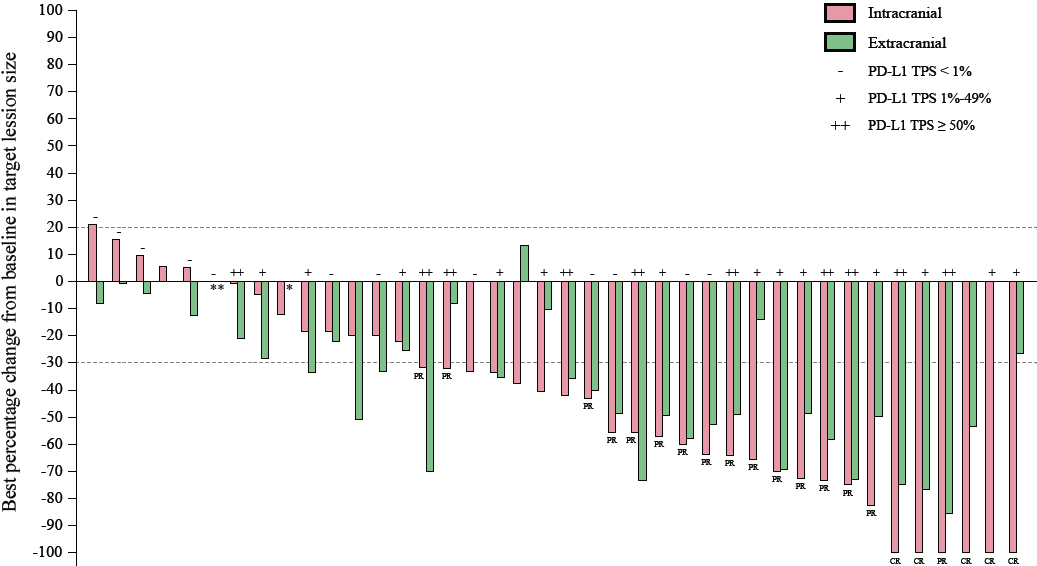
图1. 最佳缓解瀑布图
45例患者中位随访12.5个月, PFS和OS还不成熟,1年iPFS率为41.9%,1年OS率为71.2%。
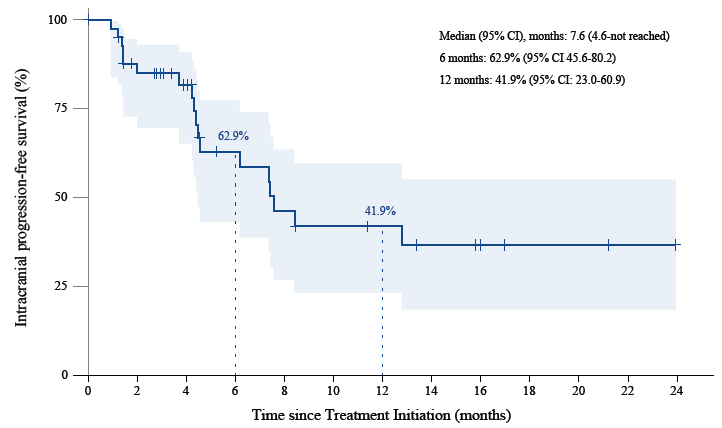
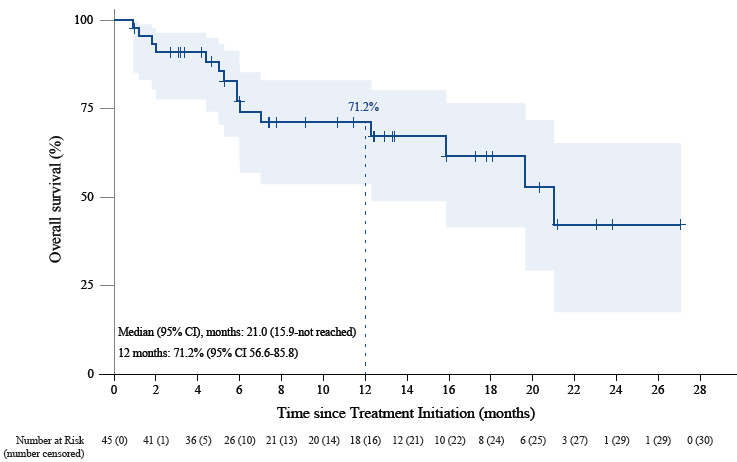
图2. 颅内无进展生存期(上图)、总生存期(下图) Kaplan-Meier分析
事后亚组分析显示,基线有脑转移症状和无脑转移症状患者颅内缓解率相似,分别为50% (6/12)和53.6%(15/28);PD-L1 TPS < 1%, 1-49%, ≥50%患者iORR分别为33.3% (4/12) ,61.5% (8/13)和80.0% (8/10),提示PD-L1表达阴性人群同样可以获益,但高表达人群缓解率更高;PD-L1 TPS ≥ 1%较< 1%的iPFS和OS在数值上更长,但还需要进一步随访。

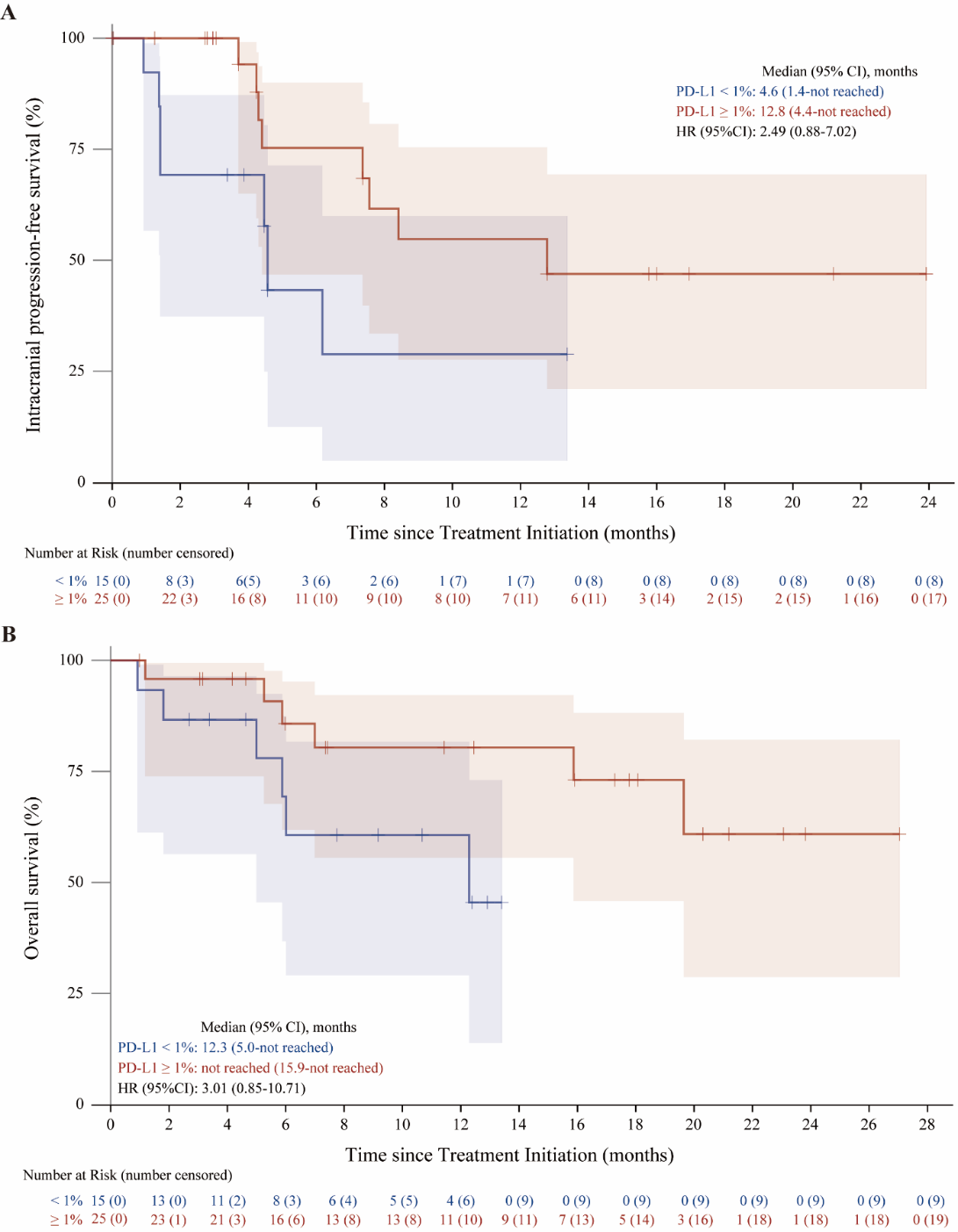
图3. 颅内客观缓解率亚组分析(上图)、不同PD-L1表达水平颅内PFS(中图)和OS亚组分析
41例(91.1%)患者报告治疗相关不良事件(TRAEs),15例(33.3%)报告3级及以上TRAEs,最常见的是中性粒细胞减少(13.3%)、贫血(8.9%)、白细胞减少(6.7%)。29例 (64.4%) 患者报告免疫相关不良事件(irAEs),3级及以上irAEs为4例(8.9%)。最常见的irAEs为毛细血管内皮细胞增生症(57.8%), 均为1-2级。
本研究还通过肺癌患者生存质量测定量表(FACT-L)和简易智能精神状态量表(MMSE)、蒙特利尔认知评估量表(MoCA)对患者生活质量和认知功能进行了评估。线性混合效应模型显示,MoCA评分和FACT-L评分随时间改变呈现具有统计学意义的改善(P=0.025; P<0.001),MMSE评分随时间无明显改善(P=0.567) 。
本研究有以下几个亮点:
1. 首个PD-1抑制剂联合化疗一线治疗非鳞NSCLC脑转移患者的前瞻性多中心研究,显示出该方案良好的颅内抗肿瘤活性和耐受性,以及对生活质量和认知功能在一定程度上的改善。与既往免疫单药用于肺癌脑转移的研究对比,本研究方案在PD-L1阴性人群同样展示出一定疗效。
2. 研究采用modified RECIST1.1标准进行疗效评估,允许5mm以上的最多5个颅内靶病灶进行评估8,10。既往文献报道40%驱动基因阴性初治肺癌脑转移人群颅内病灶小于10mm11,而注册研究并不纳入这部分人群,本研究纳入人群更广泛,更符合肺癌脑转移的临床特征。
3. 既往注册研究要求入组患者无脑转移症状,或症状稳定至少2周以上,或入组前7-14天内停止激素治疗。本研究允许入组基线有脑转移症状的患者,允许入组时继续进行脱水治疗,这部分患者与无症状患者的颅内疗效相似,进一步证实了在这类患者推迟脑放疗的可行性。
总体来说,本研究结果为免疫治疗在脑转移的应用提供了有利证据,为肺癌脑转移的药物治疗再添利器。
1. Hou X, Zhou CZ, Wu GW, et al. Efficacy, Safety, and Health-Related Quality of Life with Camrelizumab Plus Pemetrexed and Carboplatin as First-Line treatment for Advanced Non-Squamous Non-Small-Cell Lung Cancer with Brain Metastases (CAP-BRAIN): A Multicentre, Open-Label, Single-Arm, Phase 2 Study. Journal of Thoracic Oncology, DOI: https://doi.org/10.1016/j.jtho.2023.01.083
2. Klos KJ, O’Neill BP. Brain Metastases. Neurologist 2004;10:31-46.
3. Vansteenkiste J, Reungwetwattana T, Nakagawa K, et al. CNS response to osimertinib vs standard of care (SoC) EGFR-TKI as first-line therapy in patients (pts) with EGFR-TKI sensitising mutation (EGFRm)-positive advanced non-small cell lung cancer (NSCLC): data from the FLAURA study. Ann Oncol 2017;28(suppl 10): LBA5.
4. 梁晓华,黄若凡,詹琼. 驱动基因阳性非小细胞肺癌脑转移诊治上海专家共识(2019年版). 《中国癌症杂志》2019年第29卷:71-80.
5. Rittmeyer A, Barlesi F, Waterkamp D, et al. Atezolizumab versus docetaxel in patients with previously treated non-small-cell lung cancer (OAK): a phase 3, open-label, multicentre randomised controlled trial. Lancet 2017;21:255-265.
6. Goldman JW, Crino L, Vokeset EE, et al. Nivolumab in patients with advanced NSCLC and central nervous system metastases. J Clin Oncol 2016; 34 (suppl): abstract 9038.
7. Gadgeel S, Rodr´ıguez-Abreu D, Speranza G, et al. Updated Analysis From KEYNOTE-189: Pembrolizumab or Placebo Plus Pemetrexed and Platinum for Previously Untreated Metastatic Nonsquamous Non–Small-Cell Lung Cancer. J Clin Oncol 2020;38:1505-1517.
8. Goldberg SB, Schalper KA, Gettinger SN, et al. Pembrolizumab for patients with melanoma or non-small-cell lung cancer and untreated brain metastases: early analysis of a non-randomised, open-label, phase 2 trial. Lancet Oncol 2016;17: 976-983.
9. Nadal E, Rodriguez-Abreu D, Massuti B, et al. Updated analysis from the ATEZO-BRAIN trial: Atezolizumab plus carboplatin and pemetrexed in patients with advanced nonsquamous non–small cell lung cancer with untreated brain metastases. Journal of Clinical Oncology 2022;40: abstract 9010.
10. Long GV, Trefzer U, Davies MA, et al. Dabrafenib in patients with Val600Glu or Val600Lys BRAF-mutant melanoma metastatic to the brain (BREAK-MB): a multicentre, open-label, phase 2 trial. Lancet Oncol 2012;13:1087-1095.
11. Yoshida H, Kim YH, Iwatsubo S, et al. Management and Outcomes of Newly Diagnosed Non-Small Cell Lung Cancer Patients with Brain Metastases: A Real-World Study in Japan. Oncology 2020;98:460-467.

通讯作者:陈丽昆,中山大学肿瘤防治中心肿瘤内科
主任医师,教授,博士生导师。广东省胸部肿瘤防治研究会脑转移专业委员会主任委员 、中国抗癌协会神经肿瘤专业委员会脑转移瘤学组副组长、中国医药教育协会肿瘤转移专委会副主任委员、广东省医师协会肿瘤内科医师分会副主任委员、广东省女子医师协会肺癌专业委员会副主任委员、广东省抗癌协会靶向治疗专业委员会常委、CSWOG肺癌专业委员会常委、广东省临床医学学会精准医疗专业委员会常委、广东省转化医学学会肿瘤学分会常委、中国抗癌协会抗癌药物专业委员会委员、广东省健康管理学会肿瘤学专业委员会委员、广东省医学会肿瘤学专业委员会委员 、荣获2008赛克勒中国医师年度奖、2019广州实力中青年医生及2021羊城好医生。

第一作者:侯雪,中山大学肿瘤防治中心内科 副主任医师,硕士研究生导师,肿瘤学博士。中山大学肿瘤防治中心优秀青年人才计划” 获得者、广东省胸部肿瘤防治研究会脑转移专业委员会副主任委员兼秘书长 、广东省抗癌协会化疗专业委员会青委会常委、广东省女医师协会肺癌专业委员会常委、广东省临床医学学会精准医疗专业委员会委员、中国南方肿瘤临床研究协会(CSWOG)肺癌专业委员会委员。

第一作者:周承志,主任医师,博士生导师,广州医科大学附属第一医院国家呼吸医学中心临床诊疗部部长,广州呼吸健康研究院呼吸与危重症学科常务副主任,肿瘤内科中心一区主任。中华医学会呼吸分会肺癌学组副组长、中国医师协会呼吸分会肺癌工作组委员、中国呼吸肿瘤协作组(CROC)秘书长兼青委副主委、中国肺癌早诊早治能力提升工程专家委员会副主席、CSCO青委、患教委员会及老年肿瘤防治专委会委员、广东省胸部肿瘤疾病学会肿瘤危重症专委会主任委员。











 苏公网安备32059002004080号
苏公网安备32059002004080号


