
2018年始,中国胸部肿瘤研究协作组(CTONG)和美国顶尖癌症医院—纪念斯隆凯特琳癌症中心(MSK)联合举办每年一度的学术研讨会,旨在加强中美两国在肿瘤领域的交流和临床研究合作,促进新型抗肿瘤药物的研发和临床试验,从而更好地惠及中美及全世界的肿瘤患者。
2022年12月3日上午,从广州到纽约,中美知名肿瘤专家在云端再度相聚MSK-CTONG年度研讨会,共同探讨肿瘤精准治疗的研究进展。研讨会由5个篇章组成,涉及液体活检、靶向治疗、生物标志物研发、患者为中心临床试验和I期临床试验的内容,超过两万人在线观看了会议。
Chapter 1 液体活检用于MRD评估及其意义
本次研讨会的第一篇章由美国MSK肿瘤内科专家Bob Li教授主持。近年来,液体活检的研究进展为基于精准医学的肿瘤治疗开辟了新思路。MSK生物标志物研发项目液体活检和基因组学主任Pedram Razavi医生在演讲中指出,众所周知,辅助和新辅助治疗改善了癌症患者的临床转归,“治愈”机会被增加的前提是隐匿的微小残留病灶(MRD)相比影像学上看到的转移病灶更容易被系统治疗根除。

借助液体活检技术动态监测ctDNA以发现MRD,可以在传统风险分层(基于临床、影像学、病理学和基因组学等特点)基础上提供额外有价值的信息。无论是对于原发耐药、早期复发、晚期复发患者,都为更早发现并迅速“拦截”MRD提供了时间窗,为改善肿瘤患者的转归提供了重要机会。
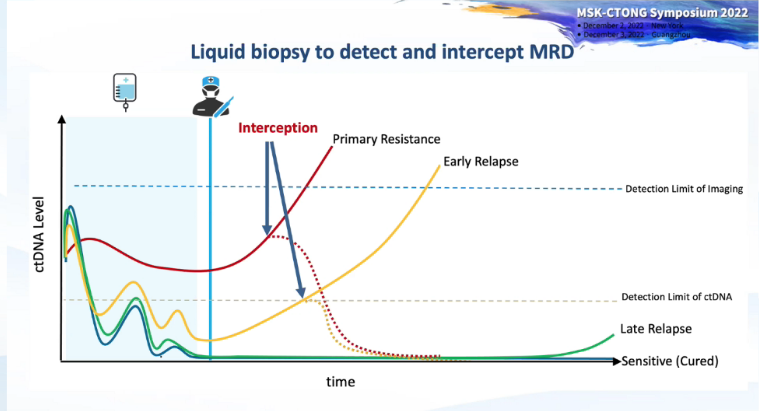
图:通过液体活检技术检测和“拦截”MRD
在一些癌种中已经开展了应用液体活检MRD指导治疗的临床试验。例如c-TRAK TN研究旨在观察MRD指导下PD-1抑制剂帕博利珠单抗治疗三阴性乳腺癌[1]。一些临床试验则观察了能否将ctDNA清除(mCR)作为具有重要临床意义的替代终点。
在检测技术层面,液体活检检测MRD的灵敏度在不断提高。例如针对III期肺腺癌患者等癌种的研究发现,阶段性变异富集及检测测序(PhaseED-Seq)新技术检测ctDNA的灵敏度高达0.00001%(即百万分之一)[2]。该技术有助于改进治疗期间和复发前的MRD检测,有望给实体瘤治疗带来革命性的变化。此外,液体活检可以用于监测恶性肿瘤的克隆演化。
在讨论环节,美国MSK实体瘤肿瘤科负责人Luis Diaz医生谈到他看好液体活检MRD用于指导实体瘤治疗的发展前景。或许在不久的将来,液体活检检测MRD会成为病理学分期的指标之一,另外可能有助于在肿瘤负荷很小的时候就发现复发,并作为生物标志物指导下一步治疗,改善患者预后。

Chapter 2 eXalt 3研究首次公布ALK阳性NSCLC亚洲人群的疗效
本次研讨会的第二篇章由中国胸部肿瘤研究协作组(CTONG)主席、广东省人民医院吴一龙教授主持。

恩沙替尼是口服、第二代、高选择性ALK-TKI,是第一个用于治疗ALK阳性非小细胞肺癌(NSCLC)的国产1类新药。2021年,恩沙替尼一线治疗ALK阳性的局部晚期或转移性NSCLC患者的国际性、多中心、开放式标签、3期、随机研究——eXalt 3研究的总体人群结果发表于JAMA oncology杂志[3]。
在本次会议上,广东省人民医院肿瘤医院周清教授首次公布了eXalt 3研究的亚洲患者数据,意向性治疗(ITT)人群共161例患者,90%以上来自中国。中位随访35.6个月,恩沙替尼225 mg QD组IRC评价的中位PFS达到41.5个月,显著优于克唑替尼250 mg BID组(11.2个月),中位PFS延长30.3个月,比总体人群(延长了13.1个月)获益更多,遗传背景不同可能是PFS获益不同的原因之一,具体还有待进一步研究。

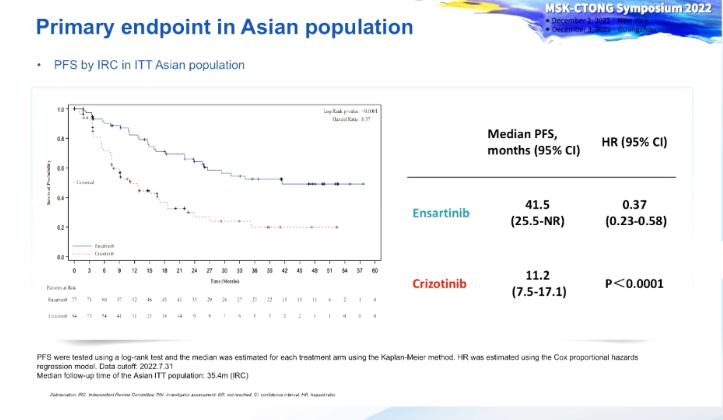
图:eXalt 3研究亚洲人群的主要终点PFS
此外,恩沙替尼相比克唑替尼使得基线有和无脑转移的患者中位PFS分别延长16.4个月(IRC评价,23.9 [9.2~41.5] vs 7.5 [5.5-9.3],P=0.0155)和32.2个月(INV评价,47.1 [29.4-NR] vs 14.9 [7.9-20.2],P=0.0002)。恩沙替尼的ORR率(80.82% vs 67.95%)、CR率(15.1% vs 3.8%)也高于克唑替尼。
安全性方面,恩沙替尼用于亚洲患者的安全性良好,未发现新的安全性问题,与总体人群数据一致。该研究结果支持恩沙替尼用于亚洲ALK阳性NSCLC患者的一线治疗。
在讨论环节,广东省中医院肿瘤内科张海波教授指出,目前在临床上选择哪种TKI主要基于患者的临床特征、有无脑转移、基因检测结果等因素做出判断。eXalt 3亚洲患者数据显示恩沙替尼治疗的中位PFS超过3年,令人印象深刻。

Chapter 3 国际生物标志物技术研发
本次研讨会的第三篇章由美国MSK生物标志物研发项目负责人Howard Scher教授主持。生物标志物的发现是一段漫长的旅程,从生物机制或临床发现、分析验证、临床验证、临床应用到临床实施,需要多学科协作和国际合作。
美国MSK癌症中心实验病理学主任Jorge Reis-Filho医生在演讲中指出,美国MSK生物标志物研发项目通过国际多学科专家合作,聚焦于临床疾病管理中未被满足的诊疗决策的需求。旨在加速生物标志物分析研发和监管审批,以促进精准诊断和治疗决策,改善全球患者的治疗转归。他强调了人工智能(AI)在生物标志物研发中的应用日益广泛、具有重要地位。

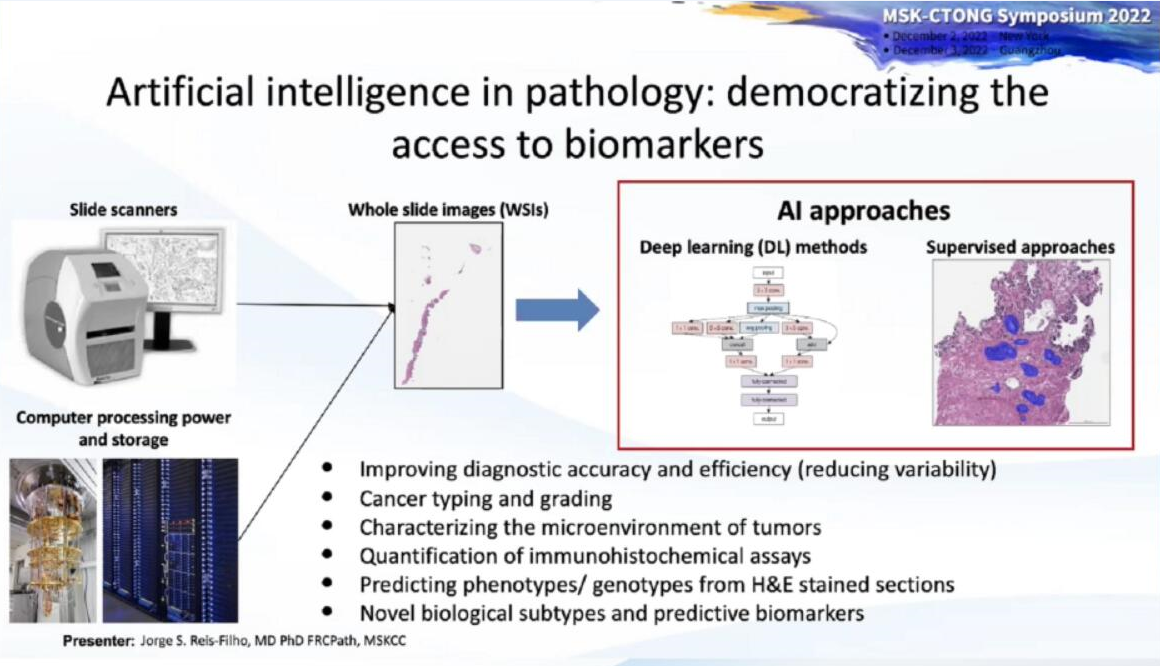
图:人工智能(AI)用于病理学:促进生物标志物的研发
在讨论环节,南方医科大学南方医院申鹏教授指出生物标志物应当简便易用,才能惠及更多的肿瘤患者。广东省人民医院医学研究部主任张绪超教授强调了多学科协作和人工智能对于生物标志物发现的重要意义。美国MSK外科学系Valerie Rusch教授认为在生物标志物的发现历程中,全球视角和全球协作不可或缺。

Chapter 4 以患者为中心临床试验的设计和实施
本次研讨会的第四篇章由广东省人民医院肺外科钟文昭教授主持。精准肿瘤学的药物研发已经开启了以患者为中心的临床试验(PCT)时代[4]。暨南大学附属第一医院博士后、CTONG临床试验医学官刘思阳博士在演讲中谈到,PCT的核心理念是在临床试验的各个阶段将患者需求放在首位。RCT过度限制的入选和排除标准使得很多患者被临床试验拒之门外,也导致了药物研发的步伐缓慢。

2020年美国FDA发布了“提高临床试验人群的多样性——资格标准、招募实践和试验设计指导意见”,提出应扩大临床试验的入选标准和避免不必要地将一些受试者排除在外[5]。以便使受试者能够更好地代表试验疗法获批后最有可能使用该药的人群,更容易发现重要的安全性和疗效信息,以提高对试验疗法效益-风险的理解。该建议同样适用于治疗罕见疾病或其他罕见情况的药物临床试验。
CTONG 1702研究设计即是基于PCT理念,是针对基因变异全覆盖的靶向/免疫药物治疗中国晚期NSCLC患者的开放、多中心、伞式、II期临床研究。相比RCT采取更为宽松的招募标准(All comers recruitment),提高了临床试验人群的多样性,更加贴近临床实践。
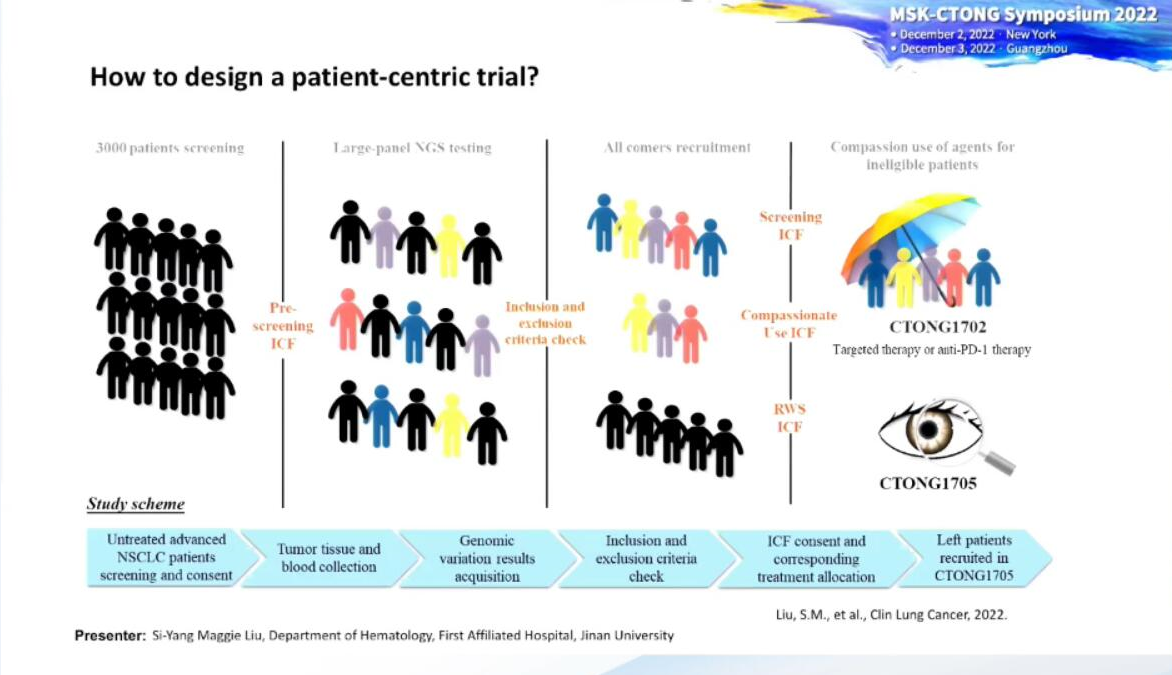
在讨论环节,广州医科大学附属第一医院胸部肿瘤科梁文华教授指出PCT兼具RCT和真实世界研究的特点,扩大入选标准,避免不必要的入选限制,使得观察结果更加贴近真实世界的临床实践。

Chapter 5 药物研发的I期临床试验
本次研讨会的第五篇章由美国MSK早期药物研发服务的临床药理学专家Dazhi Liu医生主持。美国MSK肿瘤内科专家Bob Li教授从执行层面谈到了肿瘤药物研发的I期临床试验。

他指出MSK的早期药物研发团队由110名多学科专家组成,致力于靶向治疗和免疫治疗的早期研发。在过去4年里已经有9个药物在全球40个国家获批适应证或授权应用。对于肿瘤的早期药物研发,研究不同癌肿、不同通路的学者之间进行对话交流,相互启发,相互借鉴不可或缺,是实现药物研发成功的关键因素。在未来我们想在药物研发上走的更远,只有通过国际合作才能实现。此外,研发者和监管者的合作对于推进肿瘤药物研发至关重要。
主席总结
Bob Li教授
感谢本次会议的全体讲者贡献了非常精彩的演讲。MSK和CTONG的成员本着严谨精神为本次会议贡献颇多,促成了此次全球肿瘤领域的顶尖专家的聚会。创新和合作是本次会议的两大主题,希望未来中国、美国和全球的专家们继续努力,携手战胜癌症。
吴一龙教授
今天的会议内容丰富,卓有成效,来自全球的肿瘤领域关键意见领袖汇聚在一起,探讨了肿瘤液体活检、生物标志物研发、靶向治疗和临床试验(包括PCT和I期临床试验)的最新学术进展。未来希望我们携手努力,让惠及广大肿瘤患者的愿景成为现实。
参考文献
1.Turner NC,et al. Ann Oncol. 2022 Nov 21:S0923-7534(22)04735-4
2.Kurtz DM, et al. Nat Biotechnol. 2021 Dec;39(12):1537-1547
3.J Horn,et al. JAMA Oncol. 2021 Nov 1;7(11):1617-1625
4.Li BT,et al. et al. Nat Med. 2022 Apr;28(4):620-626)
5.FDA. Enhancing the Diversity of Clinical Trial Populations — Eligibility Criteria, Enrollment Practices, and Trial Designs Guidance for Industry. FDA website. Published November 2020. Accessed November 10, 2020. https://www.fda.gov/media/127712/download
排版编辑:肿瘤资讯-HYC











 苏公网安备32059002004080号
苏公网安备32059002004080号


