随着CT筛查的普及,我们发现了越来越多的早期肺癌。
对这部分患者而言,积极的手术治疗往往是最好的选择。
但是,手术以后效果如何呢?
尽管原位腺癌(AIS)、微小浸润性腺癌(MIA)都已经证明可以通过手术实现根治效果,而永不复发。
但绝大多数的浸润性肺腺癌却做不到。
比如,有学者分析了四川华西医院接受手术切除的1387例I期肺癌患者的生存结局。
发现在5年的随访过程中,有将近20.2%的患者会出现复发。
从手术到复发的平均间隔是25.5月。
即,就算早期,也不能治愈。
有什么办法可以预测疗效
那有没有好办法可以知道自己的治疗效果如何呢?
目前,常用的方法,是基于CT的影像学表现。
比如,郑医生之前的一个帖子就跟大家分享过,早期肺癌,只要影像学上有毛玻璃,5年总生存率都高于90%。
即早期肺癌,只要有毛,就不要担心。
但,影像学表现再厉害,也是外在的。
而真正决定一个肿瘤的内在生物学行为,是病理。
简单来说,纯毛玻璃肺癌之所以效果很好,因为这里面几乎都是原位腺癌和微小浸润性腺癌。
纯毛玻璃是表象,而原位腺癌/微小浸润性腺癌是本质。
那既然病理如此重要,为什么我们不能更好地挖掘一下呢?
毕竟,它才是内核,才是本质。
肺腺癌的病理分型
2011年,IASLC/ATS/ERS基于肺腺癌的生物学特点,提出了五大生长模式:
贴壁生长型、腺泡型、乳头型、微乳头状以及实性生长型。
并基于各自的侵袭特点进行了划分。
低度侵袭性是贴壁生长型;
中度侵袭性是腺泡型、乳头状生长型;
高度侵袭性是微乳头状以及实性生长型。
除此之外,复杂腺样生长型(比如粘液腺癌)也属于高度侵袭性。
这是一个伟大的发明,标志着肺癌的病理划分进入了彻底的微观时代。
用人类社会做比喻。
在这个分类没出来之前,我们只有男人和女人。
在这个分类出来以后,我们有了绿茶女、凤凰男、文艺范、留守儿童、空巢老人等一系列标签,社会一下子层次分明起来。
到底哪个更重要?
但是,实际情况下,每个病人的标本中,往往混杂有多种生长模式。
比如下面这个报告,就是贴壁型30%、腺泡型40%、乳头型30%、微乳头5%。

那,效果到底如何呢?
既然低度侵袭性的生长模式可能疗效更好,
而高度侵袭性的生长模式可能疗效更差。
那到底谁的影响力更大呢?
2020年,一个发表在肺癌殿堂级杂志<Journal of Thoracic Oncology>上的研究给出了答案。
在这个研究中,作者从多个中心搜集到796名I期浸润性肺腺癌患者。
作者基于他们的病理报告,采取了两种截然不同的划分标准,对整组人群进行了划分,并比较不同划分标准的合理性。
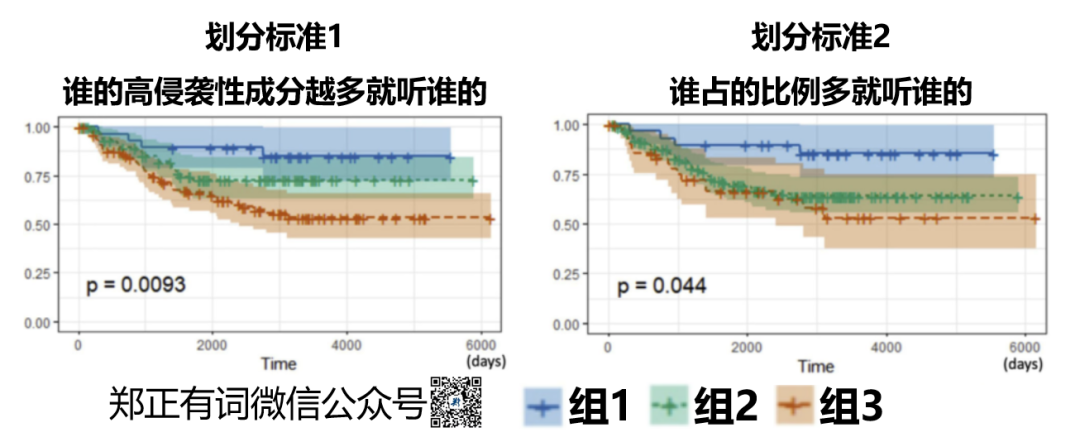
划分标准1——谁的高侵袭性成分越多就听谁的。
基于这个标准,整体人群被划分为3个大组:
组1:以贴壁生长为主,而微乳头/实性/复杂腺体生长成分不足20%;
组2:以乳头、腺泡生长为主,而微乳头/实性/复杂腺体生长成分不足20%;
组3:微乳头/实性/复杂腺体生长成分超过20%。
划分标准2——谁占的比例多就听谁的。
基于这个标准,整体人群被划分为3个大组:
组1:以贴壁生长为主型;
组2:以乳头、腺泡生长为主型;
组3:以微乳头/实性/复杂腺体生长为主型。
结果发现,标准1实现了更好的预后风险分层。
即,影响肺腺癌生物学行为的最重要因素,是高度侵袭性腺癌成分的比例。
肺癌的生物学行为,也遵循短板效应。
即真正对一个肺癌起决定作用的,不是它的低度侵袭性成分占多少,而是高度侵袭性成分有多少比例。
还能更精细些吗?
顺着这个思路,自然而然就有人会提出这个问题。
那是不是高侵袭性成分越多,效果就越差呢?
2022年,发表在<Annals of Surgical Oncology>上的一个研究回答了这个问题。
在这个研究中,作者回顾性纳入1049例接收手术的病理I期浸润性肺腺癌患者。
通过筛选得到191名纳入研究。
筛选标准即,这个患者的肺癌病理成分中,必须有至少1%的高度侵袭性成分。
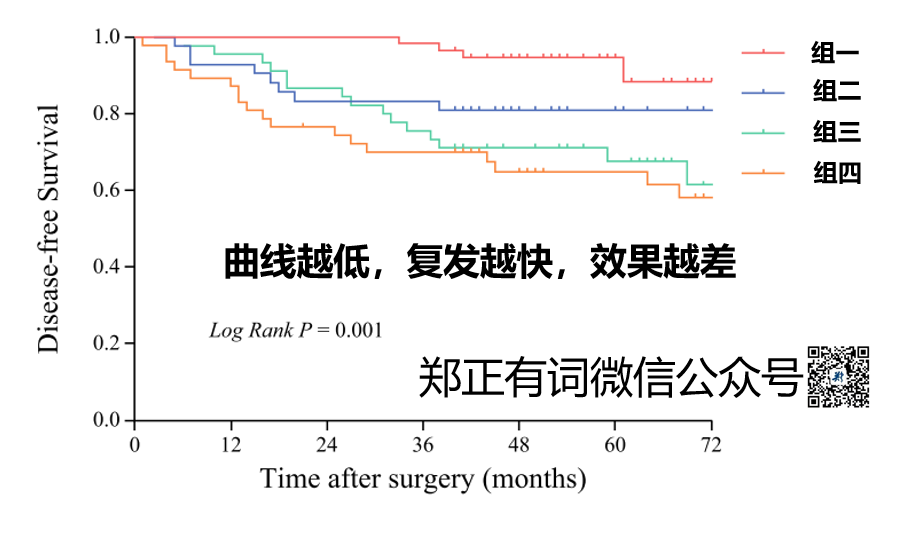
在后续的研究中,作者基于其高侵袭性成分的比例将全组人群划分为4组:
组1:高侵袭性成分≤30%
组2:高侵袭性成分31-55%
组3:高侵袭性成分56%-85%
组4:高侵袭性成分≥86%
果然,高侵袭性成分越高的患者,复发越快。
可以通过病理报告,算生存率吗?
现在,就要进入这篇文章的正题了。
既然,我们已经知道肺腺癌的病理生长模式的预后影响,那能不能通过病理报告,预测出远期的生存效果呢?
答案是,可以的。
相关研究来自国内巨头天津肿瘤医院的王长利教授团队,并于2022年3月发表在<Journal of Surgical Oncology>期刊上。
在这个研究中,作者回顾性纳入595名I期浸润性肺腺癌的临床信息。
基于病理报告结果,计算得到微乳头及实性生长腺癌总比例(TPSM)。
TPSM=微乳头生长百分比+实性生长百分比
将TPSM划分为3组:
TPSM低表达组(TPSM-L),即TPSM<10%;
TPSM中表达组(TPSM-M),即TPSM≥10且<40%;
TPSM高表达组(TPSM-H),即TPSM≥40%。
不出所料,TPSM分层能很好地实现对复发/死亡风险的预测。
在经过一系列统计分析,最终得到可以有效预测疗效的nomogram预测模型。
nomogram模型,简单来说,就是预后模型的可视化。
即通过这个模型,可以提取到每个预后变量的预后权重得分。
那么,通过计算某个个体的全部预后变量的总分数,就可以对应出其相应的3年、5年肿瘤的肿瘤控制率和总生存率。
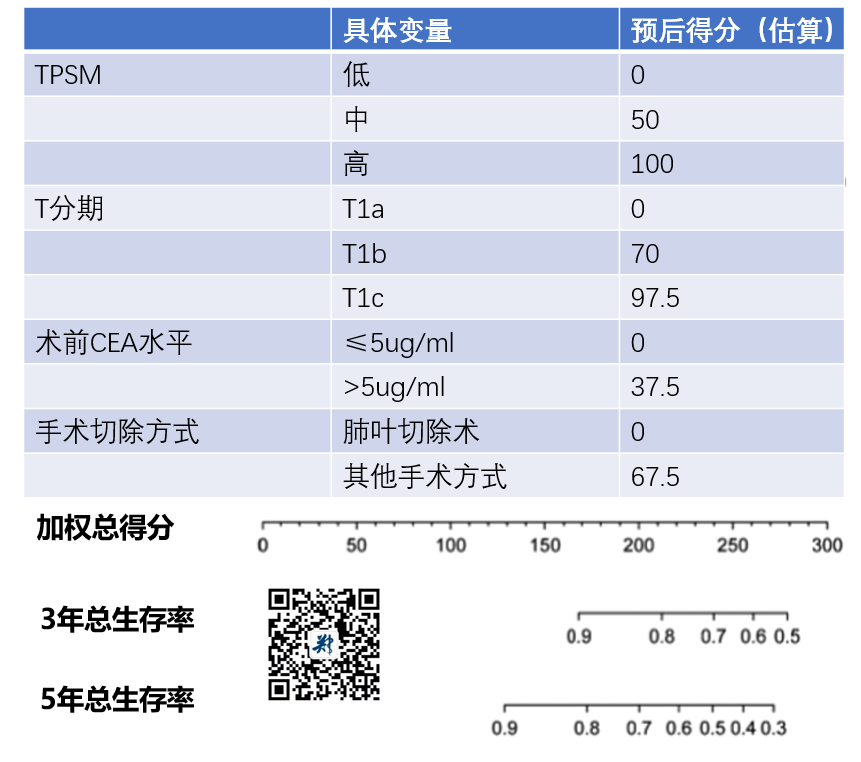
最终,在总生存预测方面,得到以下结果:
如何解读呢?
第一步:就是把自己的临床变量挨个对上去,得到一个加权分;
第二步:把每个加权分相加得到一个总分;
第三步:对应这个总分去下面匹配对应的3年和5年生存率。
举个例子:
患者A,TPSM-L、肺腺癌T分期T1b、术前CEA水平8ug/ml、最终接受了肺叶切除术。
那么它的加权分就分别是0分、70分、37.5分和0分,最终总分107.5分。
对应下面的3年和5年生存率,均大于90%。
在无复发率预测方面,得到以下结果:
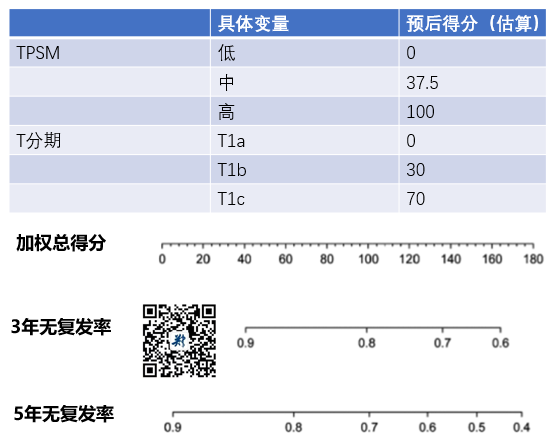
值得注意的是,这个测模型的c-index指数,在总生存率是0.76,而在无复发率方面则是0.67。
目前的研究数据中,一个模型一旦c-index突破0.8,是该模型准确可靠的重要标志。
因此,天津肿瘤医院这个研究中,所得到的总生存率的预测相对可靠,而无复发率方面的预测,则可能存在一定的偏倚。
但是,有总好过没有吧。
写在最后

临床上常常遇到一个现象。
相同分期的早期肺腺癌患者,手术效果却大相径庭。
这里面,可能就是病理亚型在起作用。
比如,同样的I期的微乳头为主型的腺癌和贴壁生长为主型的腺癌,侵袭性不同,自然效果不一样。
可能有人会说,郑医生,你今天只说了病理亚型,可是关于淋巴血管浸润、以及最新的气腔播散(STAS)却压根没有提。
你的结论可能不准确哦,因为这些因素都可能对预后有影响。
没错,你说得对。
但是,这些因素的背后,依然是病理亚型。
比如,前面2020年<Journal of Thoracic Oncology>的研究就发现,气腔播散作为一个重要的预后因素,只见于那些含有高侵袭性成分(微乳头/实性/复杂腺体生长)的肺腺癌患者中;
即没有高侵袭成分的肺腺癌,压根就不会出现气腔播散。
而在2022年<Annals of Surgical Oncology>的研究则发现,淋巴血管侵犯(LVI)在高侵袭成分越高的腺癌患者中越多见;
而当淋巴血管侵犯和病理侵袭成分共同纳入分析后,淋巴血管侵犯则立刻失去临床意义。
狐假虎威:谁是狐狸,谁是老虎,一目了然。
我们现在常常说毛玻璃肺癌的预后如何如何。
但在我看来,所谓的CT表现,都是构建在病理亚型的基础上。
在随访阶段,我们可以说,这个结节有毛玻璃成分,危害性不大。
但是在手术以后,在取得了具体的病理报告以后,则更应该深入挖掘病理报告的预后信息。
毕竟,肺癌发展这么多年,早已进入了微观世界。
用放大镜就可以看的CT图像,自然比不过用显微镜才能出具的病理报告。
早期肺腺癌术后患者,想了解具体远期疗效如何?
很简单呀,拿出病理报告,好好比对一下前文的图表,就知道了。
万事不求人,多好。
参考文献:
1. Clinicopathological variables influencing overall survival, recurrence and post-recurrence survival in resected stage I non-small-cell lung cancer. BMC Cancer.020 Feb 24;20(1):150.
2. A Grading System for Invasive Pulmonary Adenocarcinoma: A Proposal From the International Association for the Study of Lung Cancer Pathology Committee. Thorac Oncol. 2020 Oct;15(10):1599-1610.
3. Percentage of Newly Proposed High-Grade Patterns Is Associated with Prognosis of Pathological T1-2N0M0 Lung Adenocarcinoma. Ann Surg Oncol. 2022 Feb 24.
4. A prognostic nomogram based on a new classification of combined micropapillary and solid components for stage IA invasive lung adenocarcinoma. J Surg Oncol. 2022 Mar;125(4):796-808.
(下滑查看更多)











 苏公网安备32059002004080号
苏公网安备32059002004080号


