
【摘要】
近年来,随着对乳腺癌筛查的重视与规范化诊疗技术的提升,中国乳腺癌患者治愈率显著提高,患者生存时间显著延长。伴随乳腺癌患者随诊随访期的延长,患者面临的肿瘤及相关其他健康问题也逐渐增加,需要制定更为精准而长远的随诊随访计划,关注更广泛的健康风险。抗肿瘤治疗、年龄、激素水平变化等因素导致的乳腺癌患者心血管、骨健康、心理健康等问题,已成为乳腺癌患者管理的新难题,其不仅影响患者的生活质量,甚至转化为疾病复发和死亡风险。因此,除了落实规范化治疗外,患者科学规范的随诊随访、伴随疾病的全方位管理、跨学科协作、全面康复也是乳腺癌治疗的关键环节,这对于提高患者的治疗效果,提升患者健康水平和生活质量均有重大意义。基于当前中国乳腺癌患者的治疗及随诊随访现状,根据文献及指南,结合跨学科专家诊疗建议,在2019版《乳腺癌随访及伴随疾病全方位管理指南》基础上进行更新,修订2022版《中国乳腺癌随诊随访与健康管理指南》,包括随诊随访路径图、随诊随访管理、全方位健康管理以及患者报告结局四大部分,旨在规范乳腺癌患者的长期随诊随访,指导临床医师积极开展乳腺癌患者全方位跨学科健康管理,从而进一步提高中国乳腺癌患者预后与生活质量。
【关键词】乳腺肿瘤;随诊随访;健康管理;指南识
近年来,在社会老龄化、环境污染等综合因素影响下,恶性肿瘤发病率和死亡率快速增加,已经成为全球主要的疾病死亡因素和公共健康问题。根据世界卫生组织国际癌症研究机构发布的2020年全球最新恶性肿瘤负担数据显示,乳腺癌全球新发病例高达226万例,已取代肺癌成为全球最常见的恶性肿瘤,其死亡人数亦居全球女性恶性肿瘤死亡人数首位。同期,中国乳腺癌新发病例数为42万例,为中国女性恶性肿瘤新发病例数之首,占整体女性恶性肿瘤的19.9%。随着精准治疗的不断进步及新药研发,乳腺癌患者的5年生存率显著提高。国家癌症中心数据显示,2015年中国乳腺癌患者的5年生存率超过83%,部分地区甚至更高,与发达国家诊疗水平相当。
2006年,国际卫生组织将恶性肿瘤列入慢性疾病管理。2015年,中国在“健康中国2030”规划纲要中,也将恶性肿瘤列入慢性疾病管理范畴。乳腺癌作为发病率与治愈率均较高、生存时间较长的恶性肿瘤,是肿瘤慢病管理的典范。研究统计表明,在早期乳腺癌患者中,随着年龄的增长,非肿瘤因素所致死亡占比逐渐增高,部分人群的非肿瘤因素所致死亡占比甚至超越乳腺癌本身所致的死亡风险,其中,心血管疾病已成为乳腺癌人群最常见的非肿瘤死亡因素,尤其是接受化疗、内分泌治疗或绝经后的乳腺癌患者,雌激素水平大幅下降,导致血脂异常和心血管死亡风险显著增加。此外,雌激素水平的降低还可能导致骨密度(bone mineral density, BMD)下降。乳腺癌患者随诊随访过程中常伴随骨代谢异常、骨质疏松,显著增加患者承重骨骨折风险。发生髋骨骨折后1年之内,20%的患者会死于各种并发症,约50%的患者致残、生活质量明显下降。有研究显示,高达50%的乳腺癌患者未能坚持完整的规范内分泌治疗,从而导致疾病复发风险增加。在乳腺癌患者随诊随访过程中,除密切监测复发转移外,更应重视乳腺癌各阶段治疗带来的不良反应及伴随疾病,理应强调患者全生命周期的全方位健康管理。
为进一步改善早期乳腺癌患者的预后,提高患者生存及生活质量,除了落实规范化治疗外,科学规范的患者随诊随访、伴随疾病的全方位管理、跨学科协作、全面康复也是乳腺癌治疗的关键环节。因此,中国乳腺癌诊疗领域专家再次携手众多心血管、内分泌、精神健康等跨学科专家,结合国内外最新循证医学证据,更新制定2022版《中国乳腺癌随诊随访与健康管理指南》,以期更细化、具体地落实临床实践,帮助临床医师更好地管理患者。
一、乳腺癌随诊随访路径图
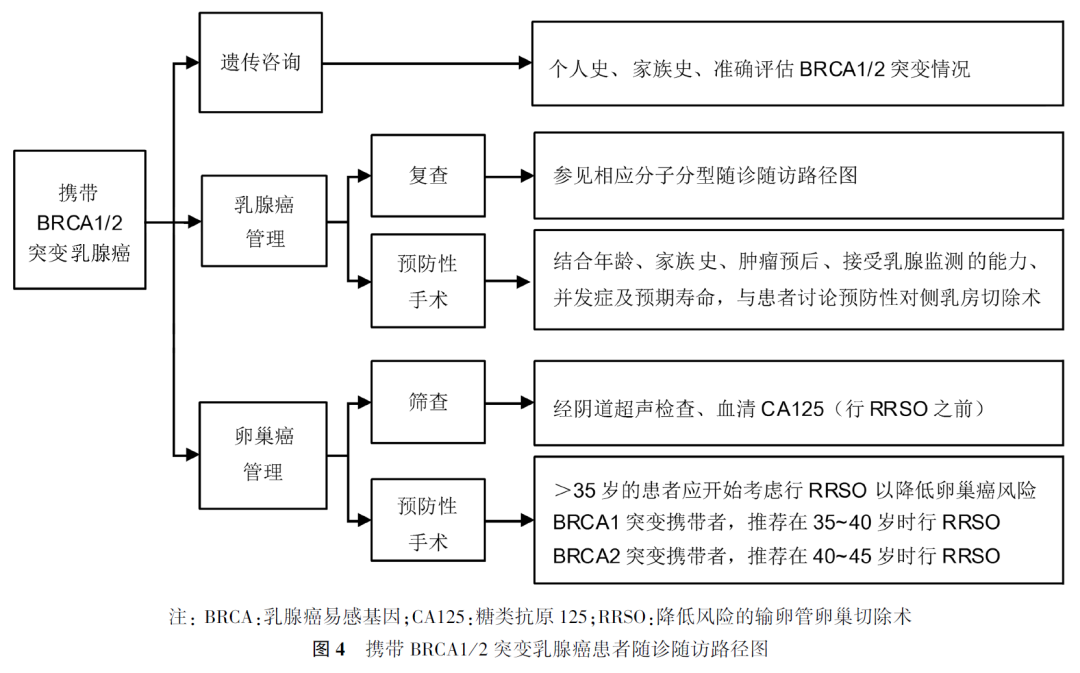
对于早期乳腺癌患者,长期随诊随访有助于早期发现疾病的复发与转移、第二原发肿瘤、治疗相关的并发症和相关伴随疾病,并给予规范的指导以促进患者康复。本指南以路径图的形式分别阐述了不同分子分型乳腺癌患者的主要随诊随访项目(包括乳腺癌疾病随诊随访、伴随疾病随诊随访及不良反应随诊随访)及不同随诊随访结果的处理原则,以及携带乳腺癌易感基因1/2突变患者的随诊随访要点(图1~4),从而协助临床医师明确掌握不同类型乳腺癌患者的长期随诊随访管理,以进一步降低乳腺癌患者疾病复发风险,减少伴随疾病对患者生存和生活质量的影响,及时发现药物相关不良反应并进行管理。
对于有转移或复发表现的晚期乳腺癌患者,在完善分期检查的同时,应将肿瘤转移灶或复发灶的活检作为病情评估的一部分,明确转移或复发的诊断,并再次评估乳腺癌分子分型,以制定针对性的治疗方案。晚期乳腺癌治疗过程中,应同时结合患者的症状、体征、影像学检查、实验室检查评估抗肿瘤治疗效果,不推荐将单纯的肿瘤标志物升高作为更改治疗方案的依据。推荐内分泌治疗的患者每2~3个月评估疗效,化疗的患者每2~3个周期评估疗效。临床医师可以综合考虑疾病进展速度、转移部位等因素,适当缩短或延长评估疗效的时间间隔。
男性乳腺癌是一种少见疾病,目前有关男性乳腺癌的相关数据大多来自回顾性病例分析,缺乏高级别证据。总体而言,男性乳腺癌的随诊随访原则可参照女性乳腺癌,但是,乳腺X线检查在男性中的价值仍有待商榷。



二、乳腺癌随诊随访管理
1. 基本随诊随访项目的复查指标和复发处理:目前尚无大型随机研究以支持可平衡患者需求和成本效益的随诊随访方案,临床多依据实际经验制定随诊随访频率。国家卫生健康委员会《乳腺癌诊疗规范(2021版)》建议的随诊随访内容和频率如下,供临床结合患者实际情况个体化选择。临床体检:最初2年每3~6个月1次,其后3年每6个月1次,5年后每年1次;乳腺超声:每6个月1次;乳腺X线:每年1次;胸片或胸部CT:每年1次;腹部超声:每6个月1次,3年后改为每年1次;存在腋窝淋巴结转移4枚以上等高危因素的患者,行基线骨扫描检查,必要时全身骨扫描每1~2年1次;血常规、血液生化、乳腺癌标志物的检测可每6个月1次,3年后每年1次;应用他莫昔芬的患者建议每年进行1次妇科检查。同时结合其他临床检查项目,患者随诊随访评估指标汇总见表1。

2. 加强随诊随访项目的复查指标和复发处理:尽管多种治疗方案有助于降低乳腺癌患者的复发率,但当患者在随诊随访期间出现以下任何一种症状和体征时,如新发肿块、骨痛、胸痛、持续性头痛、呼吸困难或腹部疼痛等,仍提示可疑复发时,应立即就诊并进行相关检查;若怀疑局部复发,则应进行细胞或病理学检查(表2)。

三、 乳腺癌健康管理
随着乳腺癌患者生存期的延长,心血管疾病、骨代谢异常、焦虑抑郁等伴随疾病问题日益凸显,治疗期间的各类急性反应在临床上易于识别和及时干预,而远期不良反应的发展则较为隐匿和缓慢,需要在整体健康管理中给予更多重视。慢病管理时代,以患者为中心的全方位健康管理不仅有助于提高患者的治疗依从性,降低其乳腺癌相关死亡率,还有助于提高患者的生活质量,降低乳腺癌患者的非乳腺癌相关死亡率。
(一)
循环系统
1. 血脂的管理
我国>45岁女性乳腺癌占69.75%,因此,超过半数的乳腺癌患者处于围绝经期或绝经期。随着雌激素水平下降,血脂异常的发生率明显上升。除辅助内分泌治疗外,辅助化疗亦会升高乳腺癌患者的血脂水平。有研究显示,含紫杉类药物的方案较仅以蒽环类药物为基础的方案对血脂的影响更大,在制定化疗决策时有必要考虑对脂代谢的影响,在化疗期间关注血脂谱变化或必要时采取措施防治脂代谢紊乱也是不可或缺的。全程关注乳腺癌患者的血脂情况并给予适当的干预,有助于防治动脉粥样硬化性心血管病(atherosclerotic cardiovascular disease, ASCVD)的发生,并可降低乳腺癌的复发风险。
血脂检测可以将术前水平作为基线标准,低密度脂蛋白胆固醇(low density lipoprotein-cholesterol, LDL-C)是乳腺癌患者防治的首要血脂观察指标。《2019年欧洲心脏病学会与欧洲动脉粥样硬化协会血脂异常管理指南》与《中国胆固醇教育计划调脂治疗降低心血管事件专家建议(2019)》均较以往提出了更为严格的降脂目标和更加积极的降脂策略,不同ASCVD风险程度的患者需要达到不同的LDL-C目标水平(表3)。

根据LDL-C管理目标,针对不同患者给予个体化治疗方案。
(1)所有患者:均应接受生活方式干预,有助于预防血脂异常的发生,同时注意每年对血脂水平进行检测,包括总胆固醇、甘油三酯、LDL-C和高密度脂蛋白胆固醇。①戒烟:不吸烟、避免吸二手烟,可使用尼古丁替代或戒烟药物。②调整饮食结构:增加多种水果、蔬菜摄入,选择全谷物或高纤维食物,每周至少吃2次鱼,限制饱和脂肪酸、反式不饱和脂肪酸、胆固醇、酒精和糖的摄入。③保持理想体重或减重:通过运动、控制饮食和行为训练维持或减轻体重,保持体质指数(body mass index, BMI)≥20 kg/m2且≤24 kg/m2,且腰围<80 cm。④运动:每周至少坚持150 min中等强度的有氧运动,如走路、慢跑、骑车、游泳、跳舞等,绝经后女性应每周至少进行2次肌肉张力锻炼。
(2)存在危险因素或出现血脂异常的患者:除上述生活方式干预外,还应给予适当的治疗措施。①结合临床疾患和(或)危险因素决定是否开始降脂药物治疗。他汀类是临床中最常用的降脂药物,且他汀类药物与内分泌药物间无相互作用,其他降脂药物则多在必要时作为他汀类药物联合用药的选择。②选择适当的内分泌治疗药物。一项前瞻性队列研究显示,对于绝经后的激素受体阳性早期乳腺癌患者,与非甾体类芳香化酶抑制剂(aromatase inhibitor, AI)药物比较,甾体类AI药物降低了36%的血脂事件发生风险(P =0.018)。因此,对于血脂异常的绝经后乳腺癌患者,治疗时可选择对血脂影响较小的内分泌治疗药物。对于AI使用前检测出血脂异常的患者,建议AI药物联合他汀类药物治疗;针对已经使用非甾体类AI治疗、出现血脂异常的患者,建议换用甾体类AI药物联合或不联合他汀类药物。拒绝接受AI治疗或不能耐受AI类药物的绝经后乳腺癌患者,可以服用他莫昔芬。③长期规律随诊随访血脂水平及降脂药物不良反应。对采取生活方式干预的患者,最初3~6个月应复查血脂水平,如血脂控制达标,则继续生活方式干预,每6~12个月复查1次,长期达标者亦需每年复查1次。首次服用降脂药物者,应在用药4~6周内复查血脂、转氨酶和肌酸激酶水平。如果血脂达标且无转氨酶和肌酸激酶水平,可以逐步改为6~12个月复查1次;如治疗1~3个月后,血脂仍未达标,需及时调整降脂药物剂量或种类,或联合应用不同机制的降脂药物,并在调整后4~6周内复查。患者血脂管理不理想时,建议与内分泌科或心血管科专家共同制定适当的干预方案,同时对疗效和依从性进行监测(图5)。

2. 心脏不良反应的管理(图6)

(1)化疗相关心脏不良反应的管理
化疗相关不良反应,通常会在患者化疗终止后逐渐消失。但是,蒽环类药物可能导致长期的心脏不良反应,影响患者的生活质量。因此,应通过定期的心电图和超声心动检查评估患者的心功能状态,以及时进行管理和干预。
蒽环类药物的心脏不良反应可表现为急性、慢性和迟发性3种类型。急性心脏不良反应常在蒽环类药物使用几小时或几天内发生,常表现为心内传导紊乱和心律失常,极少数患者表现为心包炎和急性左心衰,且在致病药物停用后通常可以恢复。慢性心脏不良反应通常在化疗后的1年内发生,表现为左心室功能障碍,最终可导致心衰。蒽环类药物还可在治疗后数年至数十年内,引发更加难以觉察的慢性心肌病,即迟发性心脏不良反应,这种蒽环类药物相关心肌病常常导致心室功能不全,随后发生临床心力衰竭和心律失常。因此,患者接受化疗时应定期随诊随访其心脏功能情况,一旦怀疑出现化疗相关心脏不良反应时,应给予适当的管理。患者化疗结束后的随诊随访期间,主要关注蒽环类药物的慢性和迟发性心脏不良反应。
①心功能正常患者:每年定期进行随诊随访,同时加强对乳腺癌患者心血管疾病的了解。
②心功能异常患者:除积极的生活干预外,在蒽环类药物化疗结束后仍应继续对患者心功能进行随诊随访,高危患者则应提高随诊随访频率,可通过超声心动图或血管造影术、肌钙蛋白、脑钠肽和心内膜心肌活检等进行评估。若疑似存在心功能异常,则可使用血管紧张素转换酶抑制剂(angiotensin converting enzyme inhibitor, ACEI)、血管紧张素受体阻滞剂和特定β受体阻滞剂,防止蒽环类药物诱导的心肌病发生。如果患者使用蒽环类药物期间发生有临床症状的心脏不良反应,或无症状但左室射血分数(left ventricular ejection fraction, LVEF)<45%亦或较基线下降幅度>15%,可考虑检测心肌肌钙蛋白T,必要时应先停药并充分评估患者的心脏功能,后续治疗应慎重。
(2)抗人表皮生长因子受体2(human epidermal growth factor receptor 2, HER-2)靶向药物相关心脏不良反应的管理
曲妥珠单抗诱导的心肌病大多表现为治疗期间LVEF无症状性下降,有症状的显性心力衰竭并不常见。有心力衰竭症状的患者LVEF较基线值下降>5%且绝对值<55%,或无心力衰竭症状的患者LVEF较基线值下降>10%且绝对值<55%,可判断为心脏不良反应。与蒽环类药物相反,曲妥珠单抗诱导的心脏功能不全似乎并不具有剂量依赖性,停止治疗后心脏不良反应通常可逆转。帕妥珠单抗亦可能导致亚临床和临床心力衰竭,尽管临床研究结果显示,在曲妥珠单抗治疗的基础上增加帕妥珠单抗并未明显增加心脏不良反应发生率。
①心功能正常患者:采用曲妥珠单抗或帕妥珠单抗或恩美曲妥珠单抗治疗时,推荐在基线以及治疗过程中每隔3个月行超声心动图检查,评估LVEF。
②心功能异常患者:若发现患者心功能出现异常,除积极的生活干预外,应立即停用相关治疗药物,同时还应给予适当的医疗管理,使不良反应降到最小。如果LVEF较基线下降>15%或下降10%且低于50%,在重新评估LVEF前应暂停使用相关治疗药物4周。若LVEF依然处于低水平或有症状性心力衰竭证据,则应终止相关药物治疗。此外,还应加强患者的随诊随访频率,建议每个月进行检测。根据心功能检查结果,同时还可邀请心内科医师会诊,以便更有效地进行管理。
(3)放疗相关心脏不良反应的管理
放疗可能引起心包、心肌、冠状动脉、心脏传导系统等多种心脏组织结构的损伤。放射性心脏损伤与心脏照射体积、照射剂量以及化疗和靶向药物的应用有关,左侧乳腺癌术后接受放疗的患者心脏损伤发生率明显增加。放疗相关心脏不良反应的潜伏期较长,早期缺乏明显的临床表现,应在放疗后长时间内随诊心肌酶、心电图、超声心动图、冠脉CT血管成像技术、心肌核素等辅助检查,以及时发现心包病变、心肌病、冠状动脉病变、心律失常等。
目前尚缺乏放疗相关心脏不良反应的特异性治疗方案。因此,在制定放疗决策时,应尽量降低正常心脏组织的照射体积和照射剂量,并减少放疗相关心脏不良反应的危险因素。对于已经出现放疗相关心脏不良反应的患者,可尝试应用抗炎、抗血栓、营养心肌、他汀类药物和ACEI等治疗,其临床应用价值仍需进一步探索。
3. 静脉血栓栓塞症(venous thromboembolism, VTE)的管理
乳腺癌患者发生VTE的风险是同年龄段非肿瘤患者的3.5倍。乳腺癌患者在化疗期间和化疗结束后1个月发生VTE的风险明显升高,分别高于未接受化疗患者的10.8倍和8.4倍;接受他莫昔芬治疗的患者,在前3个月治疗期间,VTE的发生风险增加了5.5倍,且风险在治疗3个月后仍持续升高;AI类药物的应用则与VTE的发生无明显相关性。因此,对于接受化疗或他莫昔芬治疗的患者,需要特别警惕VTE事件发生。应有选择地针对风险最高的患者进行血栓预防,以避免低受益患者的过度治疗和不良反应。
美国国立综合癌症网络肿瘤相关静脉血栓栓塞指南2021.V2推荐所有住院患者采取措施预防静脉血栓栓塞,包括基础预防策略:加强健康教育;足踝主动或被动运动,被动挤压小腿肌群;注意尽早下床活动;避免脱水。无抗凝药物禁忌证的住院患者可预防性应用抗凝药物,如普通肝素、低分子肝素(表4),有抗凝药物禁忌证的患者可采用机械预防,如间歇充气压迫装置、分级加压弹力袜(下肢动脉供血不足者慎用)、足底静脉泵。对于门诊化疗患者,可根据Khorana评分评估静脉血栓风险,低风险(0分)、中风险(1~2分)、高风险(≥3分)发生有症状VTE的风险分别为0.3%~1.5%、1.8%~4.8%、6.7%~12.9%(表5),中高风险者(≥2分)考虑6个月的口服抗凝药预防(表6),低风险者(<2分)不建议常规预防性抗凝治疗。



对于已经发生VTE的肿瘤患者,抗凝治疗至少进行3个月或贯穿整个患癌和抗癌治疗期间。首次抗凝治疗后的前14 d至少每2~3 d检测1次血红蛋白、血细胞比容和血小板技术,此后每2周复查1次或根据临床指征进行检测。对抗凝治疗具有绝对禁忌证的患者,可行下腔静脉滤器(inferior vena cava filter, IVCF)置入术,以预防下腔静脉系统血栓栓子脱落引起肺动脉栓塞,IVCF置入术和取出术的适应证及禁忌证见表7。

(二)
呼吸系统
1. 药物治疗相关肺炎:在乳腺癌患者的全程管理中,需关注患者的呼吸系统症状及体征,结合实验室检查及胸部CT表现,明确患者有无肺炎以及判断是何种原因引起的肺炎,并排除肺部转移。化疗导致的骨髓抑制可能继发肺部感染,抗HER-2靶向治疗可能导致间质性肺炎,免疫检查点抑制剂的应用增加了免疫相关肺炎的风险。对于感染性肺炎,应以抗感染治疗为主。对于抗HER-2治疗引起的间质性肺炎,可全身应用糖皮质激素治疗,并对相关靶向药物进行减量、暂停给药或永久停用。对于免疫检查点抑制剂相关肺炎,基本用药为糖皮质激素,初始激素治疗不敏感者可考虑冲击量激素、丙种球蛋白、白细胞介素6受体抑制剂、肿瘤坏死因子α抗体或环磷酰胺等其他免疫抑制剂治疗。
2. 放射性肺炎:放射性肺炎通常发生于放疗后的1~6个月内,临床可表现为发热、刺激性干咳、胸痛、呼吸困难等,多数患者只有影像学改变,缺乏临床症状。放射性肺炎的发生与患者基础肺部疾病与肺功能、肺部照射体积、肺部照射剂量以及同步化疗有关。制定放疗决策时,应尽量降低正常肺组织的照射体积和照射剂量。对于已经发生放射性肺炎的患者,应根据患者个体情况,给予止咳、祛痰、抗感染、吸氧等对症处理;对于重症患者,应用糖皮质激素,以抑制免疫、减少渗出、抑制促纤维化因子产生,当临床症状明显好转后可逐渐减量至停用。目前尚缺乏对于糖皮质激素初始剂量、维持时间和减量速度的标准,我国学者根据临床经验推荐如下:(1)建议使用地塞米松或泼尼松等长效糖皮质激素;(2)地塞米松可以5 mg的较低剂量起始,分2次口服或静脉用药,前2~3 d症状改善不明显者,可每2.5 mg增加至10 mg,但更高剂量的改善是有限的;(3)可在用药后的前2~3 d行疗效评价,症状明显缓解即可,如基本正常或明显改善,并作为维持剂量,否则可增加≤2.5 mg的剂量,再次评价效果,以得到较小而有效的剂量作为维持剂量;(4)维持剂量治疗3~4周,之后缓慢减量,如2~3 d减量1片或2 d减半片直至全部停药。
(三)
运动系统
1. 术前及术后康复运动量评估及标准
诊断乳腺癌后,患者应避免静坐的生活方式,尽快恢复患病以前的日常体力活动。在阶段性抗肿瘤治疗结束后,咨询康复科医师,获得康复运动的建议。每3~6个月咨询专科医师或专业体育指导人员,评估目前的体力活动情况并获取改善建议。随诊随访时,应关注患者是否有规律地进行日常体力活动,以何种频率进行,每次进行多长时间。中等强度活动包括:骑车(车速<16 km/h)、步行(速度≤6.4 km/h)、跳舞(社交舞、广场舞等)、家居活动(如整理床铺、搬桌椅、拖地、手洗衣服、清扫地毯等)。高强度活动包括:竞走或跑步(速度≥8 km/h)、骑车(车速≥16 km/h)、跳绳、游泳、篮球、足球、负重爬山(负重≥7.5 kg)。
18~64岁的成年乳腺癌患者,每周坚持至少150 min的中等强度运动(大致为每周5次,每次30 min)或75 min的高强度有氧运动,力量性训练(大肌群抗阻运动)每周至少2次。锻炼时以10 min为一组,最好保证每天都进行锻炼。年龄>65周岁的老年乳腺癌患者应尽量按照以上推荐进行锻炼,如果合并使行动受限的慢性疾病,则根据医师指导适当调整运动时间与运动强度,但应避免长时间处于不运动状态。
2. 骨丢失和骨质疏松的管理
在绝经后雌激素水平降低的影响下,自然绝经的女性BMD每年下降1.9%,容易出现骨量减少和骨质疏松及骨折。绝经前乳腺癌患者如接受卵巢去势,雌激素下降更为明显,骨丢失和骨质疏松及骨折的风险亦明显增加。此外,当乳腺癌患者接受AI或化疗等治疗时,骨量丢失加速,导致骨折的风险进一步增加。所有接受AI、卵巢去势、化疗或绝经后的乳腺癌患者都应评估临床风险因素,并监测BMD。推荐采用双能X线吸收测量法(dual-energy X-ray absorptiometry, DXA)测量BMD,参照WHO推荐的诊断标准:中轴BMD T值≥-1.0为正常,-2.5<T值<-1.0为低骨量,T值≤-2.5为骨质疏松。胸腰椎X线侧位像,有助于发现椎体压缩性骨折,如椎体或髋部发生脆性骨折(指低能量或非暴力情况下发生的骨折),可诊断骨质疏松症;如脆性骨折部位发生在肱骨近端、骨盆或前臂远端,而DXA测定的BMD的T值显示为低骨量,也可诊断骨质疏松症。根据BMD和临床风险因素,给予患者个体化治疗方案(图7)。

(1)所有患者:均应进行生活方式干预,建议每日≥30 min中等强度的运动,如步行、跑步等,鼓励负重运动;提倡户外活动,增加日光照射;进食含钙丰富的食物;戒烟戒酒;特别注意防止跌倒和身体猛烈撞击,应坚持每年进行BMD检测并对骨折风险进行评估。饮食中钙摄入不足或光照不足者则应适当补充钙剂和维生素D。
(2)低骨量、骨质疏松或存在危险因素的患者:除需改善生活方式外,还应及时给予适当的药物管理,同时还应加强BMD监测频率。①药物干预:足够的钙剂和维生素D对于维持BMD极为重要;地舒单抗60 mg每6个月1次是预防骨折可选的治疗;不同双膦酸盐抑制骨吸收的效力差别较大,其对BMD和骨吸收的改善以及对骨折的预防力度均有不同,临床研究显示,双膦酸盐能够减少高危乳腺癌患者的复发风险,但双膦酸盐治疗前应检测肾功能,肌酐清除率(creatinine clearance, CrCl)<35 ml/min者禁用;甲状旁腺激素类似物特立帕肽刺激骨形成和骨吸收,是减少绝经后妇女骨折发生率的可选方案。因此,乳腺癌患者应选择适当的剂量及方案进行治疗(表8),老年患者骨折风险显著增加,更需要药物干预。②建议选择对骨安全影响较小的内分泌药物,以降低骨安全问题的发生。甾体类AI药物具有独特的雄激素样结构,与非甾体类AI药物比较,对骨安全的影响较小。有研究证实,甾体类AI和非甾体类AI药物降低雌激素水平和增加骨吸收标志物水平的程度相近,但24周甾体类AI治疗可持续增加血清骨形成标志物I型前胶原氨基端前肽(procollagen type I N-terminal propeptide, PINP)水平,基线校正的0~12周和0~24周PINP曲线下面积显著大于非甾体类AI。因此,建议高危患者可选择甾体类AI药物治疗。③存在脊柱病变的患者应至骨科或脊柱外科医师处就诊,寻求关于手术的建议。④酌情提高BMD监测频率,建议患者可每6~12个月进行检测。

3. 肌肉骨骼(关节)疼痛的管理
BMD降低、骨转移和治疗相关药物等均可导致患者出现疼痛症状。因此,有效地鉴别患者疼痛特别是骨痛诱因极为重要。当怀疑患者为BMD降低而导致骨痛时,可通过BMD检测进行诊断,影像学检查及骨髓检测可诊断患者是否存在骨转移,治疗相关骨痛可在停止使用相应药物后症状消失。
(1)未出现肌肉骨骼疼痛的患者:应对患者常规进行宣教,加强患者对可能出现的肌肉骨骼疼痛的解;鼓励患者参加运动,如有氧训练、力量训练、瑜伽等;肥胖患者需要进行体重管理。
(2)出现肌肉骨骼疼痛的患者:①非药物治疗:运动(包括有氧训练、力量训练、瑜伽)、针灸均可以在一定程度上改善接受内分泌治疗乳腺癌患者肌肉骨骼疼痛的症状。此外,暂停AI治疗2~4周,可以极大缓解患者的肌肉骨骼疼痛,症状改善后,可换用另一种AI治疗或考虑他莫昔芬治疗。对于AI引起的腕管综合征和扳机指,通常症状较轻,必要时可采用夜间夹板或手术治疗腕管综合征,局部注射糖皮质激素治疗扳机指。②药物治疗:目前,针对由AI类药物所致的疼痛,常选择对乙酰氨基酚或非甾体抗炎药(non-steroidal anti-inflammatory drugs, NSAIDs)治疗。选择NSAIDs时需参阅药物说明书并评估NSAIDs的危险因素,以权衡疗效和安全性后选择适当的治疗方案,同时还应注意避免同时使用2种或2种以上NSAIDs。不推荐长期或大剂量应用NSAIDs控制疼痛,亦不推荐阿片类药物用于管理AI相关肌肉骨骼疼痛。有随机对照研究显示,度洛西汀可以改善AI类药物导致的关节疼痛,并改善患者的生活质量。Ω-3脂肪酸较安慰剂可以改善BMI≥30 kg/m2患者的AI相关肌肉骨骼疼痛,推荐应用于肥胖患者。有少数维生素D治疗AI相关肌肉骨骼疼痛的研究,其结论不尽相同,因此,目前不推荐以管理肌肉骨骼疼痛为目的进行维生素D检测和补充。有小型研究提示,呋塞米、葡萄糖胺联合软骨素、降钙素、短疗程低剂量口服泼尼松可以改善乳腺癌患者的肌肉骨骼疼痛,因证据级别较低,暂不推荐常规用于此类患者的管理。③应提高患者肌肉疼痛的监测频率,建议每3~6个月进行随诊随访。对于尝试多种方法仍无法改善的AI相关肌肉骨骼疼痛,需重新评估内分泌治疗的绝对获益,讨论是否继续内分泌治疗(图8)。

(四)
消化系统
药物性肝损伤(drug-induced liver injury, DILI)是指由各类处方或非处方的化学药物、生物制剂、传统中药、天然药、保健品、膳食补充剂及其代谢产物乃至辅料等所诱发的肝损伤。DILI是常见且严重的药物不良反应之一,重者可致急性肝衰竭甚至死亡。
1. 肝功能检测正常患者:注意患者的生活方式干预,如有规律地参加体力活动、调整膳食结构、戒烟戒酒等。依据随诊随访原则每年监测,在DILI发生风险相对高的治疗中,应在用药期间,特别是用药的前3个月加强生化监测,及时发现肝损伤并给予合理的治疗。
2. 肝功能检测异常患者:(1)停药原则:若怀疑存在DILI时应及时停药,停药标准可参考美国食品药品监督管理局药物临床试验中出现DILI的停药原则。①血清谷氨酸氨基转移酶(alanine aminotransferase, ALT)或天门冬氨酸氨基转移酶(aspartate aminotransferase, AST)>8倍正常上限(upper limit of normal, ULN);②ALT或AST>5倍ULN,持续2周;③ALT或AST>3 ULN,且总胆红素>2 ULN或国际标准化比值>1.5;④ALT或AST>3倍ULN,伴逐渐加重的疲劳、恶心、呕吐、右上腹疼痛或压痛、发热、皮疹和(或)嗜酸性粒细胞增多(>5%)。(2)随诊随访原则:提高肝功能随诊频率,建议每3~6个月复查。(3)药物治疗:应充分权衡停药引起原发病进展和继续用药导致肝损伤加重的风险,同时根据DILI的临床类型选用适当的药物治疗。主要包括:①药物引起的急性肝衰竭患者应尽早选用N-乙酰半胱氨酸(N acetylcysteine, NAC),但NAC对中、重度DILI的疗效有待进一步研究,成人一般用法为50~150 mg/(kg·d),疗程≥3 d;②异甘草酸镁可用于治疗ALT明显升高的急性肝细胞型或混合型DILI;③轻中度肝细胞损伤型和混合型DILI、炎症较重者可试用双环醇和甘草酸制剂(甘草酸二铵肠溶胶囊或复方甘草酸苷等);炎症较轻者,可试用水飞蓟素;胆汁淤积型DILI可选用熊去氧胆酸或腺苷蛋氨酸。目前不推荐2种或以上保肝抗炎药物联合应用,也不推荐预防性用药以减少DILI的发生。对于已进展为肝硬化的患者,其预后需根据是否出现肝功能失代偿情况而定,并且需通过影像学监测是否会发生肝细胞癌。
(五)
生殖系统
1. 生育功能保护
目前,没有明确证据提示生育影响乳腺癌患者预后,有生育要求的患者应在诊断乳腺癌时就开始考虑生育功能保护,并在开始全身治疗前实施。化疗期间应用促性腺激素释放激素类似物(Gonadotropin-releasing hormone agonist, GnRHa)保护卵巢功能的效果和安全性已有相关研究支持,建议在化疗前2周开始使用GnRHa,每个月1次,直至化疗结束后2周给予最后一剂药物。但是,即使在化疗期间应用GnRHa保护卵巢,仍然应该向患者提供其他生育力保护的手段,可供选择的方案有胚胎冻存、卵母细胞冻存、未成熟卵母细胞冻存、卵巢组织冻存等,这些方案需要在有经验的生殖中心进行,并且必须在放化疗之前完成,因此有延误患者抗肿瘤治疗的风险,需要对患者进行充分告知。
准备实施生育计划时,应与患者充分讨论其肿瘤相关复发风险以及生育相关风险,包括对后代的影响。以下情况可考虑生育:(1)乳腺原位癌患者手术和放疗结束后;(2)淋巴结阴性的乳腺浸润性癌患者手术后2年;(3)淋巴结阳性的乳腺浸润性癌患者手术后5年;(4)需要辅助内分泌治疗的患者,在受孕前3个月停止内分泌治疗(如戈舍瑞林、亮丙瑞林、他莫昔芬等),直至生育后哺乳结束,再继续内分泌治疗。
2. 子宫内膜增厚的管理
针对使用内分泌药物(尤其是他莫昔芬)治疗的患者应关注子宫内膜增厚的问题。针对绝经前患者,子宫内膜厚度在月经周期的不同阶段存在显著差异,增殖期子宫内膜厚度≥12 mm,判断为子宫内膜增厚。针对绝经后患者,服用他莫昔芬的患者子宫内膜厚度≥8 mm时,或服用AI或托瑞米芬的患者子宫内膜厚度≥4 mm时,判断为子宫内膜增厚。需结合临床症状及经阴道超声综合判断子宫内膜增厚情况(图9)。(1)子宫内膜检查结果正常时,仍需重视每6~12个月对子宫内膜的随诊监测;(2)子宫内膜检查结果异常时,首先应判断是否与内分泌药物(如他莫昔芬)相关,随后依据评估结果给予适当的治疗(图10)。此外,针对已出现子宫内膜增厚的患者,同时还应提高随诊频率,建议每3~6个月进行检测。


3. 萎缩性阴道炎的管理
主要针对接受AI类药物治疗的患者进行监测。依据患者年龄及临床表现进行诊断,同时应排除其他疾病时才能诊断为萎缩性阴道炎。(1)检查结果正常时,应重视每年的随诊监测,并建议患者关注日常的生活方式;(2)若考虑患者为萎缩性阴道炎,可使用1%乳酸或0.1%~0.5%醋酸液冲洗、阴道用抗生素,严重者可使用阴道局部雌激素治疗,选择普罗雌烯阴道用软胶囊或乳膏,其不吸收入血影响全身,只在阴道局部起作用,一般连续使用3周,症状完全改善后,每周使用2次维持。但有研究显示,局部应用雌激素制剂可以引起血浆雌激素水平的升高,尽管目前没有此类疗法增加乳腺癌复发风险的明确证据,建议由妇科专科医师指导,权衡疗效与风险后再给予相应治疗。此外,萎缩性阴道炎患者同时还应提高随诊频率,建议每3~6个月监测。
4. 性健康的管理
乳腺癌患者接受乳房切除术会影响患者的自身形象,接受化疗、内分泌等综合治疗会降低患者的雌激素水平,心理和生理的双重影响对女性患者的性健康造成了严重的打击,影响性生活、夫妻关系,甚至威胁家庭完整性,降低了康复期的生活质量。有研究显示,性功能障碍在总体乳腺癌患者中的患病率高达73.4%,中国大陆乳腺癌患者中性功能障碍患病率显著高于其他国家和地区。因此,在乳腺癌患者的康复期随诊随访中,有必要以问诊、量表等形式评估其性健康水平,并给予其相应的指导。
改善乳腺癌患者的性交困难应首选非激素疗法,局部应用4%利多卡因溶液、水性润滑剂、润滑油、维生素D和维生素E栓剂均是经临床研究证实有效的疗法。局部应用雌激素药物可以改善与雌激素剥夺有关的阴道症状进而改善性交困难,但该疗法目前仍存在一些争议,尚需要长期和大样本的研究进一步评估,可以在极其严重的情况下短期应用该疗法。此外,认知行为疗法、心理咨询也是有效的非药物治疗方式,建议患者与其伴侣共同参与。
健康及适度的性生活有利于乳腺癌患者的身心康复,但需要提醒患者注意避孕,推荐物理屏障避孕法,避免使用激素类药物避孕法。
5. 更年期综合征的管理
更年期综合征是指妇女在绝经及其前后的一段时间,由于雌激素水平降低或波动而出现的一系列躯体及精神心理症状,包括潮热、多汗、失眠、情绪低落、激动易怒、肌肉骨骼疼痛等。绝经前乳腺癌患者接受化疗、内分泌治疗等可能会造成卵巢功能抑制、雌激素水平降低,提前发生更年期综合征。此处着重介绍血管舒缩症状(潮热、多汗)的治疗,对于精神心理、肌肉骨骼疼痛的管理见前述章节。
(1)非药物治疗:对于AI类药物或他莫昔芬治疗的患者,体重增加与潮热的发生风险独立相关,因此,控制体重和饮食可能是改善乳腺癌患者潮热症状的重要策略。星状神经节阻滞手术改善潮热症状的效果与普瑞巴林和帕罗西汀相当,但考虑其有创性,不应作为首选的治疗策略。认知行为疗法、催眠疗法可以有效改善患者的血管舒缩症状,同时改善患者的精神心理状态与睡眠问题。此外,针灸、瑜伽和放松训练均可以在一定程度上改善乳腺癌患者的血管舒缩症状,同时帮助患者树立正确认知,调整生活方式,必要时进行心理疏导。
(2)药物治疗:患者症状较重,非药物治疗未能缓解,可予以适当药物治疗。①激素替代治疗:局部应用雌激素对缓解泌尿生殖道萎缩症状或阴道干涩等症状疗效确切,长期治疗可获得持续有效性,尚未发现局部低剂量雌激素有全身不良反应。全身激素替代治疗会增加乳腺癌患者的复发风险,因此不推荐应用于乳腺癌患者。②非激素类药物:该类药物主要为植物中提取的植物雌激素,不与雌激素受体结合,直接调节中枢神经系统发挥作用。黑升麻提取物、莉芙敏和希明婷均为此类药物。③其他辅助药物:随机对照研究证实,抗抑郁药(如文拉法辛、度洛西汀、帕罗西汀、舍曲林等)可以显著改善乳腺癌患者的潮热症状,对于他莫昔芬治疗的患者,推荐选择影响代谢小的药物,如文拉法辛。抗惊厥药物加吧喷丁和普瑞巴林是有效的替代治疗,与文拉法辛的作用相当。α受体阻滞剂可乐定、抗胆碱能药物奥昔布宁也可以改善患者的潮热症状,但在临床上应平衡其利弊,谨慎做出选择。
(六)
皮肤和皮下组织
1. 上肢淋巴水肿的管理:上肢淋巴水肿是乳腺癌患者常见的不良反应,多见于接受腋窝淋巴结清扫或放疗的患者,主要与手术清扫范围、淋巴引流区放疗、放疗剂量、患者体质和年龄等因素有关,临床上可表现为患侧上肢肿胀、疼痛、周径增粗、肢体变形、功能障碍,可继发感染。
随诊随访期间可以通过询问患者主观感受、客观测量患侧上肢臂围等方式评估上肢淋巴水肿的情况,一般认定患侧上肢周径比对侧上肢周径长<3 cm为轻度水肿,3~5 cm为中度水肿,>5 cm为重度水肿。对患者进行患教预防上肢淋巴水肿:(1)使患侧上肢避免高温环境,(2)避免负重,(3)避免上肢近端受压,(4)睡眠时使患侧上肢高过心脏平面,(5)患肢避免有创性操作、避免感染,(6)尽快恢复手臂功能,(7)乘坐飞机或长途旅行时戴弹力袖套,(8)适当进行体育锻炼等。
上肢淋巴水肿的治疗需要多学科共同参与,分为保守治疗和手术治疗。保守治疗包括人工淋巴引流、皮肤护理、多层绷带压迫、按摩理疗、功能锻炼等。手术治疗适用于重度淋巴水肿患者,包括淋巴结移植、建立淋巴管-静脉吻合等。患侧上肢红肿热痛或水肿突然加重者,应及时排查继发感染;确诊继发感染者,应及时进行抗炎处理。
2. 放射性皮肤损伤的管理:放射性皮肤损伤多在放疗3~4周后出现,可表现为皮肤色素沉着、毛囊扩张、汗毛脱落、红斑、水肿,甚至水疱、破溃。放疗期间可通过以下措施预防放射性皮肤损伤:穿着宽大柔软的内衣、避免皮肤摩擦、保持照射区域皮肤清洁干燥、避免阳光和紫外线照射等。轻度放射性皮肤损伤可自行恢复,无需治疗。较为严重的放射性皮肤损伤可以局部涂抹激素类药膏,或采用激素+抗生素联合治疗。
3. 乳腺纤维化的管理:乳腺纤维化表现为全乳腺或乳腺局部质地变硬,同皮下组织纤维化相似,其发生与放疗技术与放疗剂量、遗传因素、结缔组织疾病、同步全身治疗、糖尿病有关。有研究显示,TGFB1基因伴有至少一个拷贝C-509T时,患者在保乳术后全乳放疗后发生乳腺纤维化的风险明显增加。
保乳术后全乳放疗可以提高保乳率和乳腺癌特异性生存,但同时也导致了乳腺纤维化的发生,进而导致乳房美观度降低、功能减退以及生活质量降低。乳腺纤维化的管理应以预防为主。现代放疗技术的发展和普及在一定程度上避免了乳腺纤维化的发生,医师应根据患者的具体情况权衡肿瘤控制和美容效果的利弊,为患者选择个体化的放疗技术与剂量。对于符合CALGB 9343与PRIME Ⅱ研究入组条件,同时结合患者个体情况,可以考虑豁免保乳术后放疗;对于复发风险较低的患者,可以考虑不进行瘤床补量;对于乳腺纤维化风险高的患者,如有担心可以在术后放疗完成后再开始内分泌治疗。
(七)
神经系统
1. 外周神经病变的管理:外周神经病变是紫杉醇的剂量限制相关不良反应,包括急性暂时性神经不良反应和慢性长期性神经不良反应,主要表现为感觉、运动和自主神经功能紊乱。可以利用欧洲癌症研究与治疗组织生命质量量表-化疗所致外周神经病变(European Organization for Research and Treatment of Cancer Quality of Life Questionnaire Chemotherapy-induced Peripheral Neuropathy 20, EORTC QLQ-CIPN20)、总神经病变评分、妇科肿瘤患者神经不良反应评估量表、患者神经不良反应问卷等工具对患者的周围神经功能情况进行综合评定。
穿戴加压手套或冰手套可以显著降低患者外周神经病变的发生率,乙酰左旋肉碱、谷胱甘肽、维生素E等药物的预防作用尚需要更高级别的循证医学证据支持。对于已经出现外周神经病变的患者,可考虑降低化疗药物剂量、延长用药间隔时间或停药。神经营养类药物在临床应用中有一定的治疗效果,神经病理性疼痛者推荐应用抗抑郁药物、加巴喷丁或普瑞巴林。
2. 脑血管病变的管理:乳腺癌本身及长期治疗药物,均可能影响凝血功能,增加脑血管病风险,在随诊随访过程中,应密切监测并积极控制血脂、血糖、血压等危险因素,减少脑血管病变发生。
3. 臂丛神经损伤:乳房切除术、腋窝淋巴结活检及切除术、针对锁骨上区和腋部放疗,可能会导致臂丛神经或上肢近端神经的急性或迟发损伤,通常表现为手术侧或放疗侧上肢持续加重的麻木疼痛和无力,随诊随访时应给予关注。治疗方面,以对症支持为主,可使用神经营养药物及镇痛药物,辅以物理功能锻炼。
4. 乳腺癌神经系统转移管理:乳腺癌是脑和脊髓转移的常见肿瘤之一,当患者出现头晕、头痛、癫痫发作、精神症状、智力减退、偏侧肢体麻木无力等脑病表现时,应及时进行脑MRI检测,必要时进行MRI增强检查以及腰穿,以判断是否有脑转移发生;当出现双侧下肢麻木无力、尿便障碍时,应注意有无脊髓转移的可能。当存在其他系统转移瘤证据时,建议对患者进行神经系统全面检查,并完善头部MRI检查。在无神经系统症状发生时,是否需要定期头部MRI检查,目前尚无循证依据支持或否定。
5. 医学难以解释的症状(medically unexplained symptom, MUS):MUS常被医师们称为非特异症状、功能性症状、神经官能症、植物神经功能紊乱等,既包括各种功能性疾病,又包括精神障碍中的躯体形式障碍,常见的症状有疲乏、头晕、头痛、失眠、呼吸困难和腹痛等。乳腺癌患者常面临焦虑和抑郁等精神心理问题,由于肿瘤的诊断以及抗肿瘤治疗的不良反应,可能会对自身症状过度关注,从而加重和强化躯体症状,甚至导致新的症状出现,这些症状无法用器质性疾病来解释,患者往往因此反复就医。
MUS的治疗应以减少或减轻症状、减少心理社会应激、减少或减轻日常功能损害、减少不合理医疗资源使用为目标,推荐社会心理干预联合药物的治疗策略。与患者建立良好的治疗关系是MUS治疗成功的基础,应鼓励患者心身并重,积极接受心理治疗、进行躯体活动和社交活动。目前尚无治疗MUS的特异药物,针对躯体症状的药物治疗是患者容易接受的治疗方式,可以参考不同症状相关专业的指南或共识。临床上,精神科药物也被广泛应用于MUS的治疗,并展现出了一定的疗效。
6. 精神心理的管理:乳腺癌患者在治疗过程中会经历身体多方面的变化,比如乳房切除术后身体形象的改变,化疗药物造成的脱发、疲乏感等,激素相关的失眠、潮热等不适,性相关问题等,这些问题均会影响患者的心理状态。有研究显示,抑郁与焦虑是乳腺癌患者最常见的精神心理问题,患病率明显高于普通人群,而且多数患者却未得到及时诊治。一方面,抑郁会降低患者的生活质量,另一方面,有抑郁史的患者更容易早期停止辅助内分泌治疗,进而影响预后。因此,有必要在治疗中关注患者的精神心理状态,进行必要的监测及治疗,可以使用量表进行评估,目前临床常用检测量表包括9条目病人健康问卷(Patient Health Questionnaire-9, PHQ-9)和广泛性焦虑自证量表,这两种问卷均是由患者基于自己过去两周的情况进行自评,依据患者自评得分结果进行评估患者精神心理状态,得出相应治疗建议(表9~11)。(1)若患者评估结果未提示存在异常,保持正确的生活方式即可,如保持健康的体重、有规律地参加体力活动、调整膳食结构、戒烟戒酒等,同时应每年对患者进行1次精神状态评估。(2)心理教育、支持性团体、放松疗法和体育锻炼均是对抗焦虑抑郁的行为方式,这些心理社会方式的干预极为重要。(3)若患者自评得分结果提示可能存在心理问题时,应及时给予适当的干预措施,以缓解患者情绪症状,达到临床治愈、促进乳腺癌康复、恢复社会功能。对于中重度患者应该转诊精神科或使用抗焦虑抑郁的药物。


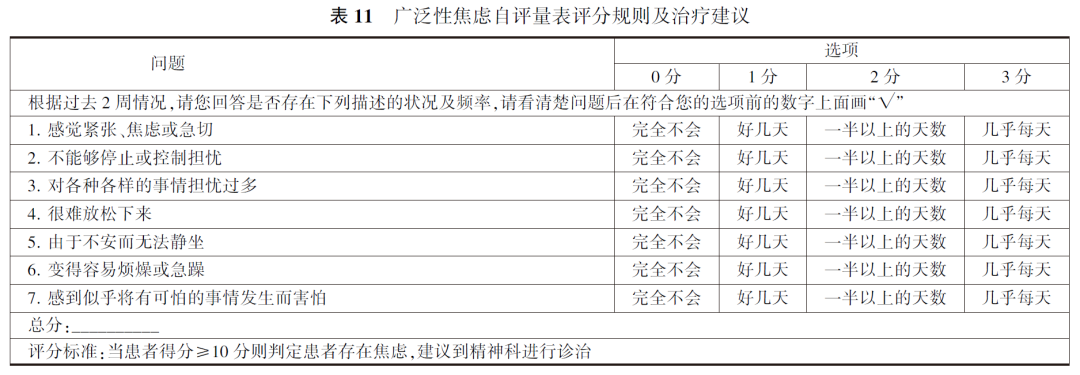
由于某些抗抑郁药影响乳腺癌治疗药物他莫昔芬的代谢,所以药物推荐选择影响代谢小的药物,如西酞普兰、艾司西酞普兰、米氮平和文拉法辛。(1)注意药物间相互作用、权衡利弊,注意个体化和灵活性,重视心理治疗。(2)关于监测频率并无明确要求,临床研究中监测频率常较高(每3~6个月1次),在临床治疗中,可根据实际情况安排。如已明确诊断为焦虑和抑郁障碍者,可在诊治早期安排较频繁的监测(每3~6个月),后期逐渐延长监测间隔时间(每1~3年)。
四、患者报告结局
患者报告结局(patient reported outcome, PRO)是直接来自于患者对自身健康状况、功能状态以及治疗感受的报告,其中不包括医护人员及其他任何人员的解释。PRO可用于对慢性疾病、精神类疾病以及缺乏客观指标的疾病评价,也可用于了解患者对治疗的总体满意度,为医师的诊断治疗提供更加全面的参考,对临床治疗实践具有十分重要的意义。PRO数据是通过一系列标准化的问卷收集而来的,这些问卷作为测评工具,由明确的概念框架构成,其中包括患者症状的报告(例如疼痛、疲劳等)、患者身体、心理和社会活动的功能状态[如健康相关生活质量(health-related quality of life, HRQoL)]、患者的健康行为(如对治疗的依从、吸烟情况和参加体育锻炼情况)、患者对于不同治疗表达出的不同倾向性、患者表示希望(或不希望)参加某项治疗的愿望、患者对治疗的满意度、患者对于医患之间的沟通、合作治疗方式以及治疗获得手段等方面信息的报告等各个层面的内容。近年来,多项肿瘤药物的注册临床试验已将PRO指标作为次要终点或探索性终点。
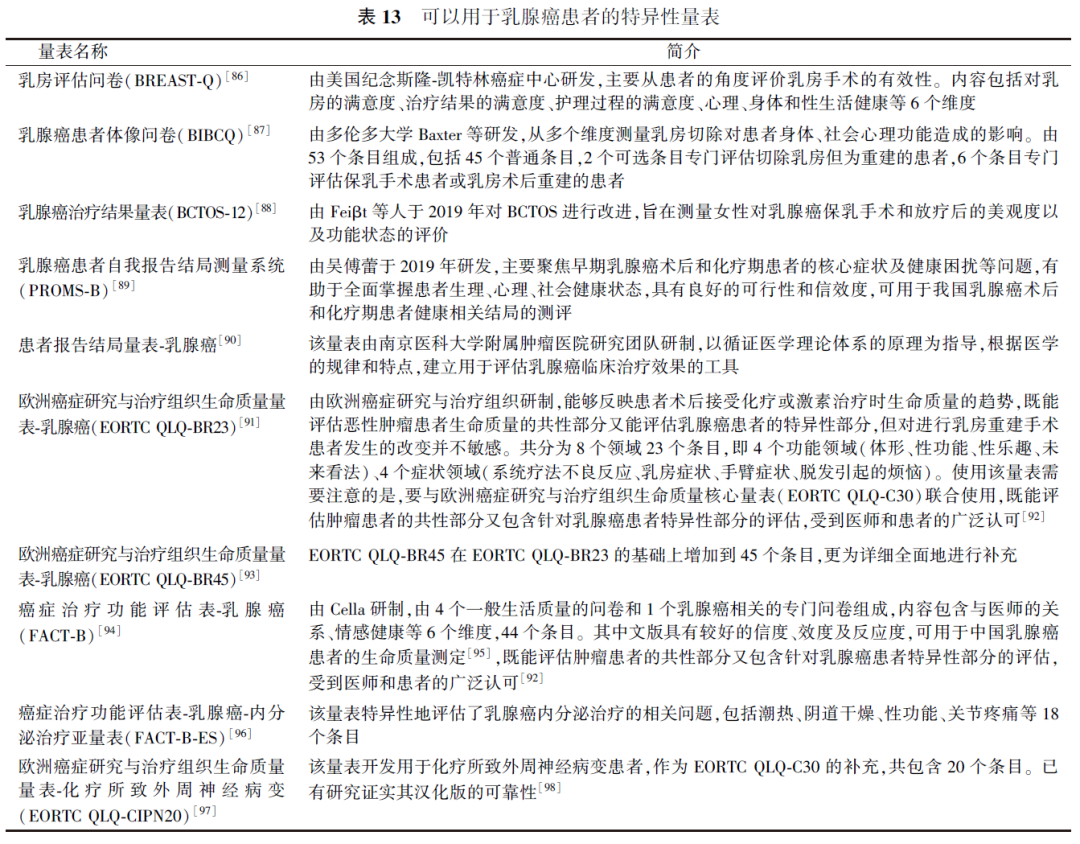
PRO量表分为普适性量表和特异性量表两类。普适性量表没有年龄限制,适用于多种疾病,亦不针对某种治疗方式,试图涉及更广泛的患者群体和普通人群。但是,对于特殊疾病患者群体,普适性量表会包含一些与其疾病不相关的内容,进而给患者带来疏离感,让患者感觉不被重视,可能以应付的心态填写量表,或拒绝回答他们认为不相关的问题,这也成为数据缺失的重要原因。特异性量表一般针对某种疾病(如乳腺癌)、特定人群(如老年患者)或特殊问题(如疼痛),也可以是表述功能状况(如日常活动能力),特殊疾病量表因为其特定的内容与患者的状况更加贴近,在临床上可以获得更好的反响。可用于乳腺癌患者的普适性量表和特异性量表见表12~14。


PRO评价可以通过纸质版量表和问卷、面对面访谈、电话访谈、电子PRO数据收集系统(ePRO)等方式进行。有研究显示,ePRO与纸质版PRO同样可靠,通过电子设备进行自我报告的患者有更好的依从性,可以减轻医护人员和患者在随访评估中的负担,是临床随访的有力工具。但是,ePRO的实施需要多方面的配合,确保患者和医护人员拥有填写或查看结果的ePRO终端设备(如手机、平板电脑、笔记本等),开发相关的应用程序和信息系统,并确保使用者具有良好的交互体验,还需对相关的医护人员及患者进行恰当的培训,尤其是老年患者和电子设备使用水平较低的患者。
PRO评价亦有其局限性。由于患者报告的特性,PRO具有较强的主观性,患者的知识结构可能影响其准确性。现有的PRO量表多为HRQoL或患者症状的评价量表,专门为PRO评价研发的量表仍在开发中。PRO的主观性较强,在临床应用中应随着乳腺癌新药研发和标准疗法的改变而调整,患者的健康状况、功能状态和自身感受也会发生变化,PRO的开发亦需要与时俱进。我国应用的PRO量表多为国外版本汉化而来,有些量表缺少规范的汉化过程,国内自主研发的PRO量表较少且缺乏大样本的验证。此外,国内尚缺乏测量PRO的信息系统,在一定程度上限制了PRO在临床研究和临床实践中的推广和应用。期待临床医师和研究人员进一步开发和验证适合中国乳腺癌患者的PRO量表,完善PRO信息系统,为乳腺癌的临床研究、临床随访与健康管理提供重要的决策依据。
五、总结
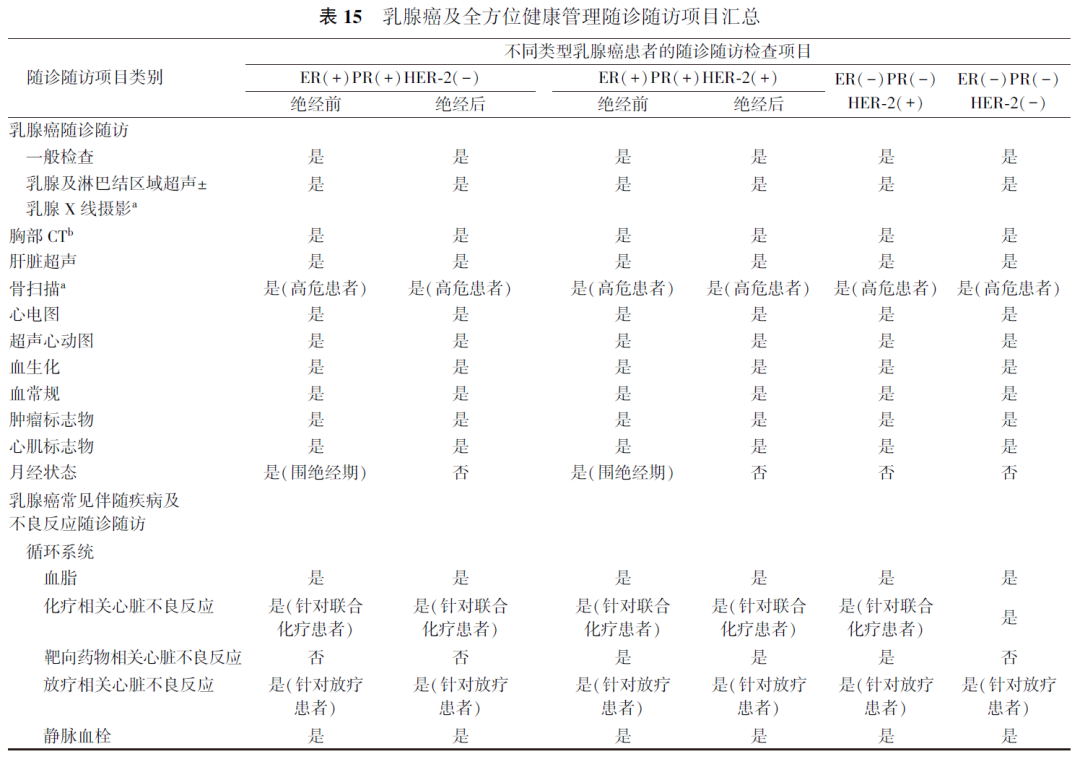
乳腺癌已进入慢病管理时代,随着乳腺癌患者生存时间的延长,在乳腺癌随诊随访期间除应关注疾病本身外,更应重视患者伴随疾病与治疗相关不良反应的管理(表15),进一步改善乳腺癌患者的预后,提高患者生存及生活质量。在实际应用中,应充分发挥基层医疗机构在乳腺癌随诊随访和管理中的重要作用,上级医院应做好对乳腺癌随诊随访管理落地的指导和帮扶。本指南作为以路径图为模式的临床管理指南,为乳腺癌患者伴随疾病和长期随诊随访的管理提供参考依据。但目前针对乳腺癌患者伴随疾病的研究十分有限,因此,临床实际应用时应结合患者自身情况给予个体化的规范管理。
执笔人
马飞(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)
莫红楠(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)
顾问委员(按姓氏汉语拼音字母排序)
代华平(中日友好医院呼吸与危重症医学科)
葛均波(复旦大学附属中山医院心内科)
李冰(北京大学第六医院心理科)
刘明生(中国医学科学院北京协和医院神经科)
茅益民(上海交通大学医学院附属仁济医院消化科)
乔杰(北京大学第三医院生殖医学中心)
宋尔卫(中山大学孙逸仙纪念医院乳腺外科)
孙燕(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)
邵志敏(复旦大学附属肿瘤医院乳腺外科)
吴德沛(苏州大学附属医院血液科)
夏维波(中国医学科学院北京协和医院内分泌科)
参加人员(按姓氏汉语拼音字母排序)
安涛(中国医学科学院阜外医院心血管内科)
曹旭晨(天津医科大学肿瘤医院乳腺外科)
陈佳艺(上海交通大学附属瑞金医院放疗科)
陈前军(广东省中医院大学城分院乳腺科)
陈蓉(中国医学科学院北京协和医院妇产科)
陈益定(浙江大学医学院附属第二医院肿瘤外科)
程蕾蕾(复旦大学附属中山医院心脏超声诊断科)
崔树德(河南省肿瘤医院乳腺科)
丁悦(中山大学孙逸仙纪念医院骨外科)
范照青(北京肿瘤医院乳腺癌预防治疗中心)
付丽(天津市肿瘤医院乳腺病理科)
高晋南(山西白求恩医院乳腺外科)
耿翠芝(河北医科大学第四医院乳腺外科)
管秀雯(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)
何畏(江苏省人民医院内分泌科)
胡夕春(复旦大学附属肿瘤医院肿瘤内科)
姜艳(中国医学科学院北京协和医院内分泌科)
江泽飞(解放军总医院第五医学中心肿瘤医学部)
金锋(中国医科大学附属第一医院乳腺外科)
兰波(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)
李国辉(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院药剂科)
李惠平(北京大学肿瘤医院乳腺内科)
李静(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院药剂科)
李青(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院肿瘤内科)
李蓉(北京大学第三医院妇产科)
李涛(中国医学科学院北京协和医院心理医学科)
李炘正(山西省肿瘤医院乳腺外科)
李兴睿(华中科技大学同济医学院附属同济医院乳腺甲状腺外科)
李毅(北京市顺义区妇幼保健院乳腺中心)
厉红元(重庆医科大学附属第一医院内分泌乳腺外科)
廖宁(广东省人民医院乳腺科)
刘彩刚(中国医科大学附属盛京医院乳腺外科)
刘健(福建省肿瘤医院乳腺内科)
刘均娥(首都医科大学护理学院)
刘强(中山大学孙逸仙纪念医院乳腺外科)
刘晓帆(中国医学科学院血液学研究所血液病医院血栓止血诊疗中心)
刘新兰(宁夏医科大学附属医院肿瘤内科)
刘运江(河北医科大学第四医院乳腺外科)
刘真真(河南省肿瘤医院乳腺外科)
卢雯平(中国中医科学院广安门医院肿瘤科)
罗婷(四川大学华西医院肿瘤科)
马斌林(新疆医科大学第三临床医学院附属肿瘤医院乳腺甲状腺外科)
马飞(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)
莫红楠(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)
莫钦国(广西医科大学附属肿瘤医院乳腺外科)
欧阳取长(湖南省肿瘤医院乳腺内科)
潘华(首都医科大学附属北京天坛医院神经病学中心)
潘跃银(安徽省立医院肿瘤化疗科)
乔广东(烟台毓璜顶医院乳腺外科)
任国胜(重庆医科大学附属第一医院内分泌乳腺外科)
任雁宏(中日友好医院呼吸与危重症医学科)
阮祥燕(首都医科大学附属北京妇产医院内分泌科)
盛莉(解放军总医院心血管内科)
史业辉(天津市肿瘤医院乳腺肿瘤内科)
孙强(中国医学科学院北京协和医院乳腺外科)
孙涛(辽宁省肿瘤医院肿瘤内科)
汤立晨(复旦大学附属肿瘤医院乳腺外科)
滕月娥(中国医科大学附属第一医院肿瘤内科)
田富国(山西省肿瘤医院乳腺外科)
佟仲生(天津医科大学肿瘤医院乳腺肿瘤内科)
万冬桂(中日友好医院中西医结合肿瘤内科)
王川(福建医科大学附属协和医院乳腺外科)
王海波(青岛大学医学院附属医院乳腺外科)
王靖(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院乳腺外科)
王坤(广东省人民医院乳腺科)
王殊(北京大学人民医院乳腺外科)
王淑莲(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院放疗科)
王树森(中山大学附属肿瘤医院内科)
王水(江苏省人民医院乳腺外科)
王曦(中山大学肿瘤中心乳腺外科)
王晓稼(浙江省肿瘤医院乳腺肿瘤内科)
王翔(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院乳腺外科)
王延风(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院综合科)
王勇(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院超声科)
王永胜(山东省肿瘤医院肿瘤外科)
王玉(山西省肿瘤医院放疗科)
王正珍(北京体育大学运动医学)
王中华(复旦大学附属肿瘤医院乳腺外科)
吴浩(北京方庄社区服务中心)
吴炅(复旦大学附属肿瘤医院乳腺外科)
吴新红(湖北省肿瘤医院乳腺外科)
邢影(吉林大学中日联谊医院神经内科)
徐兵河(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院药物临床试验研究中心)
徐贵颖(吉林省肿瘤医院乳腺外科)
徐莹莹(中国医科大学附属第一医院乳腺外科)
薛冬(北京大学肿瘤医院中西医结合科暨老年肿瘤科)
杨谨(西安交通大学附属第一医院肿瘤内科)
杨俊兰(解放军总医院肿瘤内科)
叶松青(福建省立医院肿瘤外科)
应红艳(中国医学科学院北京协和医院肿瘤内科)
应建明(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)
余科达(复旦大学附属肿瘤医院乳腺外科)
郁琦(中国医学科学院北京协和医院生殖内分泌科)
袁芃(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院特需医疗部)
殷咏梅(江苏省人民医院肿瘤内科)
曾晓华(重庆市肿瘤医院乳腺肿瘤中心)
张钢龄(内蒙古包头肿瘤医院乳腺外科)
张宏伟(复旦大学附属中山医院乳腺外科)
张健(中国医学科学院阜外医院心力衰竭中心)
张瑾(天津医科大学肿瘤医院乳腺外科)
张莉莉(江苏省肿瘤医院肿瘤内科)
张频(国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院北京协和医学院肿瘤医院内科)
张清媛(哈尔滨医科大学附属肿瘤医院肿瘤内科)
张宇辉(中国医学科学院阜外医院心力衰竭中心)
郑跃(Dana-Farber Cancer Institute Harvard University Statistician)
朱丽(上海交通大学医学院附属瑞金医院乳腺疾病诊疗中心)
朱铁楠(中国医学科学院北京协和医学院北京协和医院血液内科)
免责声明本文仅供专业人士参看,文中内容仅代表中华肿瘤杂志立场与观点,不代表肿瘤资讯平台意见,且肿瘤资讯并不承担任何连带责任。若有任何侵权问题,请联系删除。
排版编辑:肿瘤资讯-Kate











 苏公网安备32059002004080号
苏公网安备32059002004080号


