
复发难治性DLBCL(R/R DLBCL)
后线治疗缺少标准治疗
临床上大约73%的R/R DLBCL患者接受二线或后线治疗后依然无法获得缓解,这部分二线治疗失败或接受造血干细胞移植(ASCT)后复发的患者预后极差,中位生存期在一年左右1。R/R DLBCL患者三线及后线治疗方案五花八门,但没有一个公认的标准治疗方案。2022年EHA大会公布了一项基于美国Flaitron登记数据库十年随访数据(2011~2021)的真实世界研究结果显示2,R/R DLBCL患者三线治疗方案异质性非常高(如图1所示),针对这部分患者尚未确立公认的标准治疗方案。近一步寻求有效延长R/R DLBCL患者总生存期的新型药物仍然是临床所亟需的。

图1.二线接受移植(A)和未接受移植(B)
R/R DLBCL患者三线治疗模式概览
CAR-T时代下R/R DLBCL后线治疗迎来新格局
最近,FDA基于ZUMA-73和TRANSFORM4两个研究的结果批准axi-cel和liso-cel的二线DLBCL治疗适应症,标志CAR-T细胞治疗开始从DLBCL三线前移至二线5。随着二线治疗格局的改变,DLBCL三线治疗格局将会开始转变,三线R/R DLBCL患者未来可能会分为“适合CAR-T治疗”、“不适合CAR-T治疗”以及“CAR-T治疗失败”三种情形,针对上述三种不同情况,我们结合2022 ASCO与EHA会议的最新进展谈谈关于DLBCL三线及后续治疗方案。
群雄逐鹿,谁执牛耳?
不适合CAR-T治疗人群治疗方案新进展
由于价格高昂,即便在CAR-T细胞产品已经上市4年以及商保支付环境相对完善的美国,也只有17.2%的三线DLBCL患者能够接受到CAR-T治疗6。除了经济原因之外,还有部分患者由于前期经过多轮治疗后导致体内T细胞数量较少或T细胞状态较差,最终导致CAR-T细胞制备失败,从而无法接受CAR-T治疗7。最近,抗体药物偶联物(ADC)、单克隆抗体、双特异性抗体、细胞内通路抑制剂等新药不断涌现,为那些不能接受CAR-T治疗的R/R DLBCL患者提供了新的治疗选择8。
表1. FDA获批的4种新药方案在R/R DLBCL三线治疗人群中的
主要结果
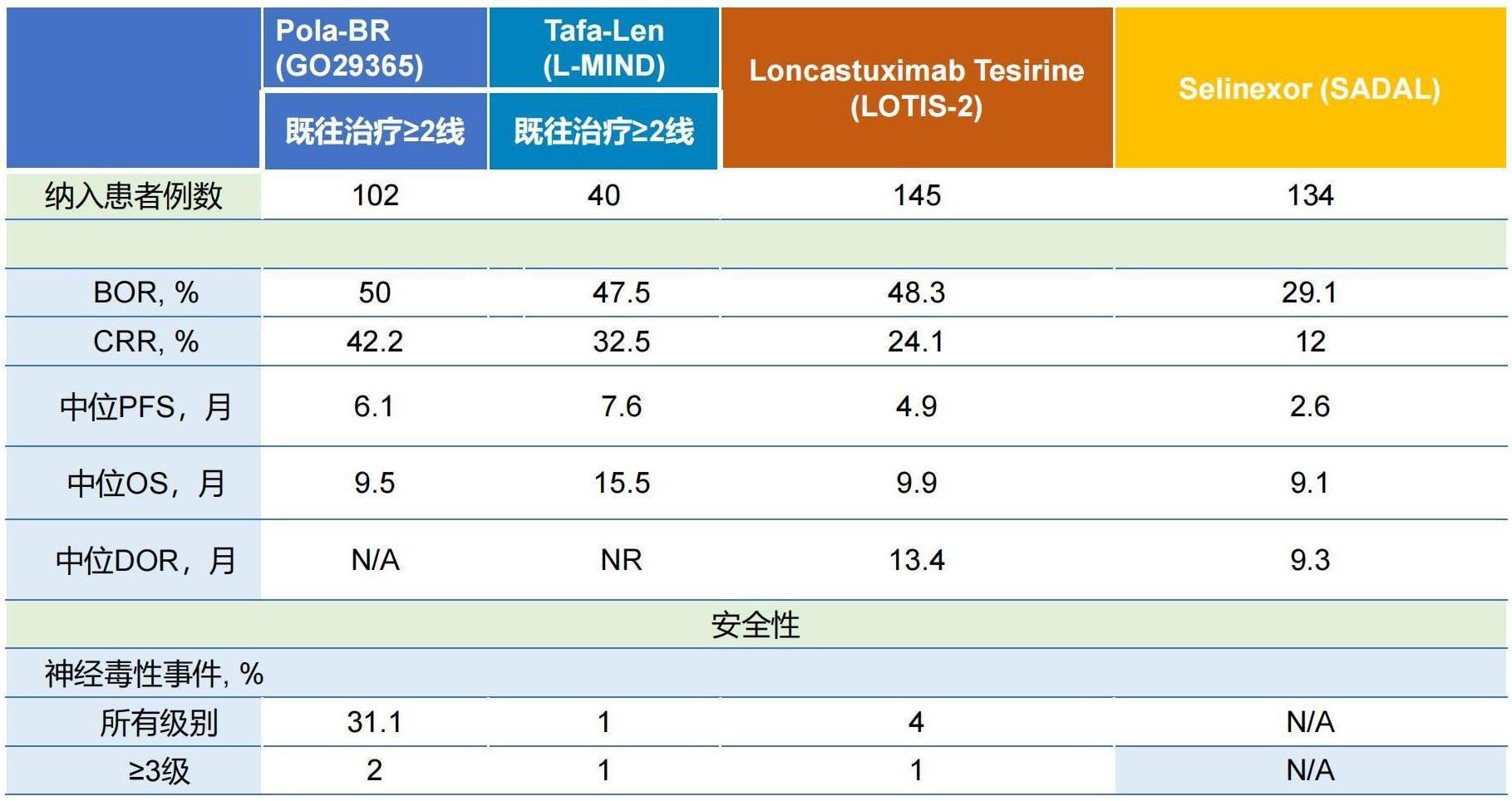
目前除了CAR-T之外,FDA批准了4种新药方案用于三线治疗R/R DLBCL人群(如表1所示)1,其中LOTIS-2研究的样本量是最大的9。作为全球首个获批且唯一一个靶向CD19 的ADC药物,在LOTIS-2研究中,Loncastuximab tesirine(Lonca)单药治疗R/R DLBCL取得了ORR 48%,CRR 24%的优异疗效9,Lonca单药疗效堪比Pola-BR三药方案10和Tafa-Len两药方案11,同时比Selinexor疗效更优12。而从安全性角度来看,四种方案的主要常见不良反应为血液学毒性,其中Lonca单药的整体安全性更具有优势。而Pola-BR方案在应用时需要更加关注患者神经毒性与眼毒性等不良反应10。
除了Pola和Lonca两个ADC药物之外,今年ASCO大会公布了CD30 ADC维布妥昔单抗(BV)联合利妥昔单抗与来那度胺(BV+R2)对比R2方案治疗之前接受过≥2次系统治疗且不适合移植与CAR-T治疗的R/RDLBCL患者的3期随机对照研究——ECHELON-3研究的安全性导入期数据分析13:共入组10例R/R DLBCL患者。中位随访6.9个月,患者整体ORR为70%,CRR为50%,中位DoR为5.6个月。100%的患者出现≥ 1次治疗相关不良事件, 8例患者由于不良事件导致药物剂量调整,原因包括贫血、中性粒细胞减少、外周神经病变和肺炎。从ECHELON-3目前公布的安全性数据来看,7例患者因为血液学毒性、神经系统毒性等进行了药物剂量调整,后续研究的药物剂量还需要进一步摸索。另外,ECHELON-3研究中BV+R2方案治疗持续到患者疾病进展或由于毒性不可耐受,并不是一个固定疗程方案,所以对于患者长期治疗产生的不良反应需要进一步研究。同时,由于ECHELON-3研究纳入的是之前接受过≥2次系统治疗的后线患者,随着Pola在临床应用的普及,二线不可移植患者应用Pola联合方案的比例会逐步增加,而Pola和BV都是携带MMAE载荷的ADC药物,非常期待后续ECHELON-3研究中可以分析针对Pola方案失败的患者,使用BV+R2方案进行挽救的疗效与安全性,现阶段ECHELON-3研究已进入随机对照研究阶段,非常期待后续研究结果的披露。
除了ADC药物之外,今年ASCO和EHA大会上也公布了两个CD20xCD3双特异性抗体Glofitamab和Epcoritamab单药治疗R/R DLBCL的扩展队列数据。
NP30179研究14是一项正在进行的I/II期临床研究(NCT03075696)评估了奥妥珠单抗预处理联合Glofitamab治疗CD20阳性的R/R DLBCL成人患者的疗效与安全性。今年ASCO大会公布了II期扩展队列的研究数据(如图2所示),该研究共入组患者154例,其中大部分为多线治疗后高度难治性患者,中位治疗线数为3,59.7%的患者既往治疗≥3线。中位随访12.6个月, 研究达到主要终点, ORR为 51.6% ,CR率为39.4%。中位PFS 4.9个月,中位OS 11.5个月。Glofitamab治疗相关3-4级AE发生率41.6%,无治疗相关5级AE发生。最常见的AE是CRS(63.0%),但主要为1级(47.4%)或2级(11.7%),3级和4级CRS仅分别为2.6%、1.3%,无5级CRS发生,且大部分CRS事件发生在治疗的第一个周期。免疫效应细胞相关神经毒性综合征(ICANS)发生率低(7.8%),≥3级仅2.6%。

图2. NP30179研究设计与主要结果示意图
NP30179研究与ECHELON-3研究不同之处在于患者接受Glofitamab单药治疗12个周期,为固定疗程的方案,患者中位DoR为18.4个月,而CR患者中位DoR仍未达到,期待后续长期随访的数据。在亚组分析中,研究者发现11例HGBCL亚组中,没有一位患者达到CR,对比LOTIS-2研究中15,同样纳入了11例HGBCL患者,其中有5例患者达到CR,CRR达到45.5%(如图3所示)。期待后续对HGBCL亚组进行更深入的基础研究,揭示HGBCL对于Glofitamab反应不佳的分子机制。另一方面,研究者也关注到整体人群1年PFS率为37%,说明仍有超过60%患者在治疗后1年内疾病进展或死亡,提示单药治疗仍然具有一定局限性。

图3. LOTIS-2研究中HGBCL与DLBCL人群的疗效结果
EPCORE NHL-1研究是一项1/2期首个人体(first-in-human,FIH)剂量递增和队列扩展临床试验(NCT03625037)16,初步评估了Epcoritamab治疗的安全性和抗肿瘤活性。2022年EHA大会上公布了2期DLBCL扩展队列的数据。研究共纳入157例 R/RDLBCL患者,患者既往治疗中位线数为3线。中位随访10.7个月,ORR为63%,CRR为39%,中位DoR为12个月,中位PFS为4.4个月,中位OS仍未达到。常见的治疗相关不良事件为CRS(49.7%,≥3级 2.5%)、发热(23.6%)、疲乏(22.9%)、中性粒细胞减少(21.7%)和腹泻(20.4%)。6.4%患者发生ICANS,其中1例患者由于神经毒性而死亡。
EPCORE NHL-1研究与NP30179研究两个研究纳入患者临床特征比较相近,两个研究在ORR(63% vs 51.6%)、CRR(39% vs 39.4%)和1年OS率(56.9% vs 49.8%)上数值都比较接近,进一步明确了双特异性抗体在R/R DLBCL三线治疗中的临床价值。当然我们也可以注意到,EPCORE NHL-1研究与NP30179研究在设计上的不同之处在于Epcoritamab单药治疗直至疾病进展,而Glofitamab采用固定疗程,两项研究疗效相似提示固定疗程是否就能够给患者带来足够的获益呢?让我们期待这两个研究的后续数据的更新。
Epcoritamab和Glofitamab都采用阶梯剂量递增静给药方式来缓解CRS,只不过Glofitamab另外添加了奥妥珠单抗预处理来缓解CRS,即便有双重举措,Glofitamab的CRS发生比例仍然较高。与CAR-T细胞治疗相比,虽然双特异性抗体的CRS与ICANS严重程度显著降低,但是整体CRS发生比例仍然不低,提示在临床使用中仍然需密切关注CRS的预防和管理。
双特异性抗体作为一种即用型(off-the-shelf)疗法,患者无需等待即可治疗,可以作为无法行CAR-T治疗患者的选择之一,现阶段这两个研究随访时间尚短,期待后续长期随访结果来评估双特异性抗体与CAR-T治疗在长期生存获益上的差异。另外,虽然Glofitamab或Epcoritamab单药治疗的ORR与CR都可与Pola-BR与Tafa-Len等联合方案媲美,但是我们也应该注意到Glofitamab或Epcoritamab单药治疗1年内有接近50%患者死亡,提示还有很大的提升空间,后续联合治疗方案是一大趋势,比如ADC药物与双特异性抗体的联合。
百尺竿头,如何更进一步?
适合CAR-T治疗人群治疗方案新进展
从表2数据可以看到不同CAR-T细胞产品治疗三线R/R DLBCL患者中的ORR和CRR数据都优于既往传统治疗方案,但是如果我们聚焦PFS数据就会发现CAR-T治疗后仍然有大约60%的患者会在两年内复发或死亡1,表明现阶段CAR-T治疗策略仍有很大改进空间。
表2:目前DLBCL领域国内外上市的CAR-T产品研究数据

前期临床前研究证实利妥昔单抗协同增强CAR-T细胞的肿瘤杀伤效果,继而研究者开展了ZUMA-14研究并在今年ASCO大会上公布了初步结果17,该研究探索了Axi-cel联合利妥昔单抗治疗26例R/R DLBCL患者,结果显示ORR为88%,CRR为73%,中位PFS为18.6个月,中位OS未达到。 92%患者发生≥3级不良事件,主要为血液学毒性,96%患者发生CRS,均为1-2级;62%患者发生神经毒性,其中15%为3级AE。ZUMA-14研究数据显示Axi-cel+R联合方案的疗效超过Axi-cel单药(ZUMA-1),而≥3级CRS与ICANS发生比例也比ZUMA-1研究低,提示CAR-T联合CD20单抗可能是后续极具开发潜力的联合方案。当然,我们也需注意到ZUMA-14研究中有19%患者之前仅接受1次系统性治疗(ZUMA-1中为3%),只有8%患者之前接受ASCT后复发(ZUMA-1中为21%),提示疗效与安全性的差异可能来自于两个研究人群和样本量的不同。CAR-T联合CD20单抗提供了一个很好的联合治疗思路,后续可以尝试CAR-T联合二代CD20单抗(奥妥珠单抗)或者CD20xCD3双特异性抗体。
虽然CAR-T细胞的疗效获得广泛认可,但是CAR-T治疗后复发率高、等待时间长、价格高昂、CAR-T特异性不良反应(比如CRS、神经毒性、长期血细胞减少)等因素还是限制了其进一步的临床应用18。未来随着CAR-T联合方案及多靶点CAR-T细胞产品的逐渐成熟,CAR-T治疗的长期疗效将获得进一步提升;而Fast-CAR技术与“通用型”CAR-T技术的成熟则能有效缩短患者等待时间,降低CAR-T治疗成本19。另外,随着CAR-NK细胞、CAR-巨噬细胞等新一代细胞治疗产品成熟后,细胞治疗的安全性也会得到改善20,我们期待DLBCL后续治疗中更多CAR-T和细胞治疗临床研究的更新。
山重水复、柳暗花明,
CAR-T治疗失败人群治疗方案新进展
CAR-T细胞治疗的短期疗效较为优异,但是约40%~50%患者在2年内复发(如表2所示),而随着CAR-T细胞疗法进军二线,未来三线治疗中CAR-T治疗失败的患者数量会越来越多,而现阶段CAR-T治疗失败的患者的治疗选择非常有限7。
在已获批的治疗方案中,Pola-BR、Tafa-Len和Selinexor的研究中都未纳入CAR-T治疗失败的患者,只有LOTIS-2研究中纳入了这部分临床上治疗较为“棘手”的患者。LOTIS-2研究中纳入了13例既往接受过CD19 CAR-T治疗的患者进行的事后分析显示(如图4所示)21, CAR-T治疗结束至接受Lonca治疗的中位间隔时间为7个月,这些患者的ORR达到 46.2%,CR为15.4%,PR为30.8%。中位随访8个月后,mOS为8.2个月,中位缓解持续时间为8个月。该数据表明LOTIS-2研究中,既往接受过CD19 CAR-T治疗的患者的反应率与入组的整体人群基本无差异,提示针对既往接受过CD19 CAR-T治疗的患者Lonca仍具备一定的治疗潜力。

图4. Lonca单药治疗CAR-T治疗失败患者的客观缓解率
虽然Pola在注册研究中未纳入CAR-T治疗失败患者,但是一项回顾性研究22分析了57例CAR-T治疗失败患者接受Pola联合方案的疗效,经过中位47周的随访,ORR为44%,CRR为14%,中位DoR为11周,中位OS为17周。
在今年ASCO和EHA大会上也有多项研究报道了新药方案治疗CAR-T治疗失败患者的初步疗效:
首先,之前我们提到ECHELON-3研究13中纳入10例患者接受BV+R2方案治疗,10例患者中有6例之前接受过CAR-T治疗,这6例CAR-T治疗失败患者接受BV+R2治疗后,最终2例获得CR,2例获得PR,而且这4例达到ORR的CAR-T治疗失败患者中只有1例肿瘤标本检测结果是CD30阳性,提示BV+R2联合方案能够帮助CAR-T治疗患者有效缩瘤,且不依赖于CD30的表达,期待后续长期随访结果,确认BV+R2方案治疗CAR-T失败患者的长期疗效与DoR。
除了ADC药物之外,双特异性抗体也在积极探索在CAR-T治疗失败患者中的治疗效果。NP30179研究14中纳入了51例(33%)之前接受过CAR-T治疗的患者,最终亚组分析显示之前接受过CAR-T治疗组与未接受过CAR-T治疗组的CRR分别为35%和42%;而在EPCORE NHL-1研究16中纳入了61例(38.9%)之前接受过CAR-T治疗的患者,最终亚组分析显示之前接受过CAR-T治疗组与未接受过CAR-T治疗组的CRR分别为34%和42%;另外,ELM-1研究23为一项评估CD20xCD3双特异性抗体Odronexmab单药治疗复发难治性B细胞淋巴瘤的1期单臂临床试验,该研究分析了33例之前接受过CAR-T治疗以及49例未接受过CAR-T治疗的R/R DLBCL患者,最终亚组分析结果显示两组的CRR均为24%;以上这三项双特异性抗体研究都提示对于CAR-T治疗失败患者接受双抗治疗能够有大约1/3患者能够获得完全缓解,后续需长期随访以明确CRR能否转化为最终的生存获益。
虽然双特异性抗体单药治疗能够让部分CAR-T治疗患者获得缓解,但是单药治疗疗效有限,所以研究者陆续探索双抗的联合治疗策略。GO40516研究24是一项评估CD20xCD3双特异性抗体Mosunetuzumab(Mosun)联合Pola(M-Pola)治疗复发难治性B细胞淋巴瘤的1b/2期单臂临床试验,研究纳入了60例R/R DLBCL患者,其中24例之前接受过CAR-T治疗,最终M-Pola联合方案治疗之前接受过CAR-T治疗患者及整体R/R DLBCL患者的CRR分别为41.7%和48.3%,相比Mosun单药疗效有显著提升,但是联合治疗也相应增加了不良反应,包括疲乏、外周神经病变、腹泻与恶心,3-4级不良反应主要以中性粒细胞减少和疲乏为主,值得注意的是研究中出现一例Mosun相关的死亡(肺炎)。
除了ADC药物和双特异性抗体之外,细胞治疗依然是CAR-T治疗失败后重要选择之一,关键在于选择什么样的细胞治疗产品?今年ASCO大会上的一项研究给我们带来了一些新的启示。GLEAN-1研究(NCT04735471)25是一项评估同种异体CAR-γδ T细胞产品ADI-001治疗R/R B-NHL患者的首次人体(FIH)1期临床试验。之前我们常说的 CAR-T 细胞其实是改造的人体内αβ T细胞,占 T 细胞群体的65%~70%。而γδ T细胞是 T细胞的一个亚群,占所有 T 淋巴细胞的0.5%~5%,与传统的 αβ T 细胞不同,γδ T 细胞能识别其目标抗原而不受 MHC 与限制,并介导抗肿瘤反应,而不会引起移植物抗宿主病(GvHD)(如图5所示),是“通用型”细胞治疗产品理想的细胞来源之一。ADI-001可通过anti-CD20 CAR元件和γδ T细胞内源性细胞毒性受体靶向恶性B细胞。这项I期研究目前入组了8例患者,包括7例R/R DLBCL和1例套细胞淋巴瘤患者,其中3例DLBCL患者之前接受过CAR-T治疗,令人欣喜的是,这3例CAR-T治疗失败患者接受ADI-001研究治疗后均获得了完全缓解,8例患者没有出现3级以上CRS、ICANS和GvHD,提示ADI-001的耐受性较好。

图5. CAR-γδ T细胞杀伤肿瘤机制示意图
点评专家简介
南昌大学第一附属医院血液病诊治中心主任、淋巴肿瘤中心主任
美国血液学会会员
江西省医学会血液学分会候任主委
中华血液学杂志通讯编委
中华医学会血液学分会淋巴疾病学组委员
中国CSCO抗淋巴瘤联盟委员
中国抗癌协会血液肿瘤专委会委员
中国慢淋专家组委员
中国整合医学会血液学分会委员
中国噬血细胞综合征联盟专家组委员
中国医药教育协会造血干细胞移植和免疫治疗分会常委
中国现有的临床实践中,针对R/R DLBCL患者的三线治疗选择非常有限,主流还是常规免疫化疗方案,但是这些方案对已经多次治疗或移植后复发患者的疗效非常有限。2022年CAR-T细胞治疗不仅改变了R/R DLBCL二线治疗格局,更是重塑了三线治疗格局。三线治疗由此逐渐进入“精细化”治疗时代,医生将根据患者在二线是否接受过CAR-T以及患者疾病情况制定相应的治疗策略:
1)不适合CAR-T治疗的患者:对于这部分患者目前可选择的新药方案五花八门,ADC药物、单克隆抗体、XPO1抑制剂已经获批,多个双特异性抗体的早期数据也已披露,但选择性药物过多也给临床医生带来新的挑战,医生需结合患者疾病特征与各个新药的研究数据来进行治疗决策的制定,比如对于HGBCL患者三线治疗, Lonca是一个不错的治疗选择。另外,不同新药之间的联合方案也是后续研究热点;
2)针对可接受CAR-T细胞治疗的患者:未来医生将根据一些预测模型评估患者接受CAR-T治疗的预后,预后较好的患者可直接接受CAR-T细胞治疗,而那些CAR-T治疗后容易发生早期复发的患者则应该采用CAR-T联合方案,降低复发率,或采用双靶点CAR-T细胞等下一代CAR-T细胞产品,进一步改善患者的疗效与预后;
3)CAR-T治疗失败的患者:现阶段针对CAR-T治疗失败患者的治疗方案探索还处于“萌芽”阶段,虽然ADC药物和双特异性抗体在这一特殊人群中积累了一些早期数据,但是我们在谈论CAR-T治疗失败后的治疗选择之前,还是需要首先深入研究CAR-T治疗失败的原因,根据不同的情况对患者“对症下药”。CAR-T治疗失败的原因主要有CD19抗原丢失、CAR-T细胞功能异常,包括无法在体内有效扩增以及T细胞出现耗竭表型、免疫抑制性肿瘤微环境抑制CAR-T细胞浸润肿瘤组织或抑制CAR-T细胞肿瘤杀伤功能。针对抗原丢失的情况,更换靶点是常用策略之一,可使用不同靶点的ADC、双特异性抗体与细胞治疗产品。但是如果是由于CAR-T细胞功能异常或体内肿瘤微环境导致CAR-T治疗失败,那就提示可能患者体内免疫系统状态较差,自体细胞来源制备的CAR-T功能较差或者CAR-T无法浸润肿瘤或无法在肿瘤微环境中生存或行使功能,这种情况下,自体细胞来源制备的CAR-T或双特异性抗体就不是理想的后线治疗方案,而ADC药物、供体来源或通用型CAR-T或者异基因造血干细胞移植联合供体来源或通用型CAR-T可能更为有效。期待后续更多的研究结果能够帮助临床医生更好的了解CAR-T失败患者的临床特征,从而制定出更加精准化、个体化的后线治疗方案。
1. Matasar MJ. Diffuse Large B-Cell Lymphoma: Optimizing Therapy for Relapsed/Refractory Disease. J Natl Compr Canc Netw 2021;19(11.5):1327–30.
2. Matthew Lunning. TREATMENT PATTERNS AND REAL-WORLD OUTCOMES IN PATIENTS (PT) WITH LARGE B-CELL LYMPHOMA (LBCL) WHO RECEIVED SECOND-LINE (2L) THERAPY. 2022 EHA :P1204.
3. Locke FL, Miklos DB, Jacobson CA, et al. Axicabtagene ciloleucel as second-line therapy for large B-cell lymphoma. N Engl J Med 2022;386(7):640–54.
4. Kamdar M, Solomon SR, Arnason JE, et al. Lisocabtagene Maraleucel (liso-cel), a CD19-directed chimeric antigen receptor (CAR) T cell therapy, versus standard of care (SOC) with salvage chemotherapy (CT) followed by autologous stem cell transplantation (ASCT) as second-line (2L) treatment in patients (Pts) with relapsed or refractory (R/R) large B-cell lymphoma (LBCL): results from the randomized phase 3 transform study. Blood 2021;138:91.
5. Westin J, Sehn LH. CAR T cells as a second-line therapy for large B-cell lymphoma: a paradigm shift? Blood J Am Soc Hematol 2022;139(18):2737–46.
6. Xie J, Wu A, Liao L, et al. Characteristics and treatment patterns of relapsed/refractory diffuse large B-cell lymphoma in patients receiving≥ 3 therapy lines in post-CAR-T era. Curr Med Res Opin 2021;37(10):1789–98.
7. Strati P, Neelapu SS. CAR-T failure: beyond antigen loss and T cells. Blood J Am Soc Hematol 2021;137(19):2567–8.
8. Sehn LH, Salles G. Diffuse large B-cell lymphoma. N Engl J Med 2021;384(9):842–58.
9. Caimi PF, Ai W, Alderuccio JP, et al. Loncastuximab tesirine in relapsed or refractory diffuse large B-cell lymphoma (LOTIS-2): a multicentre, open-label, single-arm, phase 2 trial. Lancet Oncol 2021;22(6):790–800.
10. Sehn LH, Hertzberg M, Opat S, et al. Polatuzumab vedotin plus bendamustine and rituximab in relapsed/refractory DLBCL: survival update and new extension cohort data. Blood Adv 2022;6(2):533–43.
11. Duell J, Maddocks KJ, González-Barca E, et al. Long-term outcomes from the phase II L-MIND study of tafasitamab (MOR208) plus lenalidomide in patients with relapsed or refractory diffuse large B-cell lymphoma. haematologica 2021;106(9):2417.
12. Maerevoet M, Zijlstra JM, Follows G, et al. Survival among patients with relapsed/refractory diffuse large B cell lymphoma treated with single-agent selinexor in the SADAL study. J Hematol OncolJ Hematol Oncol 2021;14(1):1–4.
13. Bartlett NL, Yasenchak CA, Ashraf KK, et al. Brentuximab vedotin in combination with lenalidomide and rituximab in patients with relapsed/refractory diffuse large B-cell lymphoma: Safety and efficacy results from the safety run-in period of the phase 3 ECHELON-3 study. 2022;
14. Dickinson M, Carlo-Stella C, Morschhauser F, et al. Glofitamab in patients with relapsed/refractory (R/R) diffuse large B-cell lymphoma (DLBCL) and≥ 2 prior therapies: Pivotal phase II expansion results. 2022;
15. Alderuccio JP, Ai WZ, Radford J, et al. Clinical Characteristics and Responses of Patients with Relapsed or Refractory High-Grade B-Cell Lymphoma Treated with Loncastuximab Tesirine in the Lotis-2 Clinical Trial. Blood 2021;138:3575.
16. Catherine Thieblemont. PRIMARY RESULTS OF SUBCUTANEOUS EPCORITAMAB DOSE EXPANSION IN PATIENTS WITH RELAPSED OR REFRACTORY LARGE B-CELL LYMPHOMA: A PHASE 2 STUDY. 2022 EHA :LB2364.
17. Strati P, Leslie LA, Shiraz P, et al. Axicabtagene ciloleucel (axi-cel) in combination with rituximab (Rtx) for the treatment (Tx) of refractory large B-cell lymphoma (R-LBCL): Outcomes of the phase 2 ZUMA-14 study. 2022;
18. Iqbal M, Savani BN, Hamadani M. New indications and platforms for CAR‐T therapy in lymphomas beyond DLBCL. EJHaem 2022;3:11–23.
19. Young RM, Engel NW, Uslu U, Wellhausen N, June CH. Next-Generation CAR T-cell Therapies. Cancer Discov 2022;OF1–14.
20. Al-Juhaishi T, Ahmed S. CAR-T in B-Cell Lymphomas: The Past, Present, and Future. Clin Lymphoma Myeloma Leuk 2022;22(4):e261–8.
21. Caimi PF, Ardeshna KM, Reid E, et al. The AntiCD19 Antibody Drug Immunoconjugate Loncastuximab Achieves Responses in DLBCL Relapsing After AntiCD19 CAR-T Cell Therapy. Clin Lymphoma Myeloma Leuk 2022;22(5):e335–9.
22. Gouni S, Rosenthal AC, Crombie JL, et al. A multicenter retrospective study of polatuzumab vedotin in patients with large B-cell lymphoma after CAR T-cell therapy. Blood Adv 2022;6(9):2757–62.
23. Bannerji R, Arnason JE, Advani RH, et al. Odronextamab, a human CD20× CD3 bispecific antibody in patients with CD20-positive B-cell malignancies (ELM-1): results from the relapsed or refractory non-Hodgkin lymphoma cohort in a single-arm, multicentre, phase 1 trial. Lancet Haematol 2022;9(5):e327–39.
24. Budde LE, Ghosh N, Chavez JC, et al. Promising tolerability and efficacy results from dose-escalation in an ongoing phase Ib/II study of mosunetuzumab (M) with polatuzumab vedotin (Pola) in patients (pts) with relapsed/refractory (R/R) B-cell non-Hodgkin’s lymphoma (B-NHL). 2021;
25. Neelapu SS, Hamadani M, Miklos DB, et al. A phase 1 study of ADI-001: Anti-CD20 CAR-engineered allogeneic gamma delta (γδ) T cells in adults with B-cell malignancies. 2022;
点击下方链接查看往期文章精选
【POST ASCO/EHA】“淋”光一线,从2022 ASCO/EHA进展看DLBCL一线治疗未来新方向
【POST ASCO/EHA】“植”上谈兵,从2022 ASCO/EHA进展看DLBCL二线移植未来新方向
【POST ASCO/EHA】不“植”可否?从2022 ASCO/EHA进展看DLBCL二线不可移植人群未来治疗新趋势
排版编辑:肿瘤资讯-Phoebe











 苏公网安备32059002004080号
苏公网安备32059002004080号


