受全球COVID-19疫情影响,美国癌症研究协会(AACR)今年决定不举办线下年会,改为两次AACR在线年会。美国东部时间2020年4月27日上午9点,AACR在线年会Ⅰ正式拉开帷幕。在4月27日的“新药在望”(New Drugs on the Horizon)专题讨论会上(Part 1),有3项最新研究结果公布,【肿瘤资讯】特做整理。
首创新药(first-in-class)Menin-MLL1抑制剂用于MLL-r和NPM1突变型白血病的治疗
演讲者:Jerry McGeehan,Syndax Pharmaceuticals Inc
MLL基因重排型白血病(MLL-r)由MLL1基因座易位产生致癌性MLL融合蛋白导致,NPM1突变型急性髓系白血病(NPM1c+ AML)由NPM1基因突变引起。基于Menin-MLL作用的具体机制,Menin抑制剂在Menin蛋白中MLL1结合域的“占位”可引起MLLr/NPM1c中白血病转录程序的丢失,从而导致细胞的终末分化。而通过介导染色质去除Menin,Menin抑制剂能引起转录程序的显著改变。
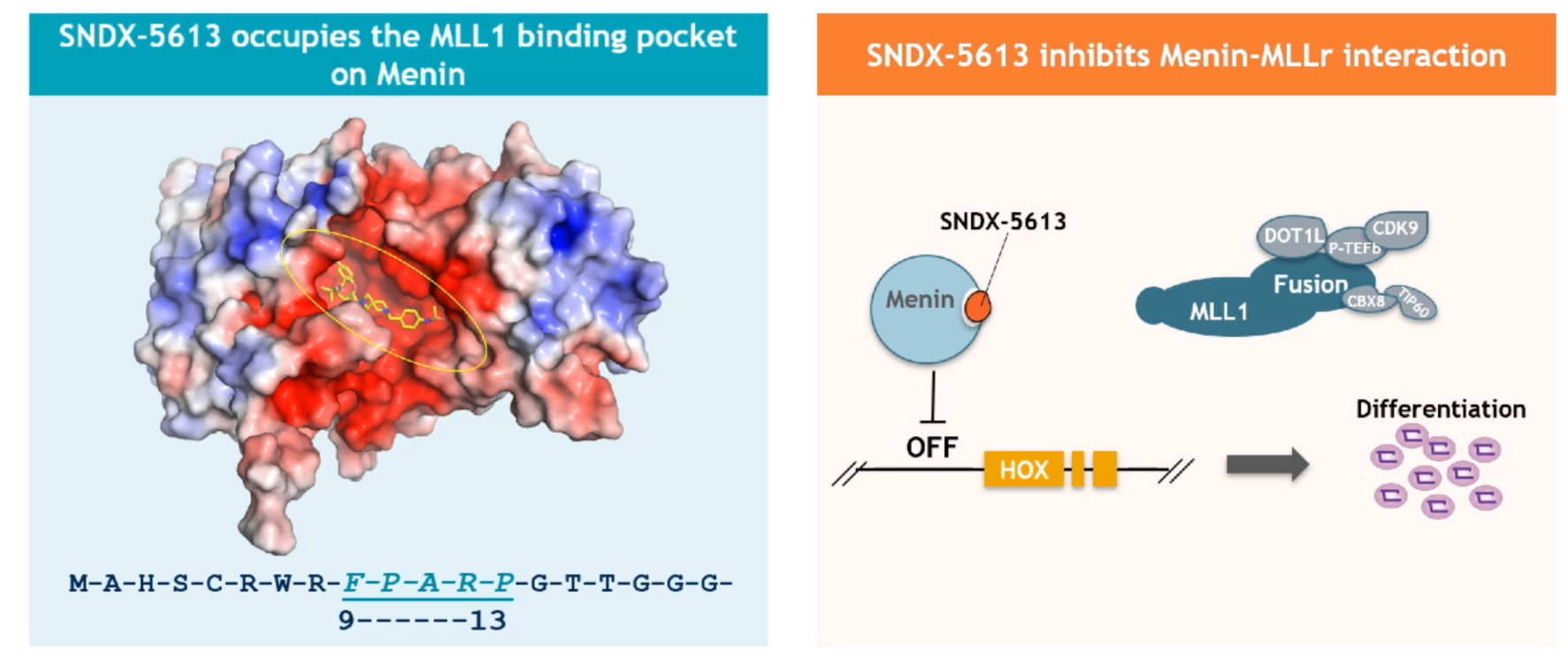
图:Menin蛋白MLL结合域及相关机制
在MLL-r肿瘤小鼠模型中,Menin抑制剂具有显著的单药活性,且能够产生显著和持续的治疗效果。基于SNDX-5613的药理学特征,该药能够在Menin-MLL抑制中发挥高度强效和特异性的作用。进一步的研究证实,SNDX-5613能够显著改善播散型肿瘤小鼠模型(MOLM-13)的生存获益并且对白血病取得良好的控制效果。稳态血药浓度的药代动力学分析表明MOLM-13小鼠模型中白血病控制所需要的药物暴露剂量。基于此,研究人员对临床试验所需要的药物剂量强度进行了探索。
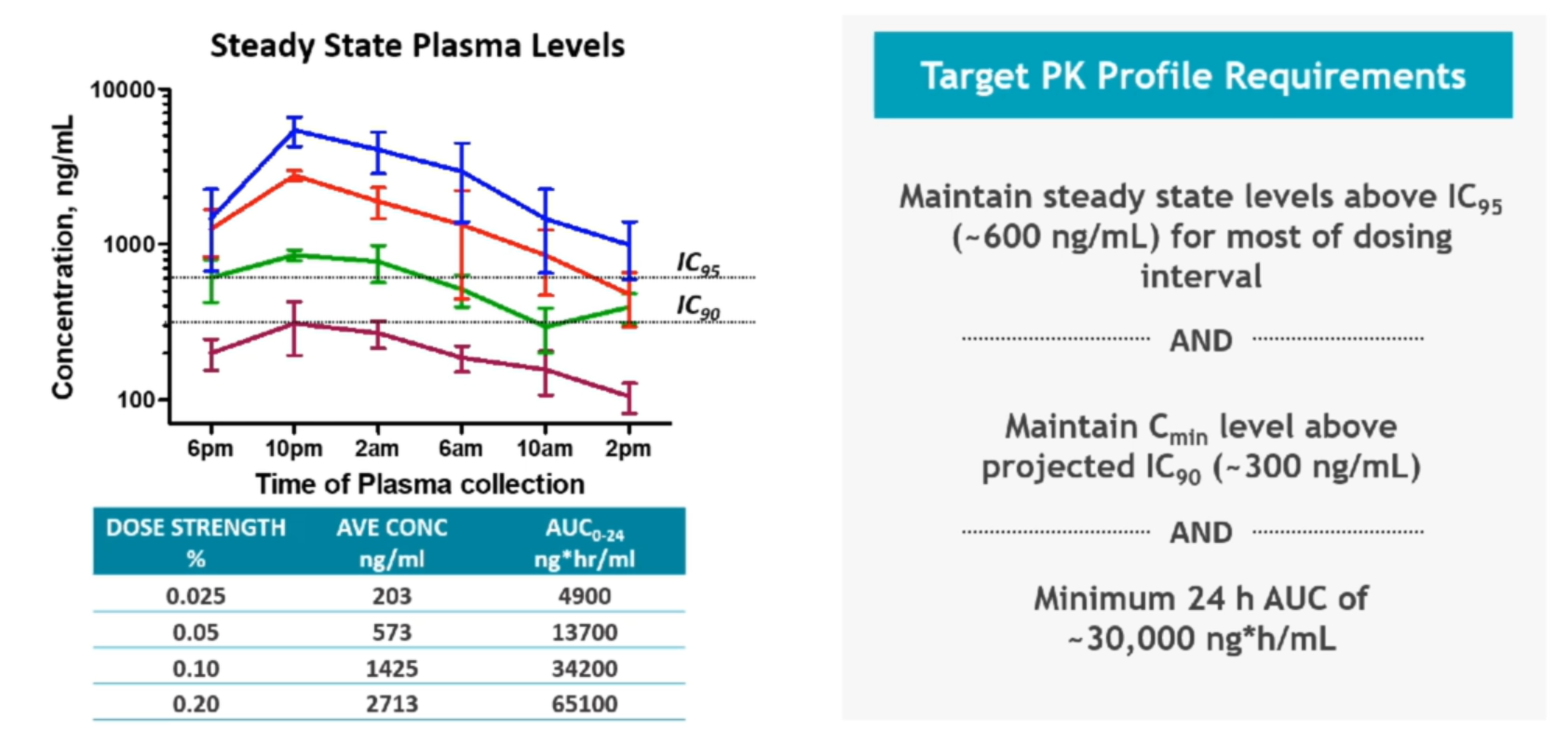
图:SNDX-5613药物暴露剂量研究
在1/2期AUGMENT-101研究中,研究人员在急性白血病中对SNDX-5613的安全性和疗效进行了初步分析。剂量递增阶段,第1例患者采用的给药方案为113mg PO q12h,第28天疗效评价为PD;第2例为226mg PO q12h,第28天疗效评价为CR伴不完全血液学恢复(CRi)。
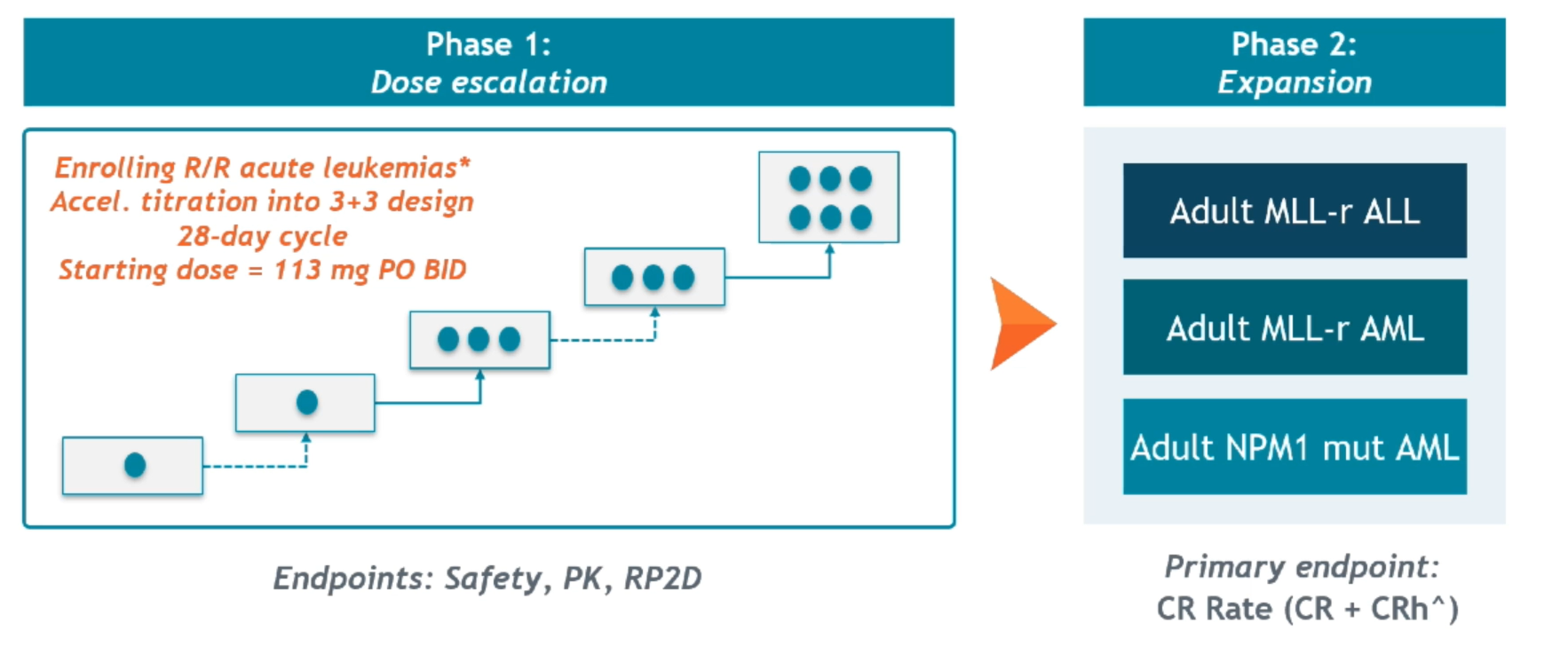
图:AUGMENT-101研究设计
截至目前为止,所纳入患者的疗效总结如下:
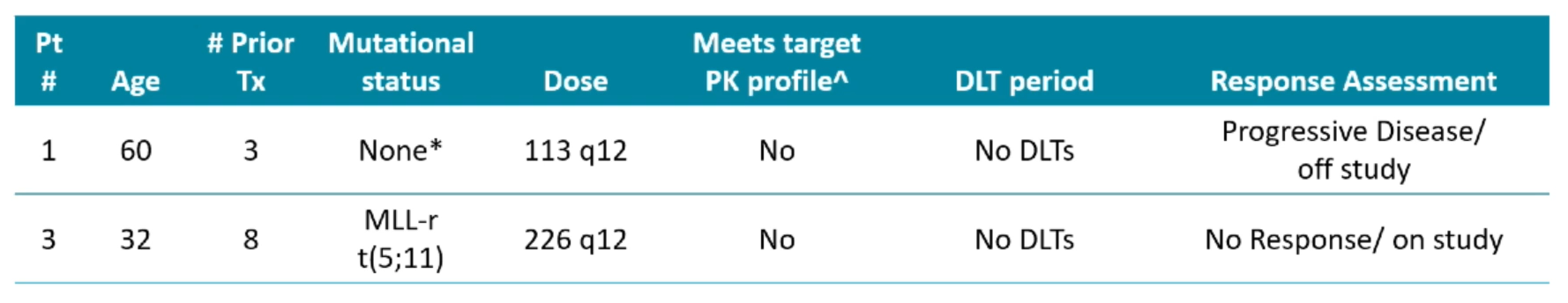
图:未结合CYP3A4抑制剂患者疗效
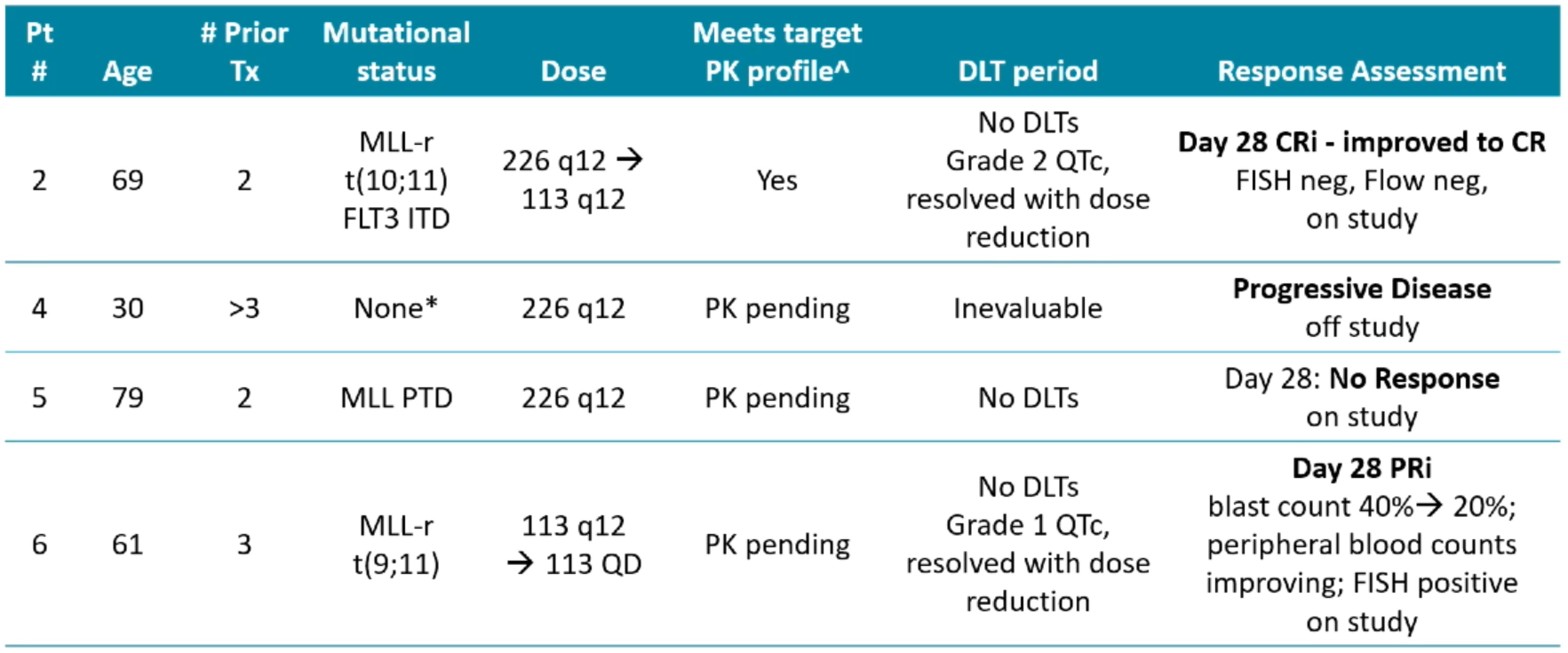
图:结合CYP3A4抑制剂患者疗效
总结:基于Menin-MLL相互作用的抑制剂SNDX-5613在MLL-r以及NMP1突变型AML中表现出全新的靶向治疗作用。作为强效、选择性的Menin-MLL1口服抑制剂,SNDX-5613在多种临床前肿瘤模型中表现出可观的单药活性,其药代动力学特征收到CYP3A4抑制剂的合并使用的影响。根据当前临床试验的结果,针对Menin-MLL1的结合抑制可作为经选急性白血病患者的治疗靶点。目前针对SNDX-5613的探索性临床试验正在持续的开展中。
BAY 2416964:作为新型抗肿瘤免疫疗法进入临床Ⅰ期研究的首个芳香烃受体(AhR)抑制剂
演讲者:Ilona Gutcher,德国拜耳(Bayer AG)
芳香烃受体(AhR)可根据来自饮食、人体微生物以及色氨酸代谢的综合信号对人体起到免疫调节作用,不仅如此,在肿瘤微环境中,AhR也能对免疫抑制的调节起到关键作用。在涉及肺、脑、肝脏、卵巢以及头颈部等的多种类型的肿瘤中,都能够观察到AhR的表达水平升高。在浸润性免疫细胞以及头颈部鳞状细胞癌(HNSCC)、非小细胞肺癌(NSCLC)以及结直肠癌(CRC)中,IHC证实AhR存在强表达的现象。
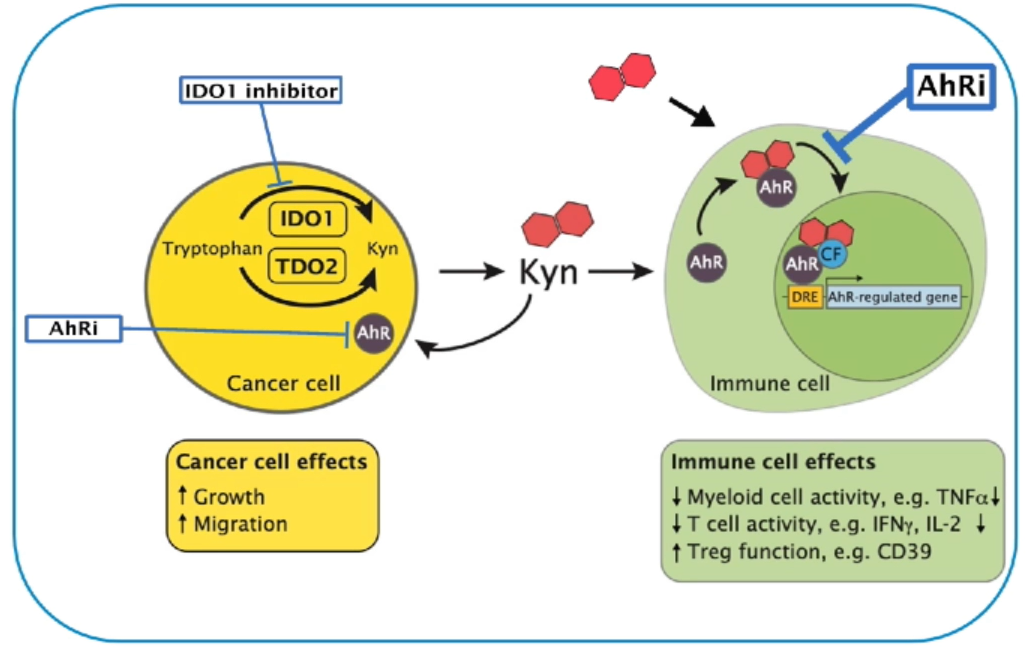
图:AhR在肿瘤微环境中的调节作用
BAY 2416964是一种高度选择性的AhR抑制剂,能够阻滞不同AhR激动性配体所介导的CYP1A1转录。BAY 2416964能够直接与AhR发生相互作用,并且能够抑制配体诱导AhR转运至细胞核。作为口服AhR拮抗剂,不同剂量以及不同给药频次的BAY 2416964均能为CT26肿瘤模型带来肿瘤生长的抑制,在当前研究中,确定的最佳给药方案为30 mg/kg QD。
图:BAY 2416964药物结构
在B16F10-OVA模型中,以30 mg/kg每日一次口服的方案给予BAY 2416964,同样能够观察到肿瘤生长的抑制,而在免疫缺陷的小鼠中无法观察到治疗效果。经过进一步的研究发现,BAY 2416964能够调节B16F10-OVA模型中肿瘤微环境的免疫组成。体外研究显示,BAY 2416964能够调节小鼠T细胞和骨髓来源的抑制性细胞(MDSC)活性。进一步的研究发现,BAY 2416964能够在不同人体免疫细胞亚群中诱导促炎作用,而BAY 2416964联合PD-1单抗能够在混合淋巴细胞反应(MLR)中进一步增强T细胞活性。在体外研究中,BAY 2416964显示出优于于IDO抑制剂Epacadostat促炎潜能。体内外实验均表明,BAY 2416964拥有良好的安全性特征。目前,对于BAY 2416964的探索已经进入Ⅰ期临床研究。
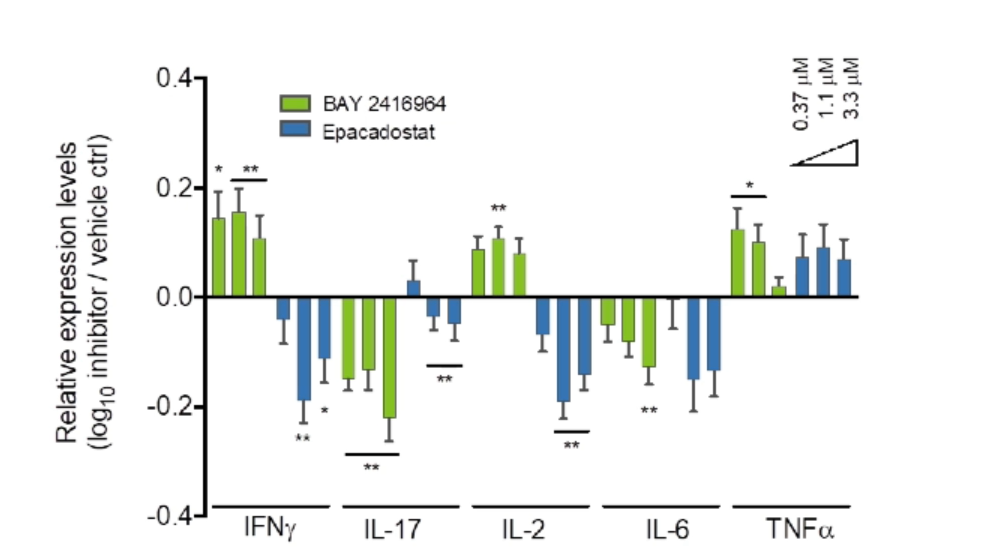
图:BAY 2416964显示出优于于IDO抑制剂的促炎潜能
总结:BAY 2416964是一种强效、选择性和交叉反应性的AhR,能够发挥多种抗肿瘤免疫调节作用。
强效、选择性谷氨酰胺酶抑制剂(GLS1)IPN60090用于KEAP1/NFE2L2突变型NSCLC和ASNS低表达型卵巢癌患者的治疗
演讲者:Jeffrey J. Kovacs,美国德州大学MD安德森癌症中心
谷氨酰胺依赖是肿瘤细胞代谢的重要特点,因此以谷氨酰胺酶(GLS1)为治疗靶点或可成为抗肿瘤药物研究的全新方向。IPN60090是一种强效、特异性的GLS1抑制剂,具有可观的临床研究前景。根据其良好的理化特性,预计IPN60090的人体半衰期为8小时。
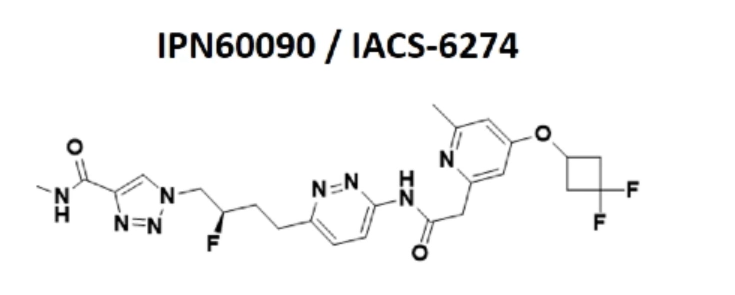
图:IPN60090药物结构
在临床前研究中,IPN60090治疗能够为不同类型的肿瘤细胞系模型带来不同程度的缓解。通过对其机制的分析,在响应的细胞系中,IPN60090治疗能够触发整体的代谢重编程,并且对谷氨酰胺至谷氨酸、谷胱甘肽的“碳运输”过程进行调节。通过对氧化还原(REDOX)平衡的选择性调节,IPN60090能够抑制部分NSCLC细胞的增殖。
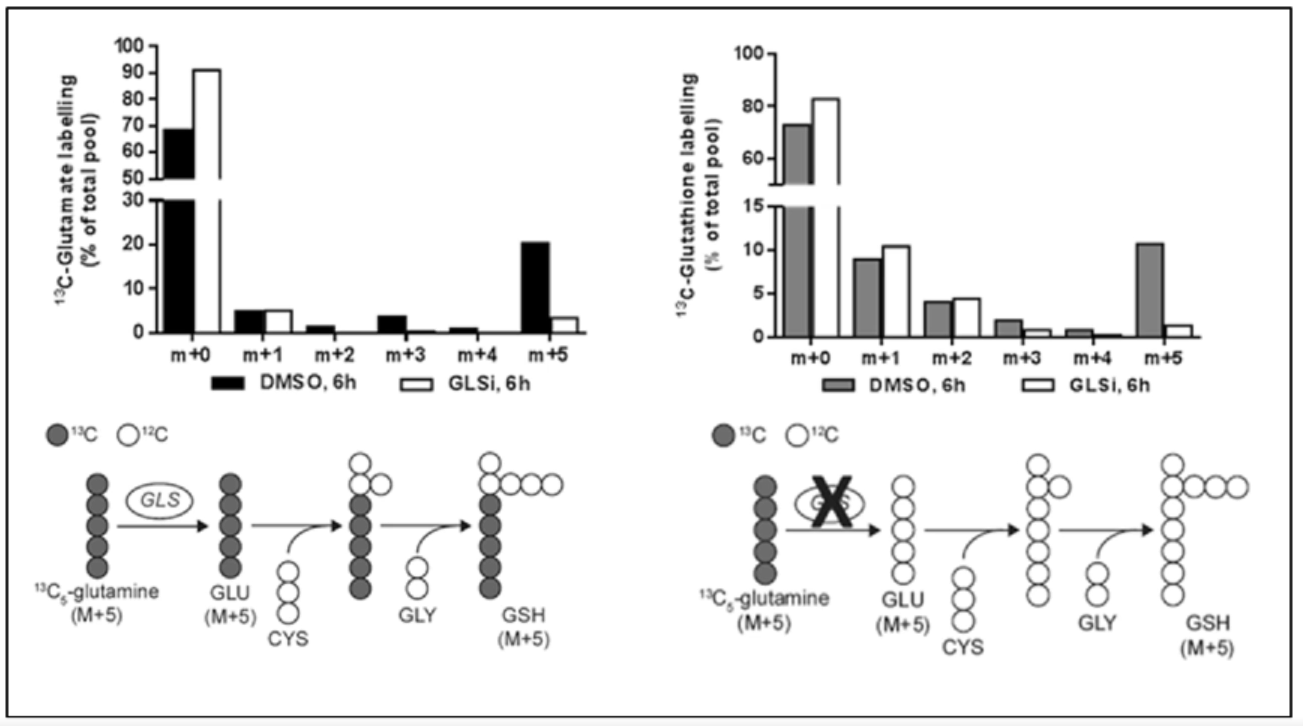
图:IPN60090对细胞代谢的影响
在当前研究中,研究人员发现,KEAP1/NRF2通路是否存在调节异常能够用于预测IPN60090治疗的效果。根据其非临床药代动力学特征,IPN60090以每日两次的剂量在小鼠中给药能够取得较好的肿瘤内靶向作用。此外,在体研究以及体外研究显示,IPN60090不仅能够抑制KEAP1突变模型中肿瘤的生长,还能够诱导多种卵巢癌细胞系产生不同程度的缓解。而对IPN60090治疗产生响应的卵巢癌细胞系,具有较低水平的谷氨酸产生天冬酰胺合成酶(ASNS)。
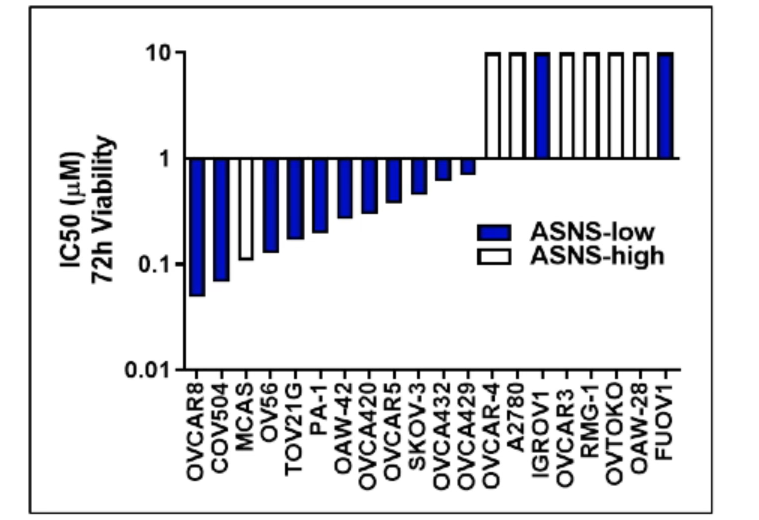
图:对IPN60090产生响应的癌细胞具有ASNS低表达特征
进一步的研究证实,在ASNS低表达卵巢癌小鼠模型中,IPN60090能够抑制肿瘤细胞的生长。基于在体研究平台,研究人员对IPN60090的适应性反应以及联合治疗策略进行了探索。在KEAP1突变的NSCLC肿瘤模型中,研究人员证实,TORC1/2双靶点抑制剂能够发挥协同作用。目前,MD安德森癌症中心与Ipsen联合,在FIHⅠ期研究中对IPN60090进行探索。在FIH试验中,研究人员在小鼠中展开临床外的替代性生物标志物分析,他们发现,IPN60090能够强效的抑制外周血单个核细胞(PBMC)中GLN的代谢,并且在不同患者中表现出良好的PK/PD特征。目前,IPN60090的Ⅰ期研究正在持续进行。
总结:IPN60090是由MD安德森癌症中心和Ipsen联合开发的强效GLS1抑制剂,具有卓越的理化性质。通过综合分析,研究人员在人体临床试验前对该药的生物标志物临床亚群以及联合治疗策略已经进行了探索。
排版编辑:Nathan
















 苏公网安备32059002004080号
苏公网安备32059002004080号


