小细胞肺癌(SCLC)约占肺癌的15%~20%,其恶性程度高于非小细胞肺癌(NSCLC),更易发生复发与转移,治疗预后差。随着免疫治疗、血管靶向治疗的发展,SCLC的治疗也迎来巨大突破。近期【肿瘤资讯】有幸邀请到内蒙古自治区人民医院的张翠英教授和山西白求恩医院的张俊萍教授,回顾2019年SCLC领域重要研究进展,探讨未来治疗发展方向。

肿瘤内科主任 主任医师 硕士生导师内蒙古自治区肿瘤研究所副所长
内蒙古自治区医院肿瘤中心副主任
内蒙古自治区草原英才/内蒙古自治区人民好医生
中国临床治疗肿瘤学CSCO理事
第一届肺癌MDT专家 委员会委员
中国医师协会肿瘤医师分会委员
中国医师协会肿瘤医师分会第一届委员会
中国研究型医院学会精准医学与肿瘤MDT专业委员会
中国医师协会结直肠肿瘤委员会第一届内科治疗专业委员会委员
内蒙古自治区医学会肿瘤内科学分会主任委员
内蒙古抗癌协会肺癌专业委员会副主任委员

山西白求恩医院肿瘤内科主任 主任医师 硕导生导师
山西科学技术学科带头人 省优专家
中国医药生物技术协会医药生物技术临床应用专委会常委
中国医药质量管理协会细胞治疗质量控制与研究专委会常委
CSCO免疫治疗专家委员会委员
中国免疫学会肿瘤免疫与生物治疗分会委员
中国抗癌协会化疗专委会委员、中国老年协会精准医疗委员会常委
中国研究型医院协会肿瘤MDT专委会常委
山西省抗癌协会生物免疫治疗专委会主委
山西生物免疫治疗专委会副主委
山西省医师协会肿瘤分会常委、细胞免疫分会常委
山西省老年医学学会胸部肿瘤分会副会长
广泛期小细胞肺癌一线免疫治疗热点解析
张翠英教授:免疫治疗是当前研究的热点与重点,在广泛期SCLC的一线治疗上,免疫治疗也带来了令人欣喜的结果,使这部分患者的中位总生存时间(OS)首次突破1年。在2019年世界肺癌大会(WCLC)上公布的CASPIAN研究中期分析结果显示,Durvalumab联合EP方案(依托泊苷+卡铂/顺铂)一线治疗广泛期SCLC,相比单纯化疗带来OS的显著获益,中位OS达到13.0个月,18个月的OS率达到33.9%(图1)。
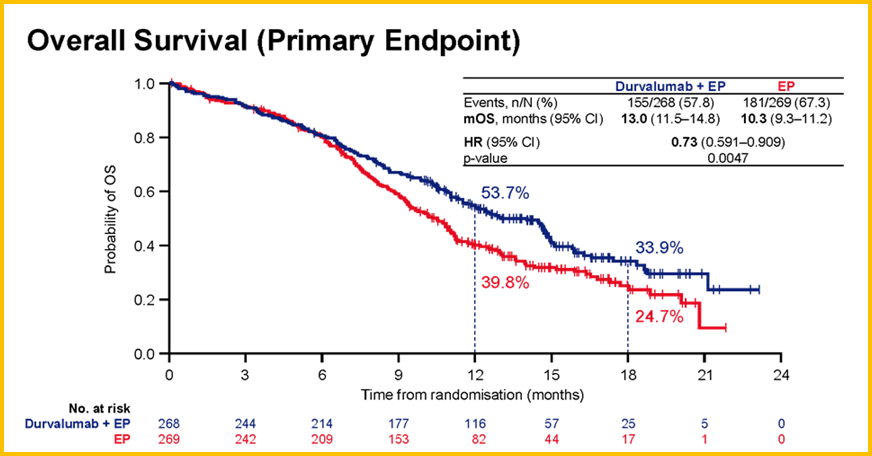
图1 CASPIAN研究OS分析
安全性方面,Durvalumab联合化疗的安全性和耐受性与药物已知的安全性特征一致,显示该方案是安全可行的。除此之外,CASPIAN研究还进行了生物标志物的探索性分析,但目前的结果显示,PDL1的表达水平似乎与疗效关联不大。
Atezolizumab联合EC方案(依托泊苷+卡铂)一线治疗广泛期SCLC的IMpower133研究也在今年更新了OS数据。中位随访时间达22.9个月,Atezolizumab联合化疗组的中位OS达到12.3个月,相比化疗组的10.3个月,具有显著的统计学差异(HR=0.76,P=0.0154;图2)。
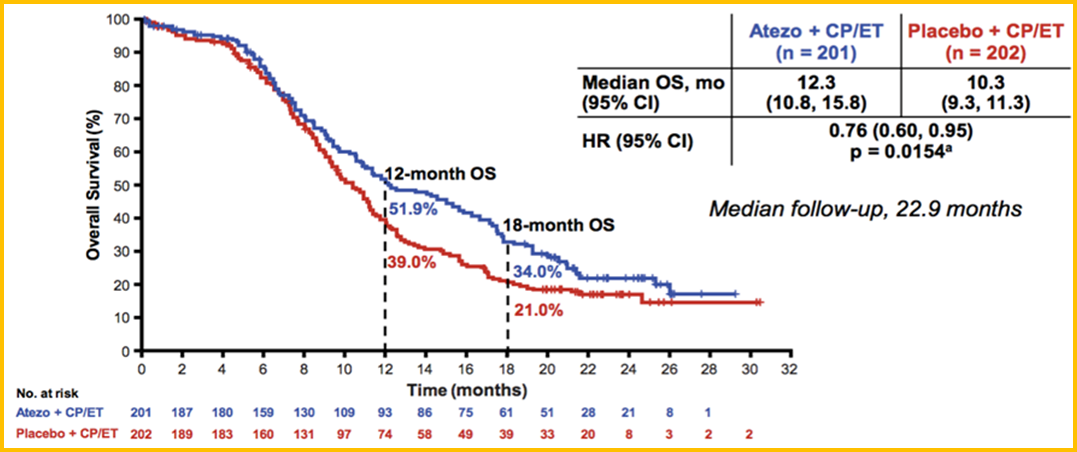
图2 IMpower133研究更新的OS数据
基于较为有限的数据,研究同样也发现,Atezolizumab联合化疗所带来的获益与肿瘤PD-L1表达水平以及基于患者外周血检测的肿瘤突变负荷(bTMB)状态无显著相关性。对于SCLC的免疫治疗生物标志物,未来还需要更多的探索。整体而言,免疫治疗联合化疗已经改变了广泛期SCLC的一线治疗模式,成为这部分患者新的标准治疗。
小细胞肺癌免疫治疗未来探索方向
张俊萍教授:当前在EC、EP方案的基础上联合Durvalumab或Atezolizumab确实为广泛期SCLC的一线治疗带来突破,然而与免疫治疗在NSCLC中的疗效相比,仅仅超过1年的中位OS,目前并不能满足临床医生和患者的治疗需求。
关于免疫治疗在SCLC中未来的研究方向,首先还是需要探索免疫治疗的获益人群,寻找更好的免疫治疗生物标记物。目前的研究数据显示,PD-L1表达水平与TMB状态对于SCLC免疫治疗的疗效预测作用不太大。免疫治疗与肿瘤微环境密切相关,新的研究数据显示,IFN-γ、T-cell相关基因的表达有望成为SCLC免疫治疗新的生物标志物。除此之外,国外有研究显示,通过转录因子的表达将SCLC分为四种亚型,其中免疫炎症型(SCLC-I)可能对免疫检查点抑制剂敏感,这也提供了非常好的研究方向。
第二个探索方向是免疫治疗与其他治疗模式的联合,如与抗血管生成药物安罗替尼的联合。目前安罗替尼与免疫治疗的联合在晚期NSCLC的治疗中展现出非常好的应用前景,而在SCLC领域,该联合治疗模式同样也值得期待。除了联合抗血管生成治疗,免疫治疗与聚腺苷二磷酸核糖聚合酶(PARP)抑制剂、新的化疗药物或新的化疗药物剂型也是未来的探索方向。
安罗替尼在小细胞肺癌中的研究进展
张俊萍教授:安罗替尼是国内自主研发的多靶点小分子酪氨酸激酶抑制剂(TKI),已经在国内获批NSCLC和SCLC治疗适应证。相比NSCLC,SCLC的治疗发展缓慢,安罗替尼也是近10余年来第一个在国内获批SCLC适应证的药物,具有非常重要的意义。
ALTER1202研究入组了既往至少接受过2种化疗方案治疗后进展或复发的SCLC患者,随机按2∶1比例接受安罗替尼或安慰剂治疗。先前公布的结果显示,相比安慰剂组,安罗替尼组延长了3.4个月的无进展生存期(PFS),降低了81%的疾病进展或死亡风险(中位PFS:4.1个月 VS 0.7个月;HR=0.19,P<0.0001,图3)。
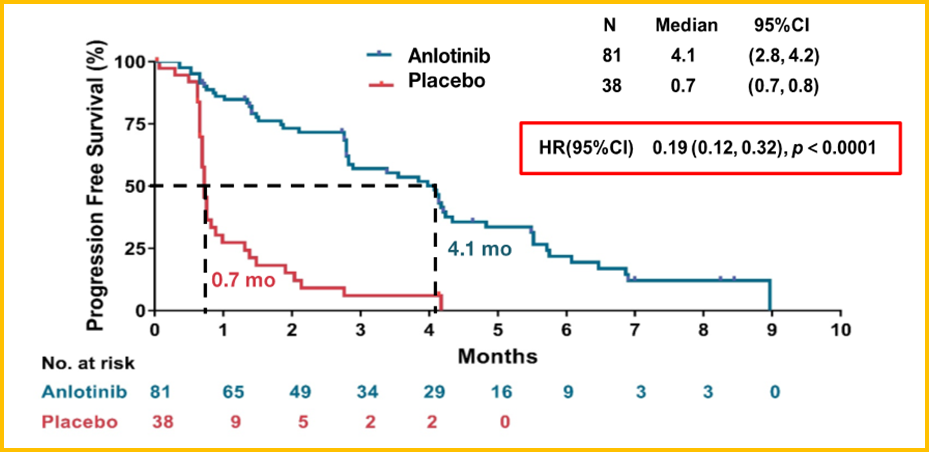
图3 ALTER1202研究PFS结果
在2019年,ALTER1202研究更新的数据多次亮相国际大会。在9月份的欧洲肿瘤内科学会(ESMO)年会上,吉林省肿瘤医院程颖教授汇报了研究的总生存(OS)数据,OS同样取得阳性结果,相比安慰剂组提高了3.4个月,降低47%的死亡风险(中位OS:7.3个月vs 4.9个月,HRHR=0.53,P=0.0029,图4)。安罗替尼再一次吸引了全球专家学者的目光。
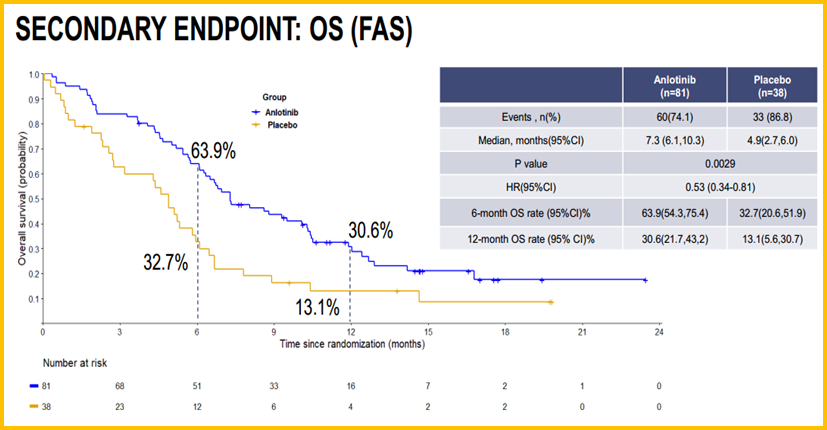
图4 ALTER1202研究OS结果
除此之外,ALTER1202研究还有3项非常重要的亚组分析结果在9月份的WCLC上公布。对于前线接受过放化疗的患者,安罗替尼带来更多获益,中位PFS延长4.8个月,中位OS延长4.6个月(图5)。基线合并脑转移的患者,安罗替尼也带来显著的获益,中位PFS和OS分别延长3.0个月和3.5个月(图6)。因此对于脑转移患者,安罗替尼是非常不错的治疗选择。
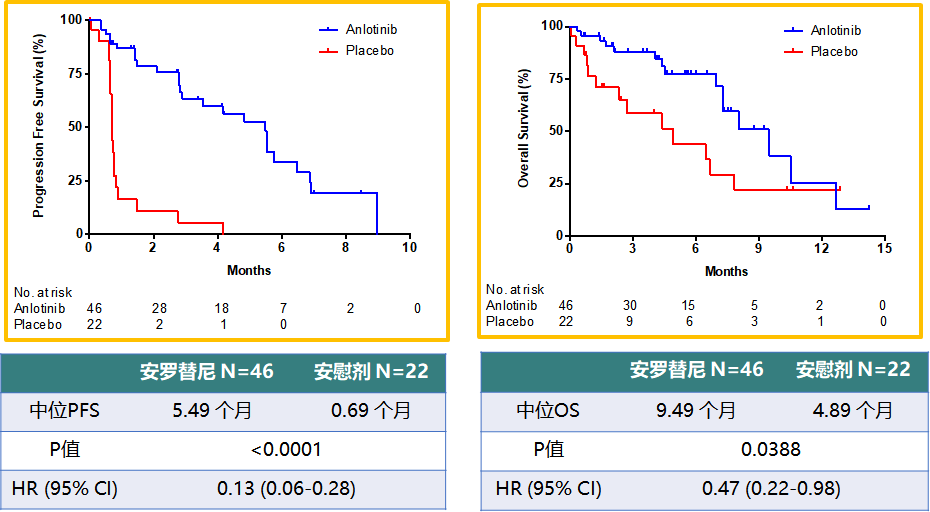
图5 ALTER1202研究前线接受过放化疗患者的PFS和OS分析结果
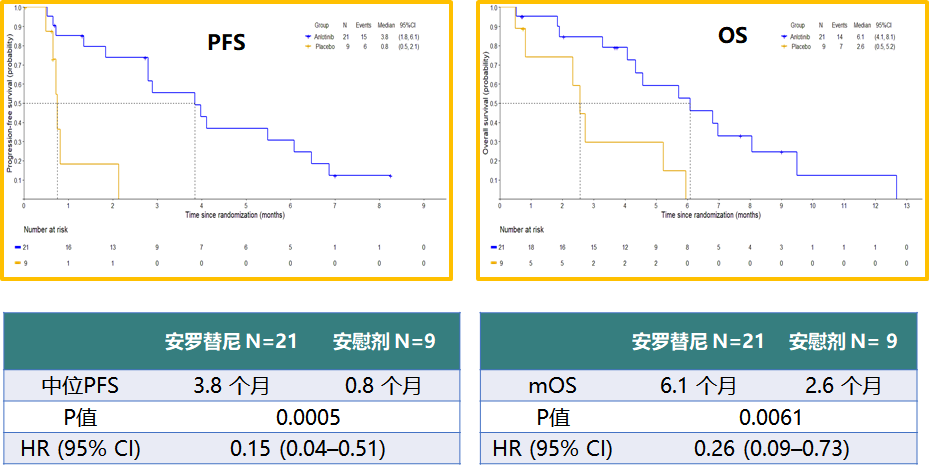
图6 ALTER1202研究脑转移亚组患者的PFS和OS分析结果
肿瘤的治疗不光要让患者活得更长,还要让患者尽可能活得会更好,与安慰剂相比,安罗替尼是否会影响患者的生活质量呢?ALTER1202研究患者的健康相关生活质量分析结果也在WCLC上公布,基于欧洲五维健康量表(行动能力、自理能力,日常活动能力,疼痛或不适,焦虑或抑郁)进行分析,发现安罗替尼应用之后并未对患者的生活质量造成影响。因此安罗替尼在提升疗效的同时,也维持了患者的生活质量。
作为国内自主研发的创新药物,安罗替尼能够有效抑制血管内皮生长因子(VEGF)、血小板衍生生长因子(PDGF)、成纤维细胞生长因子(FGF)等3条信号通路,同时对干细胞生长因子(c-KIT)信号通路有抑制作用,有效抑制肿瘤细胞的增殖。从临床试验到临床实践,安罗替尼疗效优异,填补了临床治疗的空白,为临床医生和患者提供了新的治疗选择。
安罗替尼在小细胞肺癌中未来的研究方向
张翠英教授:SCLC的治疗现状其实较为尴尬,多年来治疗停滞不前。安罗替尼用于既往至少接受过2种化疗方案治疗后进展或复发的SCLC患者,表现出非常好的疗效,带来显著的获益。关于安罗替尼未来在SCLC领域的探索方向,我个人认为首先是联合治疗,例如联合化疗、联合免疫治疗等,我们期待能有相关的研究数据,来证实联合治疗的疗效。在疗效得到证实后,进一步扩大安罗替尼的适应证,用于一线治疗让更多的患者尽早获益,这无疑是非常巨大的利好消息。
第二方面,在患者接受一线治疗后,安罗替尼能否用于维持治疗,尤其是脑转移的患者,在全脑放疗后进行维持治疗,这也是值得重点研究和探索的。第三方面,随着对SCLC基因表达谱、分子分型更为深入的探索,我们期待能够发现新的靶点,研发新的药物来治疗SCLC,而安罗替尼与这些新靶点药物的联合也值得进行探索。
小细胞肺癌其他重要研究进展
张俊萍教授:在2019年SCLC的治疗上,另一个比较重要的进展是Lurbinectedin二线治疗复发性SCLC研究结果在美国临床肿瘤学会(ASCO)年会上公布。研究结果显示,Lurbinectedin单药二线治疗SCLC的客观缓解率(ORR)为35.2%, 在耐药型(ORR:22.2%)或敏感型 (45.0%) 的SCLC中均具有一定的疗效(图7)。
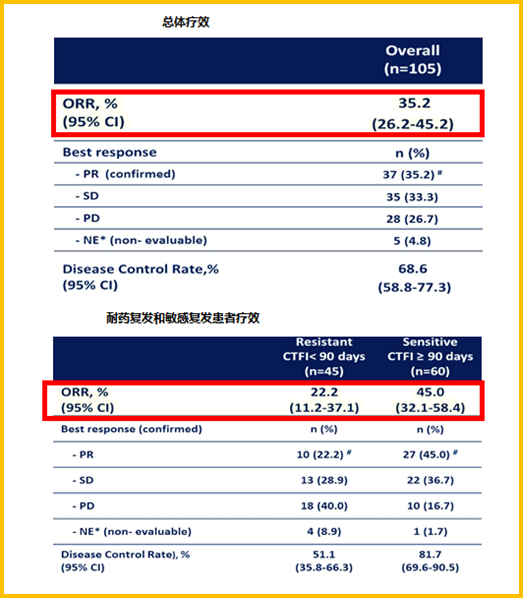
图7 Lurbinectedin单药二线治疗SCLC的ORR结果
Lurbinectedin是海鞘素衍生物,为核糖核酸(RNA)聚合酶Ⅱ的抑制剂,通过与脱氧核糖核酸(DNA)双螺旋结构上的小沟共价结合,抑制RMG1和RMG2,使肿瘤细胞在有丝分裂过程中畸变、凋亡、最终减少细胞增殖。作为一个新型的化疗药物,Lurbinectedin为SCLC的化疗带来了新的惊喜,同时我们也期待Lurbinectedin与免疫检查点抑制剂联合能够带来更好的疗效。
张翠英教授:PARP抑制剂奥拉帕利联合替莫唑胺(OT疗法)治疗SCLC的Ⅰ/Ⅱ期临床研究也受到大家的广泛关注,研究全文发表在Cancer Discovery杂志上。在经治的SCLC中,奥拉帕利联合替莫唑胺的ORR达到41.7%,中位PFS为4.2个月,中位OS为8.5个月(图8)。尽管这是一项单臂的早期临床研究,但确实取得优异的疗效数据,值得进行进一步的探索。
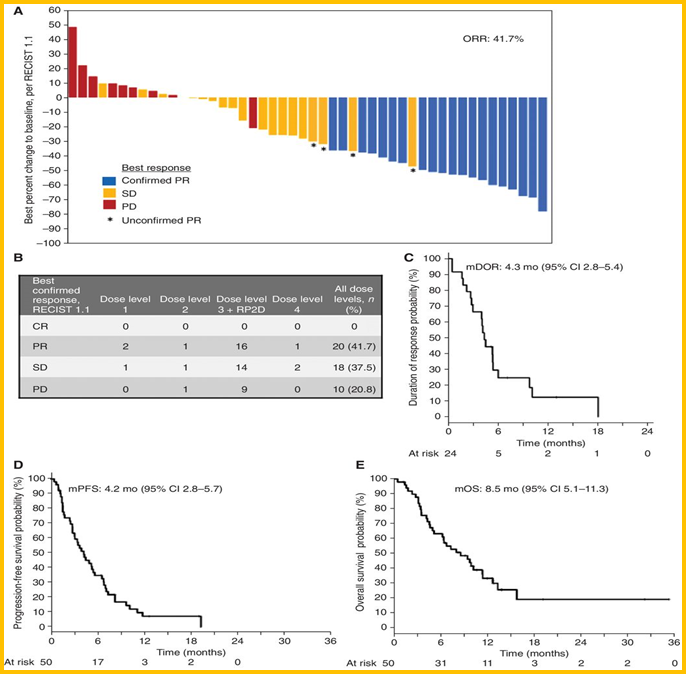
图8 奥拉帕利联合替莫唑胺治疗复发性SCLC的疗效分析
周期蛋白依赖性激酶(CDK)4/6抑制剂Trilaciclib与拓扑替康的联合也是今年的一大亮点,该研究可谓另辟蹊径。研究的结果显示,相比安慰剂联合拓朴替康治疗,Trilaciclib联合拓扑替康可减轻患者的骨髓抑制,显著降低严重嗜中性粒细胞减少症的发生(40.6% vs 75.6%,P=0.016),间接地提高了患者对于拓扑替康的耐受性。目前化疗仍是SCLC治疗的重要武器,然而化疗引起的骨髓抑制一直是限制化疗应用的急性毒性之一,而此项研究的结果也为减轻化疗的毒副反应提供新的思路。
除了上述研究之外,在SCLC的治疗上其实还有很多值得大家回味的研究,例如虽然抗体药物偶联物(ADC)Rova-T治疗小细胞肺癌的结果令人沮丧,但新的小分子药物偶联物(SMDC)PEN-221进入早期人体临床试验,或可成为偶联药物新的突破点。此外,有研究提示靶向DNA损伤修复(DDR)的药物亦可通过促进T细胞活化,增强患者免疫应答,提高免疫治疗的疗效,这也为SCLC的治疗带来了新的曙光。












 苏公网安备32059002004080号
苏公网安备32059002004080号


