2019年9月27日至10月1日,2019年欧洲肿瘤内科学会(ESMO)年会在西班牙巴塞罗那举行,该会议是欧洲最负盛名和最具影响力的肿瘤学会议,会议期间大量肿瘤临床治疗相关的研究结果公布,为推动肿瘤诊疗进步发挥巨大作用。在本次大会上,非小细胞肺癌(NSCLC)领域的精准治疗仍然是研究热点。精准治疗离不开精准检测,其中由Foundation Medicine Inc.(FMI)开发的全面基因组检测平台,全面助力NSCLC精准诊疗。
(一)采用NGS检测初治ALK+NSCLC患者,阿来替尼疗效显著
LBA81:II/III期BFAST研究ALK阳性队列初步结果:外周血检测筛查初治ALK+NSCLC
BFAST研究是一线全球II/III期、多队列研究,在初治晚期NSCLC患者中,前瞻性的评估基于外周血的生物标志物与靶向或免疫治疗临床疗效的关系。研究纳入不可切除IIIB或IV期NSCLC,初治,有可测量病灶,ECOG PS 0-2分。对外周血cfDNA使用FMI检测,对检测到特定生物标志物阳性的患者给予相应的治疗。研究包括ALK+、RET+、bTMB+、ROS1+多个队列。本次研究报道ALK+队列患者的初步结果,这一队列旨在评估阿来替尼用于外周血检测ALK+患者的疗效和安全性,并以基于组织检测的ALEX研究结果作为参照。

图1. BFAST研究ALK+患者队列设计
研究共筛查了2219例患者,其中87例患者检测到ALK基因融合,纳入ALK+队列。ALK阳性率为5.4%,与预期5%的阳性率接近。87例ALK阳性患者中,38例(43.7%)同时检测到TP53突变。患者基线时的中位bTMB为2mut/Mb,其中3.4%的患者bTMB≥16mut/Mb。
ALK阳性队列患者的中位年龄为55岁,女性占40%,93%的患者为腺癌,基线时40%的患者合并脑转移。横向对比ALEX研究中阿来替尼组患者的基线特征,表现出相似的特征。中位随访时间为12.58个月。疗效分析显示,研究者评估的客观缓解率(ORR)为87.4%,独立评估委员会评估的ORR为92.0%,与之前ALEX研究的结果保持一致(71.7%)。在基线合并CNS转移(n=35)和未合并CNS转移(n=52)的患者中,ORR分别达到91.4%和84.6%。
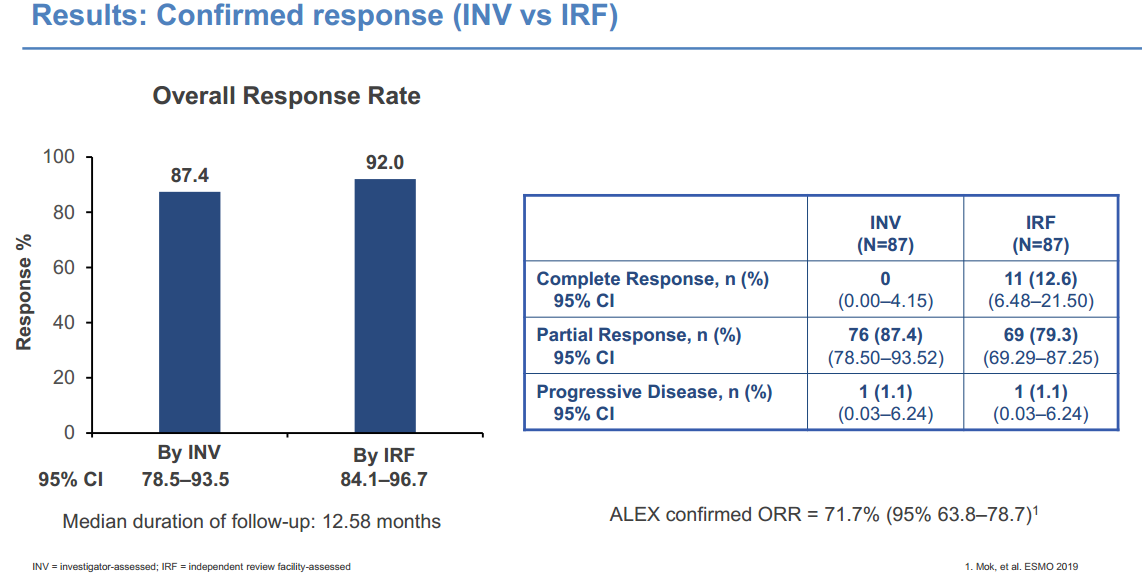
图2. 患者的ORR分析
治疗6个月后分析显示,63例患者仍在接受治疗,6个月的无事件率达到90.4%。安全性分析显示,所有患者报道过一次不良事件(AE),严重AE发生率为24%,3-4级AE发生率为35%。因AE导致治疗中止的患者比例为7%。安全性分析数据与阿来替尼用于ALK+患者一线治疗的其他研究数据一致。发生率≥10%的AE主要包括便秘、恶心、呕吐、腹泻、肝酶升高、外周水肿、贫血等。
小结:① BFAST研究是第一项前瞻性、仅以基于FMI血液检测平台作为检测可靶向驱动变异的研究,为初治晚期NSCLC患者寻找合适的靶向或免疫治疗。结果首次前瞻性的证实,对于通过FMI血液检测平台证实存在ALK融合的初治NSCLC患者,阿来替尼治疗有效,而且ALK阳性的检出率与既往报道的结果一致;② FMI血液ctDNA检测可避免侵入性活检,即使对于活检材料质量/数量不足的患者,也有机会接受更有效的精准治疗。
(二)bTMB或可预测NSCLC免疫治疗反应
LBA83:前瞻性II期B-F1RST研究:评估血检肿瘤突变负荷[bTMB]预测atezolizumab一线治疗NSCLC疗效的有效性
研究纳入了不可切除的IIIB-IVB期NSCLC,要求患者ECOG PS评分0-1分,有可测量病灶,排除携带EGFR敏感突变或ALK重排的患者。患者接受atezolizumab 1200mg IV q3w治疗直至进展、不可耐受或失去临床获益。研究采用FMI的bTMB assay来检测患者的bTMB。共同主要终点为ITT人群(n=152)中研究者评估的ORR,以及生物标志物可评估人群(BEP人群,n=119)中,以TMB≥16和<16mut/Mb作为cut-off值分析无进展生存(PFS)。
ITT人群在随访了≥18个月后分析,患者的ORR为17.1%(95% CI: 11.5, 24.1),BEP人群的ORR为12.6%。以≥10mut/Mb作为cut-off值,TMB≥10和<10mut/Mb的患者,ORR分别为20.4% vs 7.1%(P=0.033);以≥16mut/Mb作为cut-off值,TMB≥16和<16mut/Mb的患者,ORR分别为35.7% vs 5.5%(P<0.0001);以≥20mut/Mb作为cut-off值,TMB≥20和<20mut/Mb的患者,ORR分别为47.7% vs 6.0%(P<0.0001)。
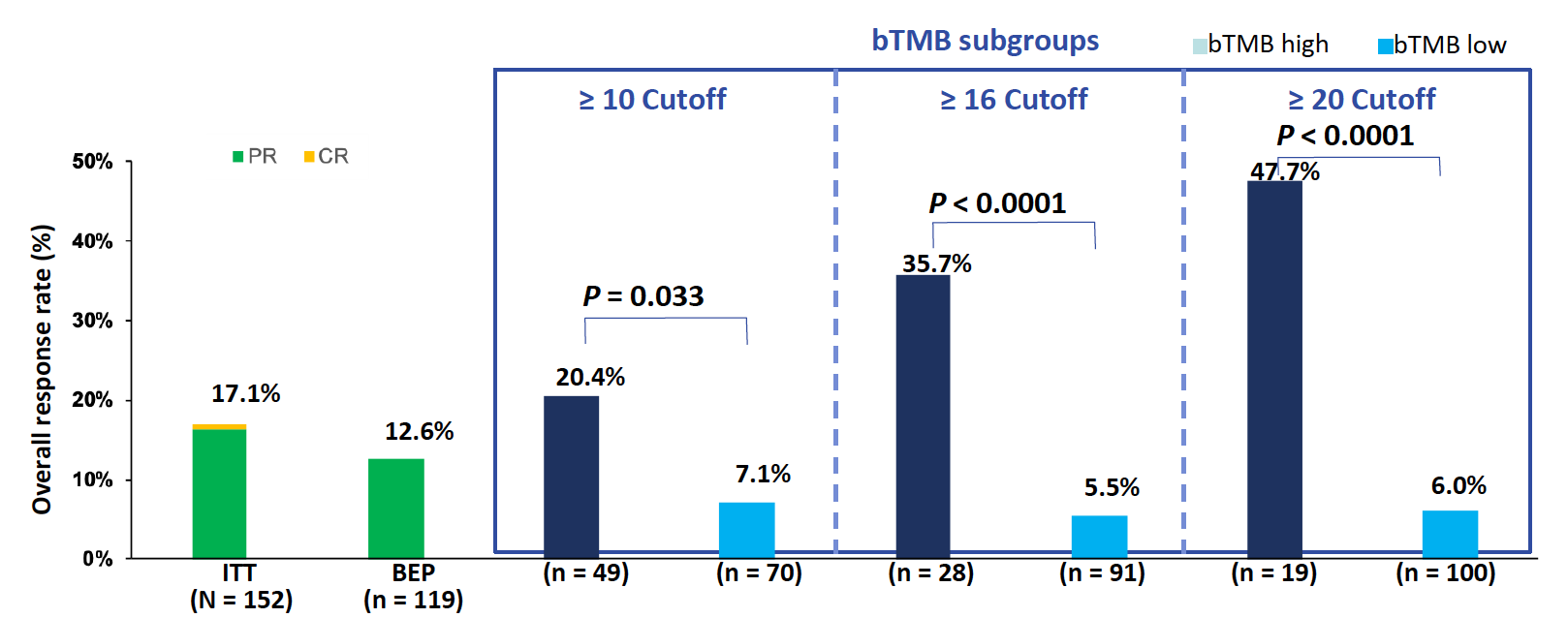
图3. 采用RECIST 1.1标准确认的ORR
ITT人群中,患者的mPFS 为4.1个月(95% CI: 2.8, 4.9),mOS为14.8个月(95%CI:12.7, 21.3)。以≥16mut/Mb作为cut-off值,TMB≥16和<16mut/Mb的患者,mPFS分别为5.0 vs 3.5个月,HR 0.80(90%CI:0.54-1.18),P=0.35;mOS分别为23.9 vs 13.4个月,HR 0.66(90%CI:0.40-1.10),P=0.18。虽然两组患者的PFS和OS无显著差异,但高TMB组的PFS和OS在数值上更长。
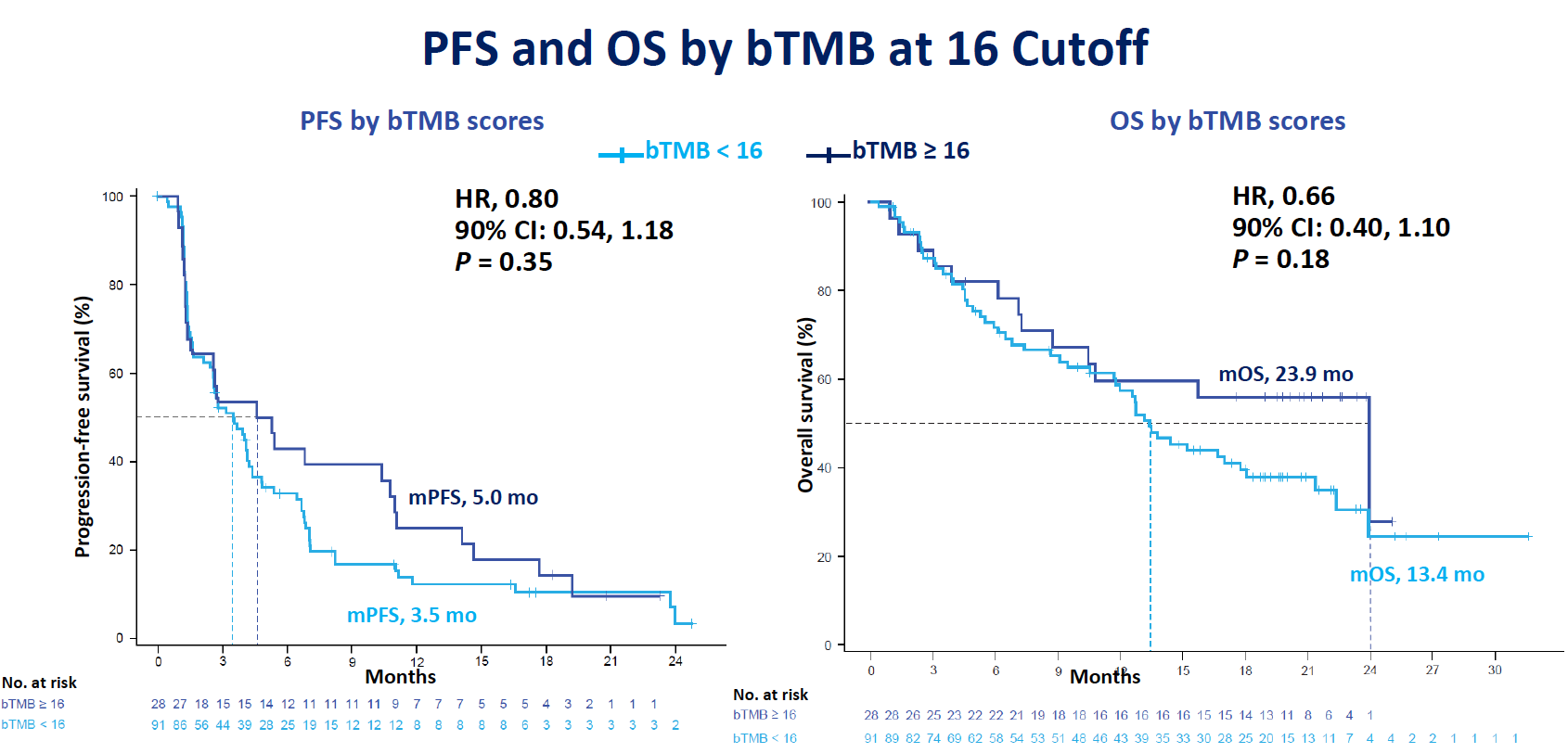
图4. 以TMB 16mut/Mb作为cut-off值分析PFS和OS
小结:B-F1RST研究采用FMI的 bTMB assay检测,利用血液标本检测TMB以指导atezolizumab一线治疗NSCLC,结果显示高bTMB(≥16mut/Mb)患者免疫治疗的ORR、PFS和OS均明显改善,证明bTMB作为预测NSCLC患者免疫治疗反应的生物标志物具有潜在的临床应用价值;同时,该研究再次力证FMI bTMB assay检测bTMB的可行性,以及血液标本检测同样具有很好的指导治疗作用。
(三)FMI助力筛选适合NTRK抑制剂/免疫治疗的NSCLC患者
1549P:CGP检测NSCLC患者的NTRK1-3基因融合
NTRK1-3是非常罕见的驱动基因,在多种肿瘤中可检测到。近期FDA批准了针对NTRK融合的靶向药物,因此明确NSCLC中NTRK融合发生率具有重要意义。研究采用FoundationOne CDx检测了42791例NSCLC,评估NTRK1-3融合基因的变异状态,同时对肿瘤的基因改变作了多方探讨,评估了TMB、MSI状态,并采用SP142抗体进行PD-L1表达检测。
结果显示,NSCLC中NTRK1-3融合改变极为少见。仅检测到63例(0.15%)患者携带NTRK1-3基因融合,这些患者的年龄和性别与其他NSCLC患者相似。在腺癌中,NTRK融合率最高,67%的融合患者为腺癌,其次为鳞癌(11%)。NTRK1-3融合的患者,平均基因变异数目为6.1-8.2个。NTRK的融合伴侣非常多,其中NTRK-IRF2BP2和NTRK1-TPM3最常见。
NTRK1-3融合驱动的NSCLC常伴随其他驱动基因共存突变,其中9例(14%)患者检测到KRAS突变,78%为KRAS G12C突变。相比于EGFR突变、ALK重排和ROS1重排的患者,NTRK1-3融合突变的患者TMB更高、PD-L1表达水平更高,提示这类患者可能适合免疫治疗。研究同时还报道了2例携带NTRK1-3融合的患者:1例为70岁男性,原发肺腺癌,FoundationOne CDx检测发现NTRK1融合,同时合并MDM2扩增、以及PBRM1、TP53 D259Y和TSC2短片段突变,TMB为53mut/Mb,PD-L1高表达>50%。另1例患者为58岁女性,FoundationOne CDx检测发现NTRK1-PTRPC融合,同时合并以下基因的短片段突变:CDKN2A、KEAP1、KRAS、NRAS和TP53,TMB为19mut/Mb。
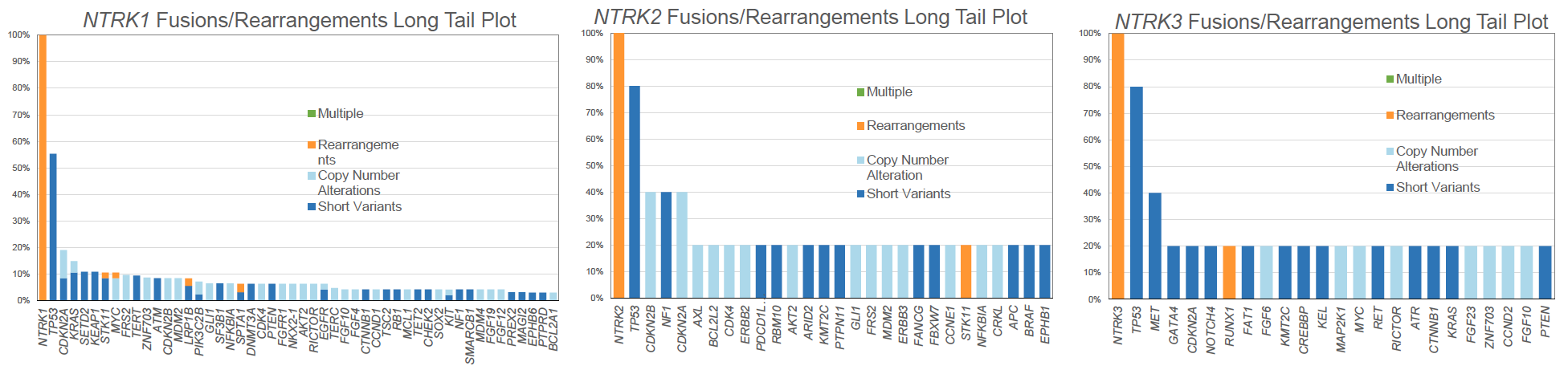
图5. NTRK1-3融合驱动的NSCLC常伴随其他驱动基因共存突变
小结:这一研究采用FoundationOne CDx检测,在大样本量的NSCLC患者中检测了NTRK1-3融合,发现其变异率非常低,且常合并其他驱动变异,TMB相对较高,PD-L1高表达。研究证实,采用FoundationOne CDx检测NTRK融合这类罕见基因是可行的,这类患者有望从NTRK抑制剂或免疫治疗中获益。
(四)FMI CGP检测明确SMARCA4突变NSCLC患者的分子特征
1583P:SMARCA4突变的NSCLC:一项CGP研究
SMARCA4是SWI/SNF染色体重构复合物的催化ATP酶亚单元,在NSCLC中,其可以通过一些基因变异失活。在原发肺腺癌中,SMARCA4突变的NSCLC是一类侵袭性较高的亚型,常表现为TTF1阴性。本研究纳入40319例临床晚期NSCLC患者中,对2840例(7.1%)SMARCA4突变的和37479例SMARCA4野生型患者进行FoundationOne CDx检测,明确基因变异谱、TMB和MSI状态;同时采用Dako 22C3进行PD-L1表达检测。
结果显示,SMARCA4可以通过以下变异失活:短片段碱基置换或截断(88%)、缺失(9%)、 复制(1%)、重排/融合(1%)。SMARCA4突变的患者更为年轻,且女性患者较少。SMARCA4突变的肿瘤相比于野生型肿瘤,每个患者的基因突变数更少,分别为3.2 vs 5.6 GA/肿瘤;两类患者非靶向的基因变异TP53和KRAS突变状态相似,但SMARCA4突变患者合并以下靶向变异的频率更低:EGFR突变、PIK3CA突变、ALK融合、ROS1融合和NTRK1-3融合;相反,SMARCA4突变肿瘤STK11突变率更高,且中位TMB更高,TMB>10和>20mut/Mb的患者比例也更高。此外,在SMARCA4突变患者中,CDK4/6突变率也更高。
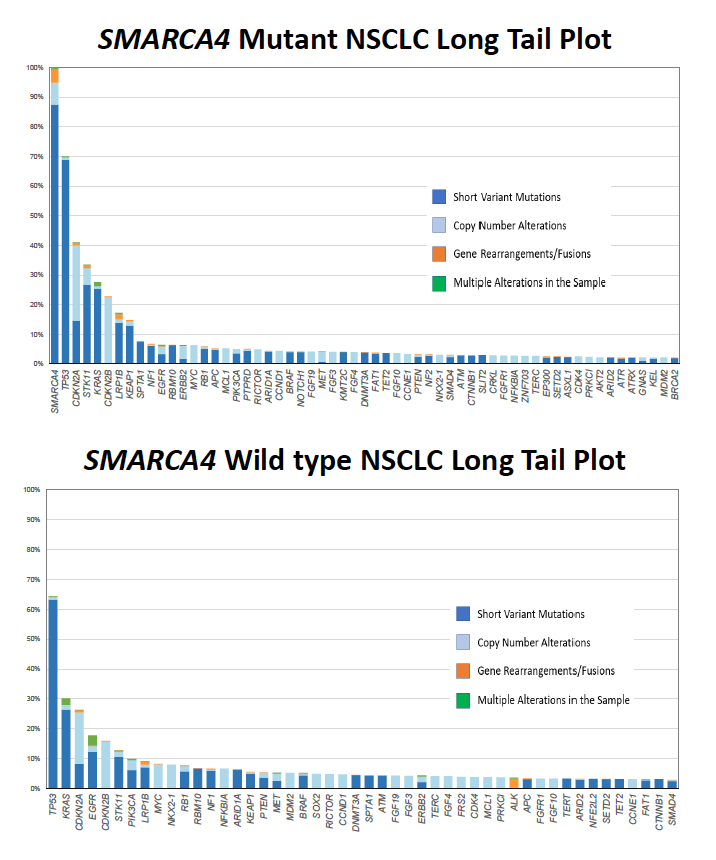
图6. SMARCA4突变和野生型NSCLC均表现为长尾现象
研究同时报道了2例SMARCA4突变的患者:1例为 56岁高加索女性,首诊晚期NSCLC,肿瘤TTF1表达阳性。FoundationOne CDx检测发现SMARCA4短片段突变(V318fs*8),同时伴随7号染色体上的CDK6和HGF扩增。其他突变包括DNMT3A R882H和TP53 R280I。这例肿瘤为MSI稳定型,TMB 10mut/Mb,PD-L1高表达。虽然患者的TMB为低到中等水平,但PD-L1高表达(>50% TPS),且未合并STK11突变,患者有可能对免疫治疗有效。此外,患者合并CDK6活化,可能对CDK4/6抑制剂治疗敏感。另1例患者为黏液性腺癌,54岁高加索女性,FoundationOne CDx检测发生SMARCA4失活突变(3169-63_3203del98),伴STK11失活突变(P280fs*7)。其他的短片段突变包括KRAS(G12V)、PARK2(N52fs*92)和RBM10(K834)以及CDKN2A、CDKN2B和MTAP缺失。患者为MSI稳定型,TMB为13mut/Mb。这例患者最初计划接受免疫治疗,但TMB中等水平,且合并STK11突变,STK11突变会介导KRAS突变患者免疫治疗耐药。后患者接受了系统性化疗。在SMARCA4缺失的NSCLC中,STK11突变率较高,达到34%。
小结:相比于SMARCA4野生型NSCLC,SMARCA4突变型NSCLC表现为多种组织学类型,TTF1阴性,且可靶向驱动基因突变如EGFR、ALK、ROS1和NTRK1-3发生率低。尽管最新证据提示SMARCA4突变的肿瘤对细胞周期抑制剂如Palbociclib敏感,但CDK4/6变异频率并不高。SMARCA4突变的NSCLC表现为高TMB水平,提示其可能从免疫治疗中获益,但STK11变异率较高,可能会降低其接受免疫治疗的疗效。
总结
上述4项研究均采用FMI CGP对晚期NSCLC患者进行检测,前两项研究均采用FMI的外周血检测平台,分别检测ALK重排和患者的bTMB,指导ALK靶向治疗或PD-L1单抗免疫治疗;第三项研究在大规模的NSCLC患者中检测罕见驱动基因NTRK1-3融合率,并发现其基因特征,以筛选更多可能从靶向和免疫治疗中获益的人群;第四项研究在大规模NSCLC中对比了SMARCA4突变和野生型患者的分子特征,为SMARCA4突变患者治疗提供思路。四项研究证实,CGP检测已经成为临床重要的检测手段,对指导个体化靶向和免疫治疗提供重要参考。

四川省肿瘤医院肿瘤内科
四川省抗癌协会老年肿瘤治疗专业委员会主任委员
成都市卫生经济学会药物经济学专业委员会副主任委员
四川省抗癌协会抗癌药物治疗专业委会常委
中国医师协会结直肠肿瘤专业委员会内科治疗专业委员会委员
中国抗癌协会肉瘤专业委员会化放疗学组委员
四川省肺癌联盟专业委会常委
《肿瘤预防与治疗》编委
在晚期NSCLC的管理中,进行驱动基因突变和免疫标签检测,寻找靶向治疗或免疫治疗的优势人群已经成为临床治疗的关键。目前,指南已经推荐晚期NSCLC患者常规检测EGFR和BRAF突变、ALK和ROS1重排以及PD-L1表达。通过对驱动基因突变进行诊断性检测可以发现从靶向治疗中获益的人群。然而临床上约30%的晚期患者诊断时,没有足够的组织标本进行分子检测;约20%的患者不能进行重复的组织活检;此外即使进行了重复活检,也有25%的患者无法获得足够的组织进行基因检测。因此,液体活检成为重要的替代检测材料,可以克服组织检测的局限性。BFAST研究和B-F1RST研究均以外周血ctDNA作为检测材料,采用FMI开发的血液检测平台分别检测了ALK重排和bTMB,结果证实了基于外周血基因检测也能够很好的筛选出从靶向或免疫治疗中获益的人群。FMI开发的FoundationOne CDx检测平台,靶向肿瘤编码区的324个基因,不仅可以全面检测患者潜在的治疗靶点,同时在10万例肿瘤样本中进行验证,可以同时准确提供TMB信息,为探寻靶向和免疫治疗优势人群提供重要参考。此外,为克服组织检测的局限性,FMI进一步开发了bTMB检测平台,并证实采用血浆可以准确和重复检测TMB。截至目前,bTMB的研究成果不断,频频亮相于各类大会。bTMB是一个相对无创的检测,可以实现动态监测,这是一个非常具有前景的研究方向,值得更多探索。期待未来,bTMB能使得精准免疫治疗落地实践。第三项研究在大规模的NSCLC患者中评估了罕见驱动基因NTRK1-3融合的发生率,并评估了这类融合基因阳性患者的分子特征,如常合并其他驱动基因突变,且TMB高,PD-L1高表达等,提示这类患者可以从靶向或免疫治疗中获益。这一研究结果提示,采用FoundationOne CDx检测平台可以进一步扩展靶向或免疫治疗的获益人群,使更多晚期NSCLC患者从精准治疗中获益。第四项研究在大规模的NSCLC患者中对比了SMARCA4突变和野生型患者的分子特征,发现SMARCA4突变患者较少合并可靶向驱动基因突变,但TMB较高,提示其可能从免疫治疗中获益;此外,研究还发现这类患者常合并STK11突变,有可能对免疫治疗耐药。因此对免疫检测点抑制剂的具体疗效还有待进一步研究。总体而言,上述研究采用FMI CGP检测平台,探寻NSCLC的分子特征,为后续治疗提供了重要的指导,CGP检测在NSCLC的全程管理中已经不可或缺。
1. Phase II/III blood-first assay screening trial (BFAST) in treatment-naïve NSCLC: initial results from the ALK+ cohort. 2019 ESMO, abs LBA81.
2. Final efficacy results from B-F1RST, a prospective phase II trial evaluating blood-based tumour mutational burden (bTMB) as a predictive biomarker for atezolizumab (atezo) in 1L non-small cell lung cancer (NSCLC) . 2019 ESMO, abs LBA83.
3. NTRK1-3Genomic Fusions in Non-Small Cell Lung Cancer (NSCLC) Determined by Comprehensive Genomic Profiling. 2019 ESMO, abs 1549P.
4. SMARCA4Mutated Non-Small Cell Lung Cancer (NSCLC): A Comprehensive Genomic Profiling (CGP) Study. 2019 ESMO, abs 1583P.












 苏公网安备32059002004080号
苏公网安备32059002004080号


