KRISTINE研究在HER2阳性早期乳腺癌新辅助治疗中,对比了T-DM1联合帕妥珠单抗(T-DM1 + P)和传统系统性化疗多西他赛+卡铂联合双靶向抗HER2治疗——曲妥珠单抗和帕妥珠单抗。既往报道的主要结果显示,T-DM1 + P组的pCR率低于TCH + P组,近期《临床肿瘤杂志》(Journal of Clinical Ooncology)发布了这一研究3年随访结果,更新了无事件生存(EFS)、无侵袭生存(IDFS)、安全性等结果。本期【新见】栏目谨对该研究进行介绍,并邀请山东第一医科大学附属山东省肿瘤防治研究院的邱鹏飞教授进行点评。

山东省肿瘤医院 乳腺病中心,博士研究生
中华医学会肿瘤学分会乳腺学组 青年委员
主持国家自然科学基金项目1项
白求恩公益基金会项目1项
山东省自然科学基金项目1项
山东省重点研发计划项目1项
山东省医药卫生科技发展计划项目1项
山东省医学科学院科技发展计划1项
参研国家及省部级科研项目6项 (前3位)
获山东省医学科学院科学技术一等奖1项 (第1位)
获山东省研究生优秀科技创新成果奖1项 (第1位)

《新见》是由中华医学会肿瘤分会乳腺肿瘤学组组织的国际会议期刊文献解读与点评。
研究背景
HER2阳性乳腺癌目前的标准新辅助治疗方案为传统化疗联合曲妥珠单抗为基础治疗,病理缓解率(pCR)为25% ~ 65%;相比于单独使用曲妥珠单抗,双靶向抗HER2治疗可以进一步提高pCR率。在HER2阳性乳腺癌中,乳腺原发灶和淋巴结pCR与更长的EFS和OS相关。尽管双靶向抗HER2治疗可以取得很高的pCR率,仍有约15%的患者会在3~5年内经历疾病复发或死亡。此外,双靶向方案在联合传统化疗时,化疗的毒性不可避免,如中性粒细胞减少和粒缺性发热。因此,开发HER2阳性早期乳腺癌的新辅助和辅助治疗方案,以期提高治疗疗效和安全性仍然是目前的重要课题。
KRISTINE研究是一项Ⅲ期、随机、多中心、开放的研究,在HER2阳性早期乳腺癌新辅助治疗中,采用抗体偶联药物T-DM1取代传统化疗,可以将化疗药物精准投递到HER2阳性肿瘤细胞中,同时还可以实现抗HER2靶向治疗。相比于传统化疗,不良事件(AEs) 发生率显著更低。KRISTINE研究在HER2阳性早期乳腺癌中,对比了新辅助T-DM1联合帕妥珠单抗(T-DM1+P)和传统系统性化疗多西他赛卡铂联合双靶向抗HER2治疗——曲妥珠单抗和帕妥珠单抗。KRISTINE研究的主要结果既往已经报道,相比于传统系统性化疗为基础的方案,T-DM1方案的乳腺和淋巴结pCR率(ypT0/is, ypN0)显著更低 (44.4% vs 55.7%; 绝对差值11.3 %;95% CI -20.5 ~ -2.0;P = 0.016);但T-DM1组3度或以上AE (13.0% vs 64.4%) 以及严重AEs (4.9% vs 28.8%) 发生率更低。本研究报道KRISTINE的最后结果,包括3年疗效、安全性和患者报告的结局(PRO)。
研究方法
KRISTINE研究入组了年龄18 岁或以上,临床分期为cT2-cT4 (>2cm)/cN0-cN3/cM0 (> 2 cm),HER2阳性乳腺癌。患者随机1:1分配接受新辅助T-DM1 + P或多西他赛、卡铂、曲妥珠单抗+帕妥珠单抗(TCH + P)。分层因素包括HR状态(HR+ vs HR-)、首诊时的临床分期(Ⅱ-ⅢA vs ⅢB-ⅢC期)和地理位置(北美vs 西欧 vs全球其他地区)。随机到T-DM1 + P 组到患者组新辅助治疗阶段和辅助治疗阶段均接受T-DM1 (3.6 mg/kg)和P (840 mg首次剂量,420 mg 维持剂量)。随机到TCH + P的患者新辅助治疗阶段接受TC + H (8 mg/kg 首次剂量,6 mg/kg 维持剂量)和P (840 mg首次剂量,420 mg 维持剂量),在辅助治疗阶段仅接受H + P治疗。两个治疗组中,抗HER2治疗每3周使用一次,新辅助和辅助阶段共使用18个周期或直至疾病进展、不可耐受的毒性或患者要求出组。在治疗完成前停用T-DM1的患者,可以换用曲妥珠单抗治疗,同时继续使用帕妥珠单抗至完成18个周期的抗HER2靶向治疗。
主要研究终点为研究中心评估的pCR率(ypT0/is,yoN0);其他次要研究终点指标包括EFS,定义为随机至疾病进展,包括术前局部进展;疾病复发(局部、区域、远处、同侧非浸润或对侧浸润性或非浸润性)或任意原因死亡;浸润性无病生存期(iDFS),定义为手术至第一次出现相关事件(同侧浸润性局部复发、同侧浸润性区域复发、远处复发、对侧浸润性乳腺癌或任意原因死亡)和OS。
研究结果
2014年6月至2015年6月,共随机了444例患者(T-DM1 + P组,n = 223; TCH + P组,n = 221),两组患者的基线特征均衡。激素受体阳性的患者占62.2%,临床分期ⅡA-ⅢA期的患者占83.1%,白人占66.4%,亚裔占25.2%。T-DM1 + P组和TCH + P组的中位随访时间分别为36.8个月和36.9个月。EFS事件发生风险对比,T-DM1 + P组高于TCH + P组(分层HR 2.61 ;95% CI 1.36 ~ 4.98;图2) 。主要是因为T-DM1 + P组手术前局部进展事件发生率和术后非浸润性复发事件发生率更高(表1)。T-DM1 + P组和TCH + P组3年的EFS无事件率分别为85.3%(95% CI 80.5% ~ 90.1%)和94.2%(95% CI 91.0% ~ 97.4%)。在可以评估IDFS的人群中,IDFS事件发生风险相似(分层HR 1.11;95% CI 0.52 ~ 2.40,表1,图2A)。
表1. 至事件疗效终点
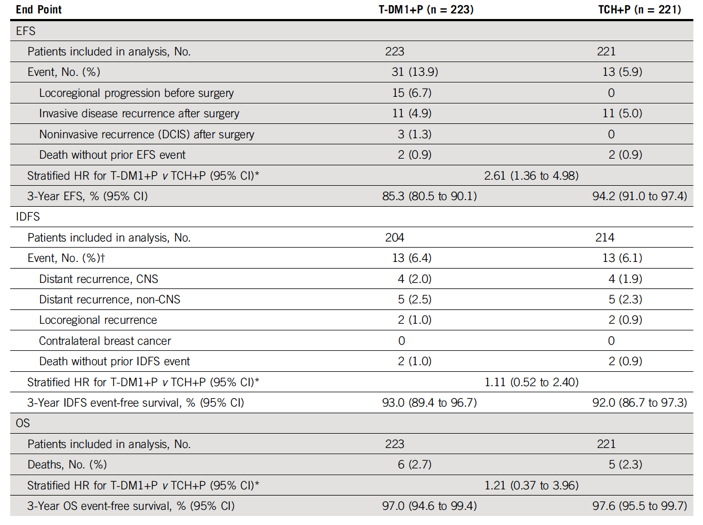
3年的无事件IDFS率,两组分别为93.0%(95% CI 89.4% ~ 96.7%)和92.0%(95% CI 86.7% ~ 97.3%)。两组的OS也相似,T-DM1 + P组和TCH + P组分别有6例和5例患者死亡,但目前死亡人数较少,很难观察到有意义的结果。在IDFS可评估人群中,同时根据pCR状态进行分析,(表2、图2C、2D)。在所有接受手术治疗的患者中(n = 418),无论患者的治疗分组和HR状态,pCR与更低的IDFS事件风险相关(分层HR 0.24;95% CI 0.09 ~ 0.60)。在取得pCR的患者中,两组IDFS事件风险相似(分层HR 0.99;95% CI 0.20 ~ 4.96)。T-DM1 + P 组和TCH + P组的3年IDFS无事件率相似,均非常高,分别为96.7%和97.5%。在新辅助治疗后有残留疾病的患者中,无论其是否接受过最佳辅助化疗,两组的IDFS 事件风险相似(分层HR 0.94;95% CI 0.38 ~ 2.33)。T-DM1 + P 组和TCH + P组3年的IDFS无事件率分别为89.4%(95%CI 83.1% ~ 95.6%)和84.2%(95% CI 72.5% ~ 96.0%)。根据激素受体状态进行亚组分析,两组的IDFS事件率仍然相似。T-DM1 + P组的204例患者中,159例接受辅助化疗、内分泌治疗和/或放疗,TCH + P组的比例为83.2% (178/214)。T-DM1 + P组共50例患者接受化疗,包括41例有残留疾病的患者(33.1%/124例)和9例pCR患者(9.1%/99例)。99例新辅助治疗后pCR的患者,9例(9.1%)接受化疗;TCH+P组无患者接受辅助化疗。
表2. 在IDFS可评估人群中,根据pCR状态分析IDFS
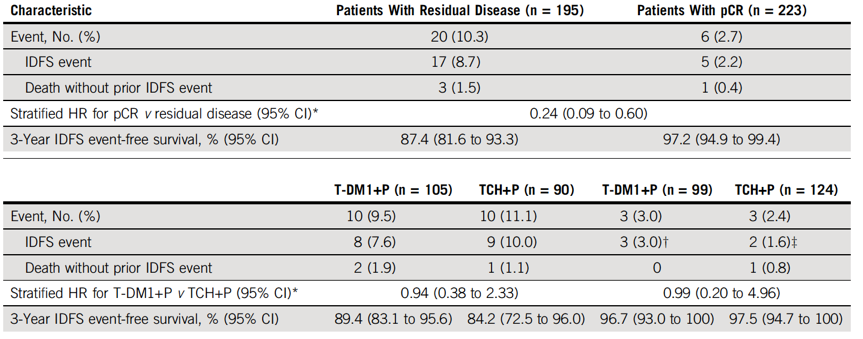
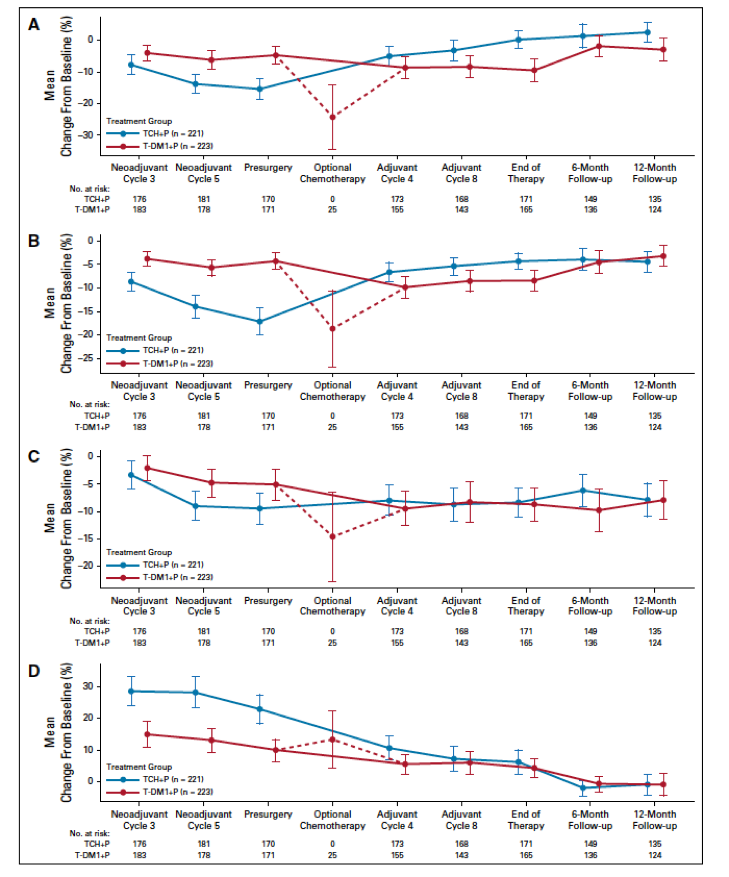
图2. A. ITT人群的EFS分析;B-D. 接受手术治疗的ITT人群中分局治疗组(B)、pCR(C)以及治疗组和pCR率(D)分析iDFS分析
安全性
T-DM1 + P组中,T-DM1和P的中位治疗时间分别为12.6和12.9个月;TCH + P组中,TC的中位治疗时间为3.5个月,HP的中位治疗时间为12.9个月。
接受T-DM1治疗的患者,19.3% 出现剂量下调。196例接受T-DM1 + P辅助治疗的患者,17 例(8.7%)因为AE转化接受H + P治疗。在新辅助和辅助整个治疗过程中,T-DM1 + P组较TCH + P组的严重sAE(13.5% vs 32.4%)和3度或以上AE (31.8% vs 67.6%)发生率更低。T-DM1 + P组最常见的≥3度AE包括贫血(5.8%)、中性粒细胞减少(3.6%)、外周神经病(3.1%)和血小板计数减低(2.2%)。TCH + P 组最常见的≥3度AE包括中性粒细胞减少(25.1%)、腹泻(15.5%)、粒缺性发热 (15.1%)和贫血(11%)。T-DM1+P组发生率≥1%的sAE包括粒缺性发热(1.3%)、贫血(1.3%)和伤口感染(1.3%)。TCH+P组为粒缺性发热(11.9%)、腹泻(4.1%)、中性粒细胞减少(3.2%)、呕吐(1.8%)、结肠炎(1.4%)和中性粒细胞计数减低(1.4%)。
PRO评估
两组患者基线的生活质量评分相似,接受T-DM1 + P治疗的患者,在新辅助治疗阶段相比于接受TCH + P治疗的患者,生活质量损伤的幅度更低(图3)。辅助治疗阶段,两个治疗组QLQ-C30和QLQ-BR23评分相当,在新辅助治疗阶段的生活质量损伤均已经恢复。
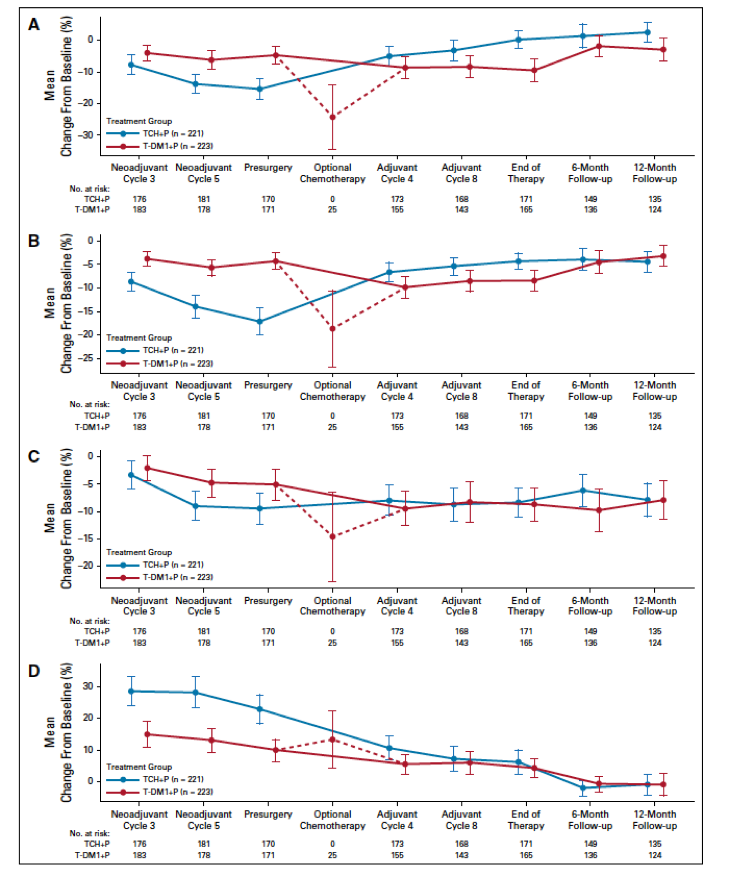
图3. 治疗过程中两组的生活质量评分
研究结论和讨论
这一Ⅲ期随机研究显示,采用T-DM1替代系统性化疗用于可手术Ⅱ-Ⅲ期HER2阳性患者新辅助治疗,EFS事件发生风险更高(HR 2.61),但IDFS事件发生风险相似(HR 1.11)。T-DM1 + P组较高的EFS事件发生风险主要是因为手术前研究者评估的局部进展较多(n = 15;6.7%)以及手术后无浸润性复发(n = 3;1.3%)。对15例出现局部进展对患者进行分析,发现其相比于T-DM1组其他患者,HER2表达水平更低,且HER2异质性更大。这些研究数据提示,HER2低表达以及异质性大的患者,需要接受传统系统性化疗联合抗HER2靶向治疗。在晚期乳腺癌中也探索了T-DM1获益和HER2表达水平的关系,虽然在所有亚组患者中,T-DM1优于传统化疗,在HER2 mRNA高水平但患者中,接受T-DM1治疗的获益更大,高于研究人群的中位值。
手术后,在IDFS可评估人群中,两组的IDFS事件发生风险无显著差异。需要注意的是,T-DM1+P组15例术前进展的患者,未纳入IDFS风险分析,因此,在结果解释时,需要慎重。此外,在T-DM1+P组,新辅助治疗后有残留疾病的患者相比于pCR的患者,更有可能在辅助治疗阶段接受化疗(33.1% vs 9.1%)。与其他研究数据一致,取得pCR的患者相比于未取得pCR的患者,无论治疗分组,有更好的长期预后,T-DM1 + P组和TCH + P组均有很高的3年iDFS无事件发生率。此外,无论患者的HR状态,均观察到pCR和更好的3年治疗结局相关。
目前,T-DM1在HER2阳性早期乳腺癌中的治疗证据正不断增多,已经有两项辅助治疗研究开展。KATHRINE研究显示,新辅助系统性化疗联合单靶和双靶治疗后,有残留疾病的患者,接受T-DM1对比曲妥珠单抗辅助治疗,发生浸润性乳腺癌复发或死亡的风险更低(HR 0.50;95% CI 0.39~0.64; P < 0.001)。正在进行的KAITLIN研究在既往未接受过新辅助治疗的患者中,对比了TDM-1+P和蒽环序贯紫杉+PH,将为TDM-1辅助治疗增加新证据。
总体而言,这一研究的优势在于经过严格的随机对照设计,且在新辅助和辅助治疗阶段均采用双靶向抗HER2治疗作为对照。研究的局限性在于EFS、IDFS和OS均是次要终点指标,研究没有足够的效能去检测这些终点指标的差异。
邱鹏飞教授精彩点评
KRISTINE研究是一项针对T-DM1设计的Ⅲ期、随机、多中心、开放性研究,旨在探索高效低毒的新型靶向药物能否取代传统化疗,是新辅助治疗领域第一项不含标准化疗的Ⅲ期临床研究。该研究的前期结果最早发布在2016年的ASCO大会,显示传统化疗+靶向药物(TCHP)组的pCR率显著优于不含化疗的T-DM1+帕妥珠单抗(T-DM1+P)组,但是T-DM1+P组在新辅助治疗阶段安全性更好。本文则报道了KRISTINE试验的次要终点,包括3年的疗效、安全性和患者报告等结果。
KRISTINE研究的启示
1. 本研究是严格的随机对照试验,并在新辅助和辅助辅助治疗阶段均采用双靶治疗作为对照。虽然研究结果显示传统化疗+双靶仍是HER2阳性乳腺癌的新辅助标准治疗方案, 但T-DM1 + P组相同的iDFS,且3级以上不良事件较低,pCR率也达到了44.4%。这为一部分无法耐受传统化疗的患者,提供了一个良好的选择。
2. 尽管T-DM1 + P组的EFS低于TCHP组(83%和94%),但两组间iDFS(排除了新辅助治疗期间进展的患者)相似(93%和92%)。另外,两组中达到pCR的患者均具有良好的预后(3年iDFS约97%),这无疑为HER2阳性乳腺癌新辅助治疗的化疗降阶梯尝试提供了新的设计思路和研究数据。
3. 在整个研究期间,T-DM1 + P组3级以上的不良事件更少,这是由于T-DM1 + P组在新辅助治疗阶段的安全性优于TCH + P组。然而,在辅助治疗阶段T-DM1 + P比HP的毒性更大,这些不良反应的增加并不能完全归因于T-DM1 + P组额外的辅助化疗(50例,24.5%)。事实上,KATHERINE研究也报道了T-DM1与更多的3级以上不良事件(24% vs 9%)和治疗中断(18% vs 4%)相关。
KRISTINE研究的局限性
1. 本研究中pCR的评估、辅助治疗阶段的放射治疗和内分泌治疗策略、以及T-DM1 + P组是否接受辅助化疗,都是遵照各家中心标准执行,缺乏统一的评估和决策。另外,研究也未设置T-DM1单药组,缺乏其在新辅助治疗中的疗效和安全性数据。
2. 本研究T-DM1 + P组允许接受在辅助治疗阶段额外的化疗,且非pCR患者比有pCR患者接受辅助化疗比例更高(33.1% vs 9.1%)。但由于接受辅助化疗的患者较少,且缺乏随机化和统一的化疗方案,我们无法对这一亚组进行有意义的分析。
3. 手术后对iDFS可评估人群的分析显示,两组间发生IDFS事件的风险无差异,但T-DM1 + P组中15例出现局部进展的患者未纳入iDFS可评估人群中,因此对该结果的解读应该审慎。另外,T-DM1 + P组有17例(8.7%)患者改用H + P,有50例(24.5%)患者接受辅助化疗,虽然比例不高但仍可能对生存数据造成影响。最后,EFS、iDFS和OS是本研究的次要终点,由于缺乏假设检验,我们需要谨慎分析这些生存数据。
砥志研思——T-DM1之于HER2阳性早期乳腺癌
T-DM1是FDA第4个获批上市的抗HER2靶向治疗药物,EMILIA研究奠定了其在HER2阳性晚期乳腺癌的标准二线治疗地位。目前,T-DM1正在逐渐步入HER2阳性早期乳腺癌中的舞台:
辅助治疗方兴未艾:正在进行的KAITLIN研究(ClinicalTrials.gov ID:NCT01966471)将比较患者在接受蒽环类药物辅助治疗后T-DM1 + P与紫杉类 + H + P的差别,从而提供T-DM1 + P在辅助治疗中生存数据。该研究的结果也许可以为HER2阳性早期乳腺癌辅助治疗中的化疗降阶梯提供新的佐证。
新辅助治疗安常守故:本文KRISTINE研究结果显示,传统化疗 + HP双靶仍是HER2阳性乳腺癌患者的新辅助治疗的标准方案。然而,2019年ASCO公布的PREDIX研究结果显示,T-DM1与多西他赛+曲妥珠单抗+帕妥珠单抗在HER2阳性乳腺癌新辅助治疗中pCR率相似(44.1% vs 46.4%, P = 0.75),且3级以上不良反应和QOL分析占优。当然,该Ⅱ期研究纳入样本量有限,且缺乏长期随访数据,尚不足以改变当前的临床实践。目前传统化疗联合曲妥珠单抗和帕妥珠单抗仍然是HER2阳性早期乳腺癌新辅助治疗的标准方案。
新辅术后以强制强:有关KATHERINE研究的结果进一步改善了新辅助治疗后有残留病灶的HER2阳性早期乳腺癌患者的预后,显示术后残留病灶患者应用辅助T-DM1比传统曲妥珠单抗的3年iDFS提高11.3%,并进一步降低了50%的复发或死亡风险。因此,HER2阳性早期乳腺癌新辅助治疗后残留病灶患者,推荐T-DM1靶向升阶梯的治疗。
瑕不掩瑜——pCR之于乳腺癌新辅助治疗
新辅助治疗已被认可为评估体内治疗效果的研究平台,以期通过短期的治疗反应预测长期的预后生存,从而加速药物由新辅助阶段过渡到辅助治疗阶段。pCR作为是一种公认的预后预测指标,即可以反映患者的药敏信息,也可以预测生存。因此,包括KRISTINE研究在内的大多数新辅助相关的临床试验都将pCR作为主要研究终点。这样固然可以通过短期的治疗反应快速的筛选出更为敏感的治疗方案,但同时也可能让我们忽略更久的生存。如何更好的利用新辅助治疗这一平台,合理利用术前的治疗反应达成早期乳腺癌治疗的最终目的——更多的治愈机会,是我们共同关注的问题。
基于pCR调整辅助治疗策略:2019年St. Gallen专家共识关于“临床Ⅱ-Ⅲ期TNBC和HER2阳性乳腺癌,新辅助治疗是否是其优选的初始治疗方案”的投票中,98%的专家赞同,说明目前的临床实践应该是在证实全身治疗疗效后再进行局部区域处理,以期最大程度地降低局部区域复发和远处转移的风险,提高该部分患者的治愈率。目前通过新辅助治疗平台的筛选,对没有pCR的患者进行辅助升阶梯治疗,不论是HER2阳性的KATHERINE模式还是TNBC的CREATE-X模式,都取得了很好的预后结果。我认为对于这两类患者,通过新辅助治疗更好地评估对于治疗反应,从而调整辅助治疗策略,可以达到更好的长期生存获益的目的。
pCR的意义不止于生存获益:KRISTINE等多项相关研究发现,尽管不同治疗方案的pCR率有所差异,但达到pCR的患者均具有良好的预后。这似乎昭示着不论采用何种治疗决策,所获得的pCR都是等同的。因此,哪些患者最有可能以更少毒性的治疗实现pCR,以及谁将有良好的长期结果也将是我们的研究目标。另外,新辅助治疗可以优化手术方式,使不可手术患者获得手术机会、使病灶较大患者获得保乳机会、使淋巴结阳性患者获得保腋窝机会。抛开pCR与患者远期生存的关系,单就其对于局部区域处理降阶梯的贡献而言,本身就已经意义非凡。最后,pCR将新辅助治疗反应简单的一分为二,而其预测关联性则依赖于分子分型、组织学分级、初始肿瘤分期和残留肿瘤负荷,也许更为系统的Neo-Bioscore评分可以替代其成为更好的预后预测指标。
小结
目前,对于HER2阳性早期乳腺癌而言,Ⅰ期患者可以采用APT模式给予单药紫杉醇+曲妥珠单抗的辅助治疗;Ⅱ-Ⅲ期患者可以参考NeoSphere研究术前给予化疗联合双靶向治疗;新辅助治疗后残留病灶患者则可根据KATHERINE研究,给予T-DM1辅助治疗强化。KRISTINE研究为HER2阳性乳腺癌新辅助治疗中靶向药物能否替代传统化疗提供了有价值的参考信息,但目前看来仍为时尚早。未来,HER2阳性早期乳腺癌治疗的个体化将成常态,我们需要“金发姑娘原则”——不多不少刚刚好——以更小的毒性来实现更好的生存,而相关的降阶梯研究也需要在pCR和其他生物标志物的指导下进行。
Slamon D, Hurvitz S.A., Martin M, et al. Neoadjuvant Trastuzumab Emtansine and Pertuzumab in Human Epidermal Growth Factor Receptor 2–Positive Breast Cancer: Three-Year Outcomes From the Phase Ⅲ KRISTINE Study. Published at jco.org on June 3, 2019
精彩回顾
【新见】徐莹莹教授&邢鹏教授:剂量密集型化疗在靶向治疗时代的价值
【新见•ASCO特刊】余科达教授:NSABP乳腺癌研究60年奥德赛之旅
【新见•ASCO特刊】郑亚兵教授:PALOMA-3:ER+晚期乳腺癌患者在氟维司群联合/不联合哌柏西利治疗中早期进展的基因组标记物
【新见•ASCO特刊】叶松青:GeparOLA Ⅱ期临床研究: 奥拉帕利联合紫杉醇对比紫杉醇/卡铂并序贯表阿霉素/环磷酰胺用于HRD阳性,HER2阴性的早期乳腺癌患者新辅助治疗的疗效
【新见•ASCO特刊】史艳侠教授:TALA in Breast Cancer
【新见•ASCO特刊】李兴睿教授:晚期乳腺癌患者的手术意义探讨
【新见•ASCO特刊】徐莹莹教授:探寻阿喀琉斯之踵--乳腺癌诊疗四十年
【新见•ASCO特刊】陈前军教授&许锐教授:HER2阳性乳腺癌的升阶治疗和降阶治疗的热点
【新见•ASCO特刊】宋东教授:精准诊疗时代乳腺癌治疗亟需生物标志物的精准选择
【新见】马力教授:Aplelisib 治疗激素受体阳性、PIK3CA突变的晚期乳腺癌
【新见】吕志栋教授:HER2阳性早期乳腺癌4年DFS数据更新:6个月曲妥珠单抗辅助治疗疗效并不劣于12个月
【新见】张聚良教授:CBCSG-036研究-内分泌联合新辅助化疗显著提高ER阳性HER2阴性患者的ORR












 苏公网安备32059002004080号
苏公网安备32059002004080号


