
第77例
“持续抗HER2,锲而不舍”对HER2+的晚期乳腺癌患者治疗来说非常重要。在临床治疗中应尽早、及时通过病理免疫组化筛选出HER2扩增,并对HER2通路持续抑制,从而能够对HER2+晚期乳腺癌患者带来持续长久的临床获益。而对于激素受体阳性、HER2阳性乳腺癌,应当通过化疗、内分泌治疗、靶向治疗有机结合,才能给患者最大的获益。

大连医科大学附属第二医院乳腺肿瘤内科主任
辽宁省百千万人才百人层次
中国肿瘤临床学会理事
中国抗癌协会乳腺癌专业委员会委员
中国临床肿瘤学会(CSCO)乳腺癌专家委员会委员
辽宁省医学会肿瘤分会副主任委员
辽宁省抗癌协会乳腺癌专业委员会副主任委员
辽宁省抗癌协会癌症与姑息康复医学会候任主委
中国医药教育协会乳腺疾病专业委员会沈阳学组副主任委员

毕业于大连医科大学,自2008年开始在大连医科大学附属第二医院肿瘤内科工作。2016年至2018年赴美国哈佛大学附属Dana-Farber Cancer Institute做高级访问学者。
中国医药教育协会乳腺疾病专业委员会乳腺癌多学科诊疗学组委员
参与国家级及省级自然科学基金多项,以第一作者在国内外期刊发表论文多篇,SCI单篇最高影响因子10.199。
基本情况
患者女性,52岁,已绝经。2014年08月主因“头痛伴右侧肢体活动障碍3月余”就诊于我院。既往史:否认慢性病、传染病、家族病史。
入院后查体:右乳6点钟及9点钟方向各触及一枚肿物,大小分别为6cm、4cm,右腋窝可触及肿大淋巴结。右侧上下肢肌力2级,肌张力2级,病理征未引出。
辅助检查:①乳腺超声:右乳腺9-10点位于乳头旁腺体层内可见一低回声团块,范围约3.2cm×1.4cm,形态不规则,边界欠清晰,呈蟹足样,内部及周边可见血流信号。6点钟位于乳头下方处腺体层内可见一低回声团块,范围约3.6cm×1.9cm,形态不规则,边界欠清晰,呈蟹足样,内部可见高回声钙化点,见血流信号。肿块周边未见导管扩张,未见皮下血肿,未见皮肤增厚。左乳腺体层回声均匀,未见明显占位性病变,未见异常血流信号。双腋下见脂肪层增厚,未见明显腺体回声。右腋下可见多个低回声,最大范围2.3cm×1.5cm,融合呈团,未见淋巴门,周边可见少量血流信号,左腋下未见明显异常肿大淋巴结。印象:右乳实性结节(BI-RADS 4c-5级),右腋下肿大淋巴结,双腋下见脂肪层增厚(副乳可能);②乳腺MR示(图1):可见左乳腺2枚肿物,大小分别为3.4cm和2.7cm,BI-RADS 5类;③胸部CT示:左肺中叶可见一实性占位,直径约1.2cm,边界规则,结合病史考虑转移来源;④颅脑MR示(图2):双顶叶占位,结合病史考虑转移,请结合临床。排除明显禁忌,遂行超声引导下右乳腺肿物穿刺活检术,病理示:(两个肿物)均为浸润性导管癌(invasive ductal carcinoma,IDC)。免疫组化示:ER(+,20%)、PR(+,20%)、HER2(2+~3+),Ki-67(+20%),进一步行HER2原位杂交(in situ hybridization, ISH)示:HER2扩增。
结合患者病史及病理学检查,目前诊断明确为:右乳腺浸润性导管癌伴右腋窝淋巴结转移、脑转移、肺转移(Ⅳ期)。
晚期一线治疗
经与患者本人及家属沟通,一线采用HT方案(多西他赛+曲妥珠单抗),同时联合颅脑立体定向放疗(stereotactic body radiation therapy,SBRT)。化疗联合靶向治疗共8周期,治疗完成后综合疗效评价(图1~2)为:部分缓解(partial response,PR)。
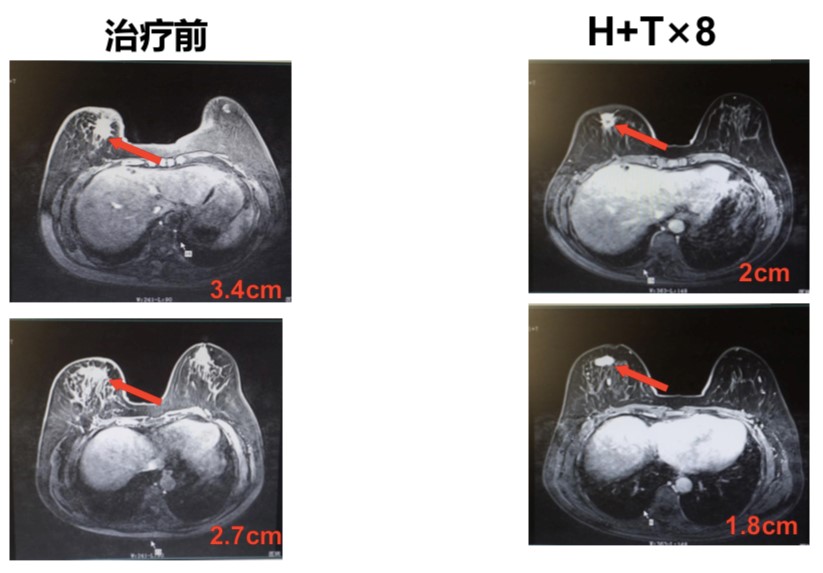
图1 患者乳腺MR(左:治疗前;右:HT 治疗8周期后)
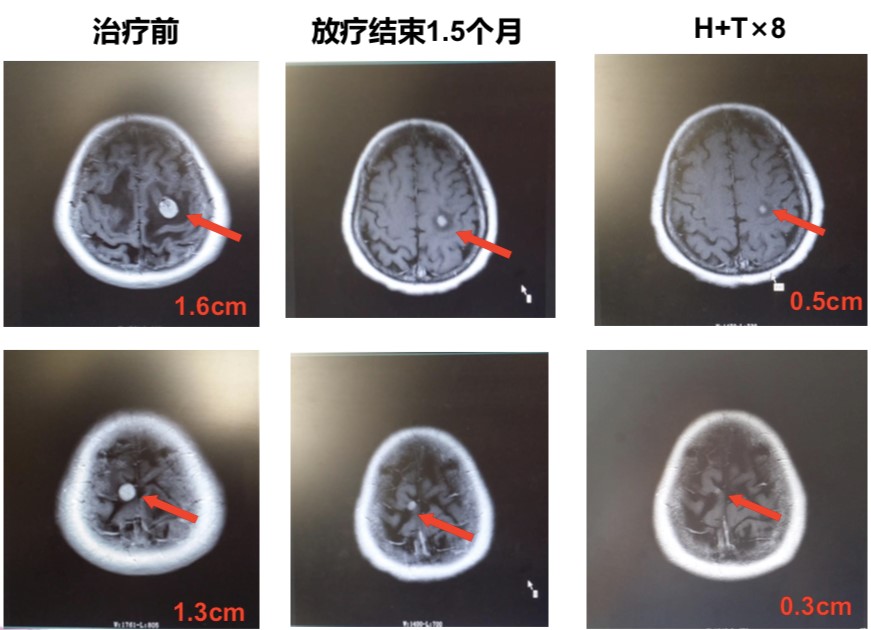
图2 患者颅脑MR
维持治疗采用来曲唑联合曲妥珠单抗治疗9个月,综合疗效评价维持PR。
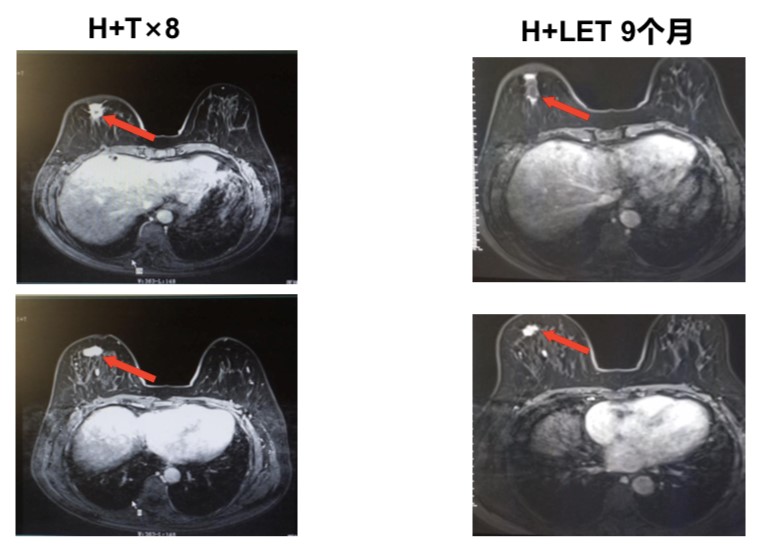
图3患者维持治疗9个月乳腺病灶变化
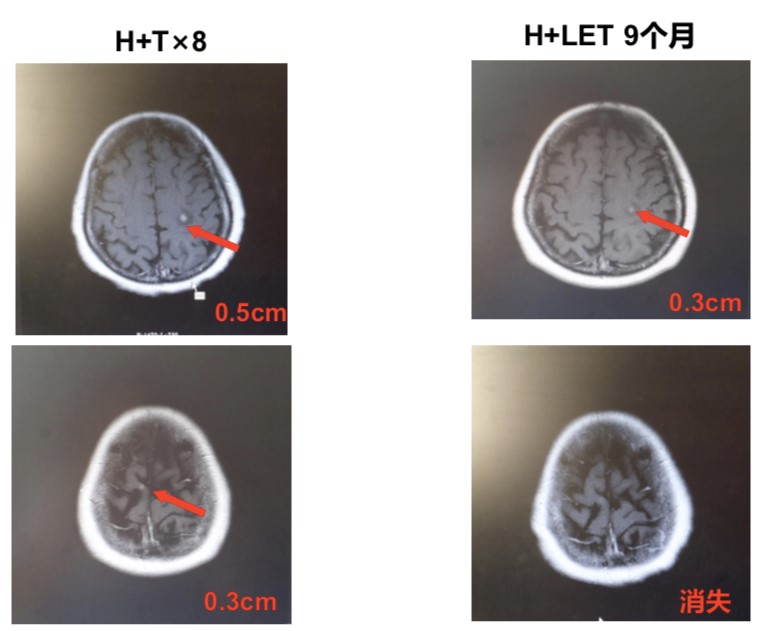
图4 患者维持治疗9个月颅内病灶变化
2015年12月患者行右乳腺癌姑息切除术,病理示:两肿物均为IDC,SBR Ⅲ级,乳头皮肤及大导管未见癌,腋窝见9/9枚转移性淋巴结。免疫组化示:ER(3+)、PR(3+)、HER2(-),Ki-67(+75%)。患者术后继续予以来曲唑联合曲妥珠单抗维持治疗。
病情进展
患者在维持治疗8个月后自行停用曲妥珠单抗4个月,仅单药来曲唑维持治疗。患者2016年3月复查胸部CT(图5)发现左肺可见一直径约1.7cm的占位,较前明显增大,结合病史考虑转移可能性大。颅脑病灶稳定,余检查未见明显异常。综合疗效评价为病情进展(progressive disease,PD),无进展生存期(progression-free survival, PFS)为28个月。后行左肺上叶部分切除术,术后病理示:腺癌,结合病史及免疫组化结果符合乳腺癌转移。免疫组化示:ER(+,60%)、PR(-)、HER2(3+),Ki-67(+20%~40%)。术后建议患者采用依西美坦联合曲妥珠单抗维持治疗。
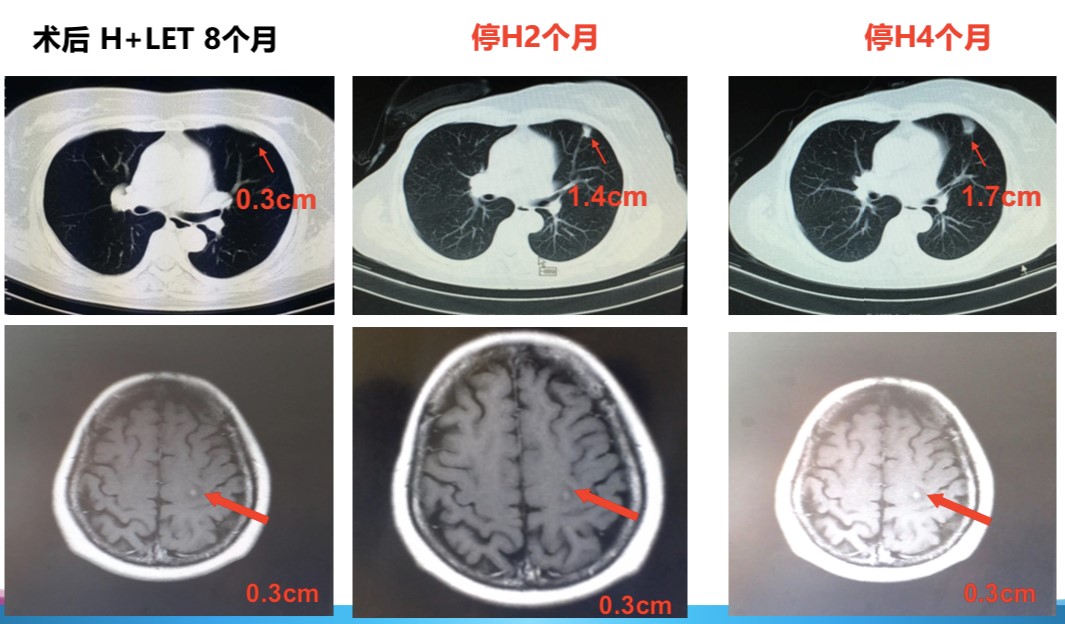
图5 患者停用曲妥珠单抗疾病变化
再次进展
患者2017年5月复查:①超声提示右侧颈部可探及多个低回声,部分相互融合,最大为2.4cm×1.3cm,部分未见淋巴门回声,可见少量血流信号。左颈部可探及多个低回声,部分相互融合,最大为1.5cm×1.1cm,部分未见淋巴门回声,可见少量血流信号。②PET-CT示:右颈部Ⅳ、Ⅴ区,双侧锁骨上区多发高代谢结节,考虑淋巴结转移可能性大,颈7椎体高代谢,结合病史考虑转移。后行右颈部淋巴结穿刺活检术,病理示:腺癌,结合病史及免疫组化考虑乳腺来源。免疫组化示:ER(+)、PR(-)、HER-2(3+),Ki-67(+30%),综合疗效评价为PD,PFS为6个月。
二线治疗采用卡培他滨联合曲妥珠单抗+唑来膦酸治疗,同时给与双颈部放疗,16周期治疗后综合评价为PR(图6)。
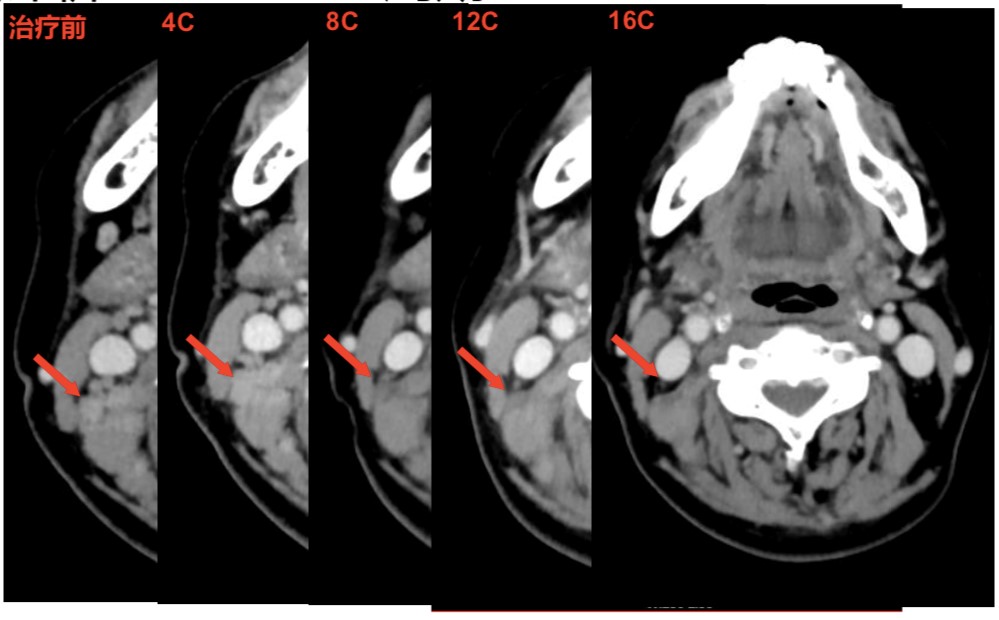
图6 二线治疗16周期患者颈部淋巴结变化
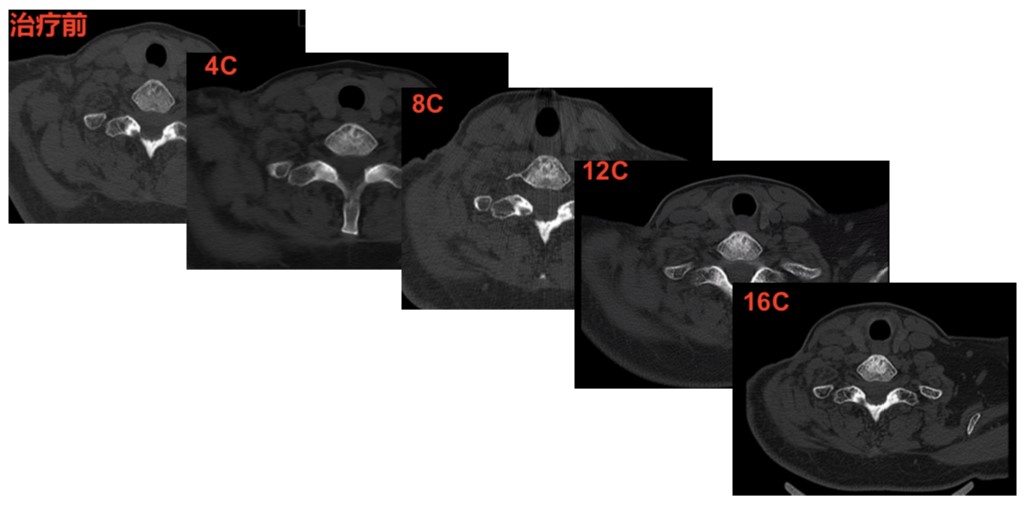
图7 二线治疗16周期第七颈椎椎体变化
第三次疾病进展
患者2018年6月发现左侧胸壁肿物,穿刺活检病理示:腺癌,符合乳腺癌转移。免疫组化示:ER(+)、PR(-)、HER2(3+),Ki-67(+30%),综合疗效评价为PD,PFS为13个月。给与三线长春瑞滨联合拉帕替尼治疗。2018年8月左胸壁肿物逐渐增大,综合疗效评价为PD,PFS仅为2个月。后给与四线T-DM1治疗 8周期,治疗后综合疗效评价为PR。目前维持至今,期间定期复查未见明显转移与复发征象(图8)。
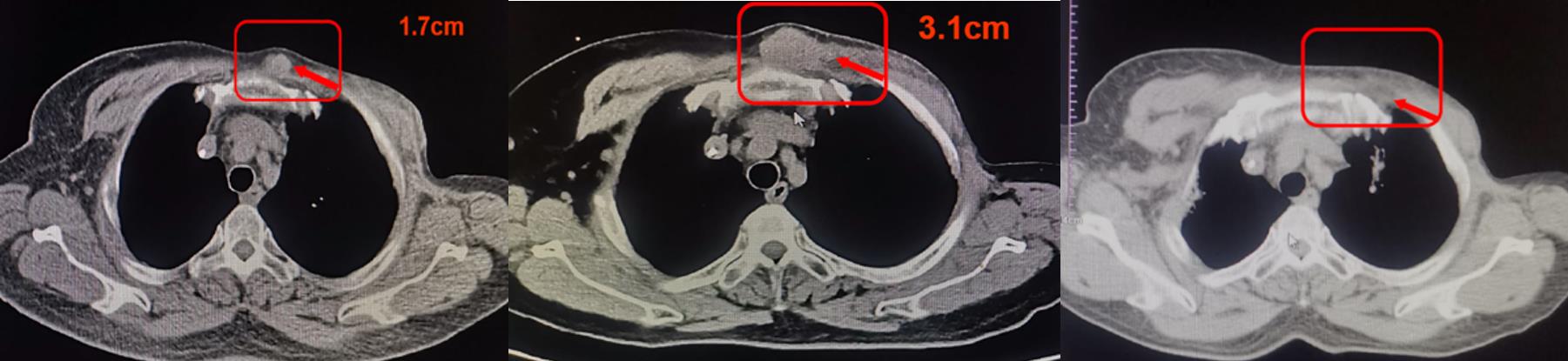
图8 胸部CT示胸部肿物变化
(左:新发;中:2周期长春瑞滨+拉帕替尼;右:T-DM1治疗后)
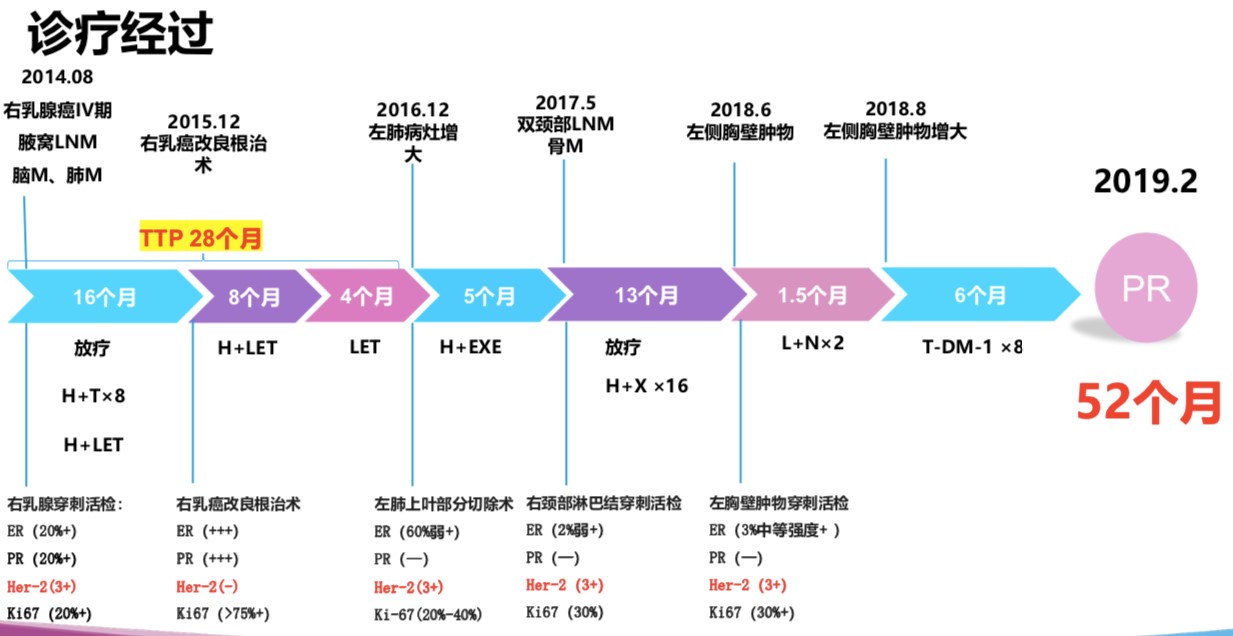
图9 患者诊疗历程
点评专家

西安交通大学第一附属医院肿瘤内科副主任
中国研究型医院学会乳腺癌专业委员会常委
中国研究型医院学会生物治疗学专业委员会青年委员
北京乳腺病防治学会肿瘤免疫治疗专业委员会常委
陕西省抗癌协会肿瘤化疗专业委员会副主任委员
陕西省抗癌协会青年专业委员会候任主任委员
陕西省抗癌协会生物治疗专业委员会常委
陕西省抗癌协会乳腺癌专业委员会常委
陕西省医学会肿瘤内科分会委员
西安市医学会肿瘤分会常委兼秘书
点评
患者中老年女性,已绝经,初诊Ⅳ期乳腺癌,腋窝淋巴结、脑、肺转移,分子分型为HR+/HER2+型。晚期一线治疗使用TH方案8周期,H+来曲唑维持治疗,疾病控制后行姑息性手术治疗,术后继续予以H+来曲唑维持治疗,因为术后病理提示HER2为阴性,患者擅自停用抗HER2治疗4个月,出现疾病进展,无疾病进展时间为28个月。随后患者多次出现疾病进展,通过多线抗HER2及内分泌治疗,目前患者生存时间已近60个月。
1. HER2阳性、激素受体阳性复发转移性乳腺癌治疗方案的选择
对于HER2阳性复发转移乳腺癌患者,接受充分的HER2靶向治疗是非常必要的。一线靶向治疗的首选应该是曲妥珠单抗为基础的治疗,根据患者激素受体情况选择治疗方案。《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》2019版明确指出,HER2阳性、激素受体阳性复发转移性乳腺癌,优先考虑曲妥珠单抗联合化疗;部分不适合化疗或进展缓慢的患者如果考虑联合内分泌治疗,可在HER2靶向治疗的基础上联合芳香化酶抑制剂治疗。对于HER2靶向治疗联合化疗达到疾病稳定的患者,化疗停止后,可考虑HER2靶向治疗联合芳香化酶抑制剂维持治疗。
该患者初诊为HER2阳性转移性乳腺癌,一线治疗选择TH方案,即曲妥珠单抗联合紫杉类治疗,患者获得病情稳定后予以曲妥珠单抗联合来曲唑维持治疗,诊疗方案符合指南推荐。
2.持续抗HER带来的获益
目前临床上对乳腺的病理组织切片进行HER2的检测,HER2阳性的定义为:免疫组化表达为HER2(3+),或HER2(2+)进一步行FISH检测阳性。只要是在病理结果中出现上述阳性结果,就可以判定肿瘤组织的HER2是扩增的。结合患者而言,其多次多部位的穿刺病理结果与手术后的病理结果在激素受体、Ki-67,特别是HER2状态的表达结果并不完全一致。充分表明乳腺癌的异质性:包括原发灶和转移灶的异质性、同一肿瘤内不同取材部位的异质性、不同时间不同治疗阶段肿瘤的异质性,从而导致了病理免疫组化结果的前后有所不同。
因此,该患者在偶然出现病理结果为HER2阴性后没有继续坚持抗HER2治疗,这也可能是患者4个月即出现疾病进展的原因。
对于复发转移乳腺癌曲妥珠单抗治疗进展后,需根据患者既往的治疗进行判断。如既往治疗有效,因为毒性或经济等多方面原因停药,则优先考虑继续使用曲妥珠单抗,换用其他化疗或内分泌治疗药物。结合患者诊疗经历,予以继续选择曲妥珠单抗为基础的治疗是合理的。
3.脑转移瘤的治疗
对于脑转移瘤的治疗,常规情况下,曲妥珠单抗作为大分子单抗,很难透过血脑屏障,曲妥珠单抗在血浆与脑脊液的比率超过300:1。但是,脑转移患者血脑屏障可能会受到许多因素的感染,包括手术、放疗、肿瘤生长等。此外,脑转移的脉管系统通常是异常的,导致血-肿瘤屏障的渗透。事实也显示,放射性同位素锆-89或铜64能够证实脑实质中曲妥珠单抗的摄取。
既往多项研究显示,HER2阳性乳腺癌患者脑转移后继续使用曲妥珠单抗可以使患者生存期延长,还有研究显示大剂量曲妥珠单抗对HER2阳性乳腺癌脑转移有效。发表于《临床肿瘤杂志》(The Journal of Clinical Oncology)的CEREBEL研究对比了HER2阳性转移性乳腺癌患者接受两种治疗方案后的脑转移发生率,研究中患者分别接受曲妥珠单抗联合卡培他滨,或拉帕替尼联合卡培他滨直至疾病进展、不可耐受的毒性或放弃治疗。结果显示,对于两组患者来说,中枢神经系统作为第一复发位点的发生率(主要终点)相似,拉帕替尼+卡培他滨组为3%,曲妥珠单抗+卡培他滨组为5%,无统计学差异。而拉帕替尼联合卡培他滨组在中位无进展生存期(6.6个月vs8.1个月;HR 1.30;95%CI 1.04~1.64;P=0.021)和中位总生存期(22.7个月vs27.3个月;HR 1.34;95%CI 0.95~1.90;P=0.095)并未显示优势,即对于乳腺癌脑转移患者,小分子TKI并未比大分子单抗显示更多优势。而CLEOPATRA研究脑转移亚组分析显示,曲妥珠单抗+帕妥珠单抗双靶方案联合化疗较曲妥珠单抗单靶联合化疗延长中位至疾病进展时间和中位OS,两组mTTP分别为15.0个月和11.9个月(HR 0.58;95%CI 0.39~0.85;P=0.0049),两组mOS分别为34.4个月和26.3个月,即对于HER2阳性脑转移患者曲帕双靶方案优于曲妥珠单抗单靶方案。
ASCO、ESMO指南以及中国晚期乳腺癌临床诊疗专家共识(2018版)中均指出,对于仅出现局部进展,如新发脑转移,而全身其他病灶维持稳定的患者,建议不要更换系统性治疗方案。结合该患者颅脑转移后继续使用曲妥珠单抗为基础的方案,患者明显获益。
4.曲妥珠单抗继发耐药,T-DM1为优选
作为一个国际标准晚期的二线抗HER2药物,T-DM1是一个靶向HER2 抗体药物结合物(antibody-drug conjugate,ADC),其含有人源化抗HER2 IgG1曲妥珠单抗和微管抑制剂DM1(美坦辛maytansine)衍生物,两者通过稳定硫醚连接物(MCC)共价连接。在晚期二线治疗方面,EMILIA研究为随机的国际性Ⅲ期研究6,纳入991例辅助治疗6个月内或针对转移性疾病治疗后进展的HER2阳性局部晚期或转移性乳腺癌患者,随机接受T-DM1(n=495)和拉帕替尼+卡培他滨(n=496)。结果显示 T-DM1组与LX组的中位PFS分别为9.6个月和6.4个月,中位OS分别为30.9个月和25.1个月。此项研究奠定了T-DM1二线治疗的地位,《CSCO乳腺癌诊疗指南》2019年版推荐T-DM1作为抗HER2的二线治疗。目前T-DM1尚未在国内上市,但应鼓励患者进入临床试验,以取得最佳生存获益。
回顾该患者的诊疗历程,作为三阳性乳腺癌,治疗过程中需要化疗、内分泌治疗和靶向治疗有机结合;作为HER2阳性乳腺癌,应当坚持不懈抗HER2治疗;在曲妥珠单抗进展后,国际标准选择是T-DM1,但是T-DM1目前尚未在国内上市,临床不可及的情况下可以选择TKI,也可以继续曲妥珠单抗并更换其他化疗药物,或者鼓励患者参与临床试验。
1. Hawkins Brian T,Davis Thomas P,The blood-brain barrier/neurovascular unit in health and disease.[J] .Pharmacol. Rev., 2005, 57: 173-85.
2.Fokas Emmanouil,Steinbach Joachim P,Rödel Claus,Biology of brain metastases and novel targeted therapies: time to translate the research.[J] .Biochim. Biophys. Acta, 2013, 1835: 61-75.
3. Leyland-Jones Brian,Human epidermal growth factor receptor 2-positive breast cancer and central nervous system metastases.[J] .J. Clin. Oncol., 2009, 27: 5278-86.
4. Verma S, Miles D, Gianni L, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer.[J]. New England Journal of Medicine, 2013, 368(25):1783-91.
5. Pestalozzi BC, Brignoli S. Trastuzumab in CSF. J Clin Oncol Off J Am Soc Clin Oncol. 2000;18(11):2349–51.
6. Dijkers EC, Oude Munnink TH, Kosterink JG, et al. Biodistribution of 89Zr-trastuzumab and PET imaging of HER2-positive lesions in patients with metastatic breast cancer. Clin Pharmacol Ther. 2010;87(5):586–92.
7. Tamura K, Kurihara H, Yonemori K, et al. 64Cu-DOTA-trastuzumab PET imaging in patients with HER2-positive breast cancer. J Nucl Med. 2013;54(11):1869–75.
8. Bartsch Rupert,Rottenfusser Andrea,Wenzel Catharina et al. Trastuzumab prolongs overall survival in patients with brain metastases from Her2 positive breast cancer.[J] .J. Neurooncol., 2007, 85: 311-7.
9. Lin Nancy U,Prowell Tatiana,Tan Antoinette R et al. Modernizing Clinical Trial Eligibility Criteria: Recommendations of the American Society of Clinical Oncology-Friends of Cancer Research Brain Metastases Working Group.[J] .J. Clin. Oncol., 2017, 35: 3760-3773.
10. Jacot William,Pons Elvire,Frenel Jean-Sébastien et al. Efficacy and safety of trastuzumab emtansine (T-DM1) in patients with HER2-positive breast cancer with brain metastases.[J] .Breast Cancer Res. Treat., 2016, 157: 307-318.
11.Pivot X, Manikhas A, Żurawski B, et al. CEREBEL (EGF111438): A Phase III, Randomized, Open-Label Study of Lapatinib Plus Capecitabine Versus Trastuzumab Plus Capecitabine in Patients With Human Epidermal Growth Factor Receptor 2-Positive Metastatic Breast Cancer.[J] .J. Clin. Oncol., 2015, 33: 1564-73.
12. Swain SM, Baselga J, Miles D, et al. Incidence of central nervous system metastases in patients with HER2-positive metastatic breast cancer treated with pertuzumab, trastuzumab, and docetaxel: results from the randomized phase III study CLEOPATRA. Ann Oncol. 2014;25(6):1116–21.











 苏公网安备32059002004080号
苏公网安备32059002004080号


