放疗,好比一个神秘武器,大家对它知之甚少,却误解甚多。近年来,放疗从技术革新到研究数据均有长足进步。从非小细胞肺癌(NSCLC)来说,如何有效地把放疗这个手段完美融入某个或各个治疗阶段,对于患者是否能够根治,或者延长生存期都是至关重要的。

浙江大学医学院附属第一医院放疗科
中国临床肿瘤学会(CSCO)患者教育专家委员会委员
中国临床肿瘤学会(CSCO)免疫治疗专家委员会委员
浙江省康复医学会肿瘤康复委员会青委会副主任委员
浙江省肿瘤靶向及细胞治疗专业委员会 青委会副主任委员
浙江省转化医学学会精准医学分会委员
主持1项国家自然科学基金和多项省级相关课题
第一作者和通讯作者发表SCI文章10余篇
参与多项抗肿瘤新药临床试验
早期NSCLC
早期肺癌患者,首选治疗方案是手术切除。但如果出现以下情况:高龄、合并其他严重疾病(心脏病、脑血管疾病、肺功能很差等无法耐受手术)而导致无法手术,难道就放弃治疗了吗?立体定向放射治疗(SBRT;stereotactic body radiation therapy,)是一种先进的体外放疗方法,针对早期NSCLC患者的临床研究已证明,SBRT提供了和手术类似的局部控制率和肿瘤特异生存率 [1]。通过复杂的规划技术,可非常精准地向肿瘤提供极大剂量的辐射,是目前国际公认的标准治疗[2]。
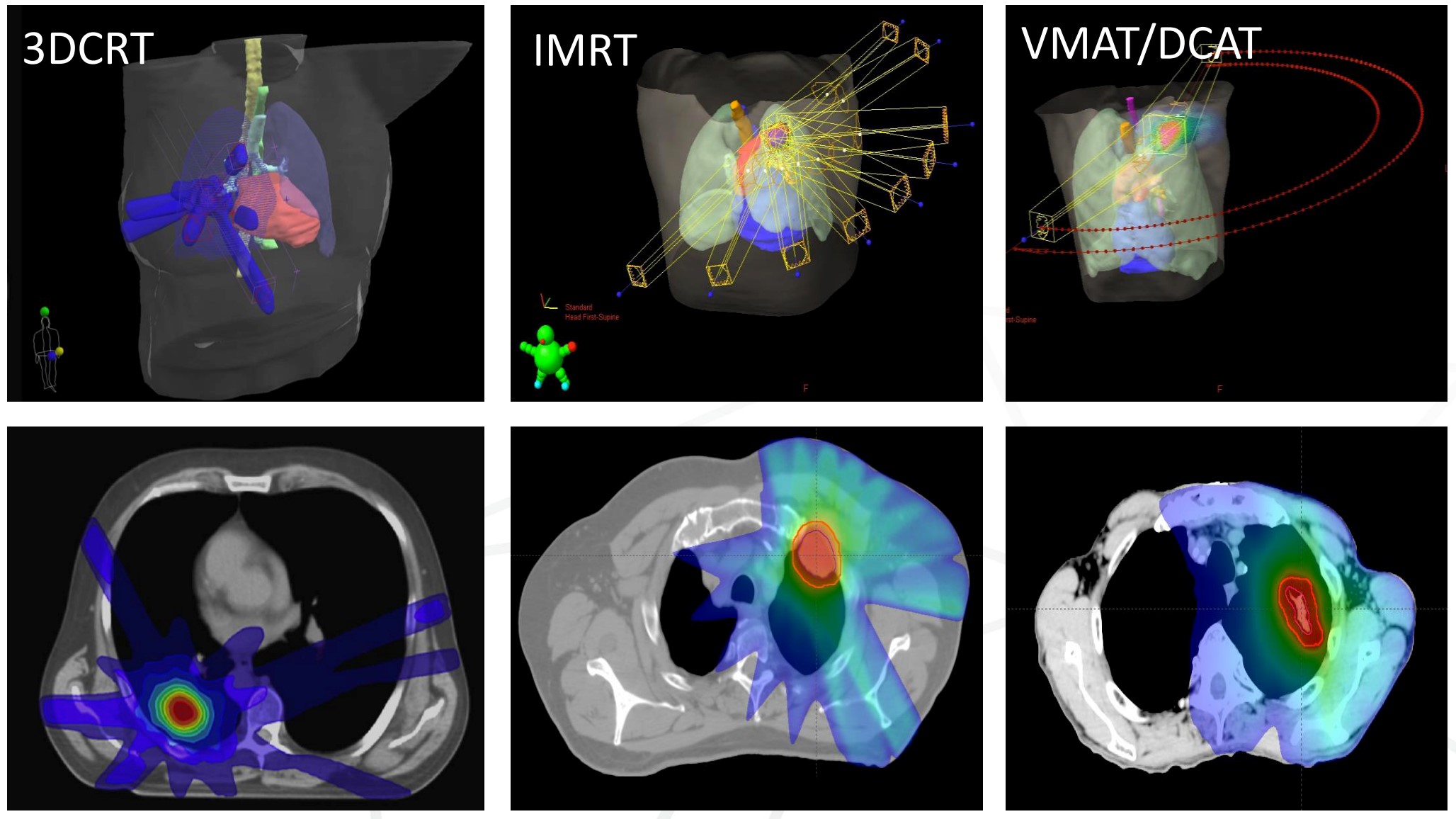
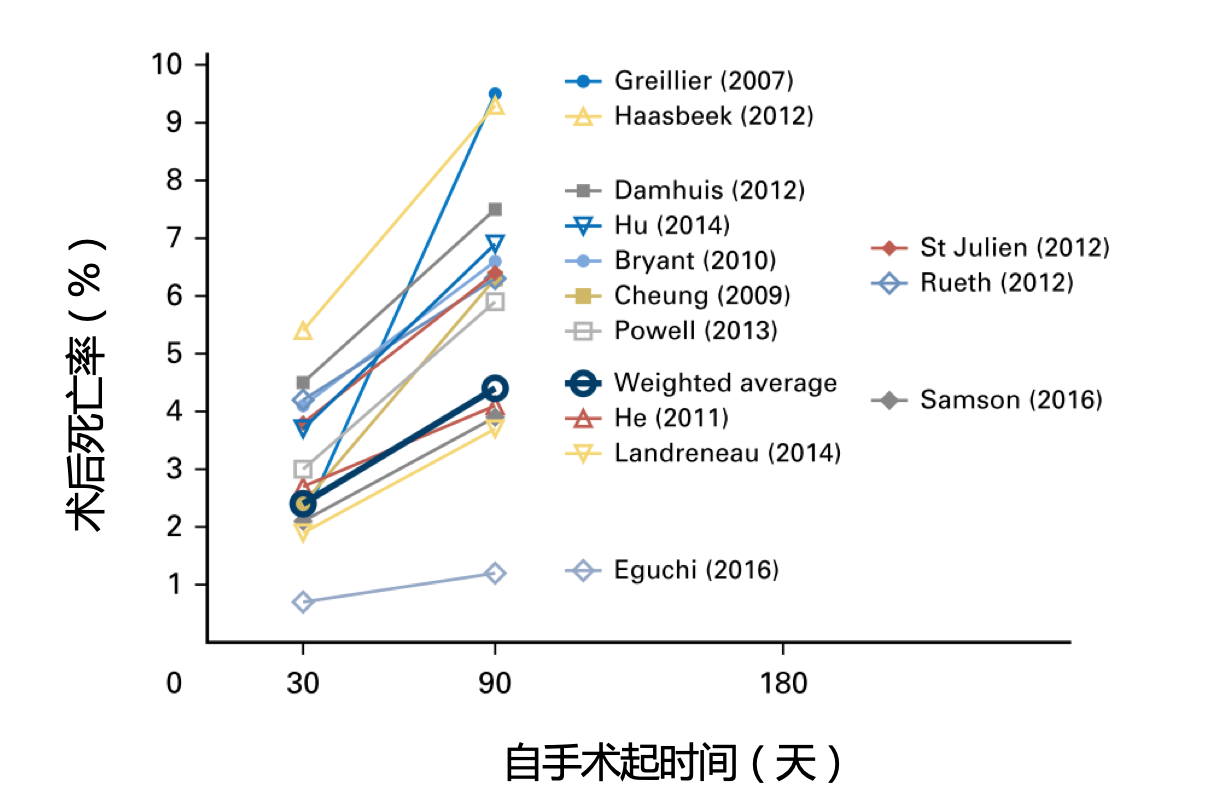
特别需要指出的是,SBRT对于外周NSCLC病灶的毒性很低,慢性疼痛<5%,急性疼痛需要药物干预的患者占10%左右,需要住院进行治疗的肺炎比例<5%,治疗相关死亡非常罕见。考虑到手术相关并发症,对于一部分患者,SBRT甚至可能成为更好的选择[3]。
 早期NSCLC放疗的价值:对于无法接受外科手术患者的替代选择,可媲美肺癌根治术。
早期NSCLC放疗的价值:对于无法接受外科手术患者的替代选择,可媲美肺癌根治术。
围手术期
对于部分有手术机会的肺癌患者(潜在可切除),如果直接手术困难,比如肿瘤侵犯大血管或神经,或淋巴结切除有难度,可考虑在手术前进行化疗±放疗,使得肿瘤缩小、降期后再行手术治疗,称为“新辅助放化疗”。术后有肿瘤残留或者淋巴结转移的患者,可给予化疗±放疗,降低局部复发风险,延长生存时间,称为“辅助放化疗”。通过对美国SEER数据库患者的分析发现,N2淋巴结转移患者可以从术后放疗中生存获益(HR=0.855; 95% CI, 0.762~0.959; P=0.0077)[4]。
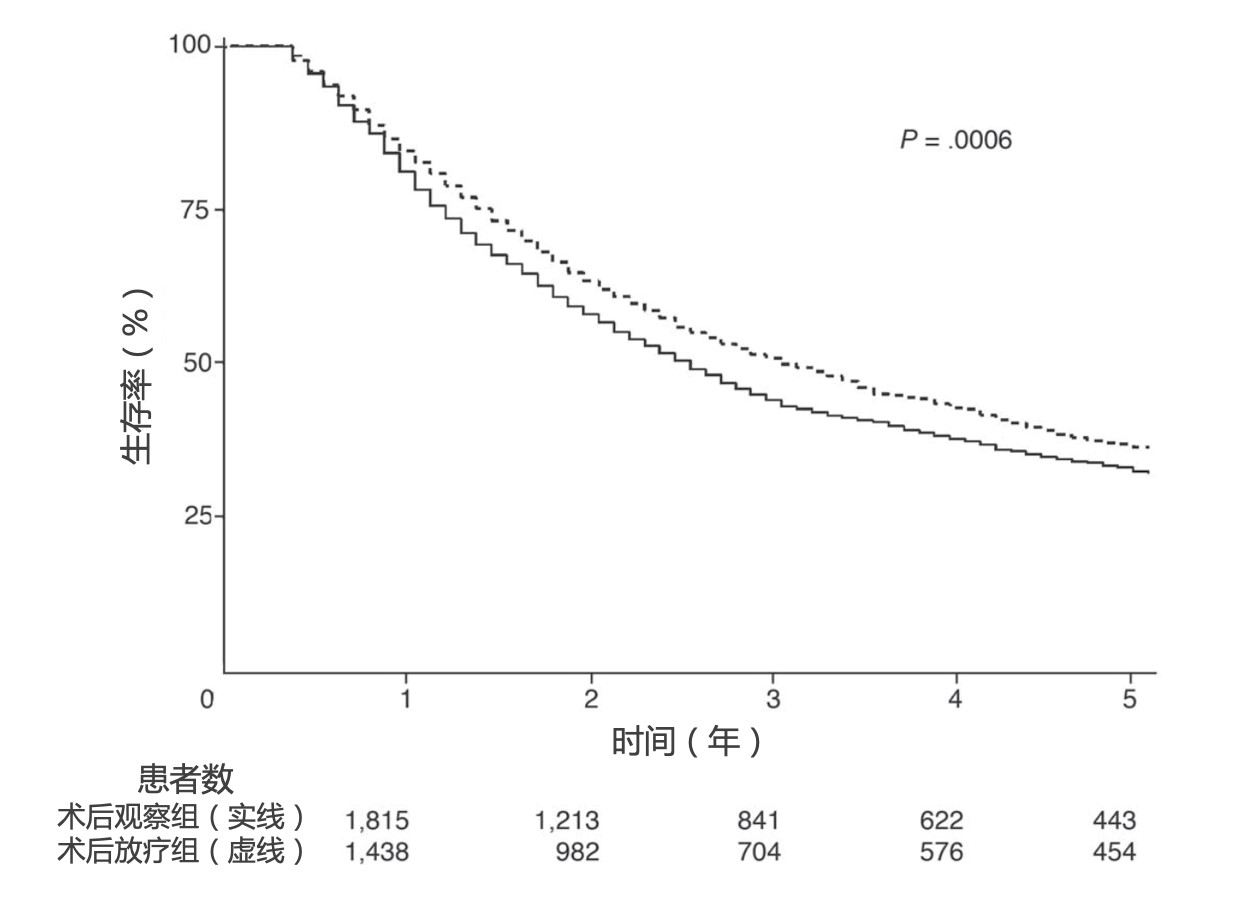
围手术期NSCLC放疗的价值:术前新辅助放化疗,降低分期,为手术创造条件;术后辅助放化疗,降低复发风险,延长生存。
不可手术局部晚期
III期患者在NSCLC患者中占1/3的比例,同步放化疗为既往的不可手术局部晚期患者的标准治疗方案。中国患者往往担心耐受性差,无法选择同步放化疗,特别是高龄患者,此时可考虑单纯性放疗。2018年发表在《胸部肿瘤学杂志》(Journal of Thoracic Oncology)的一项研究结果提示,老年患者选择放化疗比单纯选择放疗获益更大,但基石依然是放疗 [5] 。专家述评也指出:幸运儿总是那些胆儿大的 [6]!
时至2019年,肺癌治疗的热门词汇是“免疫治疗”,在免疫治疗大潮席卷之下,放疗在肺癌中的价值显得尤为重要。放疗可以诱导肿瘤细胞免疫原性改变,适应性地上调肿瘤细胞PD-L1的表达,并能提高抗PD-(L)1治疗的疗效[7],被称为免疫治疗的“点火器”。
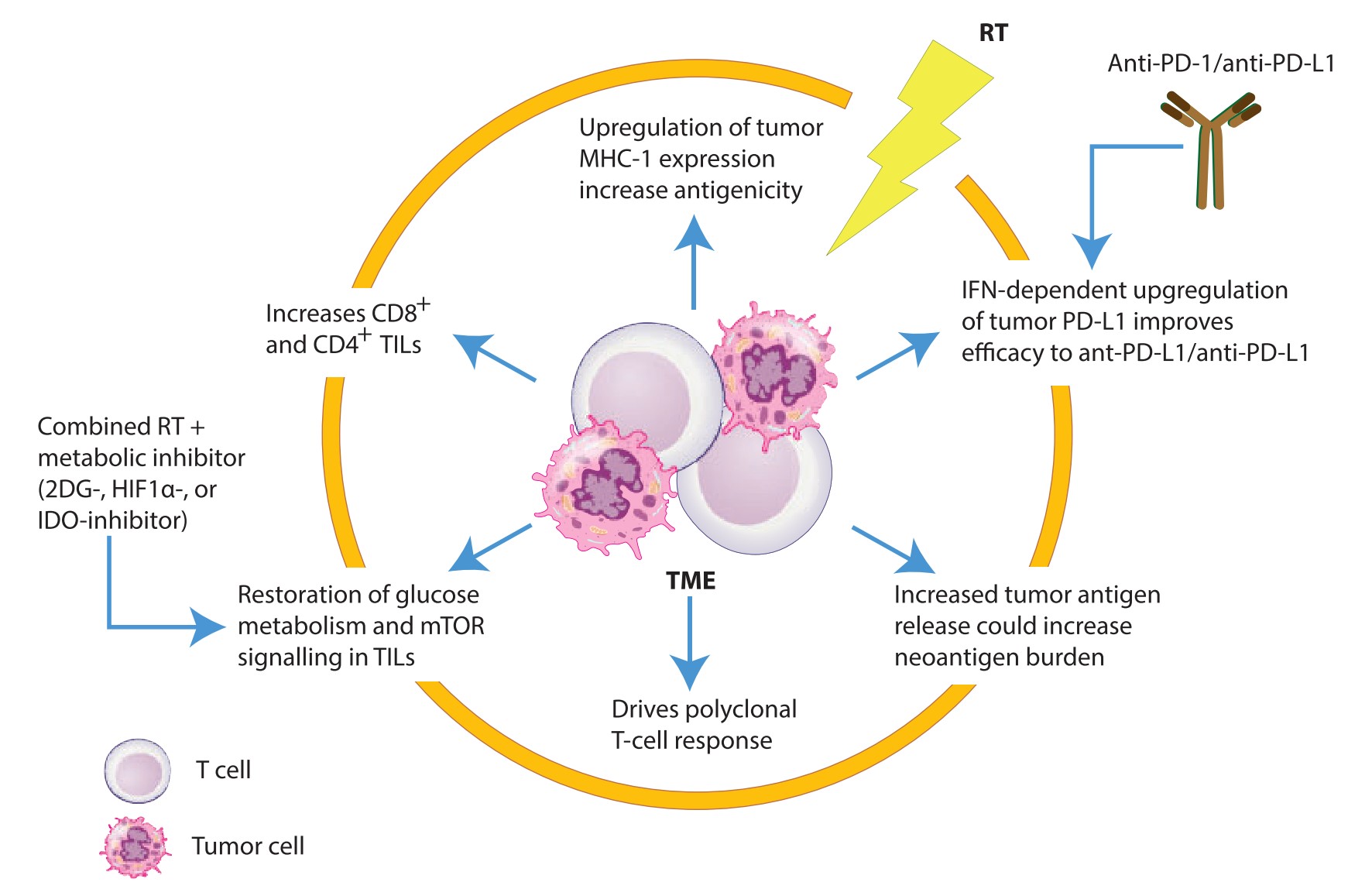
在PACIFIC研究3年总生存(OS)率57%的强大支持下,Durvalumab巩固治疗将会使更多的患者从多种治疗手段的合理搭配中,获得长期生存获益;且各预设亚组均有不同程度的生存获益。因此,不可手术局部晚期NSCLC目前的标准治疗方案为,同步放化疗后序贯Durvalumab维持治疗。
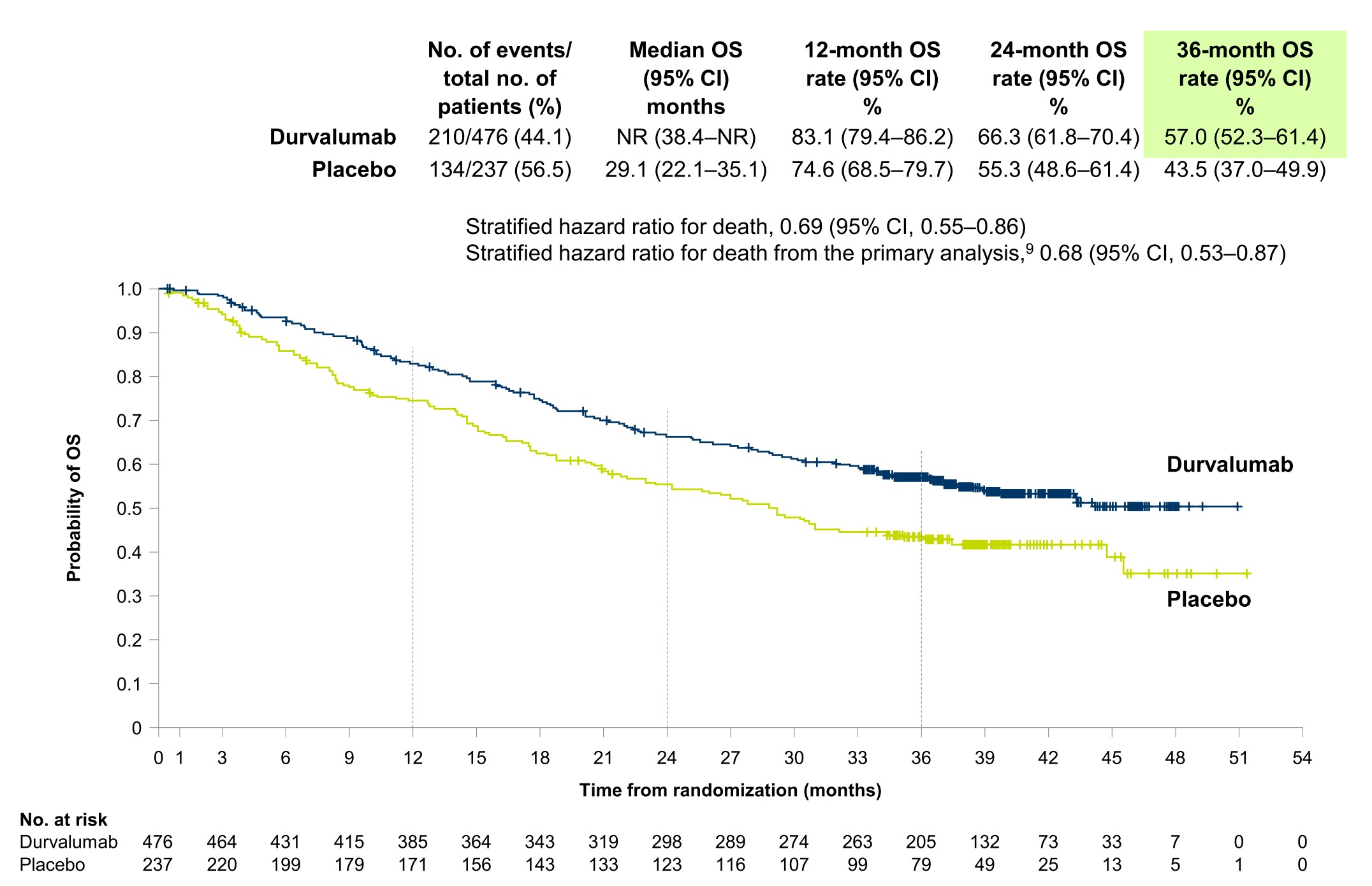
不可手术局部晚期NSCLC放疗的价值:放疗是基石,同步放化疗是既往标准,目前放化疗基础上Durvalumab免疫巩固治疗是新的标准治疗。
晚期NSCLC
放疗在晚期中的作用,既往认为意义仅局限于骨转移的止痛,或脑转移的姑息放疗等,但随着全身治疗手段的丰富和对肿瘤生物学认知的深入,放疗在晚期肿瘤中的意义和价值得到了进一步的扩展,从而使得患者生存期得以进一步延长。
1.寡转移灶:
肿瘤发生转移的部位局限,数量较少(一般认为≤5个)。基于寡转移是介于早期疾病和晚期系统性疾病的中间状态,目前学者认为,寡转移状态的治疗目的应该是潜在治愈 [8]。
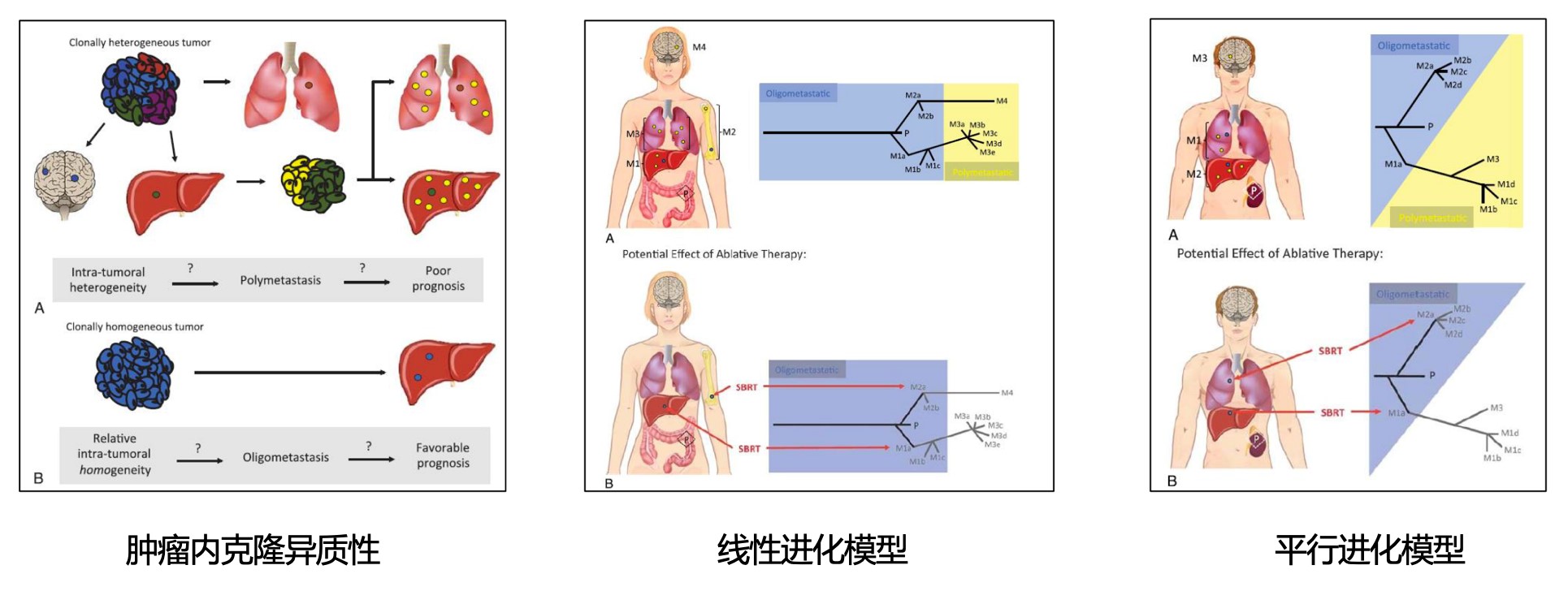
在全身治疗控制的同时,对寡转移灶进行放疗,可以显著延长疾病控制时间,此时多采用SBRT的精准放疗方法。根据寡转移灶肿瘤进化的不同,放疗不仅可以消灭局部病灶,还可以防止远处播散[9]。
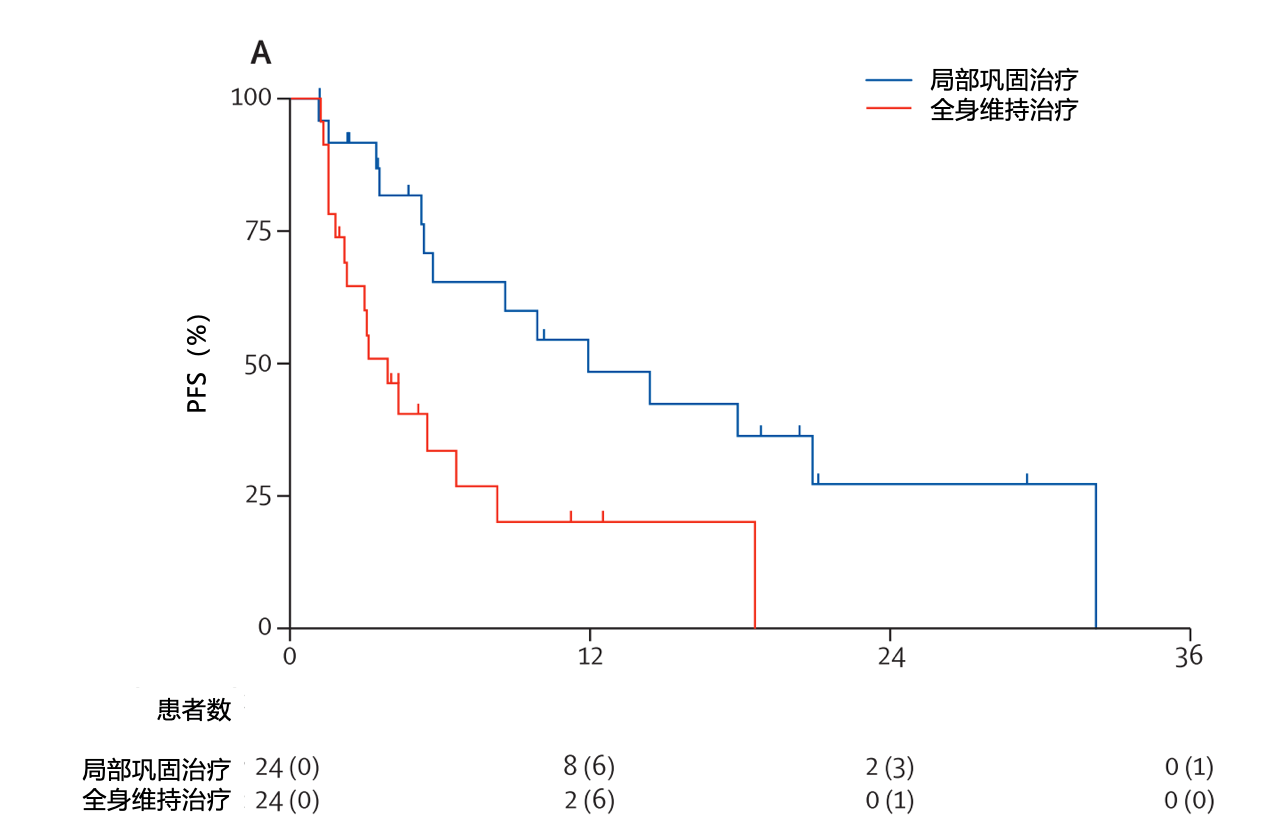
随机对照研究中,晚期NSCLC寡转移患者(不超过3个病灶),接受全身治疗,包括4个或更多周期的标准化疗(含铂双药治疗)或3个月或以上的靶向或抗血管生成药物(EGFR TKI 或ALK TKI),一线治疗后没有进展的患者随后被随机分配到局部巩固治疗(25例患者)vs 维持治疗或观察(24例患者)。结果提示,在维持治疗基础上加用局部巩固治疗(如放疗),可以改善无进展生存(PFS),这一结论证实,对于转移灶有限的IV期肺癌患者,接受维持治疗的患者可以选择接受局部治疗如放射治疗,有助于延长生存期 [10]。
2.全身系统治疗联合放疗:
晚期NSCLC失败的模式之一是局部复发。晚期肺癌全身治疗基础上,局部给予放疗,可以起到锦上添花的作用。
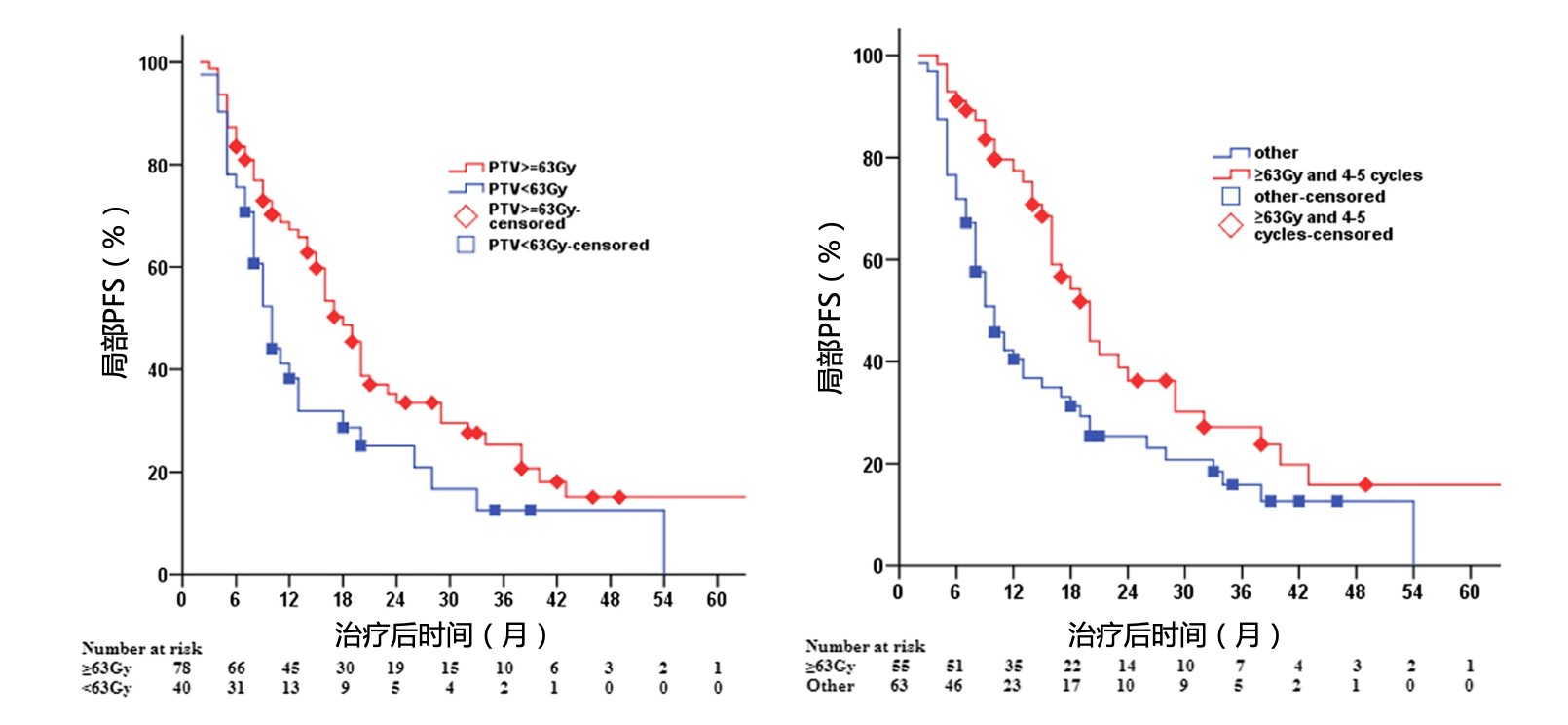
(1) 化疗联合放疗:单中心数据结果提示,在晚期NSCLC中联合应用4~5个疗程的化疗和三维放疗可延长生存期,尤其是在接受≥63Gy放疗的患者中 [11]。
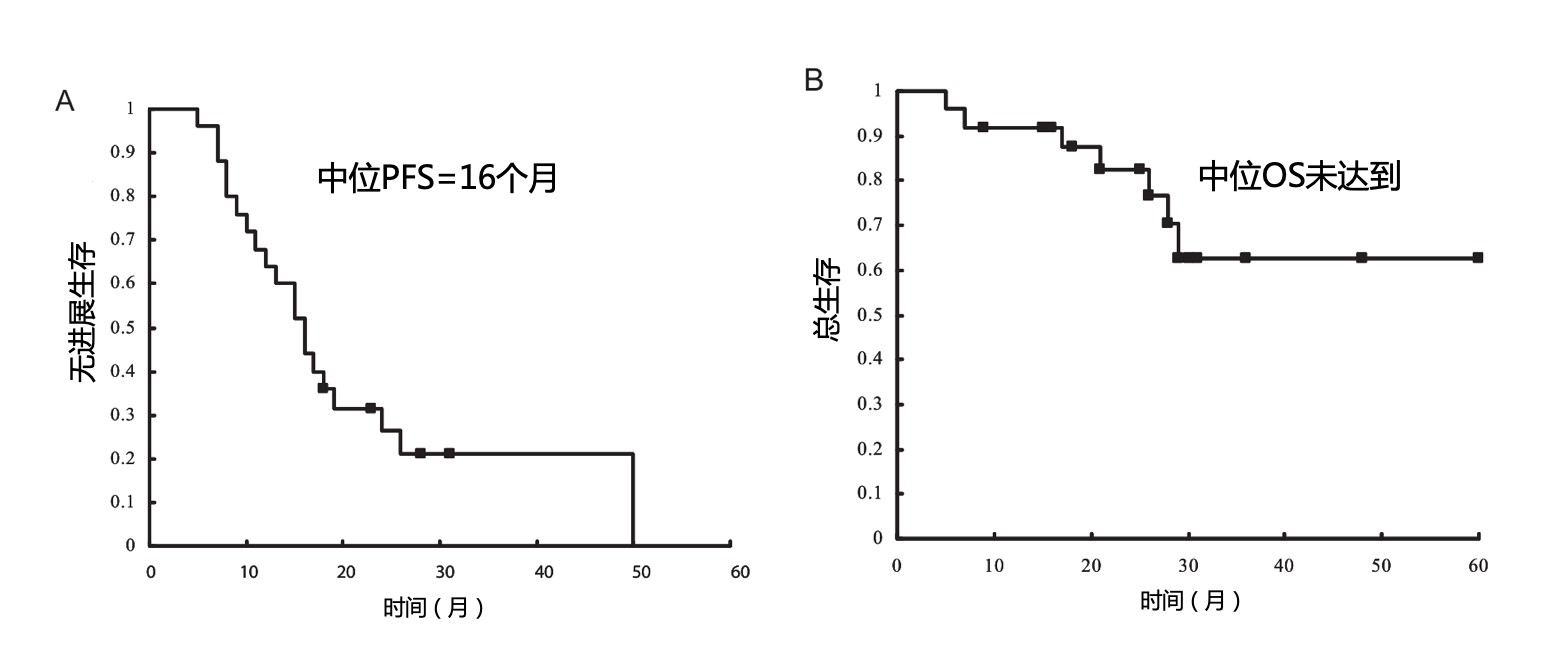
(2)靶向治疗联合放疗:对EGFR-TKI敏感的NSCLC患者,在治疗期间予以病灶多靶点放疗可有效延长PFS,为患者带来明显临床获益 [12]。
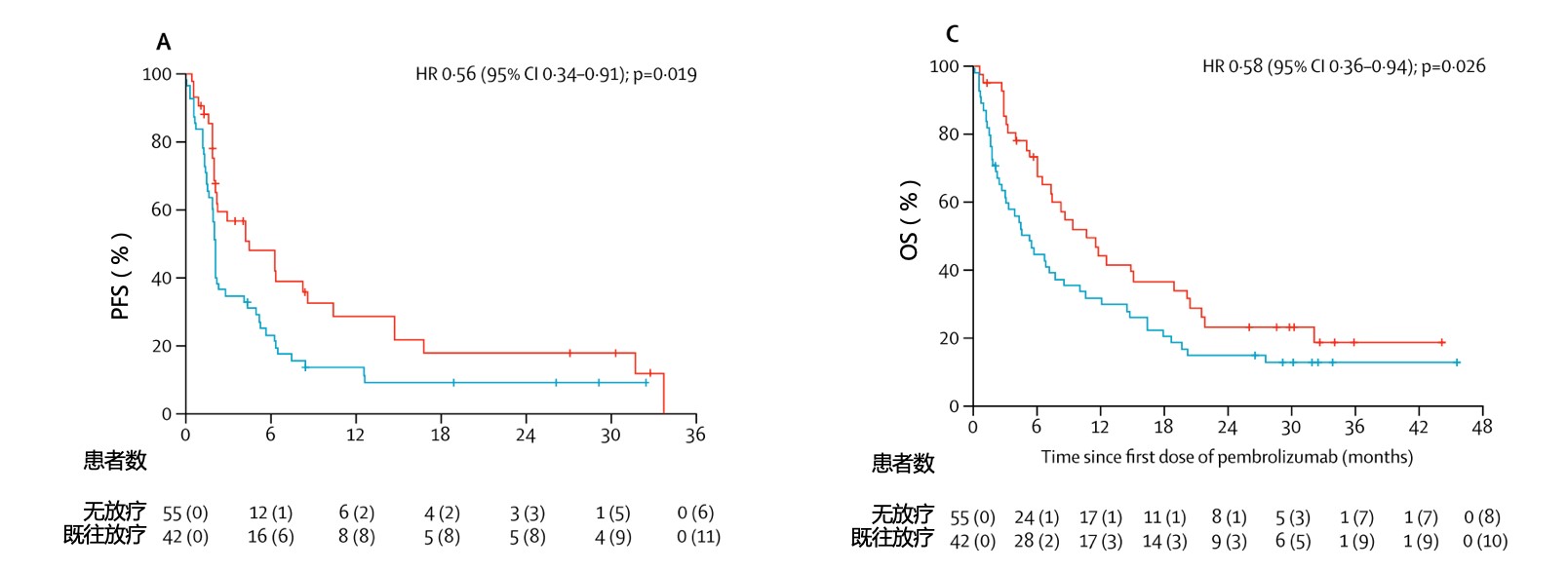
(3)免疫治疗联合放疗:KEYNOTE-001研究的二次分析发现,97例患者中,42例(43%)入组前接受过放疗,其中39%是颅外放疗,25%是胸部放疗。入组前接受放疗者PFS延长2~3倍,OS也翻倍延长 [13]。
晚期NSCLC放疗再认识:放疗作为多种治疗手段的“好伙伴+神助攻”,在晚期NSCLC治疗中的作用也越来越重要。
重新认识放疗,是在肿瘤综合治疗的背景下融入多种手段,发挥各自优势,协同作战、精准打击的完全诠释。无论是何种分期NSCLC的治疗,放疗在其中的地位和价值均是不可或缺的。
1.Chang JY, Senan S, Paul MA, et al. Stereotactic ablative radiotherapy versus lobectomy for operable stage I non-small-cell lung cancer: a pooled analysis of two randomised trials[J]. Lancet Oncol, 2015,16(6):630-7.
2.Schneider BJ, Daly ME, Kennedy EB, et al. Stereotactic Body Radiotherapy for Early-Stage Non-Small-Cell Lung Cancer: American Society of Clinical Oncology Endorsement of the American Society for Radiation Oncology Evidence-Based Guideline[J]. J Clin Oncol, 2018,36(7):710-9.
3.Rusthoven CG, Palma DA, Senan S, et al. The Head Start Effect: Will Acute and Delayed Postoperative Mortality Lead to Improved Survival with Stereotactic Body Radiation Therapy for Operable Stage I Non-Small-Cell Lung Cancer[J]? J Clin Oncol, 2017,35(15):1749-51.
4.Lally BE, Zelterman D, Colasanto JM, et al. Postoperative radiotherapy for stage II or III non-small-cell lung cancer using the surveillance, epidemiology, and end results database[J]. J Clin Oncol, 2006,24(19):2998-3006.
5.Miller ED, Fisher JL, Haglund KE, et al. The Addition of Chemotherapy to Radiation Therapy Improves Survival in Elderly Patients with Stage III Non-Small Cell Lung Cancer[J]. J Thorac Oncol, 2018,13(3):426-35.
6.Arulananda S, Mitchell P. Elderly patients with stage III NSCLC survive longer when chemotherapy is added to radiotherapy-fortune favours the bold[J]. Transl Lung Cancer Res, 2018,7(Suppl 4):S388-S92.
7.Kordbacheh T, Honeychurch J, Blackhall F, et al. Radiotherapy and anti-PD-1/PD-L1 combinations in lung cancer: building better translational research platforms[J]. Ann Oncol, 2018,29(2):301-10.
8.Hellman S, Weichselbaum RR. Oligometastases. J Clin Oncol, 1995,13(1):8-10.
9.Correa RJ, Salama JK, Milano MT, et al. Stereotactic Body Radiotherapy for Oligometastasis: Opportunities for Biology to Guide Clinical Management[J]. Cancer J, 2016,22(4):247-56.
10.Gomez DR, Blumenschein GR, Jr., Lee JJ, et al. Local consolidative therapy versus maintenance therapy or observation for patients with oligometastatic non-small-cell lung cancer without progression after first-line systemic therapy: a multicentre, randomised, controlled, phase 2 study[J]. Lancet Oncol, 2016,17(12):1672-82.
11.Ouyang WW, Su SF, Hu YX, et al. Radiation dose and survival of patients with stage IV non-small cell lung cancer undergoing concurrent chemotherapy and thoracic three-dimensional radiotherapy: reanalysis of the findings of a single-center prospective study[J]. BMC Cancer, 2014,14:491.
12.Chang CC, Chi KH, Kao SJ, et al. Upfront gefitinib/erlotinib treatment followed by concomitant radiotherapy for advanced lung cancer: a mono-institutional experience[J]. Lung Cancer, 2011,73(2):189-94.
13.Shaverdian N, Lisberg AE, Bornazyan K, et al. Previous radiotherapy and the clinical activity and toxicity of pembrolizumab in the treatment of non-small-cell lung cancer: a secondary analysis of the KEYNOTE-001 phase 1 trial[J]. Lancet Oncol, 2017,18(7):895-903.












 苏公网安备32059002004080号
苏公网安备32059002004080号


