审校:韩强 河北大学附属医院肿瘤内科
原发中枢神经系统淋巴瘤是一种罕见的非霍奇金淋巴瘤亚型,局限于脑、脑膜或眼部,与其他结外弥漫性大B细胞淋巴瘤相比,预后相对较差。而基于甲氨喋呤的诱导化疗,巩固化疗或高剂量治疗和自体干细胞移植可以改善生存,同时降低神经系统相关毒性。B细胞受体信号的异常激活和NF-κB的激活是其常见的遗传改变,为该淋巴瘤亚型的靶向治疗提供了机会。

河北大学附属医院肿瘤内科首席医师
河北省“三三三”人才工程人选。
河北省抗癌协会肿瘤内科专委会委员。
中国研究型医院学会分子肿瘤与免疫治疗专业委员会委员。

河北大学附属医院肿瘤内科主治医师
主攻淋巴肿瘤诊断及治疗
流行病学
原发中枢神经系统淋巴瘤(PCNSL)是一种限于大脑、脑膜、眼或脊髓的结外非霍奇金淋巴瘤(NHL)。PCNSL约占所有原发中枢神经系统肿瘤的2%,中位年龄为65岁。自2000年以来,PCNSL的总体发病率有所增加,尤其是老年人。
病理
大约90%的PCNSL是弥漫大B细胞淋巴瘤(DLBCL),其余由T细胞淋巴瘤、特征不良的低度恶性淋巴瘤或Burkitt淋巴瘤组成。超过90%的原发中枢神经系统DLBCL病例为活化的B细胞样(ABC)亚型。现在可以更好地理解PCNSL的分子发病机制。具有下游靶标NF-κB的B细胞受体(BCR)信号传导轴受到频繁突变的影响,主要在MYD88,CD79B和较少见的CARD11和TNFAIP3群组中。MYD88和CD79B突变在ABC PCNSL中富集,并且在CNS之外的ABC-DLBCL中更常见。因此,PCNSL更接近其他免疫豁免部位如睾丸中发现的淋巴瘤,其中超过70%的样本报告了MYD88和MYD88 + CD79B突变。
诊断和预后因素
神经认知症状是最常见的PCNSL临床特征。国际PCNSL协作组(IPCG)制定了确定疾病程度的指南。增强脑磁共振成像(MRI)扫描是检测PCNSL最敏感的放射学工具(图1)。大多数PCNSL患者存在单发肿块。PCNSL的诊断通过立体定向脑活检,脑脊液(CSF)分析或眼球受累患者的玻璃体抽吸分析建立典型的PCNS诊断模型。鉴于后两种方法可能延误诊断和治疗,建议在几乎所有手术可及的病例中立即进行立体定向活检。继发性CSF和眼部受累分别发生在PCNSL患者的约15-20%和5-20%中。呈现眼部受累的症状包括眼痛,视力模糊和漂浮物。在PCNSL中,诸如体重减轻,发热和盗汗等B症状很少发生。需要进行彻底的诊断评估以确定淋巴瘤的程度并确认对CNS的定位。如果没有禁忌,应进行腰椎穿刺,并应通过流式细胞术,细胞学和免疫球蛋白重链基因重排评估脑脊液。因为必须排除神经外疾病以确定原发中枢神经系统淋巴瘤的诊断,所以应对胸部,腹部和骨盆进行计算机断层扫描(CT)/正电子发射断层扫描(PET)扫描,并进行骨髓活检和抽吸,排除隐匿性全身性疾病。应该排除视神经,视网膜或玻璃体液的参与,并由眼科医生进行全面的眼球评估,包括光照检查。血液检查应包括血清乳酸脱氢酶和人类免疫缺陷病毒(HIV)。
已经为PCNSL专门开发了预后评分系统
在105名PCNSL患者的回顾性研究中,国际结外淋巴瘤研究组(IELSG)确定年龄大于60岁,东部肿瘤协作组(ECOG)状态大于1,血清乳酸脱氢酶(LDH)水平升高,CSF蛋白浓度升高,脑深部受累,是预后不良的独立预测因子。在具有0和1个高危因素,2和3个高危因素以及4和5个高危因素的患者中,2年生存率分别为80%,48%和15%。在另一项预后模型中,根据年龄和表现状况将PCNSL患者分为三组:(1)小于50岁;(2)大于或等于50岁,Karnofsky绩效得分(KPS)≥70;(3)大于或等于50岁,KPS <70。基于这三个分区,观察到总体和无失败生存率的显著差异。
治疗
确定对PCNSL治疗的反应需要评估疾病涉及的所有部位。IPCG已建立了适用于许多前瞻性临床试验的反应标准(表1)。
皮质类固醇可减轻肿瘤相关水肿,并可能导致肿瘤部分缓解。对皮质类固醇的初始反应与PCNSL的良好预后相关。但是,在对皮质类固醇的初始反应后,几乎所有患者都迅速复发。如果可能的话,应该在活组织检查之前避免皮质类固醇,因为存在破坏细胞形态的风险,这可能导致病理标本失去诊断价值。
鉴于该肿瘤的多灶性和潜在的长期病程,手术切除不是PCNSL标准治疗方法。神经外科手术在PCNSL中的作用是通过立体定向活检建立诊断。
PCNSL的标准化诱导和强化治疗尚未确定。从历史上看,PCNSL仅用全脑辐射(WBRT)治疗,剂量范围为36至45Gy,这导致高比例的放射反应但早期复发。 在一项多中心2期试验中,41例患者接受WBRT治疗至40Gy加20Gy肿瘤加强治疗,中位总生存期(OS)仅为12个月。由于缺乏对辐射的持久反应和导致相关的神经毒性风险,对于大多数PCNSL患者,单独使用WBRT不再是推荐的初始治疗方法。
PCNSL的有效治疗方法是静脉注射高剂量甲氨蝶呤(HD-MTX),剂量可变(1-8 g/ m2),通常与其他化疗药物和/或WBRT联合使用。然而,对于HD-MTX的最佳剂量或放射联合甲氨蝶呤在PCNSL治疗中的作用还没有达成共识。甲氨蝶呤的剂量大于或等于3g/m2可以达到脑实质和脑脊液中的治疗浓度,并且当与WBRT组合时,它们导致更持久的治疗反应。在2期试验中,79例PCNSL患者随机分为:(1)HD-MTX(3.5g/m2,第1天)和(2)HD-MTX(3.5g/m2,第1天)+阿糖胞苷(2g/m2,第2和第3天)。每个化疗周期为21天。所有患者诱导化疗后均行强化WBRT治疗。HD-MTX +阿糖胞苷组的完全缓解比例较高,3年的OS较高。随后的随机试验与诱导化疗的三个不同组进行比较:HD-MTX +阿糖胞苷与HD-MTX,阿糖胞苷,塞替派与HD-MTX,阿糖胞苷,塞替派,利妥昔单抗,所有组均接受强化治疗。四种药物MATRIX诱导与最佳总有效率相关。现在人们普遍认为,包括WBRT在内的联合治疗,神经毒性发生率很高,特别是在老年患者中。后一种观察促使使用较低剂量的WBRT进行研究。在一项多中心2期研究中,联合小剂量WBRT(23.4 Gy)和阿糖胞苷对于诱导化疗(包括HD-MTX)完全应答的患者,神经认知功能没有明显下降。有必要对这些患者进行更长时间的神经心理随访,以明确评估该方案的安全性,因为许多研究表明WBRT对PCNSL人群的迟发性神经毒性效应,以及单用化疗方案降低神经毒性的风险。考虑到临床神经毒性的风险,其他研究已经评估了WBRT是否可以从PCNSL的初始治疗中消除。在一项多中心3期的临床试验中,患者被随机分成两组,分别接受基于HD-MTX的含或者不含WBRT的化疗。入选患者551例,其中318人按协议接受了治疗。意向治疗分析显示,联合治疗组(化疗+WBRT)治疗的患者延长了PFS,但没有改善OS,说明从治疗方案中消除WBRT并没有损害OS。这导致对新诊断的PCNSL患者WBRT和单独化疗方法的延迟。这些方法是建立在HD-MTX的基础上的。HD-MTX的可变剂量和时刻表已被使用,但一般情况下,建议首次给药剂量大于或等于3g/m2,然后持续输注3小时以上,每10至21天给药一次。多项2期研究报告了基于HD-MTX的化疗方案的安全性、有效性和相对的认知保留效果。此外,长时间持续的HD-MTX诱导化疗(大于6个周期)导致更高的完全缓解比例。
PCNSL的几种第一代化疗方案中包括鞘内化疗。然而,在包括鞘内化疗的非随机研究中,与不包括鞘内注射化疗方案相比,结果没有改善。
PCNSL的联合治疗方案包含利妥昔单抗。当利妥昔单抗以375至800mg/ m2的剂量静脉使用时,脑脊液的血清药物水平实现了从0.1%至4.4%的提升。尽管脑脊液渗透率有限,但在用利妥昔单抗单药治疗的复发性PCNSL患者中观察到X线反应。需要注意的是,第3期Hovon 105/Allg NHL 24研究中,将利妥昔单抗加入以甲氨蝶呤为基础的化疗方案(HD-MTX、卡莫司汀、替尼泊苷、泼尼松),包括200例新诊断的PCNSL,均未显示出对应答率、无事件生存率和PFS有显著改善。利妥昔单抗在新诊断的PCNSL中的未来作用尚不确定。
鉴于在许多PCNSL研究中观察到的有限的持久反应,高剂量化疗(HDT)引起了人们越来越多的兴趣,其次是自体干细胞移植(ASCT)作为PCNSL的一线强化治疗。包括塞替派在内的调整方案已经显示出令人鼓舞的结果。与强化WBRT或者非清髓化疗相比,开展了许多随机试验来探讨这种方法的可行性,安全性和有效性。IELSG32试验证明,4个疗程的MATRix或其他方案后给予WBRT 36 Gy和HDT/ASCT,均安全有效,而WBRT与某些认知功能显著下降有关。
对PCNSL病理生理学的深入了解已将BCR途径确定为PCNSL发病机制中的关键机制。靶向BCR通路组分的新型药物的应用,即Bruton酪氨酸激酶(BTK)抑制剂,伊布替尼和免疫调节药物(IMiDs),如来那度胺和泊马度胺,到目前为止仅限于复发性和难治性PCNSL患者,且有较好的疗效。越来越多的临床试验探索小分子化合物和新药在复发/难治性PCNSL中的疗效,包括免疫检查点抑制剂,IMiDs,BTK和PI3K/AKT/mTOR抑制剂。
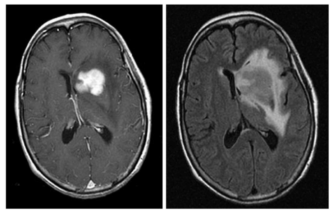
图1:原发中枢神经系统淋巴瘤患者的磁共振图像。T1‐加权后对比序列(左)显示肿瘤在左侧尾状核区域均质强化。T2/FLAIR序列(右)显示肿瘤周围有高信号,反映血管源性脑水肿。
表1:国际PCNSL合作小组关于评估PCNSL疗效的共识指南。
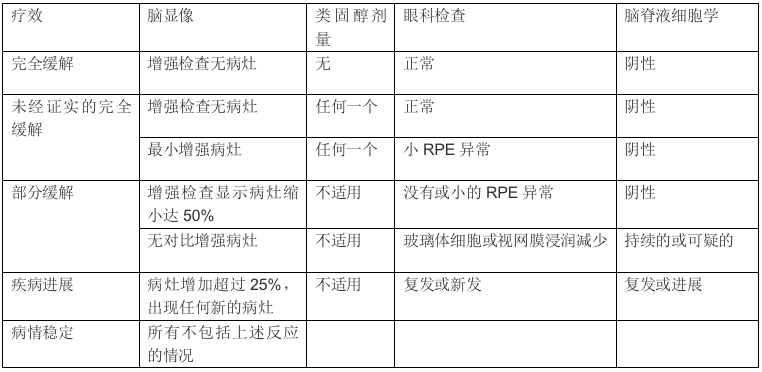
缩写:CSF,脑脊液;NA,不适用;PCNSL,原发性中枢神经系统淋巴瘤;RPE 视网膜色素上皮。
1. Dolecek TA, Propp JM, Stroup NE, Kruchko C. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2005‐2009. Neuro Oncol. 2012;14(Suppl 5):v1‐v49.
2. Villano JL, Koshy M, Shaikh H, Dolecek TA, McCarthy BJ. Age, gender,and racial differences in incidence and survival in primary CNS lymphoma. Br J Cancer. 2011;105(9):1414‐1418.
3. Swerdlow SH, Campo E, Harris NL, et al. (Eds). WHO Classification of Tumours of the Haematopoietic and Lymphoid Tissues. Lyon: IARC;2008.
4. Grommes C, Nayak L, Tun HW, Batchelor TT. Introduction of novel agents in the treatment of primary CNS lymphoma. Neuro Oncol.2018. Epib ahead of print
5. Abrey LE, Batchelor TT, Ferreri AJ, et al. Report of an international workshop to standardize baseline evaluation and response criteria for pimary CNS lymphoma. J Clin Oncol. 2005;23(22):5034‐5043.
6. Chan CC, Rubenstein JL, Coupland SE, et al. Primary vitreoretinal lymphoma:a report from an International Primary Central Nervous SystemLymphoma Collaborative Group symposium. Oncologist. 2011;16(11):1589‐1599.
7. Ferreri AJ, Blay JY, Reni M, et al. Prognostic scoring system for primary CNS lymphomas: the International Extranodal Lymphoma Study Group experience. J Clin Oncol. 2003;21(2):266‐272.
8. Abrey LE, Ben‐Porat L, Panageas KS, et al. Primary central nervous system lymphoma: the Memorial Sloan‐Kettering Cancer Center prognostic model. J Clin Oncol. 2006;24(36):5711‐5715.
9. Mathew BS, Carson KA, Grossman SA. Initial response to glucocorticoids:a potentially important prognostic factor in patients with primary CNS lymphoma. Cancer. 2006;15:383‐387.
10. Bellinzona M, Roser F, Ostertag H, Gaab RM, Saini M. Surgical removal of primary central nervous system lymphomas (PCNSL) presenting as space occupying lesions: a series of 33 cases. Eur J Surg Oncol.2005;31(1):100‐105.
11. Nelson DF, Martz KL, Bonner H, et al. Non‐Hodgkin's lymphoma of the brain: can high dose, large volume radiation therapy improve survival?Report on a prospective trial by the Radiation Therapy Oncology Group (RTOG): RTOG 8315. Int J Radiat Oncol Biol Phys. 1992;23(1):9‐17.
12. Glantz MJ, Cole BF, Recht L, et al. High‐dose intravenous methotrexate for patients with nonleukemic leptomeningeal cancer: is intrathecal chemotherapy necessary? J Clin Oncol. 1998;16(4):1561‐1567.
13. DeAngelis LM, Seiferheld W, Schold SC, Fisher B, Schultz CJ, Radiation Therapy Oncology Group Study 93‐10. Combination chemotherapy and radiotherapy for primary central nervous system lymphoma: Radiation Therapy Oncology Group Study 93‐10. J Clin Oncol.2002;20(24):4643‐4648.
14. Ferreri AJ, Reni M, Foppoli M, et al. High‐dose cytarabine plus high‐dose methotrexate versus high‐dose methotrexate alone in patients with primary CNS lymphoma: a randomised phase 2 trial.Lancet. 2009;374(9700):1512‐1520.
15. Ferreri AJ, Cwynarski K, Pulczynski E, et al. Chemoimmunotherapy with methotrexate, cytarabine, thiotepa, and rituximab (MATRix regimen) in patients with primary CNS lymphoma: results of the first randomisation of the International Extranodal Lymphoma Study Group‐32 (IELSG32)phase 2 trial. Lancet Haematol. 2016;3(5):e217‐e227.
16. Morris PG, Correa DD, Yahalom J, et al. Rituximab, methotrexate,procarbazine and vincristine followed by consolidation reduced‐dose whole‐brain radiotherapy and cytarabine in newly diagnosed primary CNS lymphoma: final results and long‐term outcome. J Clin Oncol.2013;31(31):3971‐3979.
17. Doolittle ND, Korfel A, Lubow MA, et al. Long‐term cognitive function,neuroimaging and quality of life in primary CNS lymphoma. Neurology.2013;81(1):84‐92.
18. Juergens A, Pels H, Rogowski S, et al. Long‐term survival with favorable cognitive outcome after chemotherapy in primary central nervous system lymphoma. Ann Neurol. 2010;67(2):182‐189.
19. Thiel E, Korfel A, Martus P, et al. High‐dose methotrexate with or without whole brain radiotherapy for primary CNS lymphoma(G‐PCNSL‐SG‐1): a phase 3, randomised, non‐inferiority trial. Lancet Oncol. 2010;11(11):1036‐1047.
20. Ferreri AJ, Guerra E, Regazzi M, et al. Area under the curve of methotrexate and creatinine clearance are outcome‐determining factors in primary CNS lymphomas. Br J Cancer. 2004;90(2):353‐358.
21. Batchelor T, Carson K, O'Neill A, et al. Treatment of primary CNS lymphoma with methotrexate and deferred radiotherapy: a report of NABTT 96‐07. J Clin Oncol. 2003;21(6):1044‐1049.
22. Bromberg JEC, Issa S, Bakunina K, et al. Rituximab in patients with primary CNS lymphoma (HOVON 105/ALLG NHL 24): a randomised, open‐label, phase 3 intergroup study. Lancet Oncol. 2019;20(2):216‐228.
23. Khan RB, Shi W, Thaler HT, DeAngelis LM, Abrey LE. Is intrathecal methotrexate necessary in the treatment of primary CNS lymphoma?J Neurooncol. 2002;58(2):175‐178.
24. Sierra Del Rio M, Ricard D, Houillier C, et al. Prophylactic intrathecal chemotherapy in primary CNS lymphoma. J Neurooncol. 2012;106(1):143‐146.
25. Batchelor TT, Grossman SA, Mikkelsen T, Ye X, Desideri S, Lesser GJ.monotherapy for patients with recurrent primary CNS lymphoma. Neurology. 2011;76(10):929‐930.
26. Ferreri AJM, Cwynarski K, Pulczynski E, et al. Whole‐brain radiotherapy or autologous stem‐cell transplantation as consolidation strategies after high‐dose methotrexate‐based chemoimmunotherapy in patients with primary CNS lymphoma: results of the second randomisation of the International Extranodal Lymphoma Study
Group‐32 phase 2 trial. Lancet Haematol. 2017;4(11):e510‐e523.












 苏公网安备32059002004080号
苏公网安备32059002004080号


