胃癌是全球第三大癌症死亡原因,晚期胃癌的生存预后依然不尽人意。与原发性其他部位的胃肠道肿瘤一样,腹膜是胃癌治疗失败的最常见的转移部位之一。60%的胃癌患者死亡时存在腹膜转移。无论是在初始诊断时出现腹膜转移,还是疾病进展或复发时出现腹膜转移,预后都很差。腹膜转移常导致张力性腹水、恶性肠梗阻、营养不良和恶病质等并发症,对胃癌患者生活质量可产生严重影响。

福建医科大学附属肿瘤医院内科 主治医师
美国临床肿瘤学会(ASCO)会员
中国老年学和老年医学学会精准医疗分会委员
中国老年学和老年医学学会肿瘤康复分会食管癌专家委员会委员
福建省肿瘤内科学会青年委员会委员

福建省肿瘤医院肿瘤内科副主任医师
福建省抗癌协会癌症康复与姑息治疗专业委员会青年委员会副主任委员
CSCO胃癌专家委员会委员
中国抗癌协会中西医整合肿瘤专业委员会委员
全国肿瘤姑息治疗与人文关怀专业委员会常委
福建省抗癌协会肿瘤内科专业委员会委员
ASCO会员
2012-2015年援博茨瓦纳公主玛丽娜医院
意大利胃癌研究组(Marrelli D, et al. Br J Surg. 2011)对1991—2005年治疗的2822例胃癌手术患者分析发现,胃癌发生腹膜转移的比例正在增加。这可能与弥漫型胃癌发病率增加有关。弥漫型胃癌有很强的腹膜播散潜能,特别是当肿瘤穿透胃壁时。这与肠型胃癌更多的是通过血液向远处转移不同。另外,虽然随着手术技巧提高,肿瘤的局部复发和淋巴结转移得以下降,但是腹膜转移并没有因此而减少。胃癌腹膜转移的治疗还面临很大的挑战,因此细胞减灭术(CRS)联合腹腔热灌注化疗(HIPEC)模式也被引入胃癌腹膜转移的治疗中,以期改善这部分患者的生存预后。
一、CRS+HIPEC治疗肉眼可见的胃癌腹膜转移
2011年,中国的Yang X J等发表的小型随机对照研究,68例胃癌腹膜转移患者随机接受CRS或CRS+HIPEC(顺铂+丝裂霉素)治疗。两组的中位生存时间分别为6.5个月和11.0个月(P=0.046;图1)。CRS+HIPEC联合治疗模式优于单纯CRS。多变量分析发现CC 0~1(CRS后肿瘤残留<2.5 mm)有更好的生存预后(图2)。法国RENAPA组织的研究也传递了同样的概念。能完全切除肉眼病灶的患者生存预后最好。在肉眼病灶被完全切除的患者中,PCI指数0~6分患者的生存曲线最漂亮(图3~4)。2016年RENAPA组织更新的数据显示CRS+HIPEC在胃癌腹膜转移患者中的治愈率为11%(5年无疾病生存时间),所有“治愈”的患者均为PCI < 7,CRS后肿瘤肉眼无残留(Chia CS, et al. Ann Surg Oncol. 2016)。
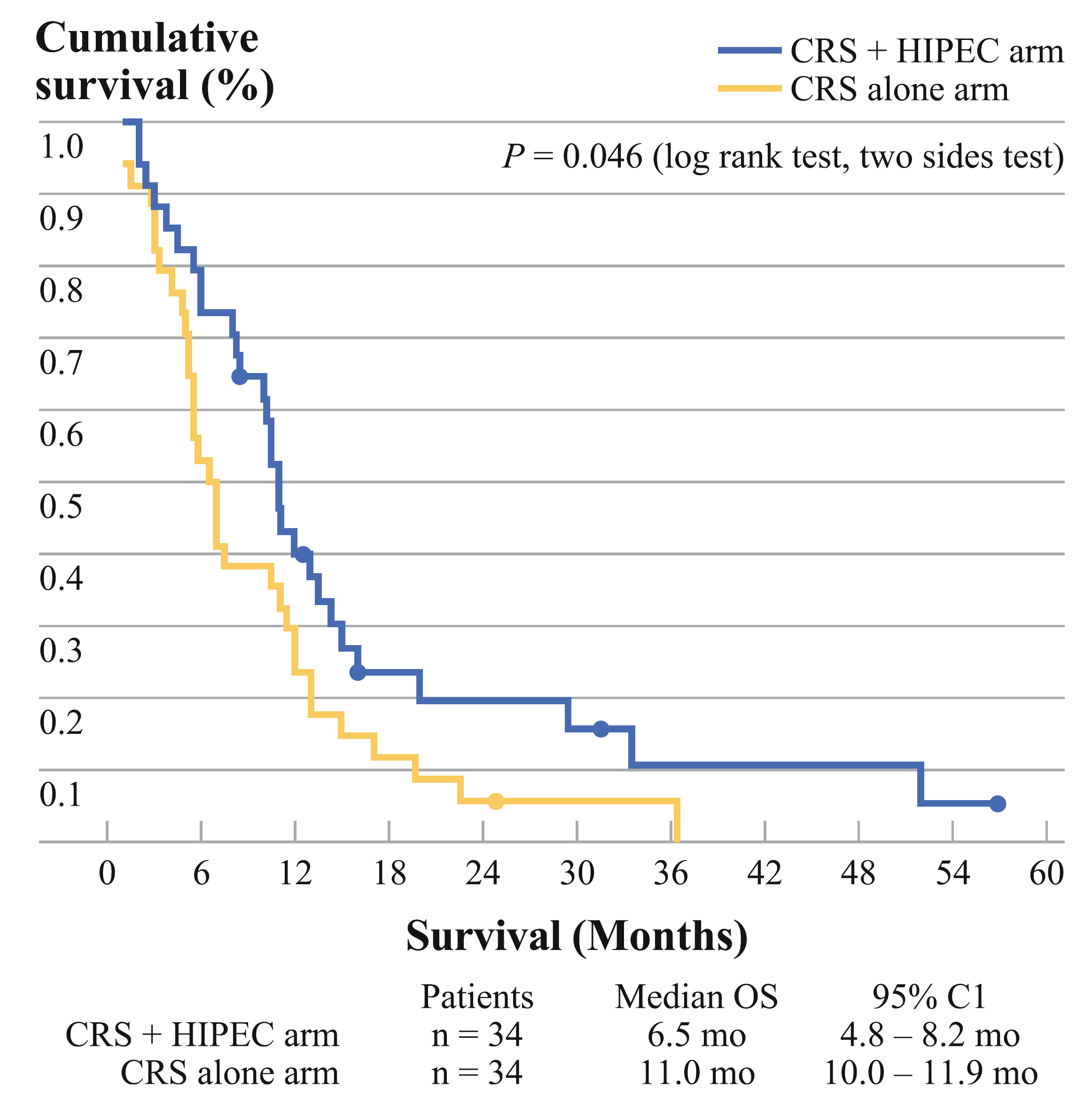
图1. CRS单纯和CRS+HIPEC联合治疗胃癌腹膜转移生存曲线(Yang X J, et al. Ann Surg Oncol. 2011)
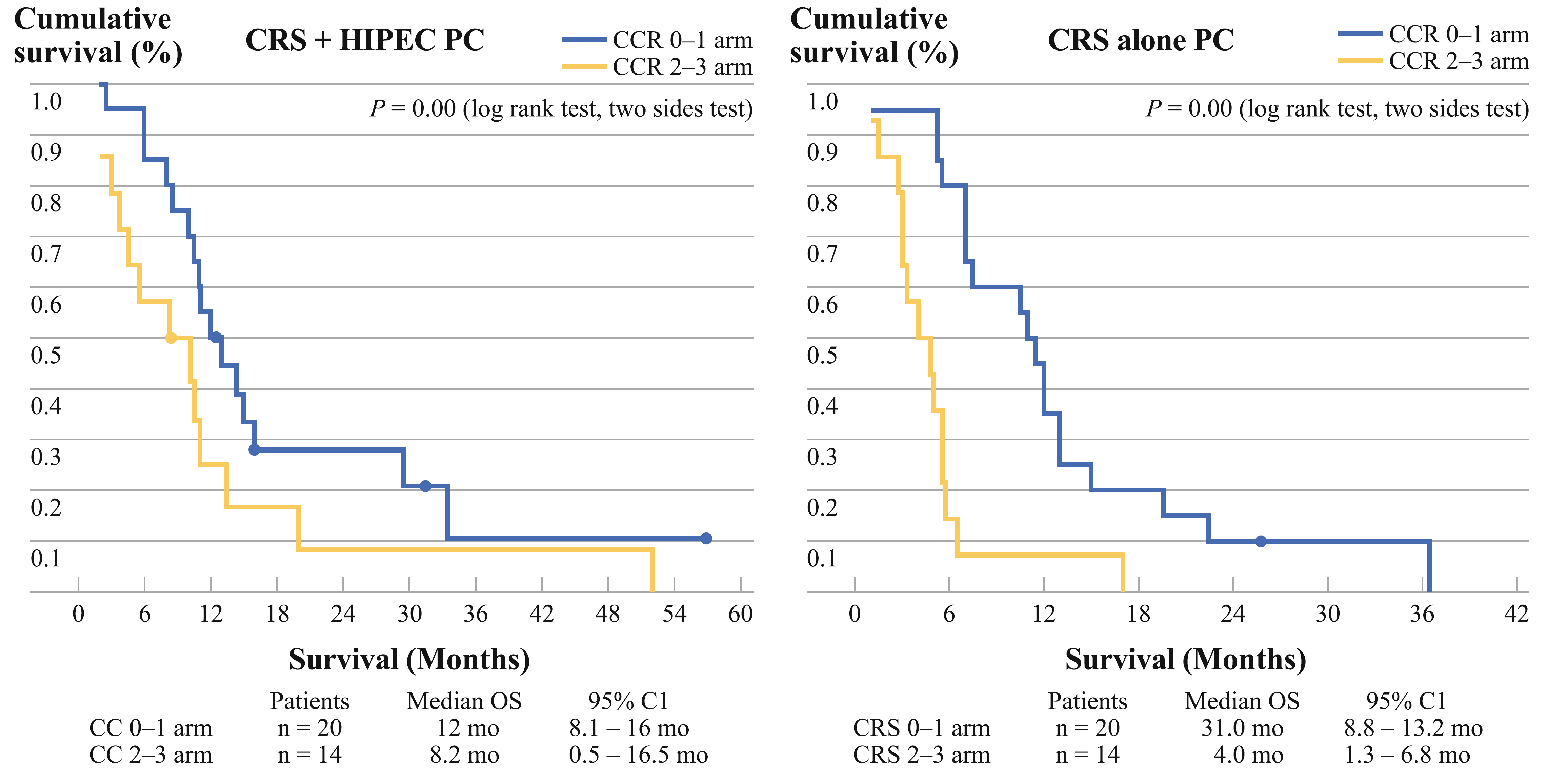
图2. 在CCR 0~1亚组的胃癌腹膜转移患者有更佳的生存预后(Yang X J, et al. Ann Surg Oncol. 2011)
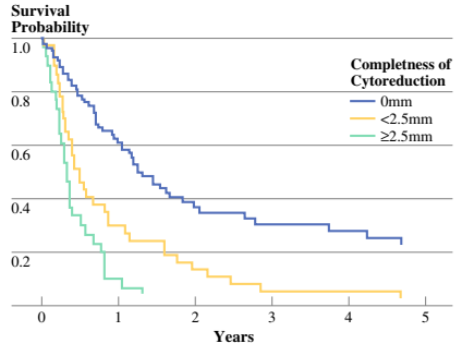
图3. 不同CRS的完全度的生存曲线(Glehen O, et al. Ann Surg Oncol. 2010)
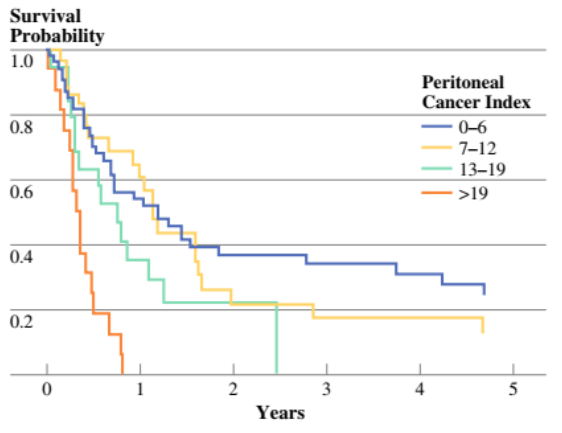
图4. 在完全CRS患者中不同PCI评分的生存曲线(Glehen O, et al. Ann Surg Oncol. 2010)
近期,腹膜表面肿瘤国际组织(PSOGI)发展了一种以治愈为目的的包括CRS和围手术期化疗在内的综合治疗方法来治疗胃癌腹膜转移。这是一个非常积极而且强烈的治疗方法。 该方法先通过腹腔镜确定PCI指数,同时放置腹腔输液港。接着进行3个周期双路腹腔/全身新辅助化疗,然后剖腹手术进行CRS+HIPEC治疗(图5)。按照这个综合治疗方法,新辅助化疗后细胞学阴性、PCI ≤ 6、完全CRS患者的5年生存率可以达到32.4%。
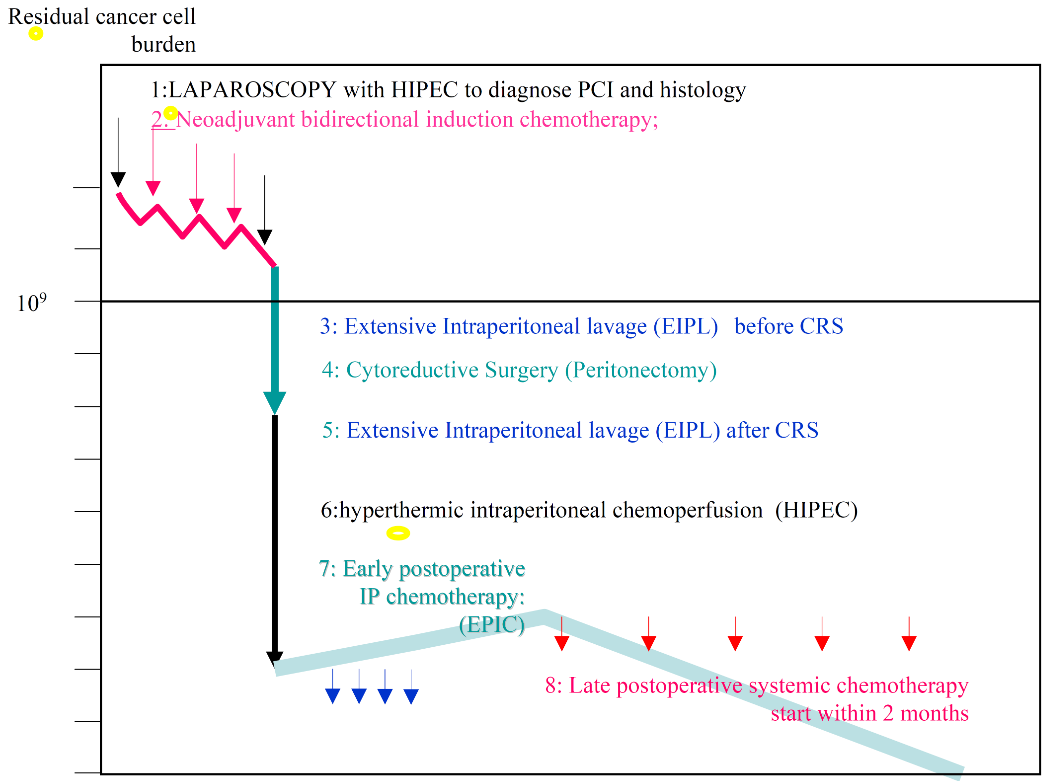
图5. 腹膜恶性肿瘤联合治疗方法(Yonemura Y, et al. Eur J Surg Oncol. 2016)
目前尚缺乏CRS+HIPEC治疗胃癌腹膜转移的大型前瞻性Ⅲ期研究,但一些前瞻性研究正在积极开展之中。GASTRIPEC是由德国Beat Rau组织进行的Ⅲ期临床研究,选择经腹腔镜证实只有腹膜转移的胃癌患者。随机分为两组,两组均接受围手术期前后各3个周期的化疗。再次手术探查时进行CRS手术,一组给予HIPEC(丝裂霉素+顺铂),另一组不给予HIPEC。中期分析时,因入组缓慢且结果并不理想,在2018年7月研究提前关闭。最终研究结果正在等待公布中(图6)。但这项研究患者PCI指数偏高,超过50%的患者 PCI> 6。另一项荷兰的Ⅲ期PERISCOPE研究,选择PCI < 7的胃癌腹膜转移患者,随机接受CRS+HIPEC或姑息化疗。预计在2020年10月可以完成入组。PERISCOPE将入组患者PCI指数限制在 < 7,这一点相比GASTRIPEC研究来说显得更合理。
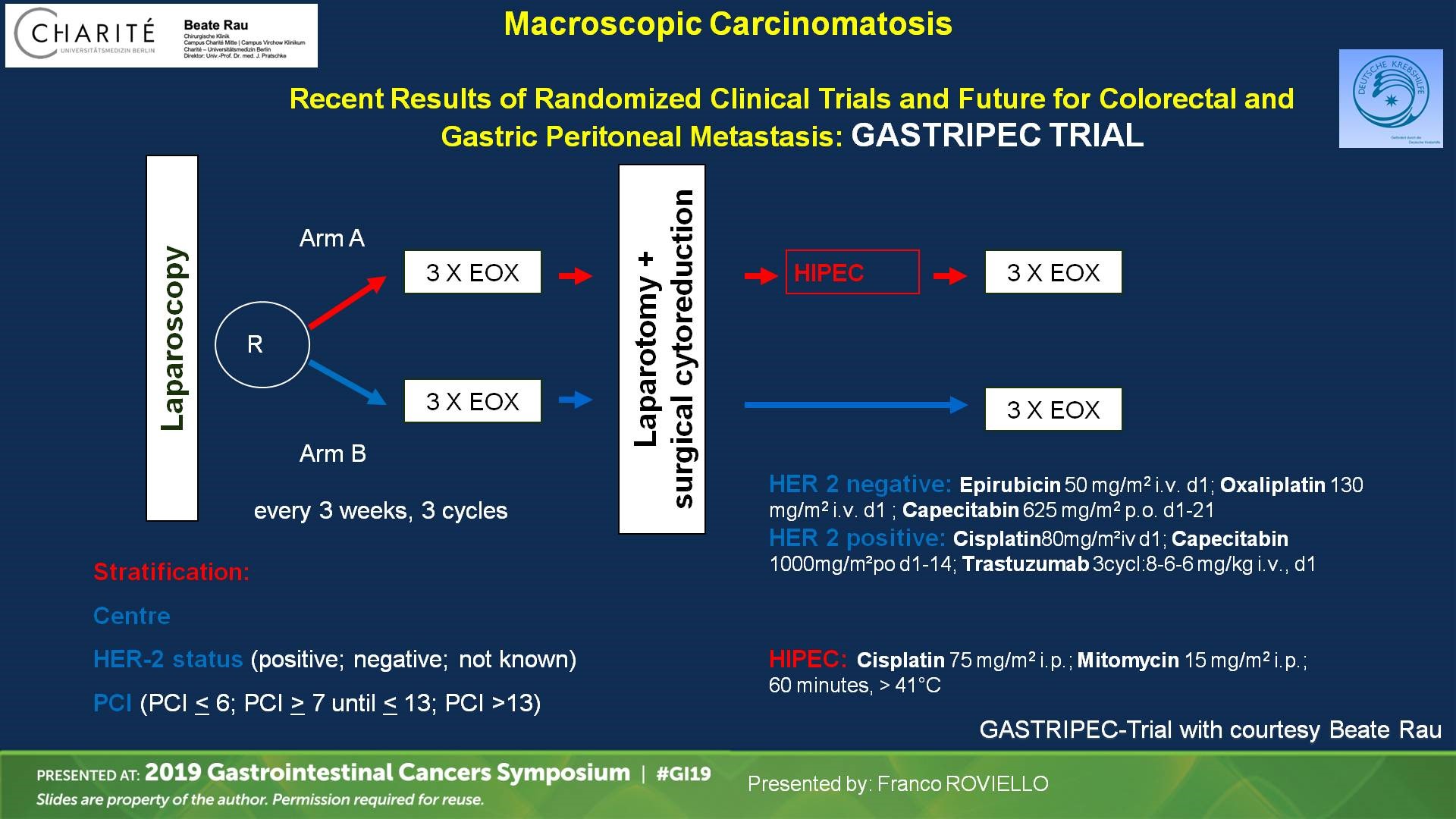
图6. GASTRIPEC研究
二、HIPEC预防胃癌腹膜转移
T3~4的胃癌,由于肿瘤浸润或穿透浆膜,很容易出现腹膜种植,在腹腔灌洗中检测到癌细胞。细胞学阳性的胃癌患者发展为腹膜转移的概率可高达80%。Roviello F等人报道胃癌术后腹膜复发与弥漫/混合型组织学类型、浆膜浸润、淋巴结受累以及肿瘤大小有关。 在弥漫/混合型组织学亚型中,无浆膜浸润的胃癌患者腹膜复发的5年累积风险为12%,而浆膜浸润的患者为69%;在肠型的胃癌患者中,浆膜阴性和阳性肿瘤患者腹膜复发的5年累积风险分别为4%和21%。(图7~8)
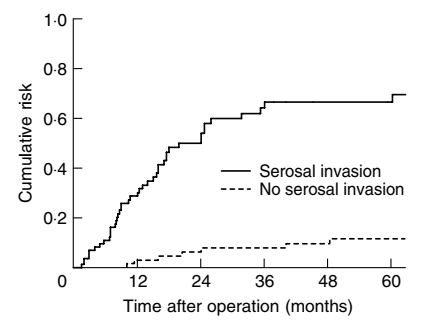
图7. 弥漫/混合型胃癌浆膜浸润与否的腹膜复发风险曲线(Roviello F, et al. Br J Surg. 2003)
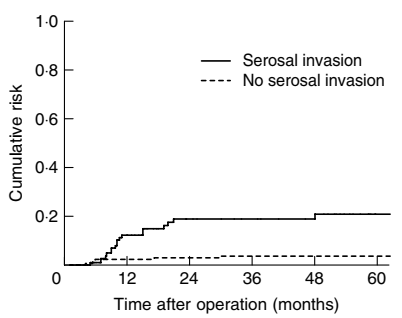
图8. 肠型胃癌浆膜浸润与否的腹膜复发风险曲线(Roviello F, et al. Br J Surg. 2003)
目前在HIPEC预防胃癌腹膜转移方面同样缺乏前瞻性随机对照Ⅲ期研究。2017年发表的来自德国的荟萃分析,共纳入11项随机对照研究和21项非随机对照研究(2520例患者)。在没有腹膜转移的患者中,3或5年生存率HIPEC组优于对照组(图9)。正在进行的德国Ⅱ期研究HIPEC-Stomach研究选择T2~4NanyM0患者,分为术前灌洗细胞学阳性、术前灌洗细胞学阳性+HIPEC(丝裂霉素+顺铂)以及术前灌洗细胞学阴性三组,主要研究终点是腹膜无复发生存时间。另一项正在进行的是来自法国的Ⅲ期GSTRICHIP研究,入组T3~4和/或N+和/或细胞学阳性胃腺癌患者,术后随机给予或不给予HIPEC(奥沙利铂)治疗。目前仍在招募患者中。这些研究都值得期待。
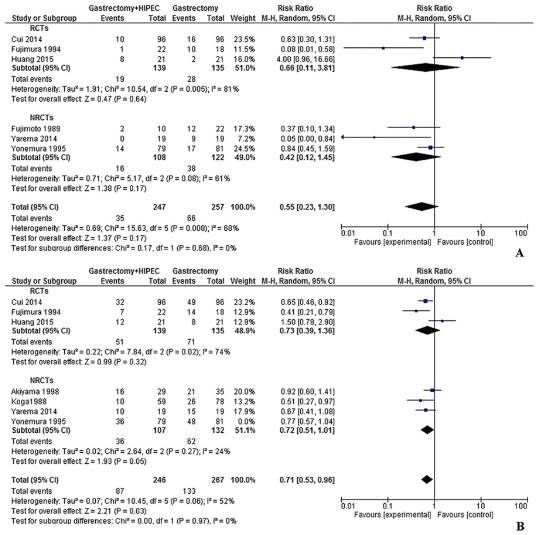
图9. 腹膜转移胃腺癌3年、5年总生存时间的荟萃分析(Desiderio J, et al. Eur J Cancer. 2017)
三、腹腔灌注化疗(没有CRS)治疗晚期患者
CRS+HIPEC需要相对较高的技术和设备要求,而且有较高的并发症和死亡率。不进行CRS且只在常温下进行腹腔化疗药物反复灌注的方法,其操作简单,只要在皮下进行腹腔输液港埋植(图10),甚至简单地放置腹腔输液导管即可(图11)。其安全性高,耐受性好,正逐渐被推广和研究中。由于紫杉醇腹腔给药可以达到1000的腹腔内和血浆的曲线下面积比,因而成为越来越热的腹腔灌注药物。PHOENIX-GC研究是第一个紫杉醇腹腔灌注的Ⅲ期研究,研究入组胃癌腹膜转移患者,以2∶1的比例随机接受IP方案[腹腔灌注紫杉醇20 mg/m2和静脉注射紫杉醇50 mg/ m2,d1、8;S-1 80 mg/(m2×d),d1~14,每3周重复]或SP方案[S-1 80 mg/(m2×d),d1~21,顺铂 60 mg/(m2×d),d1、8,每5周重复]。共183例患者入组。除了IP组中患者腹水显著更多之外。两组之间基线特征平衡。IP和SP组的中位生存时间分别为17.7个月和15.2个月(HR=0.72;95%CI,0.49~1.04;P =0.080)。在调整腹水基线的敏感性分析中,HR=0.59(95% CI,0.39~0.87;P = 0.008)。 IP组的3年总生存率为21.9%,SP组为6.0%(图11)。虽然该试验未能显示腹腔灌注紫杉醇有统计学优势,然而探索性分析表明腹腔灌注紫杉醇可能对胃癌有临床获益。我们中心进行的Ⅱ期FNF-004研究,对比FOLFOX联合或不联合紫杉醇80 mg/m2腹腔灌注治疗(图12)。虽然腹腔灌注高剂量紫杉醇没有提高有效率,但是延长了患者的生存时间,而且耐受性好。因此,提高腹腔紫杉醇灌注剂量可能可以进一步提高治疗疗效。
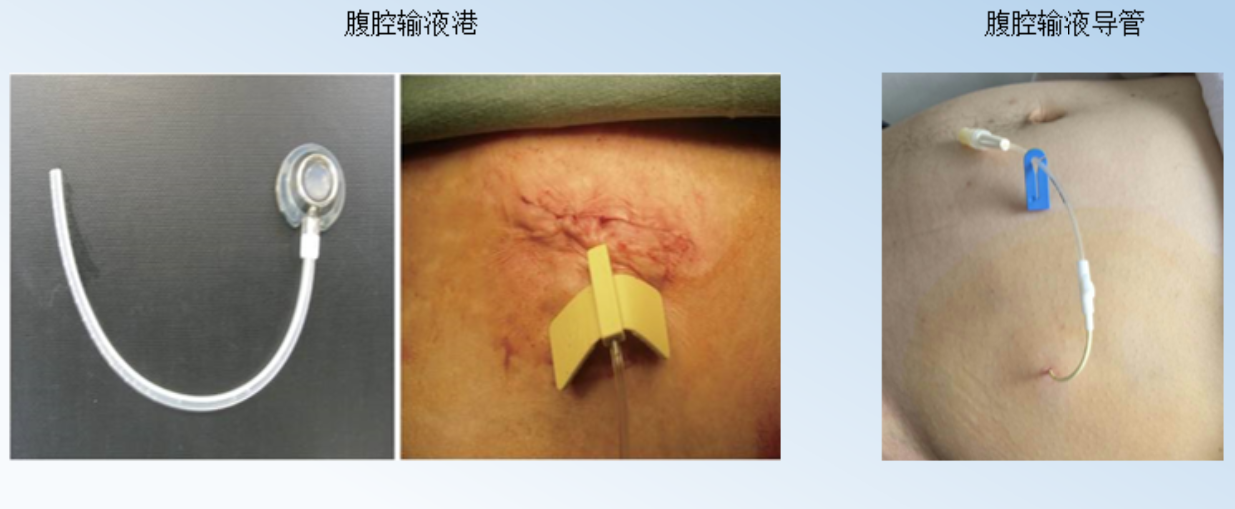
图10. 腹腔输液港和腹腔输液导管
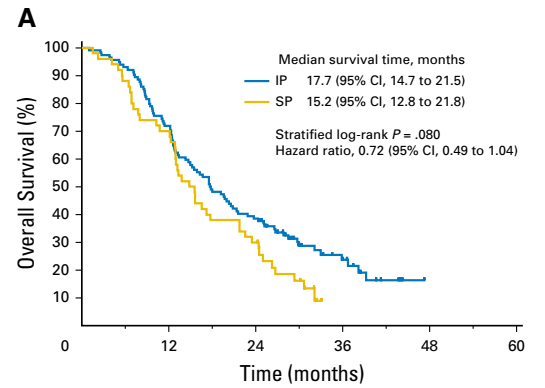
图11. 全分析集患者生存曲线(Ishigami H, et al. J Clin Oncol. 2018)
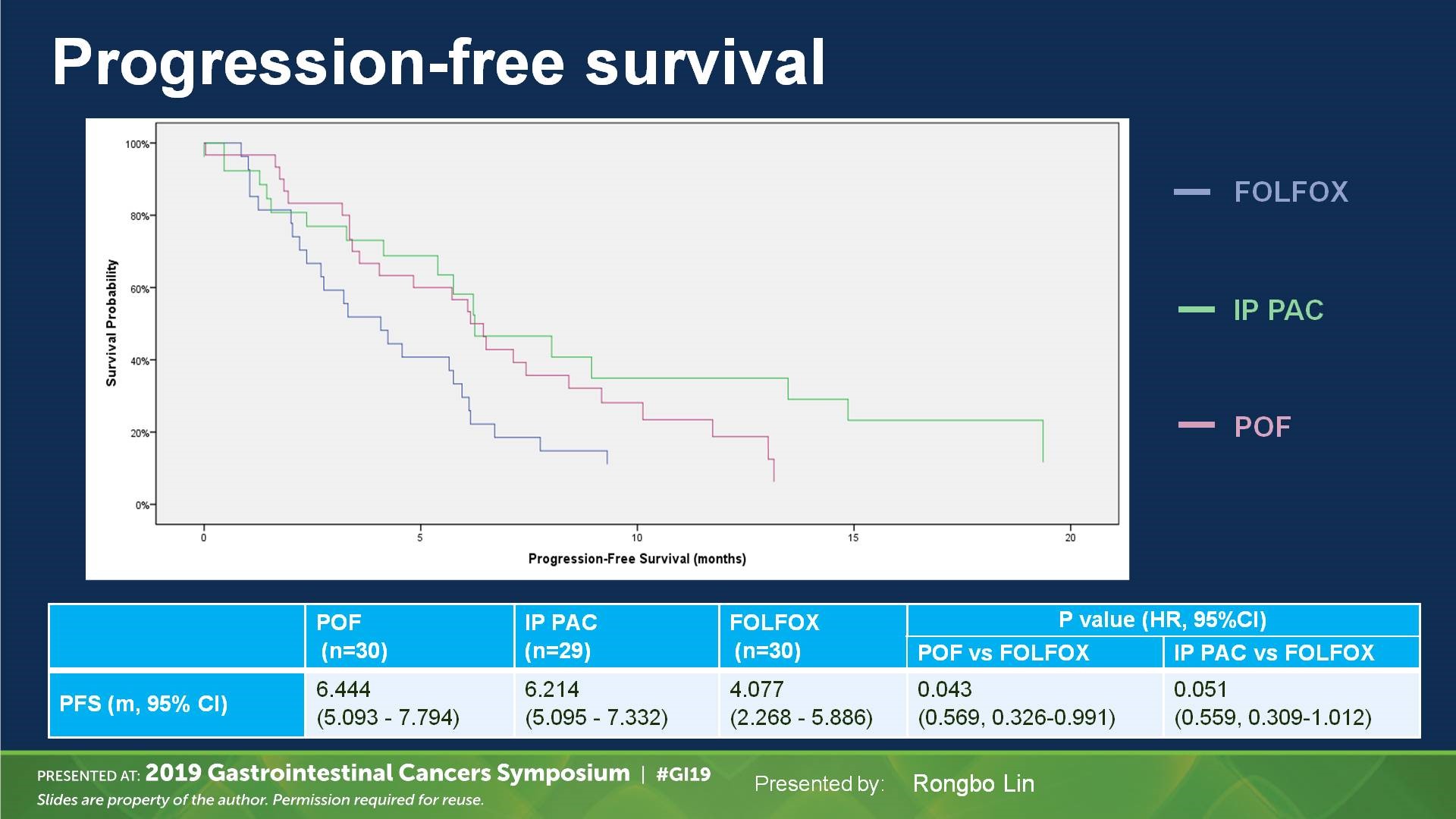
图 12. FOLFOX、IP PAC(紫杉醇腹腔灌注+FOLFOX)、POF(紫杉醇静脉注射+FOLFOX)一线治疗晚期胃癌的无疾病进展时间(LIN R, et al. ASCO-GI 2019)
总之,HIPEC联合CRS治疗胃癌腹膜转移或者HIPEC预防腹膜转移似乎看到了临床受益,但仍需要大型Ⅲ期研究来证实。紫杉醇腹腔灌注可能对胃癌有临床获益,更高的紫杉醇剂量可能获益更大。
1. ROVIELLO F, et al. Optimal Patient Selection for HIPEC for Metastatic Gastric Cancer[R]. ASCO-GI 2019.
2. ISHIGAMI H, FUJIWARA Y, FUKUSHIMA R, et al. Phase III Trial Comparing Intraperitoneal and Intravenous Paclitaxel Plus S-1 Versus Cisplatin Plus S-1 in Patients With Gastric Cancer With Peritoneal Metastasis: PHOENIX-GC Trial[J]. J Clin Oncol,2018,36(19):1922-1929.
3. LIN R B, LI H, CHEN Y G, et al. FOLFOX versus POF (paclitaxel plus FOLFOX) versus IP PAC (intraperitoneal paclitaxel plus FOLFOX) as a first-line treatment in advanced gastric cancer (AGC): a multicenter, randomized phase 2 trial, FNF-004 Trial [R]. ASCO-GI 2019.















 苏公网安备32059002004080号
苏公网安备32059002004080号


