
第33例
对于HER2阳性晚期乳腺癌患者,抗HER2治疗改变了HER2阳性乳腺癌的自然病程,并显著延长了患者的生存时间。任何阶段使用抗HER2治疗均可以改善预后,对于复发HER2晚期乳腺癌患者而言,复发后继续使用抗HER2治疗仍可达到控制肿瘤改善预后的目的。本文通过一个曲妥珠单抗治疗复发HER2阳性型晚期乳腺癌并获益,生存时间达到10年的病例,介绍目前有关该类患者的临床治疗思路。

厦门大学附属成功医院肿瘤二科主任
福建省抗癌协会肿瘤营养与支持专业委员会常委
福建省抗癌协会癌症姑息专业委员会委员
厦门市抗癌协会副秘书长
南京军区重大科研基金面上基金各1项(第一完成人)
获军队及福建省医学科技进步三等奖3项
以第一作者在统计源期刊发表论著24篇( SCI 2篇)
专著2部《临床肿瘤新进展》(第二副主编)、《现代肿瘤学治疗技术与进展》(第四主编,吉林科学技术出版社出版)

厦门大学附属成功医院肿瘤二科
2007年毕业于福建医科大学
病史简介
患者女性,发病年龄60岁。既往有高血压病及高脂血症史,长期口服药物控制血压及血脂,血压控制良好,血脂偏高。52岁绝经。个人史、家族史无特殊。于2007年7月23日在福建省某医院肿瘤外科行“左乳保乳根治术(左腋下淋巴结清扫术)”。术后病理示:左乳浸润性混合型癌(小叶癌、导管癌),多灶性,Ⅱ~Ⅲ级,浸润周围脂肪纤维结缔组织,间质脉管可见癌栓,左腋窝淋巴结见癌转移1/21。免疫组化:ER-,PR-,HER2+++,E-Ca +/-GCDFP-15 +/-,Ki-67 +++。入院诊断:左乳浸润性混合型癌术后(pT2N1M0,IIB期,HR-/HER2+型)。
辅助治疗
术后1周即开始“紫杉醇+阿霉素”方案术后辅助化疗6周期。2008年2月25日至4月9日在福建某医院行局部放疗25次(DT 5000cGY/25f 三窗),加切口局部放疗6次,放疗后复查ECT全身骨骼无异常发现。
第1次复发
2008年9月,外院CT及ECT检查提示“术后肋骨、胸壁复发左锁骨上下淋巴结转移”。诊断:左侧乳腺浸润性混合型癌术后化放疗后胸壁、骨转移(rT2N1M1,Ⅳ期,HR-/HER2+型)。DFS=14个月。
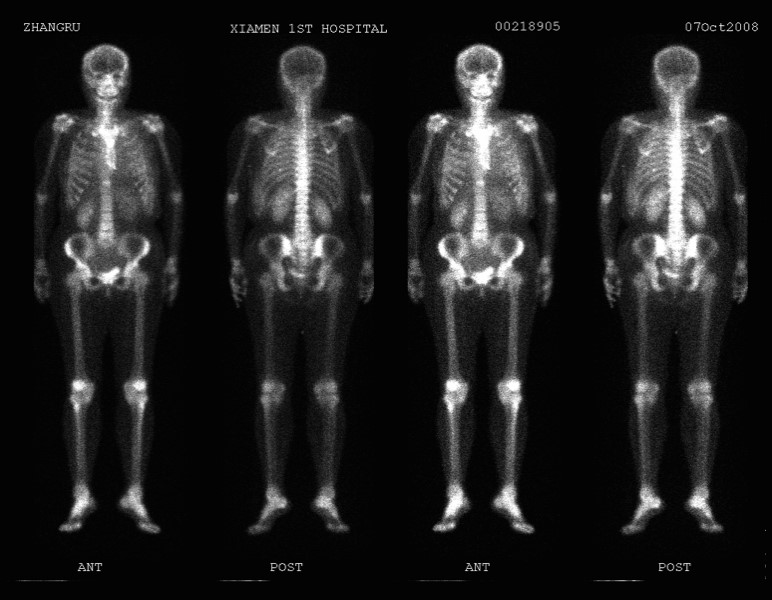
2008年10月7日ECT检查结果
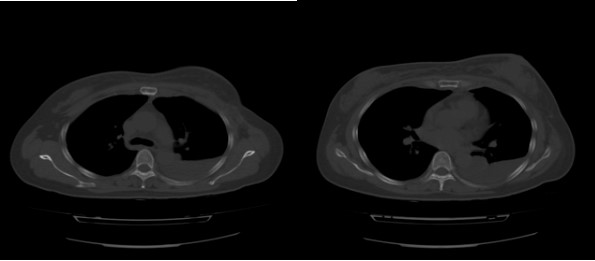
2008年10月7日CT检查结果
复发后治疗及评价
2008年10月,患者于上海某医院乳腺外科就诊,行“TCH方案(多西他赛+卡铂+曲妥珠单抗)”化疗3周期,同时给予“伊班膦酸钠”保护骨骼(每4周1次)。第1周期结束后左锁骨上下淋巴结均消失。第2周期结束后胸壁结节缩小。疗效评价为PR。
2008年12月,患者于厦门某医院肿瘤中心二区入院,给予“TXH方案”(曲妥珠单抗+多西他赛+卡培他滨)治疗3周期后,胸壁小结节消失。
2009年2月21日,患者于漳州市某医院行PET/CT检查,结果示:①左侧乳腺癌手术及放化疗后复查;②局部未见明显残留及复发,全身未见明显转移。疗效评价为CR。
后续治疗
2009年3月初,患者于上海某医院就诊,医生建议继续使用“曲妥珠单抗+卡培他滨”抗HER2治疗。2009年3月中旬开始,患者于厦门某医院肿瘤按照上述方案维持治疗。2009年12月起,患者一直使用曲妥珠单抗+卡培他滨维持治疗,并随访复查。此后一直按照此方案维持治疗至2016年7月(定期复查血常规、肝肾功能及心功能),其间定期复查未见肿瘤复发。2016年7月至今,患者一直使用曲妥珠单抗维持治疗。

2011年11月CT复查结果
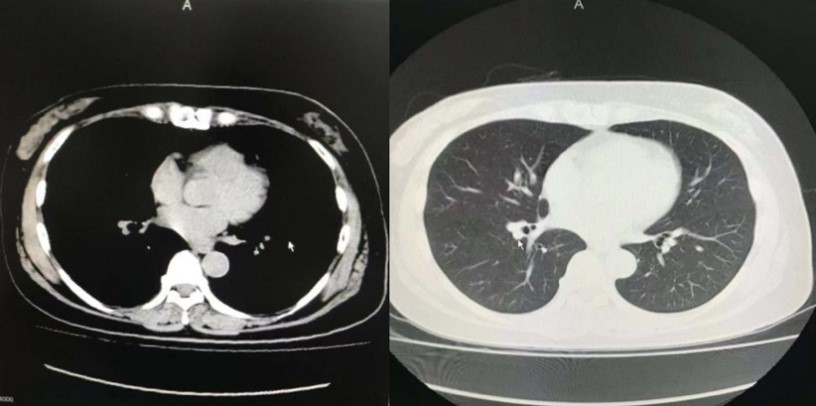
2017年11月CT复查结果
毒副反应
患者口服卡培他滨期间出现Ⅲ~Ⅳ度手足综合征,给予减量后症状缓解,此后一直维持卡培他滨1000mg/m2 口服,每日2次,q21d。骨髓抑制:白细胞最低Ⅱ度,其余两系未见明显下降。患者应用曲妥珠单抗期间未出现明显的心悸、胸闷等不适,定期检查心功能:EF 53%~75%。
总结
患者女性,发病年龄60岁。2007年7月23日行“左乳保乳根治术(左腋下淋巴结清扫术)”。术后诊断左乳浸润性混合型癌术后(pT2N1M0,ⅡB期,HR-/HER2+型)。术后1周即开始在该院给予“紫杉醇+阿霉素”方案术后辅助化疗6周期。2008年2月25日至4月9日行局部放疗25次(DT 5000cGY/25f 三窗),加切口6次,放疗后复查ECT全身骨骼无异常发现。定期复查未见肿瘤复发转移。2008年9月外院CT及ECT检查提示“术后肋骨、胸壁复发左锁骨上下淋巴结转移”。诊断:左侧乳腺浸润性混合型癌术后化放疗后胸壁、骨转移(rT2N1M1,Ⅳ期,HR-/HER2+型)。DFS=14个月。2008年10月开始TCH方案化疗3周期,同时伊班膦酸钠保护骨骼(每4周1次)。第1周期结束后左锁骨上下淋巴结均消失。第2周期结束后胸壁结节缩小。疗效评价为PR。2008年12月开始TXH方案化疗3周期,胸壁小结节消失。2009年2月21日行PET/CT检查提示:①左侧乳腺癌手术及放化疗后复查;②局部未见明显残留及复发,全身未见明显转移。疗效评价为CR。2009年3月曲妥珠单抗+卡培他滨方案维持治疗。一直随访复查。此后一直按照此方案维持治疗至2016年7月(定期复查血常规、肝肾功能及心功能),期间定期复查未见肿瘤复发。2016年7月至今,患者开始曲妥珠单抗单药维持治疗。
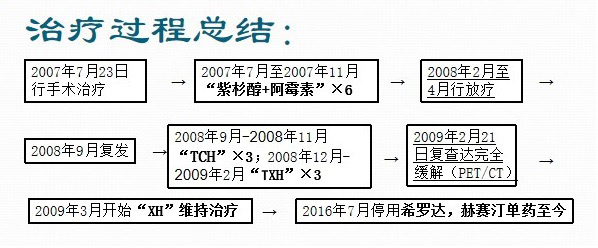
患者治疗历程图
点评专家

复旦大学附属肿瘤医院肿瘤内科行政副主任、副主任医师
上海市肿瘤化疗质控中心秘书
中国抗癌协会乳腺癌专业委员会委员
中国抗癌协会临床肿瘤学协作专业委员会乳腺癌专家委员会委员
中国抗癌协会临床肿瘤学协作专业委员会肿瘤支持与康复治疗专家委员会常务委员
中国抗癌协会临床肿瘤学协作专业委员会青年专家委员会委员中国研究型医院协会乳腺专业委员会青委会副主任委员
中国研究型医院协会乳腺专业委员会常务委员
上海市抗癌协会癌症康复与姑息治疗专业委员会常务委员
上海市抗癌协会青年理事
国家食品药品监督管理总局CDE首批化药临床兼职审评员
JCO中文版(泌尿男生殖系统肿瘤专刊)编委
《中华乳腺病杂志》中青年编委
《精准癌症医学》(Precision Cancer Medicine)青年编委
《中国癌症杂志》青年编委

复旦大学附属肿瘤医院肿瘤内科
病例点评
患者为老年女性,发病年龄60岁,已绝经。根据手术及术后病理结果,诊断为左乳浸润性癌术后(pT2N1M0,ⅡB期, HER2阳性型)。临床特征及病理结果提示该患者为术后高危复发风险组,根据《中国临床肿瘤学会(CSCO)乳腺癌诊疗指南》2018V1,辅助治疗上建议予以蒽环类+紫杉醇类+抗HER2治疗,后续再进行辅助放疗。根据NSABP B31、NCCTG N9831和 BCIRG006 这三个临床[1,2,3]试验结果得知,曲妥珠单抗联合蒽环序贯紫杉的方案较不包含曲妥珠单抗的蒽环序贯紫杉方案化疗显著提高HER2阳性的N+及N-高危患者的DFS和OS,并且H与T联用较序贯效果更优。这个病例放到今天,可能处理方式会多一种选择:APHINITY[4]研究结果显示,与使用含曲妥珠单抗的方案相比,使用含帕妥珠单抗和曲妥珠单抗的双靶向治疗方案能够降低 19% 的 iDFS 事件(HR=0.81;95%CI:0.66~1.00;P=0.045),其中淋巴结阳性患者和激素受体阴性患者从治疗中获益最多。因此对于有高危复发风险的患者,一定程度上可尝试帕妥珠单抗和曲妥珠单抗双靶向辅助治疗。患者当时未进行抗HER2治疗,仅予以紫杉醇+阿霉素化疗6周期;局部放疗25次(DT 5000cGY/25f 三窗),加切口6次,存在辅助治疗不足的情况。且辅助化疗不推荐AT方案,PACS04、ECOG E2197临床研究[5,6]均提示AT方案并不优于AC、FEC方案。这些可能是患者后续复发的重要原因。
在2008年9月外院CT及ECT检查提示“术后肋骨、胸壁复发左锁骨上下淋巴结转移”,考虑复发,DFI为14个月。根据《ESO/ESMO晚期乳腺癌国际共识指南》第4版[7]:HER2阳性的晚期乳腺癌患者除非存在禁忌证都应尽早开始抗HER2治疗;对于之前未接受过抗HER2治疗的晚期患者的一线治疗标准方案是化疗+曲妥珠单抗+帕妥珠单抗,已证实此方案获得的OS优于化疗+曲妥珠单抗;当帕妥珠单抗不可获得时,一线治疗方案可选曲妥珠单抗+长春瑞滨/紫杉烷类;一线治疗不推荐拉帕替尼,一线方案选择化疗联合曲妥珠单抗在PFS、OS方面都要优于化疗联合拉帕替尼。事实上,H0648g[8]和M77001[9]研究已证实在紫杉类基础上联合曲妥珠单抗治疗能够显著提高PFS和OS,确立了曲妥珠单抗联合紫杉类在一线标准治疗的地位。甚至,Harris[10]等针对抗HER2治疗全球研究资料的荟萃分析也显示抗HER2治疗可以提高患者OS 22%、提高PFS及TTP分别为37%及44%,证实了抗HER2治疗对于转移性乳腺癌的重要性。后续的CLEOPATRA研究[11]提示相较于曲妥珠单抗+多西他赛而言,帕妥珠单抗+曲妥珠单抗+多西他赛延长了PFS(18.5个月 vs 12.4个月, P=0.0001)与OS(56.5个月 vs 40.8个月, P=0.0002),因此有条件的患者可予以双靶一线治疗。CHAT研究[12]证实,对于能够耐受双药化疗的患者,曲妥珠单抗联合多西他赛加卡培他滨,比曲妥珠单抗联合多西他赛效果更好,尤其适用于考虑维持治疗的患者。该患者在TCH 3疗程PR后进一步尝试了TXH,虽不甚符合“效不更方”的原则,但疗效也达到了CR。根据《中国晚期乳腺癌维持治疗专家共识》[13],接受规范的一线化疗(通常 6~8 个周期)后达到疾病控制(包括完全缓解、部分缓解和疾病稳定)的晚期乳腺癌患者,通过延长药物治疗时间,控制肿瘤进展,达到缓解症状,改善生活质量,提高PFS的目的。抗HER2治疗的最佳持续时间尚不明确,若没有出现不可耐受的毒性可使用至疾病进展。对于HER2阳性晚期乳腺癌,既往的H0648g、M77001[8,9]研究均显示,曲妥珠单抗联合化疗后,予曲妥珠单抗治疗至疾病进展,能显著提高患者的 PFS 与 OS,且维持阶段的不良反应发生率低。CLEOPATRA 研究[11]表明,帕妥珠单抗联合曲妥珠单抗,在联合化疗结束后继续使用至疾病进展,能显著提高患者的 PFS 与 OS,且并未增加心脏毒性。该患者2009年3月初HX;2009年12月予以减量HX;2011年3月予以标准量HX;2016年7月使用曲妥珠单抗至今。复发转移治疗至今已达10年,并持续获益中,治疗有效。维持治疗期间患者口服卡培他滨期间出现Ⅲ~Ⅳ度手足综合征,给予减量后症状缓解,此后一直维持卡培他滨1000mg/m2 口服,每日2次,q21d。骨髓抑制:白细胞最低Ⅱ度,其余两系未见明显下降。患者应用曲妥珠单抗期间未出现明显的心悸、胸闷等不适,定期检查心功能:EF 53%~75%。毒副反应可耐受。
该病例带给我们一些思考以及提示:①对于HER2阳性型早期乳腺癌患者来说,应该强调抗HER2辅助治疗的重要性,对于高危的患者,甚至可以尝试双靶向辅助,譬如曲妥珠单抗+帕妥珠单抗。②对于晚期患者而言,抗HER2单靶或双靶可带来生存获益。在毒副反应可耐受的情况下,应尽可能延长使用抗HER2治疗的使用时间,对于达到CR的患者何时停用抗HER2治疗尚无定论。③曲妥珠单抗的跨线治疗,亦能使HER2阳性患者从中获益,持续改善生活质量,甚至延长总生存。
[1] GANZ PA, ROMOND EH, CECCHINI RS, et al. Long-term follow-up of cardiac function and quality of life for patients in NSABP protocol B-31/NRG oncology: A randomized trial comparing the safety and efficacy of doxorubicin and cyclophosphamide (AC) followed by paclitaxel with ac followed by paclitaxel and trastuzumab in patients with node-positive breast cancer with tumors overexpressing human epidermal growth factor receptor 2[J]. J Clin Oncol. 2017;35(35):3942-3948. doi:10.1200/JCO.2017.74.1165
[2] PEREZ EA, ROMOND EH, SUMAN VJ, et al. Four-year follow-up of trastuzumab plus adjuvant chemotherapy for operable human epidermal growth factor receptor 2-positive breast cancer: Joint analysis of data from NCCTG N9831 and NSABP B-31[J]. J Clin Oncol. 2011;29(25):3366-3373. doi:10.1200/JCO.2011.35.0868
[3] SLAMON DJ, EIERMANN W, ROBERT NJ, et al: Phase III randomized trial comparing doxorubi- cin and cyclophosphamide followed by docetaxel (AC-T) with doxorubicin and cyclophosphamide followed by docetaxel and trastuzumab (AC-TH) with docetaxel, carboplatin and trastuzumab (TCH) in HER2neu positive early breast cancer patients: BCIRG006 study[J]. Cancer Res 69:500s, 2009 (ab- str 62)
[4] MINCKWITZ G, PROCTER M, AZAMBUJA E, et al. APHINITY Steering Committee and Investigators. Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer[J]. N Engl J Med. 2017 Jul 13;377(2):122-131.
[5] SPIELMANN M, ROCHÉ H, DELOZIER T, et al. Trastuzumab for patients with axillary-node-positive breast cancer: Results of the FNCLCC-PACS 04 trial[J]. J Clin Oncol. 2009;27(36):6129-6134. doi:10.1200/JCO.2009.23.0946
[6] GOLDSTEIN LJ, O’NEILL A, SPARANO J, et al: E2197 Phase III AT (doxorubicin/docetaxel) vs AC (doxorubicin/cyclophosphamide) in the adjuvant treatment off node positive and high risk node negative breast cancer[J]. J Clin Oncol 23:7s, 2005 (abstr 512)
[7] CARDOSO F,SENKUS E,COSTA A, et al. 4th ESO-ESMO International Consensus Guidelines for Advanced Breast Cancer (ABC 4)[J] .Ann. Oncol., 2018, 29: 1634-1657.
[8] BASELGA J, CORTÉS J, KIM SB, et al. Pertuzumab plus Trastuzumab plus Docetaxel for Metastatic Breast Cancer[J]. New England Journal of Medicine, 366(2), 109–119.
[9]MARTY M, COGNETTI F, MARANINCHI D, et al. Randomized phase II trial of the efficacy and safety of trastuzumab combined with docetaxel in patients with human epidermal growth factor receptor 2-positive metastatic breast cancer administered as first-line treatment: The M77001 study group[J]. J Clin Oncol. 2005;23(19):4265-4274.
[10] HARRIS,CA,WARD RL,DOBBINS TA,et al. The efficacy of HER2 targeted agents in metastatic breast cancer:a meta analysis[J]. Ann Oncol,2011,22(6):1308-1317.
[11] MILES D, IM YH, FUNG A, et al. Effect of docetaxel duration on clinical outcomes: Exploratory analysis of CLEOPATRA, a phase III randomized controlled trial[J]. Ann Oncol. 2017;28(11):2761-2767.
[12] WARDLEY AM, PIVOT X, MORALES-VASQUEZ F, et al. Randomized phase II trial of first-line trastuzumab plus docetaxel and capecitabine compared with trastuzumab plus docetaxel in HER2-positive metastatic breast cancer[J/OL]. J Clin Oncol. 2010;28(6):976-983. doi:10.1200/JCO.2008.21.6531
[13]徐兵河,王树森,江泽飞, 等.中国晚期乳腺癌维持治疗专家共识[J].中华普通外科学文献,2018,12(1):1-5.












 苏公网安备32059002004080号
苏公网安备32059002004080号


