
第29例

湖北省肿瘤医院乳腺外科
湖北省抗癌协会乳腺癌专业委员会委员
擅长乳腺癌手术治疗、新辅助及辅助化疗、内分泌治疗、分子靶向治疗、微创手术治疗
擅长早期乳腺癌的保乳手术及乳腺癌术后乳房重建手术、对晚期乳腺癌的维持治疗有丰富的临床经验

湖北省肿瘤医院乳腺外科
武汉医师协会整形分会 委员
基本病史
患者女性,49岁,已绝经。2011年6月27日以“左乳腺癌切检术后1周”为主诉入院。既往体健,否认慢性病、传染病史。
病理会诊结果:左乳浸润性导管癌Ⅱ级伴脉管癌栓,免疫组化结果:ER(-),PR(-),HER2 (3+),未见Ki-67。
治疗经过
患者无明显禁忌,为最大程度改善预后,于2011年6月28日至2011年8月9日期间行TEC方案新辅助化疗3周期。2011年8月25日在全麻下行“左乳腺癌改良根治术”。病理示:左乳原切口下未见癌组织残留,左腋窝淋巴结见转移性癌(3/17)。
术后诊断
左侧乳腺侵润型导管癌Ⅱ级并左侧腋窝淋巴结转移(pT2N1M0,IIB期)。
分子分型:HER2阳性HR阴性型。
术后辅助治疗
为最大限度巩固手术治疗效果,经与患者沟通,术后1个月开始行TEC方案(多西他赛+表柔比星+环磷酰胺)辅助化疗3周期。化疗结束后行曲妥珠单抗靶向维持治疗1年。因患者自身原因未行放疗。其间定期复查,未见明显转移或复发迹象。
病复发及治疗
患者2013年9月17日门诊复查ECT结果示:第3胸椎骨质代谢异常活跃;腰椎MRI检查结果示(图1):第3胸椎骨片状影,结合病史考虑转移。余检查未见明显异常。无病生存期(disease-free survival,DFS)24个月。
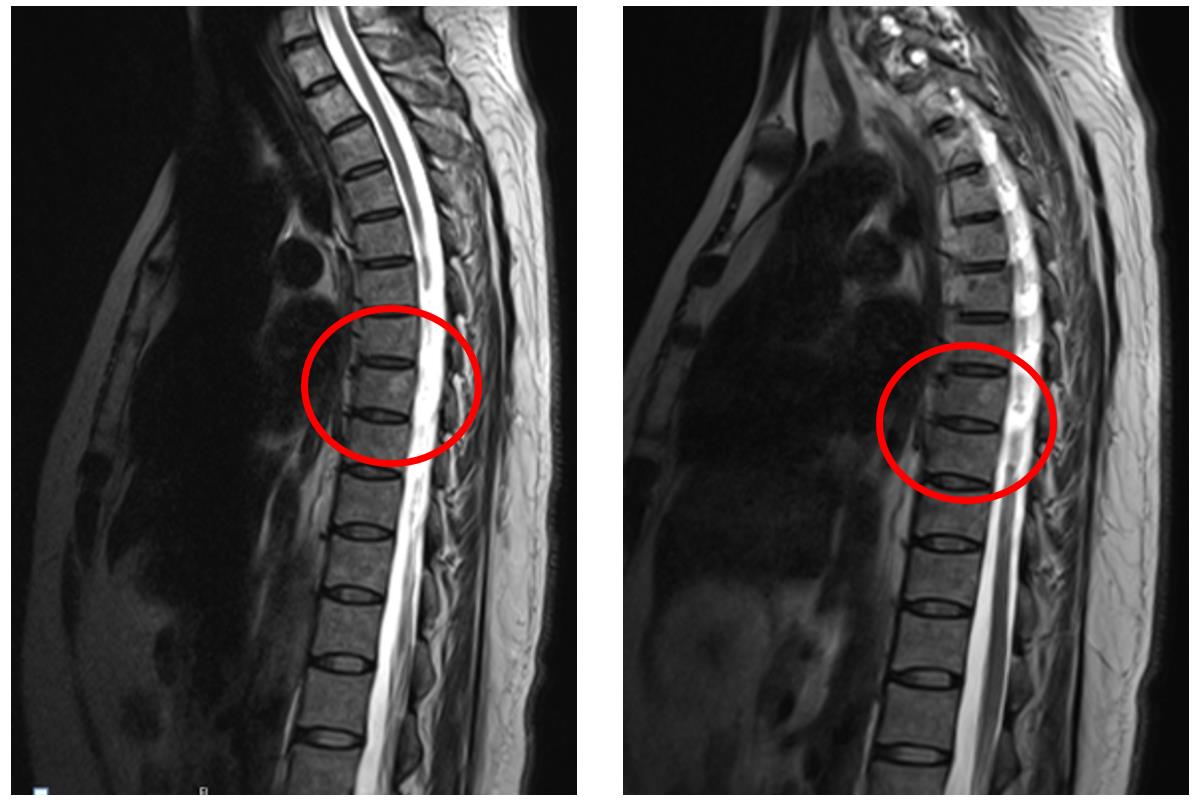
图1 患者胸椎MRI检查结果
(左,2014年4月24日;右,2014年11月8日)
为最大限度改善预后,经与患者及其家属反复沟通,于2013年9月28日至2014年1月17日期间行NG+H方案(长春瑞滨+吉西他滨+曲妥珠单抗)一线化疗6个周期,综合疗效评价为部分缓解(partial response,PR)。于2014年2月25日至2017年1月11日行曲妥珠单抗联合唑来膦酸维持治疗,其间定期复查未见明显转移或复发迹象。
2017年1月18日骨扫描示:右顶骨,第3、4、6、7、11胸椎,第5腰椎,右骶髂关节骨质代谢活跃,考虑治疗后骨多发转移。无进展生存(progression-free survival, PFS)39个月。2017年2月至今,行卡培他滨化疗同时联合曲妥珠单抗抗HER2治疗,其间每3个月注射唑来膦酸抗骨转移治疗。定期复查,多次疗效评价为病情稳定(stable disease,SD)。
总结
患者2011年6月以“左乳腺癌切检术后1周”入院。病理会诊为:左乳浸润性导管癌Ⅱ级伴脉管癌栓,免疫组化结果:ER(-),PR(-),HER2 (3+)。行TEC方案化疗3周期后,全麻下行左乳腺癌改良根治术,术后病理示:左乳原切口下未见癌组织残留,左腋窝淋巴结见转移性癌(3/17),分子分型:HER2阳性HR阴性型。术后1个月开始行TEC化疗3周期,化疗结束后曲妥珠单抗靶向治疗1年。患者2013年9月复查ECT结果提示胸椎骨转移,行NG+H方案一线化疗6周期,后至2017年1月行曲妥珠单抗联合唑来膦酸维持治疗。2017年1月骨扫描示治疗后多发骨转移,于2月起至今行曲妥珠单抗联合卡培他滨化疗,其间每3个月注射唑来膦酸抗骨转移治疗,定期复查,疾病稳定。

图2 患者治疗历程图
点评专家

山东大学齐鲁医院肿瘤中心化疗科副主任
山东省抗癌协会乳腺癌专业委员会常委
山东省消化道肿瘤专业委员会副主任委员
中华预防医学肿瘤筛查与防治山东分会副主任委员
中华医学会肿瘤姑息治疗山东分会副主任委员
山东省健康管理协会肿瘤防治专业委员会副主任委员
山东省痛疼研究会肿瘤精准治疗专业委员会副主任委员
点评
患者女性,49岁。首诊ⅡB期乳腺癌患者,左侧乳腺浸润性导管癌Ⅱ级并左侧腋窝淋巴结转移(pT2N1M0,ⅡB期),分子分型为HER2阳性HR阴性型。多项研究数据表明20%~25%的浸润性乳腺癌具有HER2的扩增以及过表达,HER2阳性乳腺癌具有侵袭性高,易发生骨、脑转移,预后差等特点。HER2阳性乳腺癌绝大部分依赖于HER2通路来驱动肿瘤细胞增殖。如不针对该通路进行治疗,相当于让肿瘤增殖的途径更多、更凶猛。新辅助治疗可以使肿瘤降级降期,缩小手术范围,减少术后并发症的发生,在早期乳腺癌系统治疗中具有重要的临床意义。NeoSphere、TRYPHAENA以及KRISTINE等研究,均显示了新辅助曲妥珠单抗联合帕妥珠单抗双靶治疗HER2阳性乳腺癌具有更高的病理缓解率。对亚洲人群进行的PEONY研究是对亚洲人群进行的相关研究,结果显示:多西他赛联合曲妥珠单抗tpCR率为21.8%,而曲妥珠单抗联合帕妥珠单抗的双靶联合多西他赛治疗组的tpCR率达到了39.3%,有显著的统计学差异(P=0.0014)。该患者在初次乳腺切除活检术后予以TEC方案新辅助治疗。考虑该患者为HER2阳性HR阴性型,新辅助治疗方案选择抗HER2治疗联合化疗更为合理,该病例选择TEC方案并非目前最佳选择,且新辅助治疗后应进行疗效评估,以评估新辅助治疗的效果。
患者全麻下行“左乳癌改良根治术”,术后予以3周期TEC方案辅助化疗,化疗结束后予以曲妥珠单抗靶向维持治疗1年。HERA研究证实曲妥珠单抗用于HER2阳性早期乳腺癌的术后辅助治疗,显著提高HER2阳性早期乳腺癌的治愈机会,显著降低复发和病死风险,是HER2阳性早期乳腺癌辅助治疗的标准药物。1年曲妥珠单抗辅助治疗,能带来将近70%的HER2阳性乳腺癌患者带来超过10年无病生存。2017年12月美国FDA批准帕妥珠单抗+曲妥珠单抗和化疗的双靶联合放疗方案,作为HER2阳性、有高复发风险的早期乳腺癌患者的术后辅助治疗选择,目前在国内帕妥珠单抗已经可及的情况下,该患者也可选择双靶联合化疗以获得更多获益。
后患者出现骨转移,化疗的同时继续联用曲妥珠单抗靶向治疗。目前,对于复发转移乳腺癌的治愈很难,需要采取“细水长流”的策略。既往RHEA研究证实辅助治疗进展后继续曲妥珠单抗治疗ORR可达61%,17%的患者疾病稳定。GBG26研究证实曲妥珠单抗在乳腺癌各个阶段均可发挥作用,进一步证明曲妥珠单抗在HER2阳性乳腺癌的各个阶段均可延长生存期,并再次确定了其作为HER2阳性乳腺癌基础治疗药物的地位。此例患者使用曲妥珠单抗联合化疗后,曲妥珠单抗维持,在发现骨转移的情况下再次联合卡培他滨,截止目前尚未出现疾病进展情况。
该病例基于指南规范的同时又结合临床现实,术前通过新辅助治疗获得降期,术后又通过“细水长流”的持续抗HER2靶向治疗,患者获得较长时间的生存获益,充分体现对于HER2阳性乳腺癌持续抗HER2治疗的必要性和重要性。
[1]PROCTER M, SUTER TM, DE AZAMBUJA E, et al. Longer-term assessment of trastuzumab-related cardiac adverse events in the herceptin adjuvant (HERA) trial[J]. Journal of Clinical Oncology, 2010, 28(21):3422-3428.
[2]GIANNI L , DAFNI U , GELBER R , et al. Treatment with trastuzumab for 1 year after adjuvant chemotherapy in patients with HER2-positive early breast cancer: a 4-year follow-up of a randomised controlled trial[J]. Lancet Oncology, 2011, 12(3):236-244.
[3]VON MINCKWITZ G, PROCTER M, DE AZAMBUJA E, et al. Adjuvant pertuzumab and trastuzumab in early HER2-positive breast cancer[J]. N Engl J Med, 2017, 377(2):122-131.
[4]SANDRA M, SWAIN M, et al.Pertuzumab, Trastuzumab, and Docetaxel in HER2-Positive Metastatic Breast Cancer[J].N Engl J Med, 2015,372(8): 724–734.
[5]GIANNI L,PIENKOWSKI T,IM Y,et al.Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial[J]. Lancet Oncol,2012 ,13(1):25-32.
[6] GIANNI L, PIENKOWSKI T, IM Y,et al.5-year analysis of neoadjuvant pertuzumab and trastuzumab in patients with locally advanced, inflammatory, or early-stage HER2-positive breast cancer (NeoSphere): a multicentre, open-label, phase 2 randomised trial[J]. Lancet Oncol ,2016.
[7]GUNTER M,MARION P, DE AZAMBUJA E, et al.Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer. DOI: 10.1056/NEJMoa1703643
[8]董倩, 姜达, 姚孜琪,等. cNCCN指南对HER2过表达型乳腺癌治疗的指导意义[J]. 中国肿瘤, 2015, 24(8):688-695.
[9]SMITH I , PROCTER M , GELBER R D , et al. 2-year follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer: a randomised controlled trial[J]. Lancet (North American Edition), 2007, 369(9555):0-36.












 苏公网安备32059002004080号
苏公网安备32059002004080号


