
第25例

华中科技大学同济医学院附属同济医院肿瘤科
毕业于华中科技大学同济医学院
中国医疗保健国际交流促进会肿瘤姑息治疗与人文关怀分会秘书、委员
《全球肿瘤快讯》 青年编委、社外编辑
《JCO中文版》 青年审稿专家
研究方向:宫颈癌放化疗,乳腺癌、肺癌、消化系统肿瘤等常见恶性肿瘤的综合治疗,恶性肿瘤姑息与对症支持治疗
基本病史
患者女性,52岁,绝经。2018年2月因“右乳腺肿物疼痛伴加重1个月”入院。既往体健,否认慢性病史、传染病史。
▎入院查体
KPS 80分,浅表淋巴结未及肿大,右乳腺肿胀,可触及质硬结节样改变,边界不清,乳头周围皮肤可见红肿改变。双侧腋窝及颈部淋巴结未及肿大。
▎影像学检查
①乳腺MRI:右乳腺稍肿胀,体积稍大,乳后脂肪间隙及皮下脂肪间隙水肿,右腋窝部分淋巴结稍大,约15mm×12mm。考虑右乳恶性肿瘤性病变。②胸部CT平扫:双肺多发微小结节,建议随访观察;右乳可见团块影,右侧乳腺组织及乳腺区皮肤增厚;右侧腋窝淋巴结增多。③腹部CT平扫:右肾小囊肿;子宫前壁肌瘤可能。④全身骨显像:未见明确肿瘤骨转移征象。
治疗经过
▎局部切除
患者无明显禁忌,为最大程度改善预后,于2018年2月26日行右乳腺病损切除术,术后病理示:右乳腺浸润型癌,非特殊类型,WHO 2级,癌组织多灶性分布并累及皮下及真皮组织,乳腺组织、真皮及皮肤切缘淋巴管内可见广泛癌栓形成,大小约为6cm×3.6cm×1.5cm。 免疫组化:乳腺病灶ER(+,约20%),PR(+,约10%),HER2(+++),Ki-67 (约10%)。皮肤病灶:ER(+,约20%),PR(+,约10%),HER2(+++),Ki-67 (约10%)。
临床分期:cT4NxM0 ⅢB期。分子分型:HER2阳性HR阳性。
▎新辅助化疗
结合患者自身状况和身体情况,于2018年3月8日至6月26日予以 PTH方案6周期,剂量如下:多西他赛75mg/m2 ;曲妥珠单抗 首次8mg/kg,后续6mg/kg;帕妥珠单抗首次840mg,后420mg,q21d。2周期后综合疗效评价为部分缓解(PR),如图1所示。
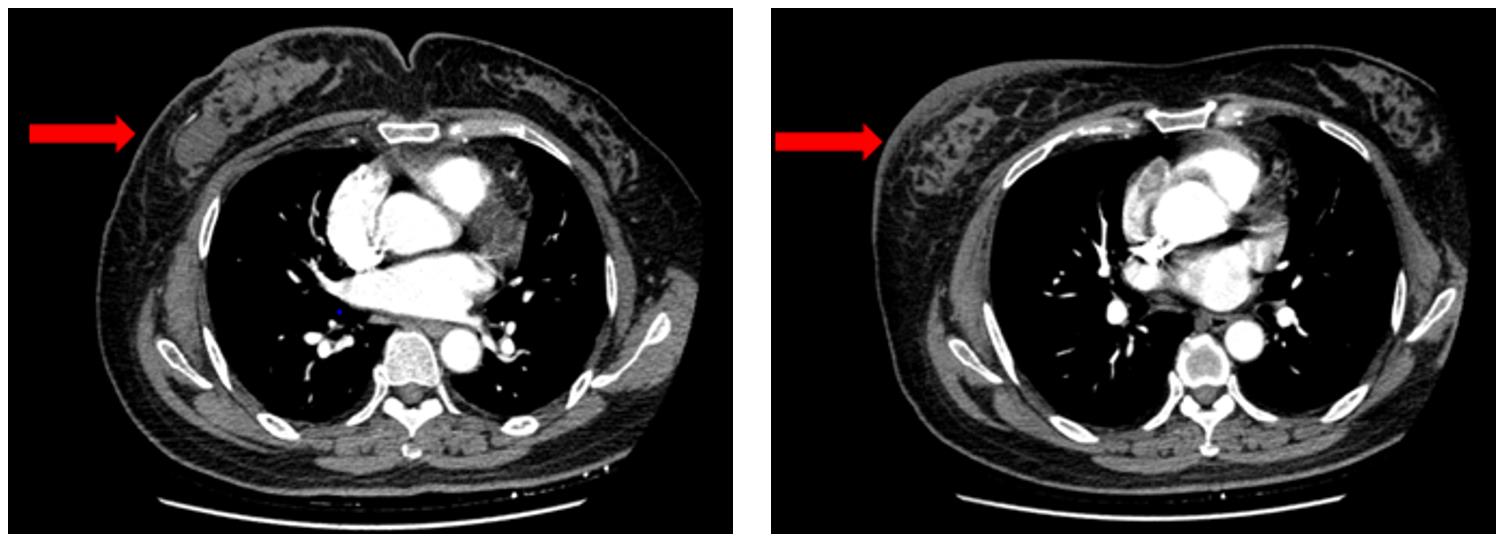
图1 患者胸部CT平扫(左,2018-02;右,2018-04)
▎根治手术
患者无明显禁忌,为最大程度改善预后,患者于2018年7月12日再次行全麻下右乳腺癌改良根治术,术后病理示:送检(右)乳腺组织多处取材,镜下均未见癌组织,主要为乳腺腺病改变伴纤维化及局灶多核巨细胞反应。乳头、基底切缘、快速送检各切缘与右侧腋窝淋巴结20枚均未见癌组织(0/20)。术后分期:ypT0N0M0,R0。
▎术后辅助治疗
双靶联合治疗:术后2周,经与患者家属反复沟通交流,于2018年7月29日至8月19日行PTCbH方案2周期,剂量如下:多西他赛75mg/m2 ;卡铂 AUC=5;曲妥珠单抗 6mg/kg;帕妥珠单抗420mg,q21d。至今仍使用曲妥珠单抗维持治疗。
内分泌治疗:于2018年8月20日2周期化疗后开始来曲唑2.5mg 口服至今。
局部放疗:2018年10月23日至11月27日行右侧胸壁及锁骨上淋巴引流区域放疗:50Gy/25F。
至今定期复查未见明显复发或转移,综合疗效评价为完全缓解(CR)。
总结
患者于2018年2月26日行右乳腺病损切除术,术后病理示:右乳腺浸润型癌,HER2阳性HR阳性。初始予以PTH方案6周期新辅助化疗。后于2018年7月12日再次行全麻下右乳腺癌改良根治术,病理未见癌组织。术后行TCbH方案化疗2周期并联合局部放疗序贯治疗,后曲妥珠单抗联合来曲唑维持至今,截止目前未出现疾病复发或进展。
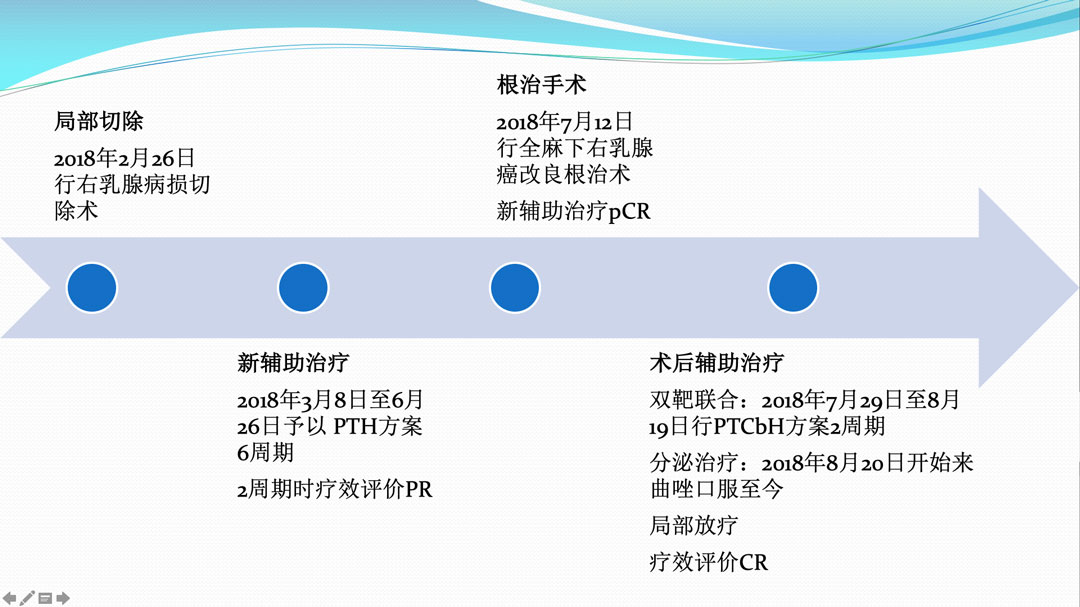
图2 治疗总结
点评专家

广东省中医院大学城医院乳腺科主任
中华中医药学会乳腺病分会主任委员
广东省中医药学会乳腺病专业委员会主任委员
广东省健康管理学会乳腺病分会副主任委员
广东省医学会乳腺病学会中青年委员会副主任委员
世界中医联合会外科分会常务理事
点评:
患者女性,52岁,首诊行右乳病灶切除,病理提示为ⅢB期的HR+/HER2+局部晚期乳腺癌。新辅助治疗后行乳腺癌改良根治术,术后完成辅助放化疗、靶向治疗及内分泌治疗,取得了良好的治疗效果。
15%~20%的乳腺癌患者存在HER2基因的扩增及其编码蛋白的过表达,与肿瘤侵袭性强、复发率高有关,其预后不良。局部晚期乳腺癌,新辅助治疗是国内外各大指南公认的标准治疗选择。对于HER2+乳腺癌的新辅助方案设计,化疗联合抗HER2治疗是标准设计。这一设计经历了抗HER2单靶时代与抗HER2+双靶时代。在单靶时代,化疗+曲妥珠单抗的pCR率比单纯化疗提高了15.1%(HR+/HER2 +)、17.9%(HR-/HER2 +)[1]。进入双靶时代,化疗+曲妥珠单抗+帕妥珠单抗pCR率进一步提高了16.8%[2];化疗+曲妥珠单抗+拉帕替尼pCR率进一步提高了9%~19%[3];化疗+曲妥珠单抗+来那替尼pCR率进一步提高了11.9%[4]。基于上述优异的治疗反应率,抗HER2双靶方案已成为临床优选方案。
令人高兴的是帕妥珠单抗已于2018年12月17日在国内上市,使得该药物具有可及性,而来那替尼目前在国内仍未上市。因此目前在中国的临床实践中,HER2+乳腺癌新辅助治疗抗HER2双靶方案的选择就有了2种选择:化疗+曲妥珠单抗+拉帕替尼、化疗+曲妥珠单抗+帕妥珠单抗。那么,对于这两种方案的选择上是否应该有优选方案呢?
我们知道,局部晚期乳腺癌仍然是潜在可治愈的乳腺癌。因此,在其新辅助方案设计上应该优选那些既可以提高治疗反应率又有能改善生存证据的方案。对于化疗+曲妥珠单抗+帕妥珠单抗,APHINITY研究[5]证实曲妥珠单抗+帕妥珠单抗联合化疗用于辅助治疗能够显著改善HER2阳性早期乳腺癌iDFS率,亚组分析显示淋巴结阳性及HR阴性患者获益更多。而化疗+曲妥珠单抗+拉帕替尼方案在ALLTO研究中生存并未得到改善[6]。正因为如此,目前国际上对于HER2阳性的新辅助治疗方案设计推荐使用化疗+曲妥珠单抗联合帕妥珠单抗的双靶+化疗治疗。该病例为局部晚期HER2阳性乳腺癌,新辅助方案选用紫杉联合双靶,术后病理提示为pCR,恰恰体现了该方案的疗效可靠性。
对于HER2阳性型乳腺癌患者,新辅助治疗后是否需要强化治疗,目前有循证医学证据可参考的是KATHERINE研究[7]。该研究针对新辅助治疗后未达pCR的HER2阳性型乳腺癌患者,一组为传统的曲妥珠单抗的治疗,另一组使用T-DM1治疗,结果显示曲妥珠单抗组3年无浸润性癌复发率(iDFS)为77%,而T-DM1组为88%,统计学存在显著差异。但是,非常遗憾,本病例患者在新辅助治疗前做了病灶切除术,而不是粗针穿刺,这样其实已经失去判断是否真正pCR的机会了。
一般而言,新辅助治疗应该在手术前打完“预设疗程”,在新辅助过程中疾病缓解很好是否追加尚存争议。该患者使用THP方案2周期后,将THP方案从标准的4周期延长至6周期,术后又追加2周期TCbH,也许是治疗组觉得该患者仅使用6THP有点弱而进行额外的强化,但这一策略在逻辑上、证据上值得商榷。该患者如果按照共识的设计方案选用THP4周期后序贯EC4周期,然后再手术、序贯放疗并足程用完HP至1年,同时联合内分泌治疗,也许更为合理。理由是,尽管该患者THP方案6周期后达到pCR,但pCR并非意味全身的“亚临床转移灶”被全部清除,所以治疗组可能不放心而术后强化TCbH方案2周期,但这是否是最优的清除潜在可能残留 “亚临床转移灶”方案(即改善DFS)很值得担心,不如4THP-4EC方案设计更放心,因为后者有明确的循证医学证据支持可以改善DFS。
1. Cortazar P, Zhang L, Untch M, et al.Pathological complete response and long-term clinical benefit in breast cancer:the CTNeoBC pooled analysis[J]. Clin Oncol,2012 30(15):1796-1804.
2.Luca Gianni,Tadeusz Pienkowski.Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced,inflammatory,or early HER2-positive breast cancer (NeoSphere):a randomised multicentre,open-label, phase 2 trial[J].Lancet Oncol ,2012,13: 25-32.
3.Hicks M,Macrae ER. et al.Neoadjuvant dual HER2-targeted therapy with lapatinib and trastuzumab improves pathologic complete response in patients with early stage HER2-positive breast cancer:a meta-analysis of randomized prospective clinical trials[J].Oncologist,2015 ;20(4):337-343.
4.SA Jacobs, A Robidoux.NSABP FB-7: A phase II randomized trial evaluating neoadjuvant therapy with weekly paclitaxel (P) plus neratinib (N) or trastuzumab (T) or neratinib and trastuzumab (N+T) followed by doxorubicin and cyclophosphamide (AC) with postoperative T in women with locally advanced HER2-positive breast cancer[J].SABCS,2015
5.Gunter von Minckwitz, Marion Procter.Adjuvant Pertuzumab and Trastuzumab in Early HER2-Positive Breast Cancer[J].N Engl J Med,2017,377:122-131.
6.Piccart-Gebhart M. Holmes E.et al.Adjuvant lapatinib and trastuzumab for early human epidermal growth factor receptor 2-positive breast cancer: results from the randomized phase III adjuvant lapatinib and/or trastuzumab treatment optimization trial[J]. Clin Oncol, 2016,34(10):1034-1042.
7.von Minckwitz,G. et al. Trastuzumab emtansine for residual invasive HER2-positive breast cancer[J]. N Engl J, 2018.












 苏公网安备32059002004080号
苏公网安备32059002004080号


