2018年12月4-8日,第41届美国圣安东尼奥乳腺癌研讨会(SABCS)在美国得克萨斯州圣安东尼奥召开。SABCS是世界上最大、最具影响力的乳腺癌会议。为期5天的会议中,共有来自世界90多个国家超过7000名科研人员与医生代表参与研讨。来自广东省人民医院乳腺外科的廖宁教授团队有三项重要研究入围SABCS 2018壁报展示。【肿瘤资讯】有幸在圣安东尼奥乳腺癌研讨会现场采访到廖宁教授,谈谈这三项重要研究。


博士生导师、主任医师
美国肿瘤外科协会(SSO)国际委员会理事
美国NCCN乳腺癌指南(中文版)专家组成员
St Gallen国际乳腺癌指南(中文版)专家组成员
《Annals of surgical oncology》编辑委员会委员
国家卫计委医政司《乳腺癌治疗规范》编写组成员
国家卫计委《乳腺癌诊断指南》专家组成员
国家卫计委合理用药专家委员会《肿瘤药物组》专家组成员
中国抗癌协会乳腺癌专业委员会(CACA-CBCS)常委
中国医师协会乳腺外科专业委员会(CMDA)常委
中国宋庆龄基金会肿瘤医疗及产学研联盟副理事长
中国临床肿瘤学会(CSCO)乳腺癌专家委员会常委
广东省女医师协会乳腺癌专业委员会主任委员
广东省药学会乳腺科用药专家委员会主任委员
广东省抗癌协会专业委员会委员
广东省人民医院肿瘤中心乳腺科行政主任

2004/09-2009/06 武汉大学,临床医学,本科
2009/09-2015/06 武汉大学,肿瘤学,医学博士
攻读博士学位期间,在中国留学基金委资助下赴美国New York University医学中心进行为期2年学术研究,主要从事抑癌基因在恶性实体瘤中信号转导机制方面的研究,在Oncogene、Free Radic Biol Med、JBC等国际知名期刊发表SCI论文10多篇,主持国家自然科学青年基金1项(项目编号81602645),参与国家自然科学基金(面上项目)、省级、市级自然科学基金项目多项。目前致力于揭示乳腺恶性肿瘤侵袭转移分子机制、探索逆转化疗药物耐药策略等方面的临床转化研究,并在廖宁教授指导下学习、掌握乳腺癌多学科综合治疗。
廖宁教授团队重点从分子水平关注乳腺肿瘤,从基因组学角度找寻其中差异,通过差异找到相应个体化治疗途径,最终达到精准医疗目的。三项研究均针对中国人群。第一项研究是基于33个基因对304例早期乳腺癌患者进行驱动基因的基因组学分析,比较中国人群与西方人群的乳腺癌驱动基因的差异寻找中国人群的分子特点。在该研究中,观察到中国人群与西方人群的差异,可以通过个体化治疗实现精准医疗。第二项是揭示原发肿瘤与转移淋巴结如何在时间、空间分子事件。该研究非常重要,因为患者出现肿瘤转移时,导致原发肿瘤的驱动基因在转移灶是否出现更多突变或保持该突变,对于患者预后及治疗均具有重要意义,为患者后续个体化治疗提供重要依据。第三项内容为FGFR1/2对于早期乳腺癌及晚期乳腺癌在时间、空间上的差异,基于不同通路,不同时间发生差异时,分子事件的融合或基因融合或扩增,尤其针对ER阳性患者治疗出现耐药等事件提供相当多的信息。
廖宁教授在采访中提到,非常荣幸这三项研究能够获得大会的肯定,参与展示与讨论,未来希望有更多在中国人群进行的分子水平相关研究为世界认可,让更多中国患者获益。
附:廖宁教授团队三项研究内容展示
摘要编号:【P4-04-05】
Spatial heterogeneity revealed by genomic profiles comparing 60 matched primary breast tumors and metastatic lymph nodes
乳腺癌原发肿瘤及其区域淋巴结转移的时空异质性的基因组学研究
Poster Session 4: Tumor cell and molecular biology: Genetics — somatic changes
背景
原发性乳腺肿瘤中的基因组分析已经广泛进行,揭示了乳腺癌突变基因组的异质复杂性。然而,对于乳腺肿瘤同步差异突变谱和腋窝淋巴结中的匹配转移知之甚少。为了识别空间一致性和淋巴结转移中潜在的生物学机制,我们使用超深度靶向测序确定了同步原发病灶(PL)和转移淋巴结(MLN)中的基因组突变谱。
方法
使用包含520个癌症相关基因并跨越1.6MB人类基因组的组进行靶向深度测序。 比较了来自60名初治乳腺癌和腋窝淋巴结转移的初治患者的匹配PL和MLN样本之间的突变谱。 在PL或MLN样品中的特异性和共有突变之间进一步进行KEGG富集分析。 还探讨了空间异质性与临床特征之间的关系。
结果
该队列的中位年龄为45岁(28-67岁),其中大多数(86.7%)被诊断为浸润性导管癌。在这个60对配对的队列中,在242个基因中鉴定出961个基因组畸变,包括405个单核苷酸变体(SNV),66个插入或缺失(INDEL),482个拷贝数扩增(CNA)和8个易位。虽然PL和MLN样本共有584个(60.8%)事件,但跨越51个基因的226个(23.5%)突变和涉及46个基因的151个(15.7%)突变分别是特异性PL和MLN样本。此外,7名患者(11.7%),均为激素受体(HR)阳性,在PL和MLN之间具有完全相似的突变谱。 21名患者(35%)具有PL特异性突变,但没有MLN特异性突变。相比之下,6名患者(10%)仅具有MLN特异性突变,其余26名患者(43.3%)具有PL和MLN特异性突变。有趣的是,7个具有完全相似突变谱的患者基于Ki67的增殖指数显着低于PL和MLN之间具有差异突变景观的其他患者(p = 0.019)。此外,KEGG途径富集分析显示,在PL和MLN样品中富集了PI3K / AKT和Ras信号通路中的失调。更重要的是,我们发现蛋白多糖途径和JAK-STAT信号传导的异常激活以及异常的HIF-1途径在MLN样品中特异性地发生,表明这些信号传导途径在淋巴结转移的参与中起关键作用。
结论
我们的研究揭示了原发性肿瘤和淋巴结之间的基因组异质性,并确定了突变以及可能与淋巴结转移相关的途径,强调这种空间异质性可能有助于疾病的进展并导致随后不同的治疗反应。
本研究得到了国家自然科学基金(批准号81602645)和广东省自然科学基金(批准号2016A030313768)的资助。

摘要编号:【P4-04-08】
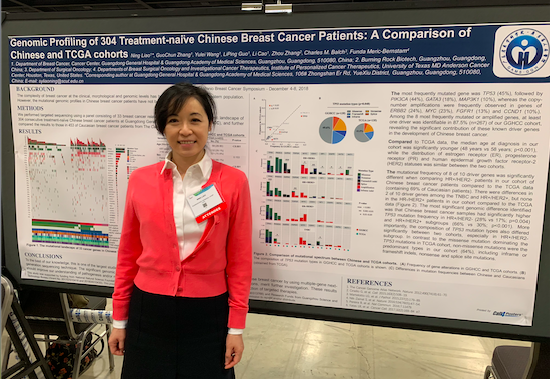
Genomic profiling of 304 treatment-naïve Chinese breast cancer patients: A comparison of Chinese and TCGA cohorts
中国乳腺癌人群中原发肿瘤的基因组特征分析
Poster Session 4: Tumor cell and molecular biology: Genetics — somatic changes
背景
乳腺癌在临床、形态学和分子水平上的复杂性已得到公认。分子谱分析揭示了亚型之间的内在生物学,显著促进了这种疾病的管理。然而,之前的研究中中国乳腺癌患者的分子数据非常有限。
方法
我们使用由36个BC相关基因组成的组进行靶向测序,以获取304名中国初治BC患者的连续基因组观,并将我们的结果与TCGA数据集进行比较。
结果
与TCGA相比,我们的队列三阴性乳腺癌患者显著更少(8.2%vs 15.5%p = 0.002)。最突出的基因组差异是我们的队列在HR + / HER2-和HR + / HER2 +组中TP53突变频率更高。在HR + / HER2-组的两个队列中TP53突变的组成也显著不同,TCGA队列是以错义突变作为主要突变; 而我们的队列中主要是无意义和移码突变。 我们根据分子特征将人口最多且多样化的HR + / HER2-癌症组分为4个亚组。使用来自TCGA的数据,通过总体存活率的差异证实了所提出的分类的临床意义。
结论
与TCGA数据相比,我们确定了与中国乳腺癌患者相关的独特基因组模式,表明根据种族状况进行基于突变的分层的重要性。 据我们所知,这是对中国BC患者进行的最大规模研究之一,该研究对突变事件的频谱进行了询问,并将这些分子特征与临床结果联系起来。
本研究得到国家自然科学基金(批准号81602645),广东省自然科学基金(批准号2016A030313768)和广州市科学技术局研究基金(批准号201707010418和201804010430)的资助。
摘要编号:【P5-04-25】
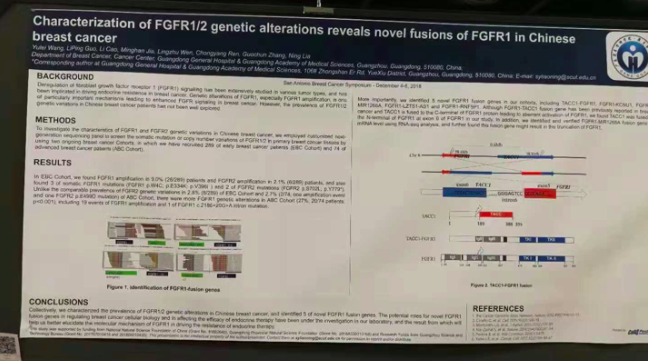
Characterization of FGFR1/2 genetic alterations reveals novel fusions of FGFR1 in Chinese breast cancer
基于中国乳腺癌人群中FGFR1 / 2突变特征揭示了新型FGFR1融合
Poster Session 5: Tumor cell and molecular biology: Endocrine Therapy and Resistance
背景
在各种肿瘤类型中已经广泛研究了成纤维细胞生长因子受体1(FGFR1)信号传导的失调,并且已经涉及驱动乳腺癌中的内分泌抗性。 FGFR1的遗传改变,尤其是FGFR1扩增,是导致乳腺癌中增强的FGFR信号传导的特别重要的机制之一。 然而,中国乳腺癌患者中FGFR1 / 2遗传变异的流行尚未得到很好的探索。
方法
为了研究中国乳腺癌中FGFR1和FGFR2基因变异的特征,我们采用定制的新一代测序板,通过使用两个正在进行的乳腺癌队列筛查原发性乳腺癌组织中FGFR1 / 2的体细胞突变或拷贝数变异。 我们招募了289名早期乳腺癌患者(EBC队列)和74名晚期乳腺癌患者(ABC队列)。
结果
在EBC队列中,我们发现9.0%(26/289)患者的FGFR1扩增和2.1%(6/289)患者的FGFR2扩增,并且还发现3个体细胞FGFR1突变(FGFR1 p.W4C; p.E334K; p.V396I)和2个FGFR2突变(FGFR2 p.S702L; p.Y779 *)。与ABC群组中2.8%(8/289)EBC群组和2.8%(2/74;一个扩增事件和一个FGFR2 p.E499D突变)的FGFR2遗传变异相当的流行率不同,ABC中存在更多FGFR1基因改变。队列(27%; 20/74患者; p <0.001),包括19个FGFR1扩增事件和1个FGFR1 c.2186 + 20G> A内含子突变。更重要的是,我们在我们的队列中鉴定了5种新的FGFR1融合基因,包括TACC1-FGFR1,FGFR1-KCNU1,FGFR1-MIR1268A,FGFR1-LZTS1-AS1和FGFR1-RNF5P1。虽然先前已报道FGFR1-TACC1融合基因存在于乳腺癌中,并且TACC1融合至FGFR1蛋白的C末端,导致FGFR1的异常激活,但在我们的研究中发现TACC1融合至FGFR1外显子6的FGFR1的N末端。此外,我们使用RNA-seq分析在mRNA水平上鉴定和验证了FGFR1-MIR1268A融合基因,并且进一步发现该融合基因可能导致FGFR1的截短。
结论
我们总结了中国乳腺癌中FGFR1 / 2基因改变的流行情况,并鉴定了5种新的FGFR1融合基因。 新型FGFR1融合基因在调节乳腺癌细胞生物学和影响内分泌治疗效果方面的潜在作用已在我们的实验室进行调查,其结果将有助于我们更好地阐明FGFR1在内分泌治疗驱动抗性中的分子机制。
本研究得到国家自然科学基金(批准号81602645),广东省自然科学基金(批准号2016A030313768)和广州市科学技术局研究基金(批准号201707010418和201804010430)的资助。












 苏公网安备32059002004080号
苏公网安备32059002004080号


