2018年6月14-17日,第23届欧洲血液学年会(EHA)在晚上11点日落,早上3点日出的斯德哥尔摩举行。第一次参会,写点体会和心得。
如果把恶性肿瘤分为两大类:容易控制的如慢性粒细胞白血病,霍奇金淋巴瘤,早期肿瘤,这些疾病比较简单,只要抓住关键因素便能成功。可惜的是,大部分肿瘤的是复杂的,只控制少部分的异常难以获得持久的疗效。
达尔文的进化理论,适者生存,适用于我们去理解癌症。以骨髓瘤为例,癌细胞可以通过进化出优势克隆使之生存下去,通过不断进化,肿瘤在不同部位表现出不同的克隆异常,比如下图,四个不同部位的肿瘤可以检测出不同的遗传学异常。
在这种情况下,假设腰部肿瘤表达BRAF,我们用anti-BRAF治疗就算有反应,对其他部位的肿瘤依然无效,整体效果为零。因此,以突变指导的靶向治疗需要成功的必要条件包括,突变广泛存在并参与疾病进展,或者,突变在肿瘤细胞基因组不稳定(进化能力)方面扮演重要角色。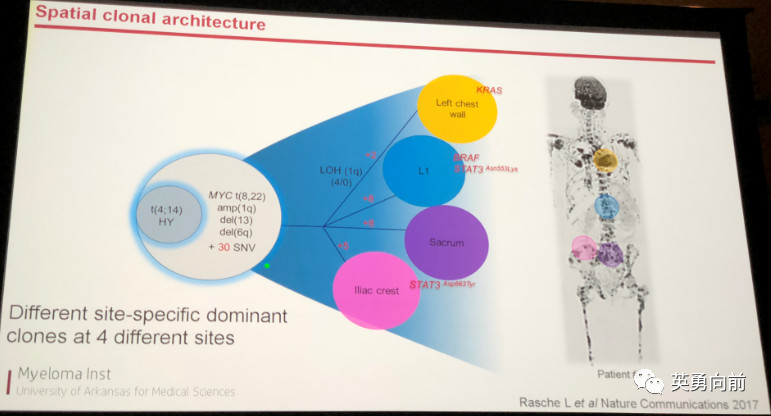
这便是肿瘤最大的特点之一:高度异质性。相比达尔文的进化论,癌细胞的进化速度是极快的,原因是癌细胞的基因组高度不稳定。这样的逻辑在EHA上被反复提起。怎么办?在介绍TRACE时(一种动态检测随治疗而变化的癌症演化过程),讲者称癌症演化为‘新达尔文进化论’,治疗上应该通过个体化治疗,找到不同细胞的“七寸” - trunk mutation,比如肺癌中truck mutation将导致发生异质性的突变以及neo-antigen的丢失。
问题是怎么去找这些”七寸”,做到所谓”精准化治疗”是何其难也。回顾过去的几十年,癌症新药的研发模式没怎么变:在众多的基础研究中寻找对疾病的认识,极少数发现促发药物合成,再通过成功的临床研究,最终将产品推向市场。
科学范式-------技术范式-------创新(颠覆式/累积式)
这里有些问题:科学和技术有时是脱节的,实验室里的细胞小鼠大概不能完全代表疾病,结果可信不可信,有用没有并非很清楚;而技术多由企业开发,看到有戏立即开发,新药合成后便进入临床研究。当临床研究结果满足统计学意义则成功,一般不会去深入研究为什么成功,或者为什么失败;不满足统计学意义的,打入冷宫。
这种大方向上循着从科学到技术到创新之路,多少忘记我们要是帮助患者治疗疾病还是去研究细胞,或者商业价值过多主导研发方向?当然这些因素本身并不矛盾。因此,如果反过来探索呢,两条腿走路?结合大数据和人工智能技术呢?情况会不会有所改善?
EHA介绍了诺华赞助的HARMONY(Healthcare alliance forresourceful medicines offensive against neoplasms in hematology)项目,简单来讲就是通过1)收集万级患者数据(临床数据和遗传学数据),2)分析数据。这就是反过来研究的案例,通过研究患者真实的疾病情况,反推分析,有机会促进科学发展,再推动新药/新治疗方法的产生。EHA详细介绍了目前完成的AML/CLL项目,其主要目的:1)了解基因-基因之间的相关性,以及对治疗结局的影响;2)基因水平的疾病危险度分层;3)发现预后/预测指标;
HARMONY项目是极具眼光的,1. 打通从科学-技术-创新这条路(不再是各玩各的),把这条路上要解决的问题(癌症/患者)放到了中心位置(细胞是解决问题的手段,癌症/患者才是问题);2. 大量分子学水平异常的关联性,A+B和A+C和A+B+C,尽管都有A但疾病特点以及对治疗的反应可能完全不同,更别说A+B+…….无数,需要基于大量的数据分析才有可能知道的更多;3. 现有分子学水平的数据(比如突变,微观数据)是基于现在的检测水平,23,000个基因编码蛋白质,其他99%的基因组片段功能并不清楚,在癌症中扮演什么角色也并不是很明白。如果通过大量的数据,发现不同组合背后的差异(通过现象去了解本质,归纳法),或者同样组合不同的结果,也许是一把照亮黑暗空间的手电筒;4.HARMONY项目看起来只包括收集+分析,当存在大量可靠微观(基因水平)/宏观数据(临床数据)前提下,再结合算法和先进的技术平台,人工智能技术在新药研发上是值得期待。AI可以支持科学研究,协助药物合成,以及通过小样本的学习推测大样本的结局,这样会大大加速新药研发的速度和效率。当然,一定离不开人工智能大神的帮助。
质疑和焦虑是科学发展的原动力。
回到EHA,今年的热点是AML和CAR-T,免疫治疗在血液肿瘤中的应用,以及各大药企目前的新药研发趋势/靶点。
2017年算得上AML年,Midostaurin,Enasidenib,CPX-351以及Gemtuzumab Ozogamicin相继获批(FDA)。AML的新药研发主要包括三个方向:
1. FLT3突变
大约25-30%以及5-10%初发AML患者合并FLT3-ITD和TKD突变,在难治复发AML中这一比例会更高。FLT-3 ITD是预后不佳指标,而TKD则不是很清楚。第一次听说FLT3 抑制剂大约2013-14年,Quizartinib想利用相当不错的二期数据支持注册,结果被FDA拒之门外,要求提供有OS数据的三期结果。而第一个获批的FLT-3抑制剂是诺华公司做了很多年的Midostaurin,去年以良好的生存数据支持获批。除了这两个药以外,FLT-3抑制剂还包括Lestaurtinib,Sorafenib,Crenolanib和Gilteritinib。
经过大约3-4年的三期研究,Quizartinib的三期结果终于公布,DrCortes在全体大会介绍了QuANTUM-R研究的结果,2:1入组367例FLT3-ITD的AML患者,245例患者接受Quizartinib单药口服,对照组122接受化疗(LoDAC=29,MEC=40,FLAG-IDA=53),两组均接受HSCT并进入长期随访。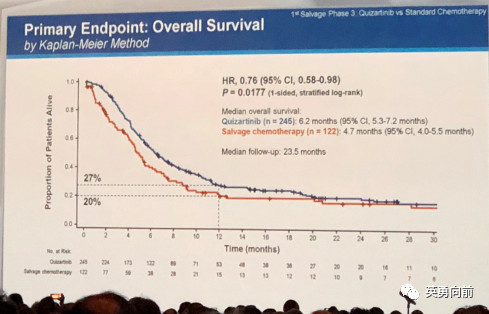
中位随访23.5个月,研究首要终点中位OS分别为6.2个月vs.4.7个月(HR=0.76, P=0.0177),CR率分别为48% vs. 27%,安全性方面除了QTcF略有增高以外,两组没明显差别。总体看来,单药口服Quizartinib可以带来明确的生存获益。FDA应该会很快批准,些许有”歉意”。
2. 靶向代谢和表观遗传学
与表观遗传学相关的靶点包括:DNMT3A(发生率12-22%),IDH1/2(10-20%),EZH2(<1%),MLL-fusion蛋白(3-5%)TET2(14%)。目前已获批准的为阿扎胞苷(DNMT3A,中国已上市,需要买)和Enasidenib(正在开展全球三期,中国参与,药物免费,可以推荐入组)。
观察到两点:1)联合阿扎胞苷治疗AML的研究逐渐成为主流,比如联合IDH1/2抑制剂,治疗初发AML患者的CR率为44/50%,ORR为78/67%;2)单药Enasidenib通过抑制2-HG,打断IDH突变诱导的代谢异常,及2-HG后发生的TET2等涉及表观遗传学的异常,控制疾病,其治疗效应好于预期。单药治疗RR-AML的CR率大约为23%,中位起效时间1.9个月,到CR为3.7个月,CR中位持续时间8.8个月,这些获得CR患者的中位OS达19.7个月,少部分患者甚至获得持续控制。有趣的是,Enasidenib可以诱导白血病细胞分化,控制2-HG后可以诱导部分凋亡(因此,TKI并非不能杀死细胞)。Ivosidenib是IDH1抑制剂,整体疗效与Enasidenib基本一致。
对于AML这么复杂的疾病,单纯控制某些靶点是有明显效果的。既然这种方式是有效的,那完全可以继续挖掘,请看其他在研产品。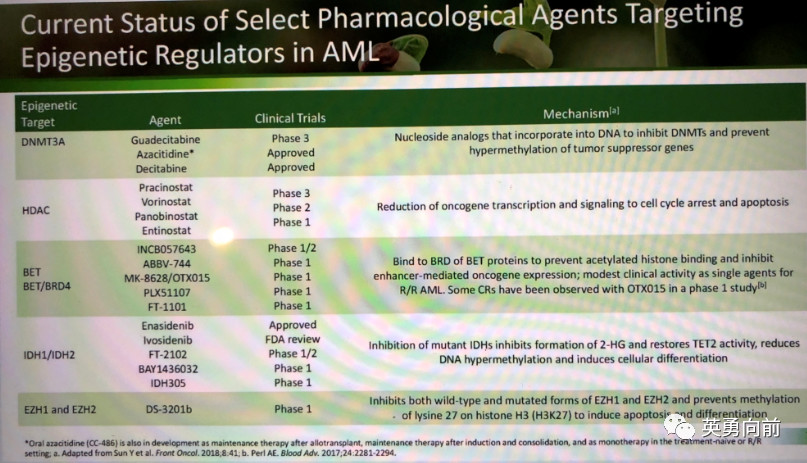 附加:靶点为DOT1L(Pinometastant),LSO1(INCB059872,GSK2879552,IMG-7289)以及Menin-MLL1(KO-539)。
附加:靶点为DOT1L(Pinometastant),LSO1(INCB059872,GSK2879552,IMG-7289)以及Menin-MLL1(KO-539)。
3. 凋亡通路
BCL-2过表达导致AML细胞失去凋亡能力,是AML治疗的研究热门。目前走的较前的有Venetoclax,单药治疗RR-AML(N=32),ORR为19%(6% CR,13%CRi),12例患者在4周时骨髓原始细胞下降>50%;在Venetoclax联合LDAC治疗初发AML时(N=61),CR/CRi为62%,中位持续13.2个月,中位生存11.4个月,12个月OS为45.9%;在Venetoclax联合阿扎胞苷/地西他滨治疗老年AML的一期研究中,总体患者(N=145)的CR/CRi为67%,其中疗效最好的亚组是Venetoclax400mg联合阿扎胞苷为76%(N=29),MRD转阴率(10-3水平,中心实验室FCM检测)为29%,最高的同样是联合阿扎胞苷组(45%)。
现有研究结论,Venetoclax单药治疗RR-AML只产生中等程度的治疗反应,联合治疗可以提供更深的缓解甚至MRD转阴,同时延长生存时间。特别是老年AML患者缺乏有效治疗的情况下,未来可以考虑联合阿扎胞苷,FLT3抑制剂,MCL-1抑制剂等治疗,炎症性研究正在进行中。
下图供参考。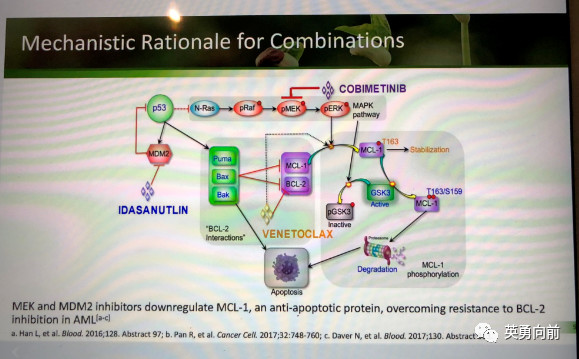
在研涉及凋亡通路的药物和靶点包括:

4. 免疫治疗在AML中的应用
免疫治疗AML/MDS的主要范式包括:1. 抗体药物偶联;2.双抗(CD3为基础的);3. 免疫检查点抑制剂;4.CAR-T(CAR-NK)。首先介绍CAR-T治疗AML。
一般认为靶向AML的CAR会引起髓细胞损伤,造成严重不良反应。本次会议一大亮点来自中国,在全体大会上介绍了一种新的CAR-T治疗AML。CD-33-CLL-1双靶点的CAR-T细胞,在完成前期细胞和动物实验后,第一例治疗的患者为44岁AML-M4型白血病的女性,起病时原始细胞71%,经4个周期化疗降至47%,FLU+CTX预处理后降为20%,回输CAR-T细胞7×105/Kg,大约第19天MRD转阴,D44天进行一次全相合移植,在随访的第1,2,3个月持续保持MRD阴性。患者出现了一次一度CRS,发生全血细胞减少。
从这一例患者来看,CD-33-CLL-1-CAR-T表现非常好,快速诱导患者达到完全缓解,安全性良好,进一步开发起码有两个方向:1)作为诱导缓解,桥接移植的策略;2)CAR-T作为终极治疗,产生持续存在的CAR-T细胞,清除MRD。如果个例结果具有普遍性的话。
另一方面,以PD-1为代表的免疫检查点抑制剂也在AML中探索。比如Nivolumab联合阿扎胞苷治疗老年RR-AML(N=70),ORR为35%,其中CR为25%(历史数据:单药阿扎胞苷为15%,阿扎胞苷+VEN为21-27%),中位生存期为10.6个月,比阿扎胞苷+VEN的3-4个月有所提高。进一步研究,没有治疗反应的患者中,肿瘤细胞高表达TIM3+和PD-1/TIM3双阳性。
因此,免疫治疗AML需要找对分子标记物,目前只是开始。
另外,新报道一个CD33/CD3的双抗(AMV564)治疗AML的初步数据。
AML的治疗进展众多,不再一一介绍。大方向有四个: 1. 以CPX-351为代表的新的细胞毒药物;2.以Nivolumab和Pembrolizumab,以及CAR-T为代表的免疫治疗;3.以FLT3,IDH和BCL-2为代表的靶向治疗;4. 以GO为代表的大分子靶向治疗。
CAR-T治疗血液肿瘤
Carl JUNE在EHA发表题为‘CAR T Cells Therapies for Cancer’ 的演讲,作为CAR-T的发明者,卡六爷简要介绍了CAR-T的基本构成和制作流程,介绍在CLL,ALL以及骨髓瘤中的应用历史。
有意思的是:
1. CTL019治疗CLL,报道了两例患者在治疗7年仍然可以检出CTL019,名副其实的‘活着的药物’,而持续存在的CAR-T与患者的长期疾病控制密切相关,属于预测指标。
2. 比较了BiTE vs. CAR-T:相同点a)相似的不良事件如CRS和神经毒性,b)均为MHC非依赖性(TCR-T则为MHC依赖性),不同点a)BiTE无须预处理,作为药物治疗患者;b)CAR-T可以进入肿瘤庇护所,最大程度杀灭肿瘤细胞,但BiTE则是被动扩散;c)CAR-T为个体化生产,BiTE为现货供应(Off the Shelf)。
3. TET(ten-eleven translocation)蛋白与CAR-T的关系:TET蛋白的功能是为转化5mC至5hmC,影响造血干细胞再生能力。在一例患者中发现,单个CTL019 TCRVb5.1+ CD8+ T细胞(去除TET)产生的子代细胞可以清除巨大的肿瘤。因此,我们有可能用单个CAR-T细胞治疗肿瘤吗?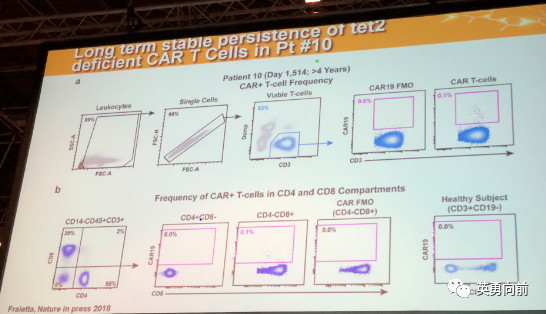
4. CAR-T研发速度超快,中国已超越美国成为研发CAR-T最多的国家,至2018年4月1日,超过270个关于CAR-T的临床研究正在开展,其中中国占了一半。
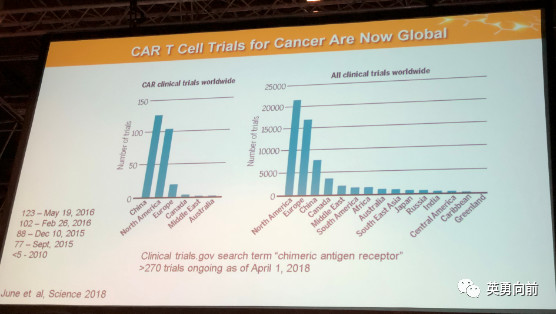 CAR-T治疗血液肿瘤局限于B系肿瘤,CLL/ALL/DLBCL/MM都是B系肿瘤在不同阶段的不同疾病形式,本次EHA的一大亮点是介绍了CAR-T在AML中的应用,特别是来自中国的双靶点CAR-T治疗一例患者的数据,以及FLT3-CAR-T治疗AML。
CAR-T治疗血液肿瘤局限于B系肿瘤,CLL/ALL/DLBCL/MM都是B系肿瘤在不同阶段的不同疾病形式,本次EHA的一大亮点是介绍了CAR-T在AML中的应用,特别是来自中国的双靶点CAR-T治疗一例患者的数据,以及FLT3-CAR-T治疗AML。
如果说CAR-T治疗血液肿瘤是一种成功的技术范式,那么便可以利用CAR-T自带的治疗特点(比如庇护所治疗,细胞持久性,甚至单细胞等等,未完全清楚),寻找更多的靶点治疗更多晚期肿瘤。在靶点的选择上有一些进展,比如:SLAMF7-CAR-T治疗骨髓瘤(Elotuzumab的靶点),以及:
CAR-T治疗肿瘤尽管取得一些成功,但显然面临的挑战更大:1.作为细胞治疗,如何对生产流程进行规范保证质量稳定可控,参考MDACC制定的CARTOX项目,实为非常细致复杂的流程要求。具体内容包括:规范制备流程,多学科协作,相关人员的培训,不良事件处理,质量管理报告,质量监察等。2.降低严重毒性反应,扩大适应症,量化生产(off theshelf),降低价格,实现规范化研发。
这些说起来容易,做起来太难。
最后送大家一张幻灯做参考,如何做个好的CAR-T治疗中心。
免疫治疗是个大概念,依赖机体的免疫系统清除肿瘤。大体上分为:1.通过患者体内ADCC或CDC作用,杀灭肿瘤细胞,比如利妥昔单抗/Elotuzumab(anti-SLAMF7)/Daratumumab(anti-CD38);2. 调节肿瘤微环境,营造利用免疫细胞发挥作用的环境,比如来那度胺;3. 阻断免疫负调因子,恢复机体抗肿瘤能力,比如anti-PD-1抗体或近年来大热的anti-CD47抗体;4.直接杀伤作用,比如CAR-T细胞治疗,TCRs,或者双抗。
由此可见,用于免疫治疗的可以是小分子药物,单克隆抗体,或者是过继性细胞免疫治疗。已取得成功的包括来那度胺为代表的免疫调节剂,美罗华为代表的单抗治疗B系淋巴瘤,以CAR-T为代表治疗B系肿瘤,或anti-PD-1治疗HL。
与靶向治疗相似,免疫治疗也不是one for all的,需要找到准确的分子标记物,做到个体化治疗。细分患者群体,依据PD-L1水平,MRD,CTLA-4表达,CD8+T细胞密度,突变负荷等。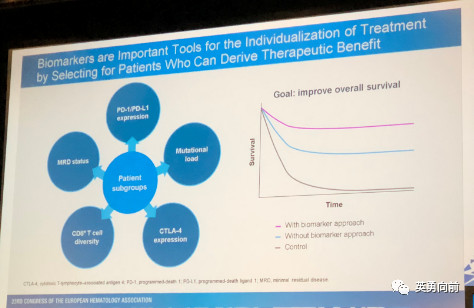
肿瘤最大的特点是高度异质性,对分子标记物的寻找应综合考虑肿瘤本身和肿瘤微环境,肿瘤1)肿瘤抗原,高突变肿瘤还是冷肿瘤,MSI-H等,2)肿瘤细胞表面表达PD-L1/L2的情况;或者,肿瘤微环境3)免疫负调微环境,比如IDO,Treg,MDSCs,LAG-3水平等,4)宿主的状态,这里特别要引起关注的是microbiome,肠道微生物的状态与肿瘤的发生发展以及治疗结果有相关性。大胆假设:不合理使用抗生素导致肠道菌群紊乱,影响免疫监视功能,在叠加因素影响下发生肿瘤,在治疗过程中大量使用抗生素的结果是预后明显差于不用抗生素的患者,在疾病和治疗基本相似的情况下(这是猜测,不是研究结论)。目前分子标记物的检测手段包括PET-CT,流式细胞,二代测序,免疫组化,检测来自肿瘤和微环境中的异常情况,结合临床治疗结局和算法,可以自我学习。。。
医药企业在血液肿瘤中的研发热点
药企关注的热门领域包括:凋亡,表观遗传学,免疫肿瘤,双抗蛋白,抗体药物偶联,癌症干细胞。
具体来说,
1. 骨髓瘤:IMiDs,蛋白酶体抑制剂,CAR-T;
2. 髓系肿瘤:表观遗传学药物(如阿扎胞苷,IDH抑制剂,地西他滨),免疫治疗(如CAR-T,PD-1,CD47),BET抑制剂,BCL-2抑制剂
3. 淋巴瘤:IMiDs,CAR-T,表观遗传学药物,anti-CD47等;
4. 骨髓纤维化:还在JAK抑制剂,但已有开始探索BCL-2和BCL-XL的应用,看看凋亡能不能用。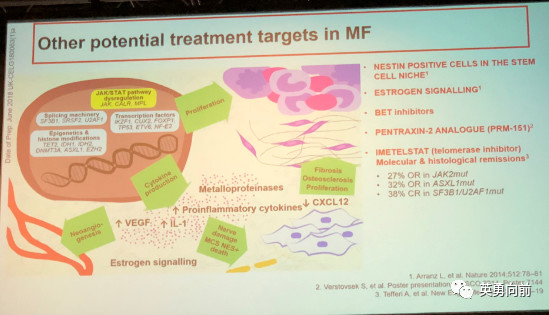
在技术范式尚未确立之前的探索,这些有潜在希望的治疗血液肿瘤的新靶点包括:PI3K,CDK4/6,CSF-1,PIM,CD123*CD3双抗,CD20*CD3双抗,SHP2,IL-15,TGFB-B,ERK,EED,RAF,MCL1,STING,FGFR,HDM2-p53,TLR7,LAG-3等。
整体看下来,BCL-2抑制剂值得进一步挖掘,特别是联合治疗,从淋到髓系可能都有作为。相比CAR-T,个人更推荐更关注BCL-2通路。
个人而言,特别兴趣点:1. BCL-2为代表的凋亡通路,在血液肿瘤中的应用。2. CAR-T跳出B系肿瘤,应用到髓系白血病。3. HARMONY项目收集大样本的患者数据,从微观层面和宏观层面进行分析,其相关性,未来或许大有作为。4.Quizartinib三期数据终于公布,好在阳性结果。5. 新达尔文主义解释肿瘤进展。6. 有幸现场听Carl JUNE的演讲,TET2是不是CAR-T治疗的核按钮?












 苏公网安备32059002004080号
苏公网安备32059002004080号


