目前,免疫检查点抑制剂在多种肿瘤中展示了临床疗效。CheckMate 205研究探索了自体造血干细胞移植(HCT)后复发/难治经典型霍奇金淋巴瘤(cHL)患者接受nivolumab治疗的疗效和安全性。结果显示,总体客观缓解率(ORR)为69%,各个队列的ORR在65%-73%之间,缓解持续时间(DOR)为16.6个月。本期IO治疗时讯邀请解放军总医院韩为东教授对该项研究进行点评。

研究背景
经典霍奇金淋巴瘤(cHL)患者中大部分有遗传突变,引起PD-L1表达。在CheckMate 205研究中,给予自体造血干细胞移植(HCT)后复发/难治cHL患者Nivolumab治疗,初始分析提示Nivolumab对3个队列中的1个队列患者有效。
CheckMate 205为一项多中心、单臂II期研究,入组HCT后复发/难治的cHL患者,分为3个队列。队列A为BV(brentuximab vedotin)未治疗患者,队列B为HCT后接受BV治疗的患者,队列C为HCT治疗前和/或后接受BV治疗的患者。所有患者接受Nivolumab(3mg/kg,q2w)治疗,直至疾病进展或毒性无法耐受。主要研究终点为独立影像评估委员会(IRC)判定的ORR。次要研究终点为IRC判定的DOR,以及PR和CR率和持续时间等。预设的探索性终点为IRC判定的PFS、OS和安全性等。
研究结果
共入组243例患者,其中队列A/B/C各有63/80/100例患者,中位随访时间为18个月,40%的患者继续接受治疗。总体ORR为69%(95% CI, 63-75%),各个队列的ORR在65%-73%之间。DOR为16.6个月(95% CI, 11.3-18.5个月)。70例患者在既往常规治疗后进展,61%有可评估病灶的患者,肿瘤稳定或靶病灶进一步缩小。不良反应(AEs):最常见的3-4级AEs为脂肪酶升高、中性粒细胞减少、ALT增加等。共发生29例死亡,均与治疗无关。
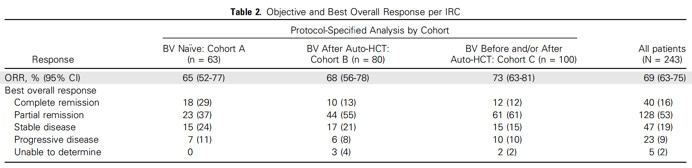
自体造血干细胞移植(HCT)后cHL患者接受nivolumab治疗的疗效
自体造血干细胞移植(HCT)后cHL患者接受nivolumab治疗的安全性
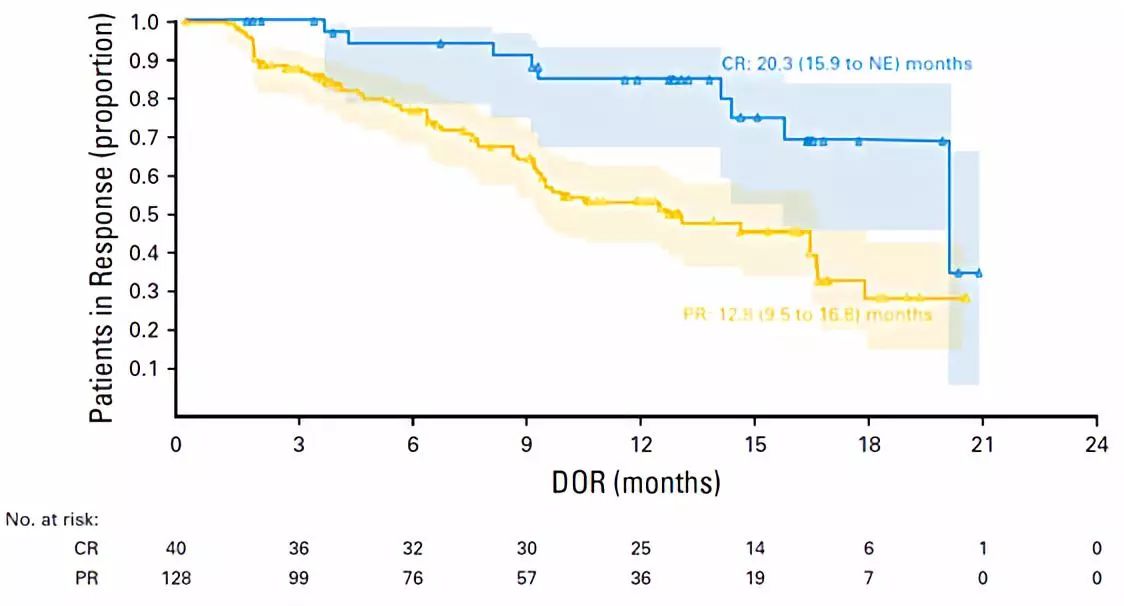
随着随访时间延长,Nivolumab的治疗获益稳定且持续。对于复发/难治cHL患者来说,Nivolumab治疗存在长期获益,安全性好。

解放军总医院分子免疫学研究室主任。医学博士,教授,临床肿瘤学博士研究生导师,首都科技创新领军人才。主要从事肿瘤治疗抵抗机制、干细胞生物学与临床研究。先后承担科技部重大专项1项,973课题2项,863项目3项,国家自然基金重点项目1项、面上项目6项,北京市生物技术前沿项目1项,获得企业投资3项,4项临床治疗技术企业转让。获得国家发明专利15项。主编专著3部。近5年以第一作者或通讯作者发表SCI论文130余篇,累计影响因子550余分。参与获得省部级二等奖以上4项。2012年创建了解放军总医院首个生物治疗转化医学病区并担任首任主任,在国内率先建立了“前店后厂”的转化医学模式。2015年,成立了中国研究型医院生物治疗学专业委员会,并担任首届主任委员。
在临床1期(NCT01592370)获得突出疗效基础上[1],于2014年8月启动了PD-1抗体Nivolumab治疗HCT失败后经典型霍奇金淋巴瘤(r/r-cHL)的多中心单臂临床试验(CheckMate 205,NCT02181738),2016年7月对入组接受治疗的80例患者进行了报道[2]。本文则是在前期研究设计基础上对前后入组的243例患者依据是否使用靶向CD30的抗体偶联药物BV与不同使用时机进一步分三组,重点比较了具有HCT背景的患者对Nivolumab治疗反应的差异性,同时也对Nivolumab使用后行异基因造血干细胞移植(allo-HSCT)的44例患者进行了安全性与疗效方面的描述分析。
本项目研究从开始到本文发表达到3.5年的时间,不仅证实了Nivolumab作为多线治疗失败或者再复发HL的长期有效性与安全性,同时也给目前PD-1抗体治疗r/r-cHL的FDA(美国食药局)与EMA(欧洲药品管理局)介入使用批准模式提出若干新问题与新思考。
一、Nivolumab治疗期间SD/PD患者是否考虑继续治疗?
本文指出,Nivolumab治疗期间即使患者是SD反应,从1年OS数据看也是获益的,1年内SD患者的OS与CR/PR获益者基本上是无显著差别的。这一点让我们思考一个问题,即抗PD-1治疗是否一定要追求CR或者是very good PR?如果以OS作为终点目标,至少在一定有限的时间范围内,追求CR/PR的临床反应性似乎显得并不是十分的迫切。当然,该项研究的随访时间还不够长,但我们还是相信,追求尽早的临床CR反应性应该对更长时间的OS是一定有利的[3]。
本文还有值得让人思考的一点是,如果cHL患者在使用Nivolumab期间,即使疾病进展,如果仍然继续使用免疫疗法,患者的OS较停用免疫疗法的要长(84% vs. 61%)。进展到需要系统治疗干预的时间在继续使用anti-PD-1者与停用免疫治疗患者之间也存在时间上的差异(8.8个月 vs. 1.5个月),这组数据意味着即使患者出现PD后继续采用抗PD-1治疗可能有助于OS的延长,同时也挑战免疫治疗终止点是否一定是传统评价的PD状态的确认。这种情况是否也在其他类型肿瘤中出现,或者存在?是否是免疫治疗的共性临床问题?这些均是值得进一步考证后回答的临床问题。
二、BV治疗史是否会对抗PD-1疗效产生影响?
研究将HCT后失败的cHL患者依据是否使用过BV分为三组观察对Nivolumab的治疗反应性,第一组是没有使用过BV的HCT后失败者,第二组是HCT之后使用BV者,第三组是HCT之前或者同时之后均使用BV者。三组对Nivolumab治疗的ORR差异不大(65%,68%,73%),但CR率与PFS还是有明显差异的,如没有BV使用历史者的CR率29%,其他两组分别是13%和12%。也就是说没有BV使用史的患者CR率是其他患者的2倍以上,对这一差异文中作者可能由于篇幅的有限性没有给出更多的解释。
从三组患者接受Nivolumab之前的疾病分期与治疗史看,后2组包含了更多的IV期患者(38%,68%,61%)与更多的疗程数,尽管这些因素可能是导致低CR率的重要原因,但也不能排除BV使用史不利于之后Nivolumab产生深度反应的可能性。
研究显示,CD30+的HL淋巴瘤细胞(Hodgkin and Reed–Sternberg cells,即HRS细胞) 在HL肿瘤瘤体只有不足10%的比率,但通过产生多种类型的细胞因子和趋化因子,如IL-13、IL-17、IL-10、TGF-beta、CCL17、CCL22等,招募多种类型的基质细胞与免疫细胞,如T细胞、Treg细胞、嗜酸细胞、NK细胞等聚集于病灶中,促使HL形成特殊的病灶病理构成,同时通过旁分泌效应形成HL所特有的免疫抑制微环境[4-6]。这一特殊的HL病理组成与PD-L1在肿瘤细胞中高表达的特质决定了该类疾病对抗PD-1治疗的临床高反应率。
作为一种偶联多个细胞毒性基团的CD30抗体,BV在肿瘤微环境中除了靶向CD30的HL细胞外,是否会对瘤体中的T细胞产生抑制性或者杀伤性顺带毒性?毕竟,我们知道丝裂原刺激的T细胞往往有CD30的表达上调[7],而前期使用BV如果对肿瘤中CD30+T细胞有减灭的话,显然对之后PD-1抗体可作用的靶细胞数目也是会有减损的。
但我们同时看到最近City of Hope血液中心同步联合输注BV与Nivolumab的I/II期临床研究结果显示,61例评价患者中ORR率(82%),与Nivolumab单药使用基本一致,但CR率却高达61%[8],提示不同的两种作用靶点不同的药物使用顺序不同,产生的临床反应也大不相同,预示着其作用模式原理也大的不同。这一点值得进一步去探索。同时,该结果指出,对于r/r-CHL患者,BV同步联合抗PD-1治疗,而非BV失败后再考虑抗PD-1治疗可能具有更好的前景。
三、PD-1抗体使用史是否会增加之后allo-HSCT的风险?
该研究中有44例已经停用Nivolumab的患者采用非清髓性化疗预处理进行了allo-HSCT治疗,其中一个不可回避的问题就是体内残存的低水平、甚至是目前手段难以检测的PD-1抗体是否会导致异基因免疫细胞的“去抑制”,诱发产生自身免疫病或者加重的GVHD,从而增加allo-HSCT的风险。目前,这个问题尚无明晰的答案。
EMBT淋巴瘤工作组于2018年对218例行allo-HSCT的HL患者进行了回顾性总结[9],通过数据比较,可以看到aGVHD(G3-G4)发生率在2组报道中分别为20%与8%;CheckMate 205报道6个月的移植相关死亡(TRM)为12.6%,EMBT淋巴瘤工作组报道的3年非疾病进展死亡(NRM)为19%。另外有一组多中心研究数据显示,PD-1抗体治疗虽可以有效的挽救allo-HSCT的失败,但却明显增加了GVHD的风险(可高达55%)[10]。由此也提示抗PD-1治疗与allo-HSCT即使是序贯进行也需要谨慎考量。
四、抗PD-1治疗后获CR是否预示着治愈?
该项研究共有16%(40例)的患者在Nivolumab后获得CR,但由于目前上缺乏足够证据证实,抗PD-1治疗后获CR就一定意味着是治愈状态,所以该大型研究的规划中依然对第一与第二组获得CR的患者继续维持原剂量与周期给药,直到疾病进展或者出现不可耐受的毒性,或者进入allo-HSCT的序列中。毕竟HSCT仍然是目前公认的可以治愈的手段之一。
也正是目前尚没有足够的“信心”认定可以停止所有患者的抗PD-1的药物治疗,该项目只允许第三组中获得CR的12例患者在CR一年后停止抗PD-1治疗,但CR后停药再复发率的问题目前还没有足够样本的数据来回答。但无论如何,只有先提高CR率,才有治愈的前提,只有足够的CR数量人群随访观察,才能回答抗PD-1后获得CR是否意味着治愈这一重大临床问题[3]。
五、如何提高anti-抗PD-1治疗在r/rHL患者中的CR率?
本项目研究最为重要的一个结论就是即使患者经历了多线治疗,HCT以及BV治疗之后再复发或者难治状态,抗PD-1单药治疗仍然有效,并且其总体有效率与之前没有经历HCT及BV治疗史的患者接近[3, 11],这也就意味着抗PD1单药治疗即使作为最末线治疗仍然可行,同时也意味着抗PD-1治疗即使在较早阶段介入,单药治疗对r/rHL而言获得更高的CR是难以突破25%瓶颈的。如何通过合理药物联合大幅度提高CR率是抗PD-1治疗未来追求的方向。
目前已知的有望大幅提高CR率的探索研究包括:1)采用针对不同作用靶点的药物联合治疗策略:如联合靶向CD30的抗体偶联药物BV[5],或者联合靶向CD30的CAR-T细胞。2)免疫增效:解放军总医院生物治疗团队基于他们对低剂量地西他宾对T细胞的抗瘤增效性识别与发现[12],设计了低剂量地西他宾联合抗PD-1治疗r/r-cHL的临床方案, CR率达到近70%,并且该方案在抗PD-1单药治疗后进展的患者中使用仍可以使得近20%的患者再次获得CR[13]。
我们相信,随着上述可大幅提高CR率方案的推进,在获得CR的患者中一定会有相当一部分是能够治愈的,并且是不用再纠结是否去承担HCT的高风险前提下获得治愈的。
1. Ansell SM., et al. N Engl J Med. 2015. 372:311-319.
2. Younes A., et al., Lancet Oncol 2016. 17:1283-94.
3. Manson G, et al. Blood. 2018 May 3. pii: blood 2018; 03-841262.
4. Maggio E, et al. Annals of oncology 2002;13 Suppl 1:52-6.
5. Hanamoto H, et al. The American journal of pathology. 2004;164(3):997-1006.
6. Liu Y, et al. Seminars in cancer biology. 2014; 24: 15-22.
7. Bowen MA, et al. J Immunol. 1996; 156: 442–9.
8. Herrera AF, Moskowitz AJ, Bartlett NL, et al. Blood. 2018;131(11):1183-94.
9. Bazarbachi A, Boumendil A, Finel H, et al. British journal of haematology. 2018;181(1):86-96.
10. Haverkos BM, Abbott D, Hamadani M, et al. Blood. 2017;130(2):221-8.
11. Shanbhag S, Ambinder RF. CA Cancer J Clin. 2018 Mar;68(2):116-132.
12. Li X, Zhang Y, Chen M, et al. Clin Cancer Res. 2017 Oct 15;23(20):6031-6043.
13. Wang CM, et al. 2018 ASCO poster. 2018; Abstract #7537.












 苏公网安备32059002004080号
苏公网安备32059002004080号


