非小细胞肺癌(NSCLC)是全球癌症相关死亡的主要原因之一,约占所有肺癌病例的85%。对于EGFR突变的晚期NSCLC患者,EGFR-TKI已成为标准的一线治疗选择。然而,在不可切除的III期NSCLC患者中,根治性放化疗(CRT)后EGFR-TKI的应用价值仍需进一步明确。
在此背景下,LAURA研究应运而生,旨在评估奥希替尼作为巩固治疗,在接受CRT后病情未进展的EGFR突变不可切除III期NSCLC患者中的疗效与安全性。该研究的初步结果显示奥希替尼组的中位PFS显著优于安慰剂组(39.1个月 vs 5.6个月,风险比[HR] 0.16,P<0.001),达到了主要研究终点。基于此结果,奥希替尼已在华获批用于该适应证,并被纳入多个临床指南。然而,初次分析时,OS数据尚不成熟(成熟度20%),虽观察到获益趋势(HR 0.81),但未达到统计学显著性(P=0.53)。
2025年3月26-29日在法国巴黎召开的欧洲肺癌大会(ELCC)上,Suresh Ramalingam教授分享了LAURA研究更新数据。本次报告旨在提供更新的OS数据以及详细的后续治疗模式分析,以更全面地评估奥希替尼在该人群中的长期疗效。

LAURA研究初步结果
研究设计
LAURA研究是一项随机、双盲、安慰剂对照的国际多中心III期临床试验。纳入标准为携带EGFR外显子19缺失或L858R突变、PS评分0或1的不可切除III期NSCLC成人患者。患者需在完成基于铂类的同步放化疗后6周内进行评估,且无疾病进展证据。
符合条件的患者按2:1的比例随机分配接受奥希替尼(80mg,每日一次口服)或安慰剂治疗,直至疾病进展(根据RECIST 1.1标准评估)、出现不可接受的毒性或患者/研究者决定终止治疗。发生疾病进展后,研究者可根据临床判断决定是否让患者(包括安慰剂组)接受奥希替尼治疗。

研究的主要终点是盲态独立中心评估(BICR)的PFS。关键次要终点包括OS、研究者评估的PFS、CNS PFS、以及多个探索性终点,如至首次后续治疗时间(TFST)、第二次无进展生存期(PFS2,定义为从随机化至第二次疾病进展或死亡的时间)和至第二次后续治疗时间(TSST)。
研究采用了序贯多重检验流程:首先检验PFS,若PFS达到统计学显著性(预设HR 0.53,90%把握度,α=5%),则将α用于后续的OS检验。OS的最终分析计划在数据成熟度达到约60%时进行,若达到统计学显著性,则进一步检验CNS PFS。
本次报告更新的OS分析数据截止日期为2024年11月,后续治疗相关终点(TFST, PFS2, TSST)的分析基于初次分析的数据截止日期(2024年1月)。

研究结果
患者基线特征与分组
研究共纳入216例患者,按2:1随机分配至奥希替尼组(n=143)和安慰剂组(n=73)。两组患者的基线特征总体均衡,包括年龄、性别、吸烟史、ECOG PS评分、疾病分期(约三分之二为IIIb/IIIc期)和EGFR突变类型。两组中绝大多数患者接受了同步放化疗。安慰剂组的EGFR外显子19缺失突变比例略高。
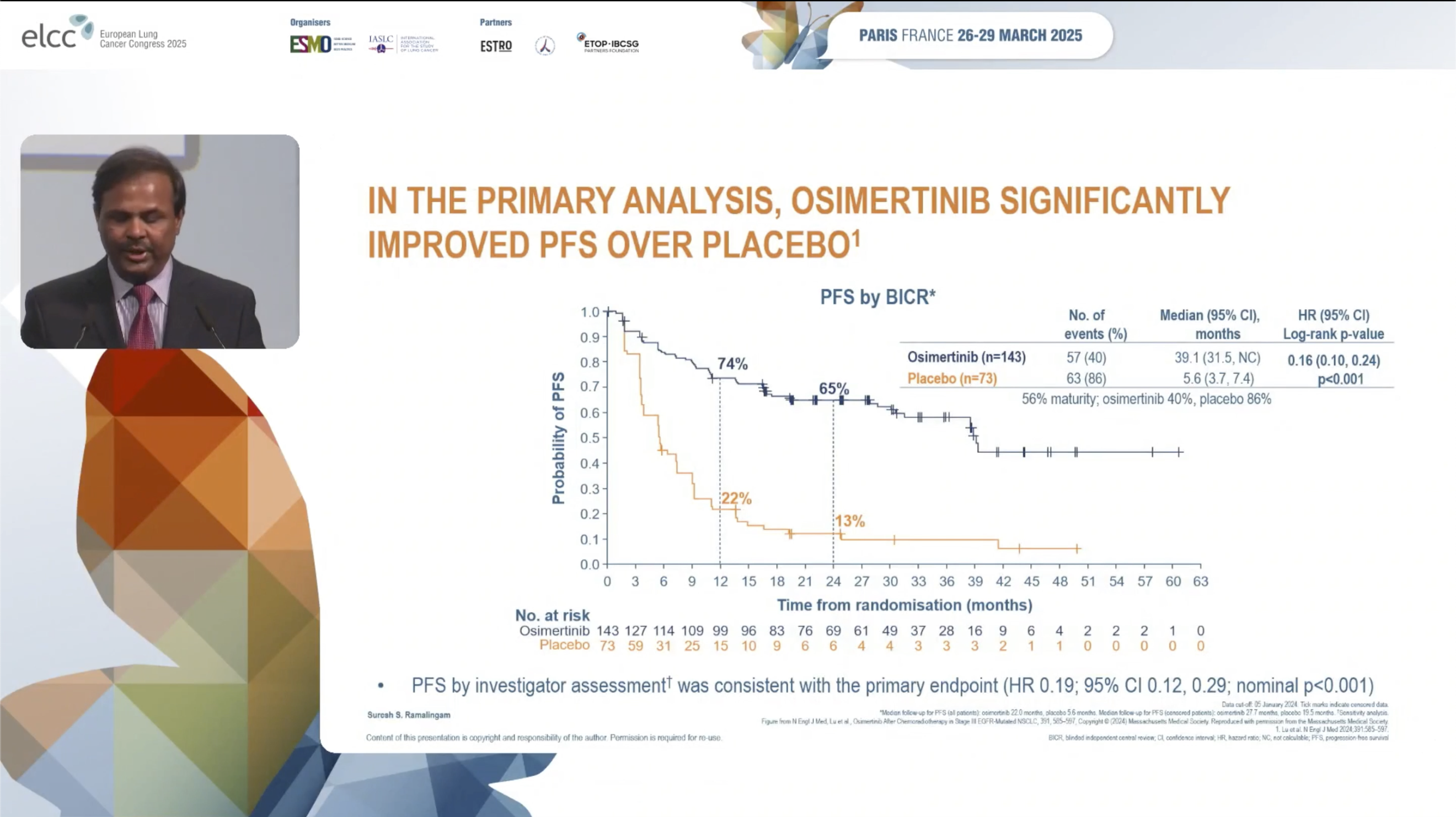
无进展生存期(PFS)
初次分析结果显示,经BICR评估,奥希替尼组的中位PFS为39.1个月,显著优于安慰剂组的5.6个月(HR 0.16, 95% CI 0.10-0.24, P<0.001)。研究者评估的PFS结果与之相似(HR 0.19, 95% CI 0.12-0.29)。
总生存期(OS)更新分析
初次分析时(数据截止2024年1月),OS事件数为43例,成熟度为20%。中位随访时间在奥希替尼组为29.5个月,安慰剂组为28.1个月。当时OS的HR为0.81(95% CI 0.42-1.56, P=0.53)。
本次更新分析(数据截止2024年11月)时,OS事件数增加至66例,成熟度提升至31%。中位OS随访时间在奥希替尼组约为39.4个月,安慰剂组约为35.2个月。更新的OS分析显示,奥希替尼组的OS获益趋势进一步增强,HR为0.61(95% CI 0.40-1.14, P=0.14)。
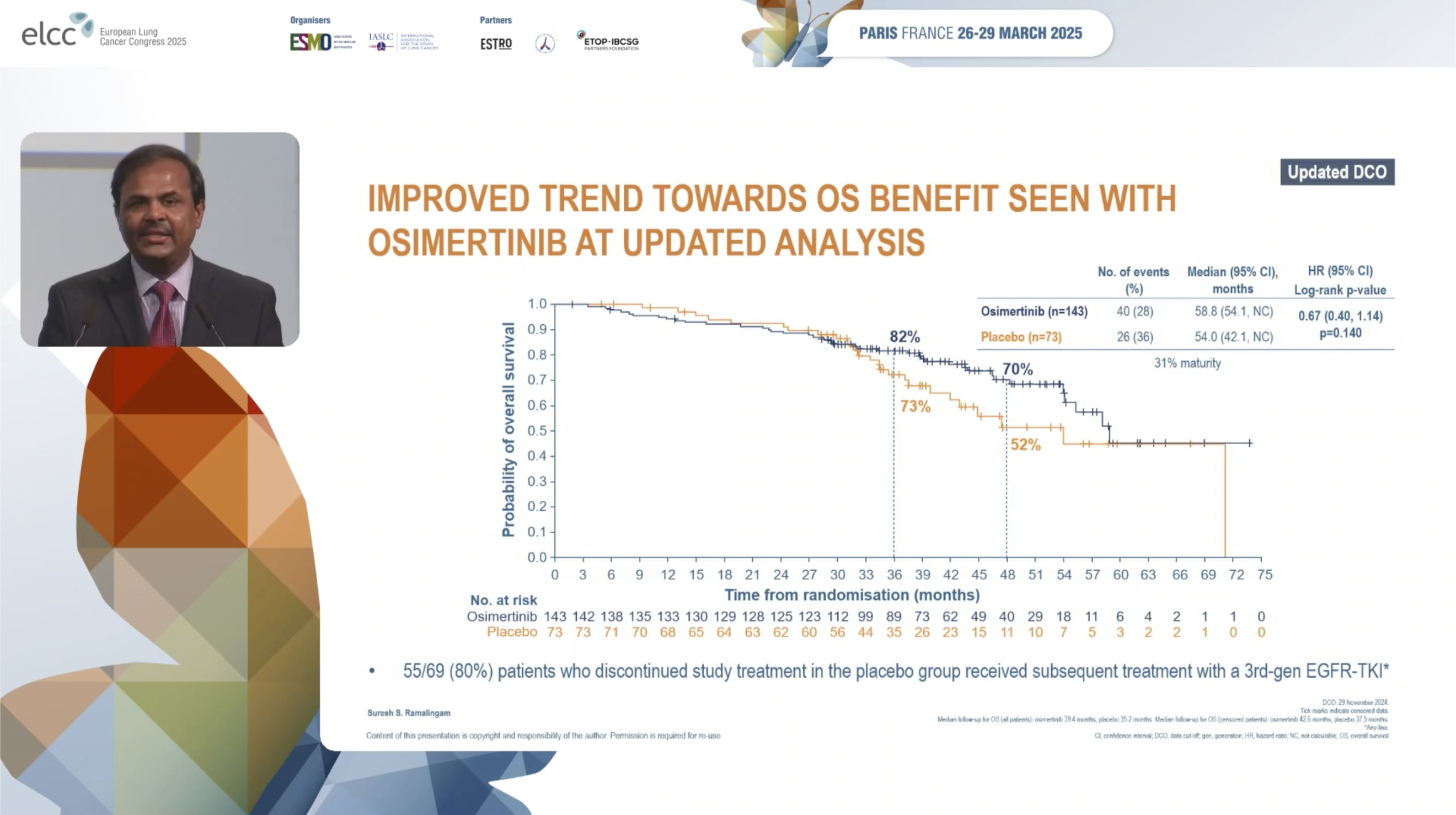
虽然尚未达到统计学显著性,但与初次分析相比,两条生存曲线在中后期的分离更明显。奥希替尼组的中位OS估计约为58.8个月,安慰剂组约为54.0个月。
值得注意的是,安慰剂组中有高达77%的患者在疾病进展后接受了奥希替尼作为后续治疗。这种高比例的交叉治疗可能影响了OS结果,解释了生存曲线早期重叠而后逐渐分离的现象。OS的最终分析将在成熟度达到60%时进行。
后续治疗模式与疗效
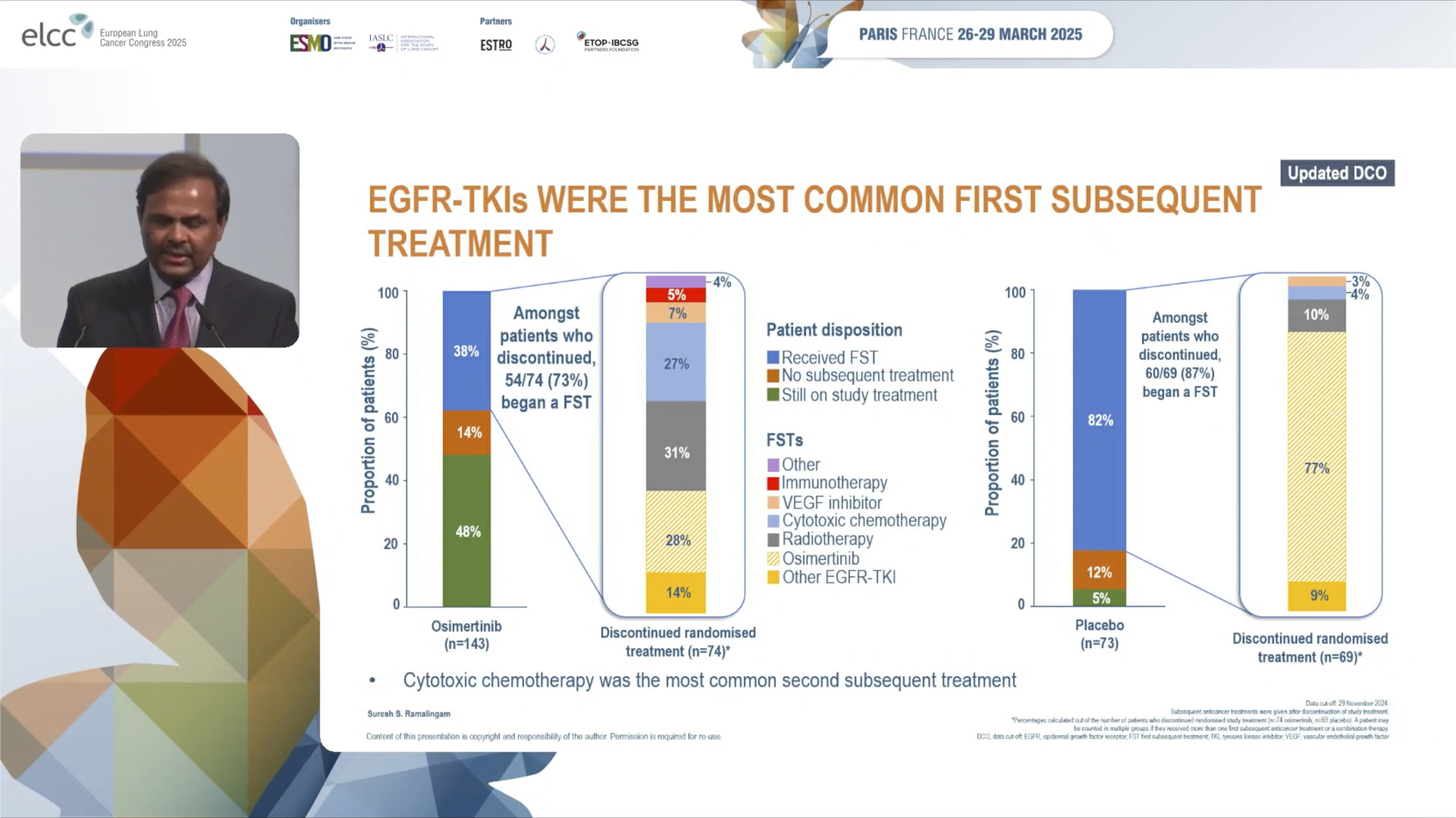
在安慰剂组,截至初次分析截止日期,95%的患者已停止治疗。其中,82%的患者接受了后续治疗。最常见的后续治疗是EGFR-TKI:77%的患者接受了奥希替尼治疗,另有9%接受了其他EGFR-TKI。
在奥希替尼组,截至初次分析截止日期,仍有48%的患者在接受奥希替尼治疗。在停止治疗的患者中(52%),有38%接受了后续治疗。后续治疗种类多样,约14%接受了另一种EGFR-TKI,31%接受了放疗,27%接受了化疗作为后续治疗。另有28%停止初始奥希替尼治疗的患者接受了后续的奥希替尼治疗。
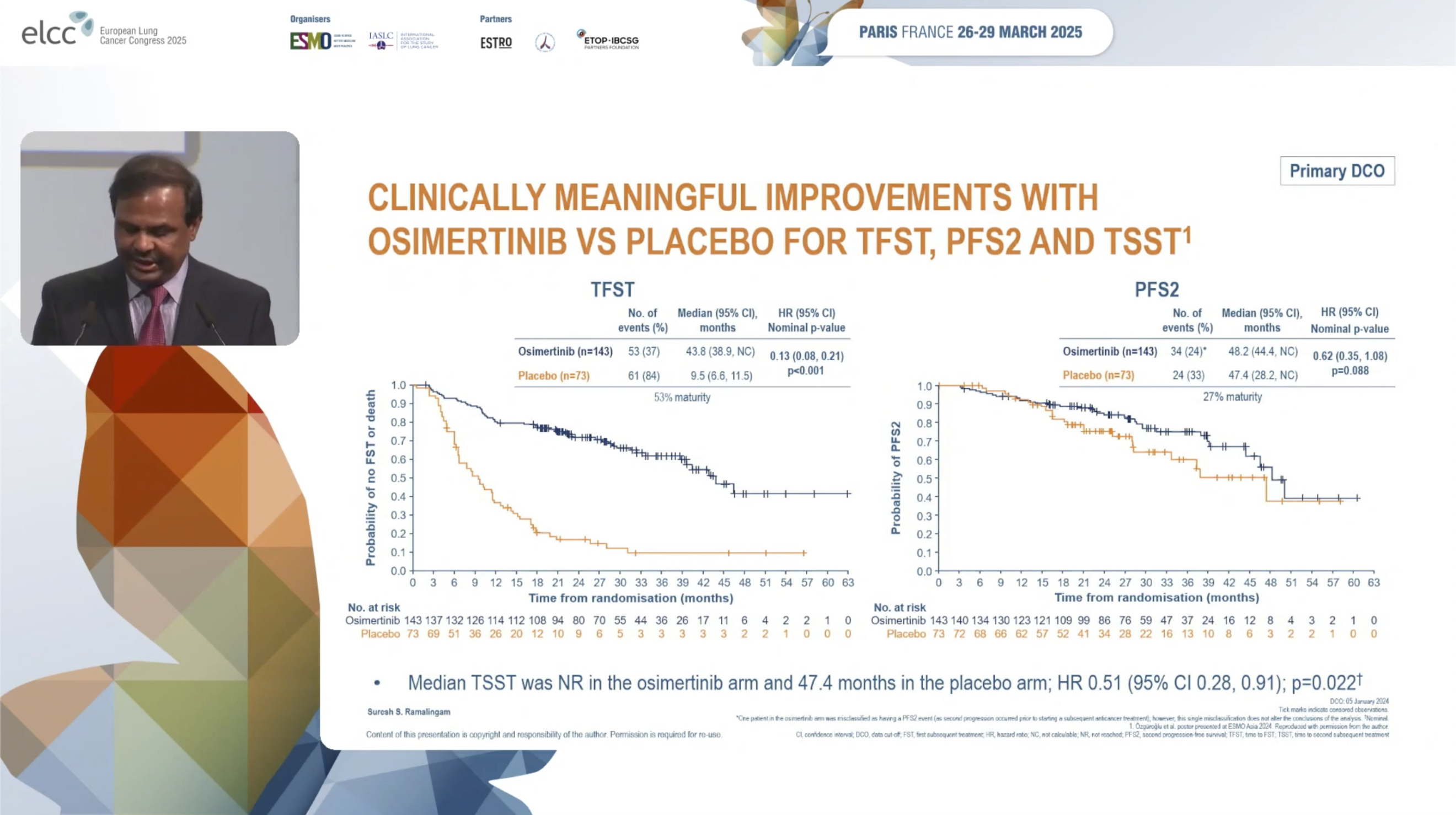
后续治疗相关终点分析显示,奥希替尼组显著延长了至首次后续治疗时间(TFST),中位TFST为43.8个月,而安慰剂组为9.5个月(HR 0.13, 95% CI 0.08-0.21, P<0.001)。此外,奥希替尼组和安慰剂组的中位第二次无进展生存期(PFS2)分别为48.2和47.4个月(HR 0.62, 95% CI 0.35-1.08, P=0.088)。在至第二次后续治疗时间(TSST)方面,奥希替尼组中位TSST未达到,而安慰剂组为47.4个月(HR 0.51, 95% CI 0.28-0.91, P=0.022)。
讨论
LAURA研究是首个评估EGFR-TKI用于根治性放化疗后EGFR突变不可切除III期NSCLC巩固治疗的III期随机对照试验。其主要终点PFS结果具有里程碑意义,明确证实了奥希替尼在该治疗模式下的显著临床获益,将中位PFS从不足半年延长至超过三年。这一结果直接推动了奥希替尼成为该适应证的新标准治疗。
本次更新的OS分析进一步支持了奥希替尼的长期疗效。尽管由于安慰剂组极高的交叉治疗率(近80%的患者后续使用了奥希替尼),OS的统计学显著性尚未达到(P=0.14),但HR值从初次分析的0.81改善至0.61,显示出更强的生存获益趋势。生存曲线在中后期的分离也提示,早期接受奥希替尼巩固治疗可能带来延迟的生存优势。
后续治疗数据的分析同样具有重要临床意义。奥希替尼巩固治疗不仅显著推迟了首次需要后续治疗的时间(TFST HR 0.13),也改善了PFS2(HR 0.62)和TSST(HR 0.51)。这表明,奥希替尼的获益并不仅仅局限于初始巩固治疗阶段,其效果可以延续到后续治疗过程中,可能通过延缓耐药或改变疾病进展模式,为患者争取更长的疾病控制时间和接受后续治疗的机会。
以上数据共同支持:对于携带EGFR敏感突变的不可切除III期NSCLC患者,在完成根治性放化疗后,奥希替尼巩固治疗是重要的标准治疗选择。
排版编辑:肿瘤资讯-丹忱













 苏公网安备32059002004080号
苏公网安备32059002004080号


