【35 under 35】风采展示第二轮已经开始啦!本轮正经名叫“病例实战分析”,不正经名叫“互相伤害”,哈哈哈~100位入围选手每人提交一个有意思的病例,并就病例提出一个问题,形成一个病例库!然后100位入围选手从病例库中任意选择一个非自己提供的病例进行解读并回答问题!最后,我们将呈现病例+别人的点评+病例提供者自己的点评,同步展示!
 100位小伙伴已将自己的病例提交,并提出了问题,让我们一起先阅读下精彩病例吧!
100位小伙伴已将自己的病例提交,并提出了问题,让我们一起先阅读下精彩病例吧!
患者病史摘要
性别:女
年龄:46
主述:咳嗽,伴右侧肋部疼痛2月余
入院时间:2013-XX-XX
体能状态评分:ECOG PS 1
既往史、个人史、家族史:无特殊
入院实验室检查:三大常规、肝肾功能未见异常。
影像学检查
入院时胸+上腹部CT平扫+增强提示:1. 右中肺肺Ca伴双肺多发转移;2. 右侧胸膜增厚伴多发结节
颅脑MRI平扫+增强、骨扫描未见特殊异常。

图1、基线胸部CT图像,肺窗
病理
低分化腺癌
分子检测
桑格测序法:EGFR 19del
入院诊断
右中肺低分化腺癌伴双肺、胸膜多发转移,T2NxM1 IV期,EGFR 19del
一线治疗方案及疗效
方案组成:阿法替尼
开始时间:2013-02-16
用法用量:40 mg QD
治疗周期数:18个月
最佳疗效:PR
疾病进展时间:2014-08-12
PFS时间:18个月
疾病进展时影像学图片:
1)、胸+上腹CT平扫+增强:1、右中肺肺Ca伴双肺多发转移,较前增多,增大;2、右侧胸膜增厚伴多发结节,较前增大
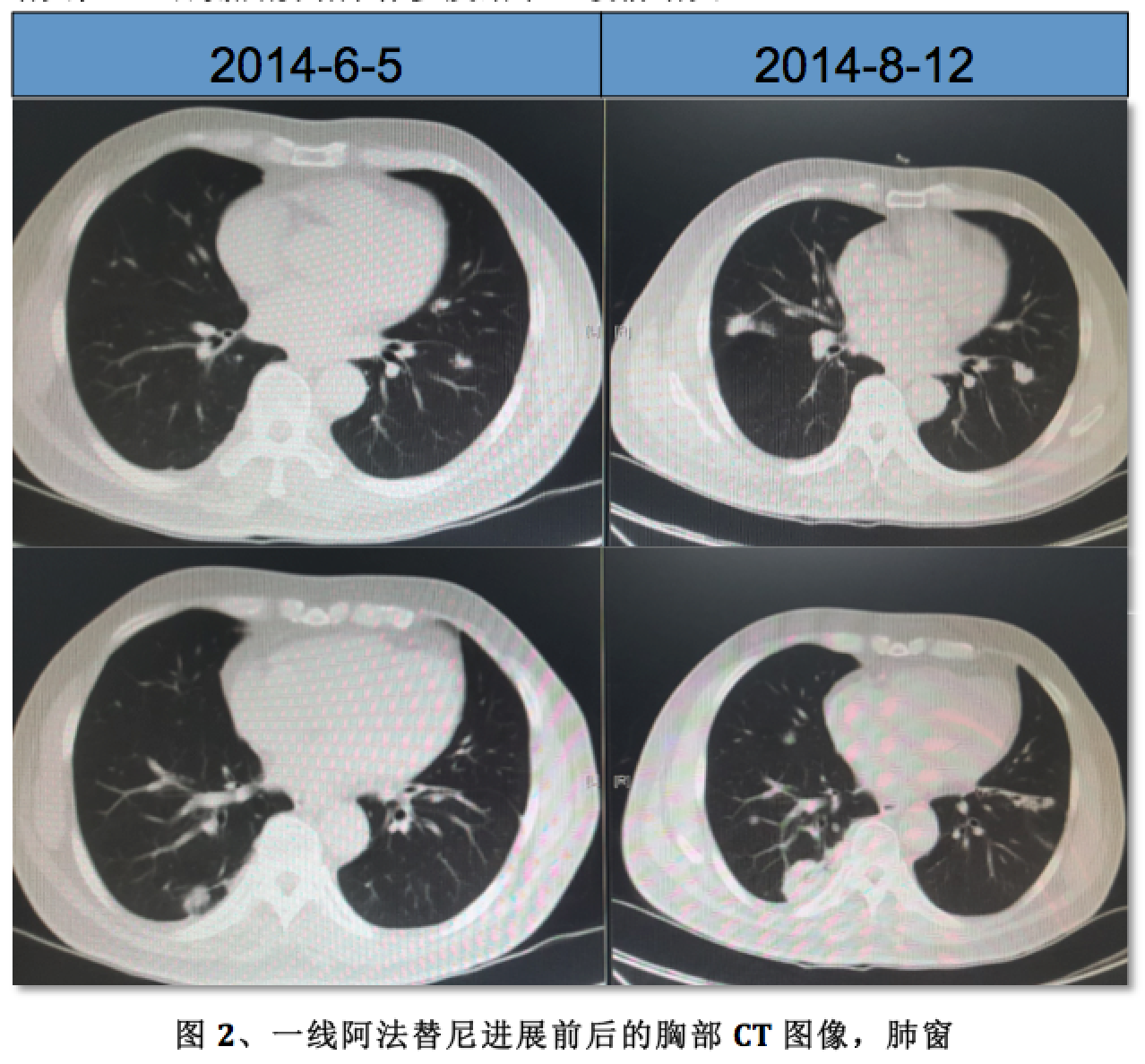
2)、颅脑MRI及骨扫描未见特殊异常
疾病进展前后肿瘤标记物:
CEA 20.91 --> 25.79 (ug/L)
CA153 40.09 --> 48.43 (U/ml)
NSE 20.48 --> 108.7 (ug/L)
疾病进展时ECOG PS:1分
二线治疗方案选择
建议患者行再活检,明确耐药机制。再活检病理:(右下肺胸膜肿物经皮穿刺)异形细胞小片巢状排列,胞浆少,核深染,核仁不明显,结合免疫组化,符合小细胞肺癌。另见少量腺癌细胞。免疫组化结果:TTF-1(3+),CK-7(2+),Ki-67(50%+),NSE(3+),Syn(2+),CgA(2+)。
显微切割出小细胞肺癌及腺癌部位,行基因检测
EGFR:ARMS法,野生型
C-met:FISH法,阴性
TP-53:小细胞肺癌部位7号外显子突变,腺癌部位阴性。
方案组成:VP-16 + DDP q3w
开始时间:2014-08-22
用法用量:VP-16:100mg/m2 D1-3 ivdrip;DDP:25mg/m2 D1-3 ivdrip
治疗周期数:6周期(末次化疗时间2014-12-18)
最佳疗效:PR
疾病进展时间:2015-04-07
PFS时间:7+个月
疾病进展时影像学图片:
1)
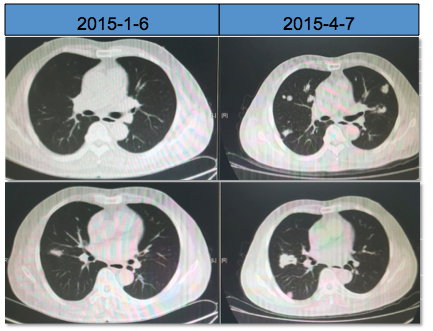
图3、二线进展前后的胸部CT图像,肺窗
2)颅脑MRI及骨扫描未见异常。
进展时ECOG PS评分:1分
三线治疗方案选择
建议患者行再活检,明确耐药机制。再活检病理:(右中肺肿物经皮穿刺):低分化腺癌混合少量小细胞癌(约10%)。免疫组化结果:TTF-1(3+),CK-7(3+),Ki-67(30%+),NSE(局灶+),Syn(+/-),CgA(-)
基因检测:
EGFR:ARMS法,野生型
多基因:NGS,结果如下
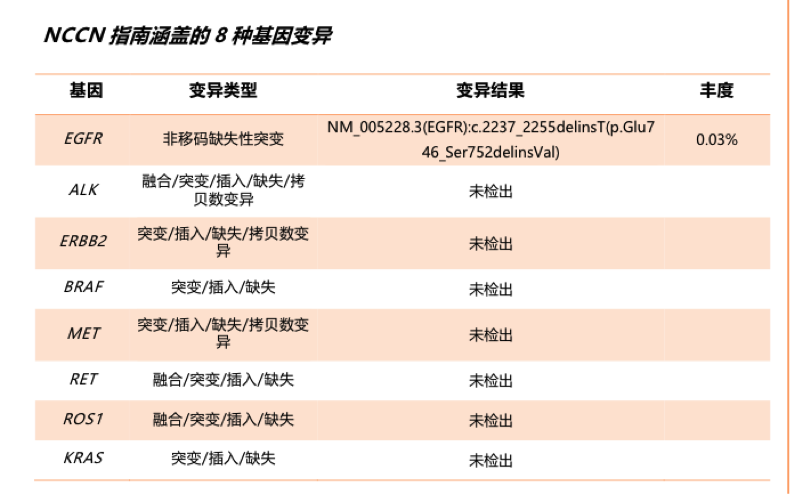
图4、二线治疗进展后再活检标本多基因检测结果
问题:
1. 该病例中,一线EGFR TKI耐药后再活检,病理提示混合型小细胞肺癌(combined small-cell lung cancer),如何解读?
2. 三线治疗方案如何选择:EGFR TKI or chemotherapy?
此病例共有1位入围选手点评:60-徐燕;病例提供作者为:71-洪少东。详情如下:
点评医生简介:60-徐燕
 点评内容分享:
点评内容分享:
表皮生长因子受体(epidermal growth factor receptor,EGFR)基因敏感突变的晚期非小细胞肺癌(non small-cell lung cancer,NSCLC),应用EGFR酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKIs)治疗,可延长患者的无疾病进展时间及总生存时间。然而,接受EGFR-TKIs治疗的患者,多数在9-14个月发生获得性耐药。目前60-70%的EGFR-TKIs获得性耐药机制通过二次活检得以明确[1],主要包括三方面:EGFR基因的二次突变(最常见的是EGFR exon20 T790M突变)、表型转化(例如EGFR突变的NSCLC转化为小细胞肺癌(small-cell lung cancer,SCLC)、以及旁路的激活(例如MET扩增)。NSCLC转化为SCLC虽然在EGFR-TKIs获得性耐药中发生率相对低,却引起了医生和研究者极大的兴趣,引发对于肿瘤克隆进化和肿瘤异质性的探讨[2]。
通常我们认为肺腺癌来源于肺泡上皮细胞,SCLC来源于神经内分泌细胞,而II型肺泡上皮细胞具有转化为SCLC和肺腺癌的潜能[2](图2)。在细胞水平和动物模型的研究发现,EGFR突变可以促进EGFR信号通路持续激活,从而导致II型肺泡上皮细胞癌变,揭示了II型肺泡上皮细胞癌变为EGFR突变阳性的肺腺癌,而敲除II型肺泡上皮细胞中的Tp53 和Rb1基因,可导致小细胞肺癌发生,提示II型肺泡上皮细胞癌变为SCLC。如果腺癌出现RB1基因功能的失活[3],也可以转变为SCLC。综上,肺腺癌和SCLC,可以同时发生于II型肺泡上皮细胞,也可以出现腺癌转化为SCLC。
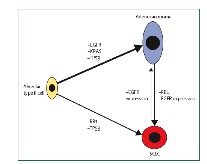 图1[2] 腺癌转化为小细胞肺癌的分子机制假设模型图
图1[2] 腺癌转化为小细胞肺癌的分子机制假设模型图
小细胞肺癌转化(Small cell lung cancer transformation),是对于NSCLC治疗过程中出现SCLC的一种说法,这里,我更愿意将真正由腺癌克隆转化所得的SCLC,称之为SCLC转化。由腺癌肿瘤克隆进化所得SCLC,意味着SCLC具有腺癌的特点,尽管病理活检标本的肿瘤表型评估,获得性耐药的肿瘤细胞具有小细胞肺癌的特点,但是从基因表型评估,这样的SCLC,具有原有腺癌的EGFR突变。有多篇文献报道了类似的病例,我院病理科进行了2例SCLC转化的腺癌患者EGFR基因检测[4],在初始的腺癌及转化后的SCLC均检测到相同的EGFR突变,我们中心回顾相关文献[5],总结了18例SCLC转化的患者,发现14例患者转化的SCLC检测到了与初始腺癌相同的EGFR基因突变,提示SCLC是由腺癌肿瘤克隆进化而得。近期在JCO发表的研究表明[6],发生SCLC转化肺腺癌中出现RB1和TP53失活的比例显著高于非SCLC转化组(82% v 3%; odds ratio, 131; 95%CI, 19.9 to 859),并再次通过基因分析证明了在克隆进化的过程中,RB1和TP53功能失活在腺癌向SCLC转化过程中的作用。
然而,并非所有EGFR-TKIs治疗后出现的SCLC都可以检测到EGFR基因突变。Ahn,S等[7]总结了6例EGFR-TKIs治疗后SCLC转化的肺腺癌患者,两例SCLC未检测到EGFR突变。我院病理科研究[4]对于复合型小细胞肺癌(combined small cell lung cancers,CSCLC)的腺癌成分和SCLC成分进行EGFR基因检测,1例患者的腺癌成分检测到EGFR突变而小细胞成分未检测到EGFR突变。因此,提示SCLC并非由腺癌直接转化所得,而可能是SCLC和腺癌同时存在(即复合型小细胞肺癌),起源于不同的肿瘤克隆,为肿瘤异质性的表现。由于晚期NSCLC的活检标本,多数为小标本病理标本,其病理标本具有一定的局限性,诊断初期,对于混有的较少的SCLC成分无法诊断,但在腺癌接受EGFR-TKIs治疗的过程中,SCLC逐渐成为优势克隆,二次活检标本以SCLC为主。
有了上述的文献复习,对于该病例,进行分析如下:
该患者初始诊断IV期肺腺癌,合并EGFR 19del,应用阿法替尼治疗最佳疗效PR。疾病进展后,二次活检,病例提示小细胞肺癌为主,另见少许腺癌成分。通过显微切割出腺癌及SCLC部位进行基因检测,SCLC成分并未检测到EGFR突变,而检测到了TP-53基因7号外显子突变,因此,考虑SCLC可能并非由腺癌直接转化而得,可能是由于治疗初期,为混有腺癌和小细胞肺癌成分的混合癌,由于活检的局限性,并未获得SCLC病理诊断,阿法替尼治疗的过程中,腺癌成分明显抑制,SCLC成为优势肿瘤,进而导致肿瘤复发,VP-16联合顺铂治疗SCLC有效。
SCLC化疗后再次肿瘤进展,第三次活检,病理标本提示:以腺癌为主混有少量SCLC成分,考虑SCLC成分在抗肿瘤治疗后明显受抑制,而腺癌成分再次成为优势肿瘤,对于腺癌的基因检测可检测到EGFR 19del。由于目前SCLC成分极少,所以,可以考虑再次尝试EGFR-TKIs治疗。但是,由于SCLC成分的存在,EGFR-TKIs治疗后可能会发生肿瘤进展,需要治疗1月后评估肿瘤疗效,如果再次进展,可以考虑化疗,可选用例如紫杉醇或者吉西他滨等可以同时覆盖腺癌及SCLC的抗肿瘤治疗方案。
病例提供作者简介:71-洪少东
 病例提供作者自评:
病例提供作者自评:
阿法替尼的耐药机制与第一代EGFR-TKI相似,可分为4类1:1. 出现耐药突变,最常见的是EGFR T79M突变;2. 旁路激活,如MET扩增;3. 表型改变,如腺癌向小细胞肺癌转化,上皮细胞向间质细胞转化(EMT);4. 下游信号通路激活。这个病例中,初次活检肺原发灶(右中肺)病理提示低分化腺癌,EGFR 19del,一线PFS为18个月,超过阿法替尼一线治疗的中位PFS2。一线阿法替尼进展后再活检,转移灶右下肺肿物病理提示为混合型小细胞肺癌(合并少量腺癌成分),EGFR野生型。NSE(神经元特异性烯醇化酶)明显升高。我们知道NSE是小细胞肺癌较为特异的肿瘤标记物,结合病理结果,似乎可以认为该病例中,阿法替尼耐药的机制为腺癌向小细胞肺癌转化。但需要注意的是,耐药前后活检的部位是不同的,并且耐药后丢失了EGFR 19del,所以无法排除肿瘤空间异质性的存在。也就是说我们无法除外基线时已经存在腺癌和小细胞肺癌两种病理类型,经阿法替尼治疗后,EGFR敏感突变的腺癌克隆被消灭,而没有EGFR突变的小细胞肺癌及腺癌克隆获得了生存空间,从而导致疾病进展。当然不管是哪种情形,因为一线耐药后不存在druggable targets,这个患者二线治疗使用VP方案应该是没有太大争议的,PR的疗效及PFS=7个月也基本符合小细胞肺癌的特点。
二线VP方案耐药后,我们再次进行活检,选择的部位是原发灶—右中肺肿物,病理结果提示:低分化腺癌混合少量小细胞癌。再次说明了肿瘤进化过程中的此消彼长,腺癌克隆又获得了生存空间。NGS检测结果提示存在非常低丰度的EGFR 19del,而ARMS方法未检出突变型EGFR,这说明肿瘤里面存在EGFR突变的克隆很少。既往研究表明EGFR低丰度,使用EGFR-TKI疗效较差3。所以在三线治疗上,这个患者并不推荐用EGFR-TKI,考虑化疗。化疗方案我们选择TC+A(紫杉醇+卡铂+安维汀),理由如下:1、TC+A是非鳞癌的标准一线化疗方案,相比TC方案显著延长PFS及OS4;2、肿瘤主要成分是腺癌,但仍存在小细胞肺癌的成分。备选方案最好是同时对这两种类型有效。研究表明,培美曲塞单药治疗经治小细胞肺癌,有效率非常低(6%, 2/35)5,而紫杉醇单药可达24%(5/21)6。
总结:诊断EGFR T790M激发耐药已经有了奥西替尼这个利器,我们亟需寻找针对其他耐药机制的治疗方法。肿瘤异质性及肿瘤进化的普遍存在,是治疗非小细胞肺癌的难点,有赖于多点活检及全面的基因测序,值得进一步研究。
以上为【35 under 35】的观点,您怎么看?欢迎广大肿瘤医生在下方留言发表您的观点!
以上所有点评参考文献略。














 苏公网安备32059002004080号
苏公网安备32059002004080号


