【35 under 35】风采展示第二轮已经开始啦!本轮正经名叫“病例实战分析”,不正经名叫“互相伤害”,哈哈哈~100位入围选手每人提交一个有意思的病例,并就病例提出一个问题,形成一个病例库!然后100位入围选手从病例库中任意选择一个非自己提供的病例进行解读并回答问题!最后,我们将呈现病例+别人的点评+病例提供者自己的点评,同步展示!
 100位小伙伴已将自己的病例提交,并提出了问题,让我们一起先阅读下精彩病例吧!
100位小伙伴已将自己的病例提交,并提出了问题,让我们一起先阅读下精彩病例吧!


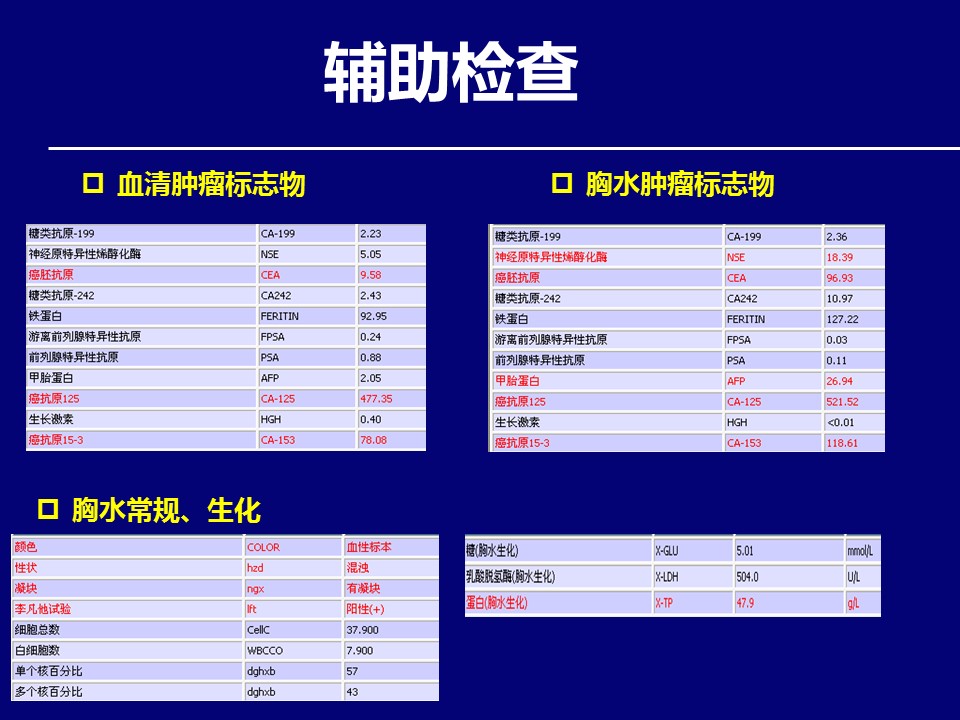






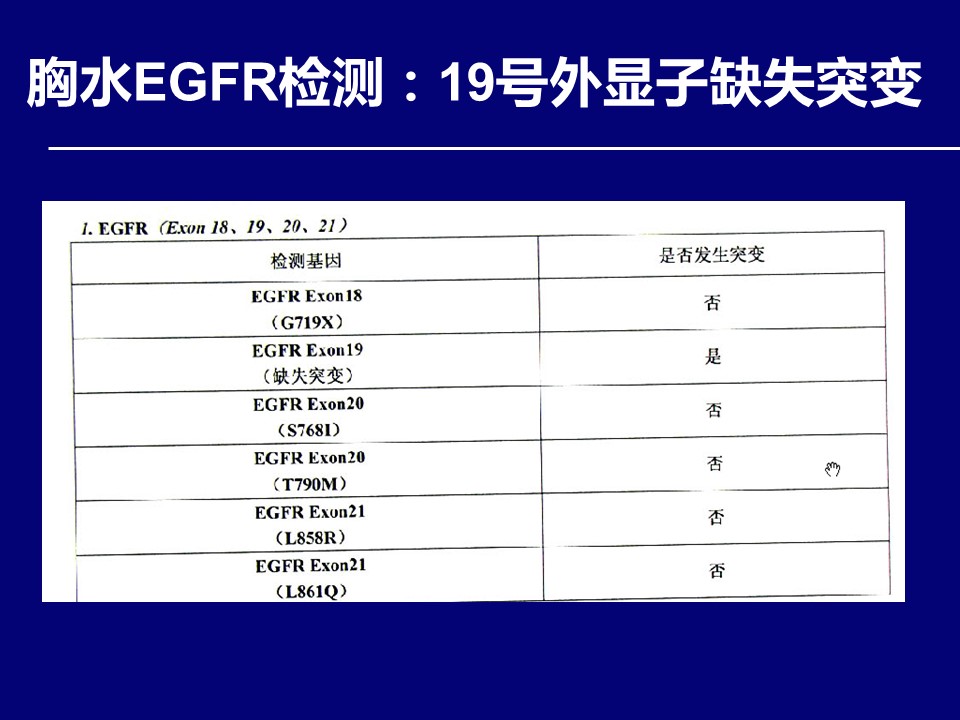









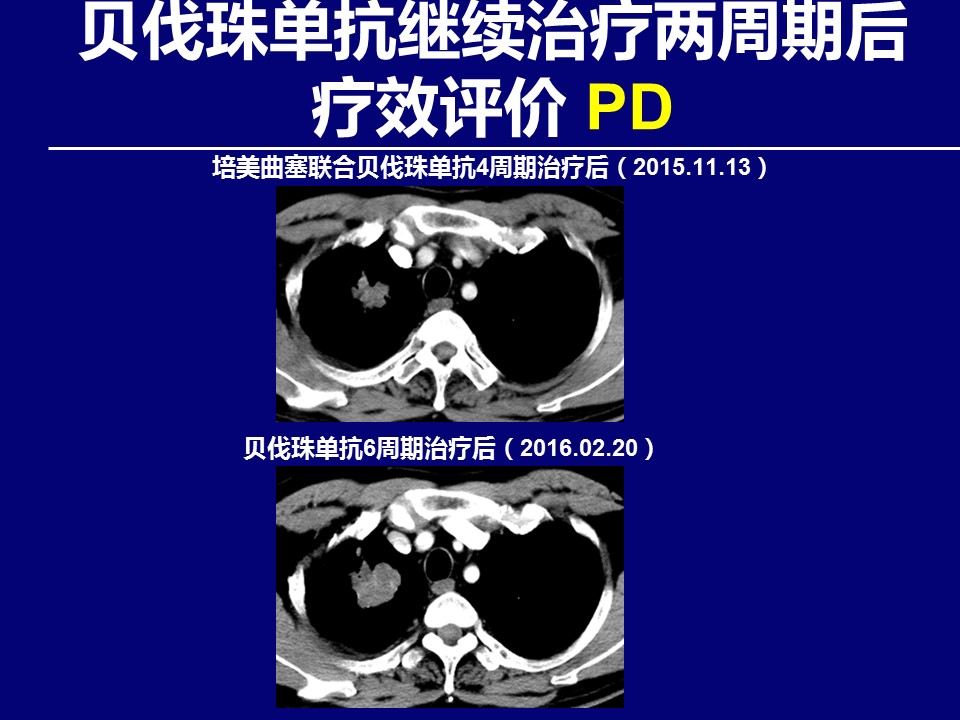

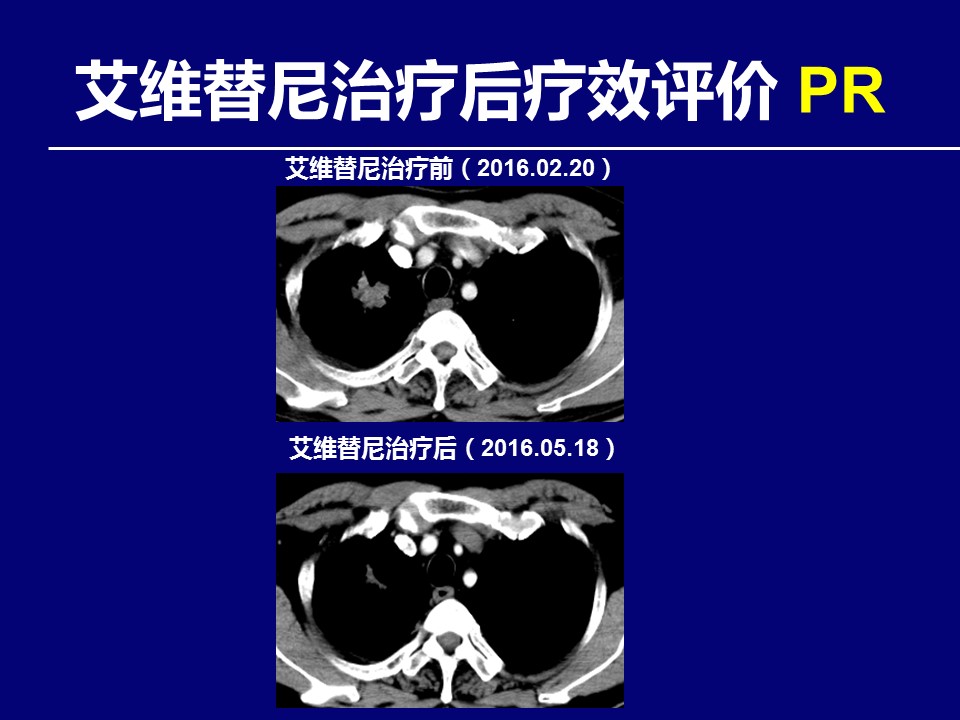

问题:对于该患者治疗策略及下一步治疗,您有何建议?请就您感兴趣的部分,进行讨论并列举循证医学证据?
此病例共有2位入围选手点评,分别为91-徐英辉;99-张永昌;病例提供作者为:95-张乐蒙。详情如下:
点评医生简介:91-徐英辉
 点评内容分享:
点评内容分享:
这是一个晚期肺腺癌病例,病例完整,治疗规范,因存在EGFR 19del敏感突变,先后经历了一代EGFR-TKI以及出现耐药突变T790M后的三代EGFR TKI治疗,均取得了显著的疗效。目前疾病再次进展,治疗上也存在多种选择,但并无统一标准,可以选择既往未应用过的化疗方案,也可以选择日前如火如荼开展起来的免疫治疗或参加适合的临床试验,但与此同时,二次活检检测基因状态,明确经过靶向耐药再靶向再耐药后是否依然存在精准靶向治疗的机会还是首要推荐的策略。
精准治疗离不开精准诊断
回顾肺癌的治疗历程,2004年一代EGFR-TKI易瑞沙的问世改变了非小细胞肺癌,尤其是肺腺癌的传统治疗模式,并从此开启了肺癌精准治疗时代,使30%-40%的肺腺癌患者获益于此,以最小的副作用,最大的有效率赢得了全民拥护。当一代EGFR TKI出现耐药后,60%左右的患者会产生EGFR T790M耐药突变[1],与此同时,三代EGFR-TKI AZD9291(奥希替尼)在国内外的上市再次成为了挽救这类患者的救命药,有效率高达71%。然而,AZD9291再神,它毕竟也是靶向药,也会出现耐药,而我们不得不面对的残酷现实是AZD9291耐药后,目前还没有第四代EGFR-TKI靶向药用来克服耐药,患者只能根据个体不同的身体状态及经济状况选择化疗、免疫治疗以及最佳支持治疗等方式治疗以求缓解。
从基础研究到临床转化的生命力
说到这里,大家是否曾记起,国人的骄傲吴一龙教授团队于2017年6月在JTO上[2]报道了全球首例AZD9291耐药肺癌患者经过一代和三代EGFR TKI联合治疗后获得了3个月的疾病控制,甚至使病灶缩小至PR水平。那么如此治疗方案的原理和依据是什么呢?AZD9291耐药的原因无疑又出现了新的耐药突变,研究表明这种耐药机制40%来自EGFR C797S突变[3],另外,包括Met扩增等旁路激活途径也占据主要地位。基因检测结果发现C797S突变包括两种方式[4],即顺式(T790M和C797S突变在同一条染色体上)和反式(T790M和C797S突变不在同一条染色体上),只有出现反式突变的情况时,一代与三代EGFR-TKI治疗才能获得疗效,而顺式突变并不能从此获益。吴教授团队报道的这一例患者便是同时存在EGFR 19del,T790M和C797S反式突变,并在一代和三代EGFR-TKI治疗中获益。临床医生们从此深受启迪,因AZD9291治疗耐药的患者也因此看到了一片曙光。
因此,对于病例090,首先建议其进行二次活检明确基因状态,一方面判断其是否可以进一步从一代和三代EGFR-TKI靶向联合治疗中获益,另一方面通过基因检测明确是否存在新的突变形式,为肺癌精准治疗提供新的线索和前景。
点评医生简介:99-张永昌
 点评内容分享:
点评内容分享:
1、MDT,势在必行!
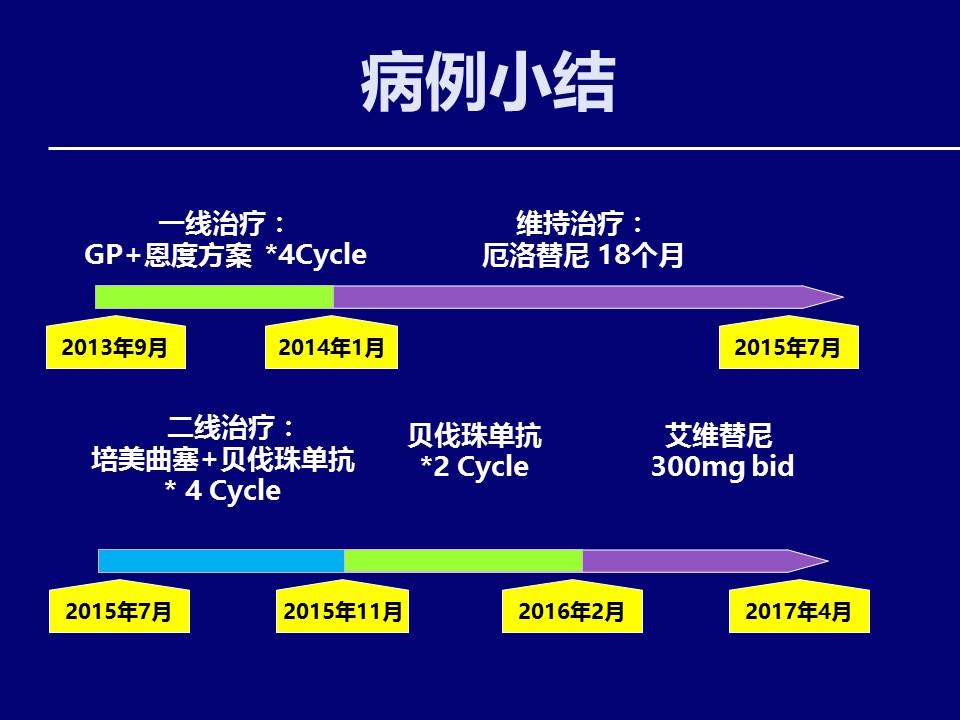
EGFR敏感突变NSCLC,一线化疗,切换至EGFR-TKI维持治疗(SATURN),二线化疗联合抗新生血管治疗,三线参加临床试验筛选,右侧心包旁新增病灶且持续增大(虽未见最近影像学),首选MDT讨论,重点讨论以下科学问题:a、局部治疗的必要性,根据病情描述,患者此刻病灶为“右上肺肿块”、“右侧心包旁肿块”,虽无全身影像学资料,但是结合既有肺部CT及描述,患者病变部位局限,故必须行全身PET-CT,如病灶仅仅为上述两个部位,建议两个部位TOMO或者直接外科手术介入,手术切除,同时继续口服马来酸艾维替尼(患者右上肺病灶控制良好)。b、如全身PET-CT提示其他部位病变(胸膜、双肺),则必须强调组织再活检的重要性必要性,尤其是右侧心包旁新增病灶的病理诊断及分子病理诊断, Camidge DR et al,在Nat Rev Clin Oncol上分析了耐药机制,对于全身病灶控制稳定,新增病灶且迅速增大(描述为AZD9291治疗2月后继续增大)的患者,需要高度患者耐药基因突变、SCLC转化,且不排除二重癌发生的可能,根据病灶大小、位置,活检方式可以考虑肺肿块穿刺、EBUS-TBNA及磁导航。再取得右侧心包旁新增病灶的病理诊断及分子病理诊断后针对性治疗,有靶向基因突变,切换至相应靶向药物;无对应突变,化疗联合抗新生血管治疗(WJOG5910L及AvaALL)。
2、液体活检,锦上添花!
关于组织与血浆基因突变一致性的亚组分析(FAST-ACTII、EURTAC、AURA),发现可靠度80%左右,最高88%,仍然有一部分患者假阴性。此案例,是否抽血行NGS检测,值得讨论,第一,患者仍口服AZD9291,瘤负荷及血浆ctDNA丰度值得讨论,检测结果极有可能假阴性,第二,在未明确右侧心包旁新增病灶病理诊断情况下,ctDNA能否反应其分子病理特征,值得讨论,如果出现SCLC转化,意义有限;第三,PD-L1、TMB检测的重要性及必要性,毋庸置疑;因此需要与患者沟通,交代利弊,获取足够的依从性。
3、 一些细节,值得讨论。
A、标题是否应该由“小细胞肺癌”调整为“非小细胞肺癌”;
B、时光无法倒回,在没有取得在组织学诊断的情况下,化疗、抗新生血管治疗,值得讨论,根据病情描述中提到胸水、胸膜病变,内科胸腔镜应该是获取组织学的可靠手段,哪怕是胸水细胞学蜡块,也是值得选择的方案;
C、“细胞学的腺癌”,一线选择GP+恩度,没错,但是是否可以做的更好呢(JMDB),含培美曲塞及贝伐珠单抗的方案应该被考虑;借鉴WCLC 2015 ORAL03.05关于罕见突变的分析,含培美曲塞方案应该是最值得考虑的方案;
D、关于疗效评价,一线2周期治疗PR,四周期治疗SD,说的应该是概念,四周期方案后应该是“PR”;
E、培美曲塞联合贝伐珠单抗治疗后病灶增大,未见胸腔积液,此时是否应该MDT介入,讨论局部治疗的方案,虽然参加艾维替尼临床研究也是不错的选择。
F、更早的MDT介入,更好的全程管理,才能让患者活的更长,更好。
病例提供作者简介:95-张乐蒙
 病例提供作者自评:
病例提供作者自评:
1、右上肺结节的局部治疗(经皮射频消融、体外立体定向放疗)。
患者初诊胸部影像学提示右上肺结节,双肺多发转移瘤,右侧胸腔积液。治疗过程中,胸腔积液控制满意,双肺多发转移病灶小且稳定。疾病多次进展,主要集中在右上肺结节。是否可以针对右上肺结节进行局部治疗以减少瘤负荷,比如经皮肺部肿块射频消融术,或体外立体定向放疗等。
两种局部治疗手段各有优缺点。体外立体定向放疗精准度高,照射范围缩小,周围正常组织损伤少,可以大幅度提高单次放疗剂量,但病灶可能对放射线敏感性差。 经皮肺部肿块射频消融术可以达到灭活局部肿瘤病灶的效果,治疗效果与临床类型和病理类型无关,克服了放疗敏感性差的缺点,但局部治疗的范围及剂量相对较难控制。如果可以考虑局部治疗,那种手段相对更优?针对这位患者,您倾向采用局部治疗吗?在什么时机?倾向采用哪种治疗方法?
2、贝伐珠单抗的应用(跨线治疗、联合治疗、控制胸腔积液)。
作为EGFR敏感突变患者的全程管理,靶向药物是当仁不让的“主角”,但是我首先更加关注的是一个“配角”——贝伐珠单抗。
第一,跨线治疗。ML18174研究提示贝伐珠单抗在晚期结直肠癌跨线治疗能使患者获益。但2017年ASCO报道AvaALL研究数据(1),晚期非鳞NSCLC 患者中跨线使用贝伐单抗,并没有延长OS。不过,TTP2及TTP3显著延长,这意味部分患者采用跨线治疗能够“长期获益”。但缺乏指导性的生物标志物,且长期治疗不良反应增加,生活质量下降,贝伐珠单抗是否长期使用仍值得商榷,需要具体问题具体分析。
第二、联合治疗。从ECOG4599到BEYOND,从Avial到REVEL,贝伐珠单抗联合化疗的疗效,已经得到公认。日本JO25567研究证实(2), 初诊EGFR敏感突变患者,厄洛替尼与贝伐单抗联用治疗,较单纯厄洛替尼治疗,PFS延长6.3个月,提示贝伐珠单抗联合靶向治疗的有效性和优越性。这例患者是否可以采用靶向药物联合贝伐珠单抗,也是需要考虑的问题。
第三、控制胸腔积液。前瞻性随机对照Ⅱ期研究提示贝伐珠单抗对恶性胸腔积液控制率高,可采用静脉联合化疗或胸腔局部灌注等方式,通过降低血管通透性,减少胸水生成(3)。这例病人胸腔积液控制满意,除全身化疗和靶向治疗外,采用过博莱霉素局部治疗,也采用过恩度、贝伐珠单抗等抗血管生成治疗。
3、再次活检的必要性和方式选择。
对于EGFR敏感突变患者的全程管理,动态观察基因突变状态及丰度至关重要。再次活检、液体活检,以及活检方式、介入治疗学就是一个绕不开的话题。EGFR耐药机制多种多样。T790M、 MET、HER2、ROS1、ALK、小细胞肺癌转化等(4),不同的耐药机制决定不同的后续治疗方案。最常见的耐药机制是T790M突变,它占所有EGFR突变获得性耐药的50%-60%(4)。已获批上市的奥希替尼,以及I/II期临床研究的国产艾维替尼,不仅仅给EGFR TKI耐药的患者提供新的治疗选择,更成为令人信服的理由使得二次活检在临床实践中被广泛接受。通过二次活检、驱动基因检测,来寻找T790M突变证据,已成为EGFR耐药后的治疗标准。
对于这例患者,右上肺病灶再次活检发现EGFR 20号外显子T790M突变,对于后续改用艾维替尼治疗,具有重要的指导意义。其实反观这个病例,初诊时胸水发现腺癌细胞,胸水EGFR检测发现敏感突变后,是否需要进行穿刺活检,病理组织学证实,并进行病理组织的基因检测,也是临床实际工作中值得思考的问题。
服用艾维替尼12个月后,患者心缘旁出现新发病灶,可以采用哪些方法获取病理标本?CT引导下经皮肺部肿块穿刺是可以的,但风险较大。通过阅片,EBUS-TBNA也是可选方案之一。此外,更为先进的磁导航技术,也可以用于心缘旁病理标本获取。当然,液体活检也是候选方案之一。至于是选择病理活检,还是液体活检,需根据患者和病灶的实际情况,具体问题具体分析。
4、吉西他滨和培美曲塞在晚期肺腺癌患者中的临床应用。
在胸水基因检测结果没有回报的情况下,胸水细胞学提示为腺癌,一线治疗采用吉西他滨、顺铂联合恩度的化疗方案。因此,在这里讨论吉西他滨和培美曲塞在晚期肺腺癌患者的临床应用。
肯定有人质疑,这个还需要讨论吗?JMDB临床研究显示(5),相比吉西他滨,培美曲塞联合顺铂在晚期非鳞NSCLC具有更好的疗效及安全性。但是,回顾国产培美曲塞或吉西他滨联合顺铂一线治疗晚期非鳞NSCLC的临床研究(6),培美曲塞联合组与吉西他滨联合组患者的中位PFS分别为5.6个月和4.7个月(P=0.16);1年生存率分别为50.0%和54.9%(P=0.47);ORR分别为24.4%和14.2%(P=0.06),均无统计学差异。两种含铂方案治疗晚期非鳞NSCLC具有相似的疗效,培美曲塞联合组不良反应发生率低。
一线治疗使用培美曲塞联合铂类,二线治疗可以使用多西他赛;而一线治疗使用吉西他滨联合铂类,二线治疗可以选择培美曲塞或多西他赛。JMEI研究证实(7),培美曲塞在非鳞NSCLC二线治疗中优于多西他赛。那么从全程管理的角度,晚期肺腺癌患者,培美曲塞二线治疗,是否也是一个可行的方案,仍值得商榷。
5、真实临床世界:EGFR 敏感突变患者,基因检测结果回报时,已经进行化疗,如何安排后续治疗。
真实临床世界肿瘤科医生经常面对这样的问题。晚期肺癌的治疗刻不容缓,基因检测通常迟于细胞、病理结果。对于基因状态未知的晚期肺癌患者,首选一线含铂双药化疗。化疗过程中,基因检测结果回报,存在驱动基因突变,之后的治疗策略应该是医患双方“互动”的结果。
首先,我会明确告知患者和家属,存在驱动基因突变,靶向治疗的疗效、费用和不良反应;同时,告知化疗的疗效、费用和不良反应。这一点我会在化疗前就明确告知,患者和家属如果愿意等待基因检测结果,可以推迟化疗。如果患者和家属强烈要求先进行化疗,则可以在化疗过程中等待基因检测结果。其次,我会告知“药尽其用”的原则。晚期肺癌患者,可供选择的治疗药物只有这么多,如果化疗有效,也不失为一种合理的选择,把有效的药物疗效发挥到最大,可以考虑靶向治疗放在一线化疗之后。充分告知后,患者和家属应该参与到医疗决策的制定过程中。这样可以增加患者的依从性,也更符合“共同参与型”的医患模式,这种模式是非常适合肿瘤这种慢性疾病的。
从循证医学的角度,SATURN研究提示(8),一线化疗之后使用厄洛替尼维持治疗,相较于安慰剂,厄洛替尼的维持治疗可显著延长晚期NSCLC患者的PFS和OS,尤其在EGFR敏感突变的患者,厄洛替尼维持治疗PFS获益最大,厄洛替尼组中位PFS是44.6周(本例患者18月,相当于72周),而安慰剂是13 周。因此,存在EGFR 敏感突变的患者,一线治疗采用含铂双药化疗方案,非PD的患者继续靶向药物进行维持治疗,仍可显著临床获益,这应该成为临床备选策略之一。
以上为【35 under 35】的观点,您怎么看?欢迎广大肿瘤医生在下方留言发表您的观点!
以上所有点评参考文献略。
















 苏公网安备32059002004080号
苏公网安备32059002004080号


